Nature | 抑制ASGR1蛋白促进胆固醇外排进而降低血脂水平
- boke
- 2022-12-15
- 7:07 上午
心血管疾病是严重危害人类健康的主要“元凶”之一,在中国其逐年上升的发病率和死亡率必须引起足够重视,加强疾病的早期发现与综合防控。血浆中脂质浓度超过正常范围时称为高脂血症,很多疾病,特别是心肌埂塞、脑卒中等心脑血管疾病,以及脂肪肝、肝硬化等代谢疾病,严重威胁着人们的健康。现在全世界有超过2亿人需要日常服用他汀(Statin)等降血脂药物来控制血脂,在发达国家的中老年人群体中,使用降脂药物的比例更高(在美国,45岁以上的人有25%需要日常使用降脂药物)。
胆固醇作为一类重要的脂质分子,对维持哺乳动物生命活动至关重要。胆固醇在体内的动态平衡是通过肠道胆固醇吸收、血浆脂蛋白摄取、从头生物合成、胆固醇分解代谢和排泄等复杂的相互作用实现的。体内高浓度胆固醇引发的心血管疾病越来越多,降脂是预防和治疗心血管疾病的必要手段。现有的降脂药物如他汀、依折麦布、PCSK9抑制剂等,可以不同程度的降低血脂,只是仍存在一定的副作用并且都不是通过直接促进胆固醇分解代谢或排泄来降低胆固醇。由于胆固醇的分子结构特性,人体自身很难高效降解胆固醇分子,如能将胆固醇外排出人体将是理想的降脂策略。
因此,对于高血脂人群,除了需要注意饮食摄入的胆固醇含量,还需要药物干预体内的胆固醇代谢(例如降低其合成和吸收,促进其分解和排出),才能起到好的降脂效果。
ASGR1作为一种去唾液酸糖蛋白受体,是一种肝脏的特异性受体,介导多种去唾液酸糖蛋白的内吞和溶酶体降解。2016年,New England Journal of Medicine发表的一篇针对冰岛人的大规模全基因组关联分析文章(Variant ASGR1 Associated with a Reduced Risk of Coronary Artery Disease)发现功能缺失的ASGR1变异与低胆固醇和CVD风险降低有关,但是其具体机理未知。
ASGR1(Asialoglycoprotein Receptor 1)主要表达在肝实质细胞膜上,介导多种去唾液酸糖蛋白的内吞和溶酶体降解。那么ASGR1调节胆固醇代谢的具体机制究竟是怎样的?能否成为新的降胆固醇药物的作用靶点呢?
2022年8月,武汉大学科研团队在nature上发表题为“Inhibition of ASGR1 decreases lipid levels by promoting cholesterol excretion”的文章深入研究了这个问题。他们首先发现,和人类类似,敲除掉ASGR1基因的小鼠,各项血脂指标有明显的下降,肝脏中的脂肪堆积也有显著减轻。同时,这些小鼠的胆汁分泌活动大大增强,胆汁中的胆固醇含量也有肉眼可见的提升。这些结果表明ASGR1基因功能的抑制促使胆固醇通过胆汁排出体外,进而降低血脂水平。
主要研究结果
Asgr1-/-促进胆固醇外排
研究人员使用siRNA敲减人肝癌细胞系Huh7中的ASGR1,并进行RNA-seq测序。GSEA分析结果显示,LXR靶基因高度富集(图1a),RT-qPCR结果也证实,敲除ASGR1的Huh7细胞中,LXR主要靶基因ABCG5、ABCG8和ABCA1表达量显著上调(图1b)。有趣的是,研究人员发现在ASGR1敲减或敲除的细胞中,LXRα和LXRβ的蛋白水平升高(图1c、d)。ASGR1过表达可降低LXRα和LXRβ蛋白水平,以及ABCG5、ABCG8、ABCA1的mRNA表达水平(图1e、f)。

图1 Asgr1缺乏会增加LXRα,促进胆固醇排泄并降低脂质水平
ASGR1在肝脏中高表达,研究人员构建了Asgr1敲除(全身敲除)小鼠。杂合子(Asgr1+/-)和纯合子(Asgr1-/-)小鼠看起来都很正常。与野生型(WT)小鼠相比,ASGR1+/−和ASGR1-/-小鼠的血清总胆固醇(TC)和甘油三酯(TG)水平以基因剂量依赖性方式显著降低(图1g、h)。Asgr1+/-和Asgr1-/-小鼠的肝脏TC和TG水平也低于WT小鼠(图1i、j)。并且ASGR1敲除可以显著减少肝内脂滴积累,而不造成任何肝脏损伤。
值得注意的是,Asgr1敲除小鼠胆囊中的胆汁体积、胆汁胆固醇和胆汁酸(BAs,胆汁中所含的多种类固醇酸的统称)浓度均显著增加(图1l-n)。与WT小鼠相比,Asgr1+/−和Asgr1-/-小鼠的总胆汁胆固醇分别增加了71%和114%,胆汁酸也有显著增加(图1o、p)。Asgr1-/- 小鼠胆汁浑浊,提示胆汁中胆固醇升高(图1q)。此外,Asgr1缺陷小鼠体内BAs成分的变化可能也有助于降低胆固醇水平。
Asgr1-/-小鼠的代谢改善依赖于LXRα
为了回答ASGR1-/-小鼠的代谢改善是否源于LXRα的升高,研究人员构建了基因敲除Asgr1-/-Lxrα-/-小鼠。当Lxrα缺失时,Asgr1-/-小鼠肝脏中升高的ABCG8、ABCA1和CYP7A1蛋白水平被完全消除(图2a)。另外,由于LXRα驱动Srebp1c及FASN、LDLR和脂肪酸生物合成基因的转录,因此与Asgr1-/-小鼠相比,Lxrα-/-小鼠这些基因表达明显降低(图2a和拓展图2p),Abcg5、Abcg8、Abca1和Cyp7a1的mRNA表达也显著降低,说明在没有LXRα的情况下,Asgr1缺失无法增加上述几个基因的表达。
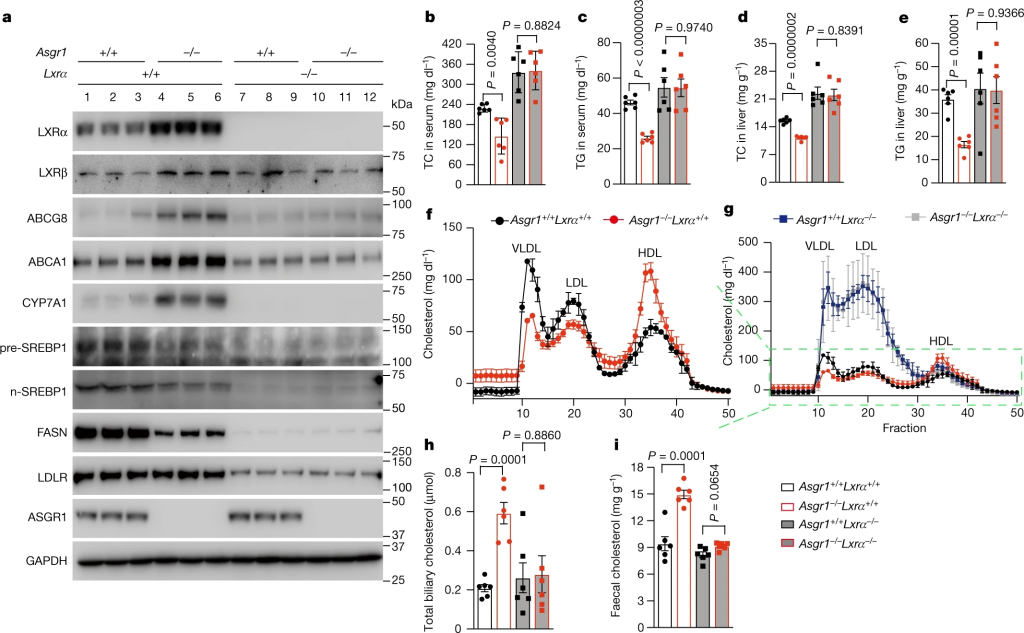
图2 Asgr1−/−中的代谢改善小鼠依赖LXRα
Asgr1-/-与Lxrα-/-小鼠表现出相似的体重、摄食量和血糖水平,但敲除Lxrα可导致肝内脂滴大量聚集,肝细胞气球样变,丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)升高。ASGR1缺失显著降低的肝脏脂质含量和血清中TC和TG水平,这些影响可以被Lxrα敲除完全消除。与Asgr1-/-小鼠相比,Lxrα-/-小鼠可显著增加VLDL和LDL的胆固醇含量,并抵消Asgr1缺乏引起的脂质变化(图2f、g)。与WT小鼠相比,Asgr1-/-总胆汁胆固醇水平增加了大约两倍,而Lxrα-/-小鼠总胆汁胆固醇则降低到基础水平。
另外,Asgr1-/-小鼠粪便胆固醇也增加了48%,这一变化在LXRα缺乏的小鼠中被抵消(图2i)。这些结果与Abcg5、Abcg8和Abca1的表达变化一致:ABCG5/G8将胆固醇外排到胆汁,然后通过粪便将胆固醇从体内排出,而ACBA1将胆固醇转运到HDL。以上结果表明,Asgr1-/-增加胆固醇外排、降低脂质水平依赖于LXRα。
LXRα的降解依赖于BRCA1和BARD1
研究人员进一步研究了ASGR1调控LXRα的机制。结果显示,蛋白酶体抑制剂MG132阻断了ASGR1诱导的LXRα降解。过表达ASGR1增加了LXRα的泛素化,而ASGR1敲除则降低了其泛素化。已有文献报道,由BRCA1和BARD1组成的泛素连接酶(Ubi)E3复合物介导LXRα的泛素化和降解。沉默BRCA1和BARD1可显著减弱ASGR1促进的LXRα泛素化和降解(图3a)。敲除ASGR1使BRCA1和BARD1水平降低,LXRα升高。
相反,过表达ASGR1可以增加BRCA1和BARD1的蛋白表达,并具有剂量依赖性。敲除或过表达ASGR1并没有改变BRCA1/BARD1其他底物的表达量,如cyclin B1和Cdc25C。Ki-67和PCNA染色显示Asgr1缺陷的肝脏细胞未异常增殖,蛋白酶体的亚基也未发生改变。上述结果显示Asgr1缺失通过特异性地降低BRCA1和BARD1来增加LXRα。

图3 Asialoglycoproteins-ASGR1-AMPK/MTORC1调节LXRα和超低密度脂蛋白
配体-ASGR1通过AMPK调控LXRα
ASGR1是一个跨膜蛋白,可结合血液中的多种去唾液酸糖蛋白。为了确定配体-ASGR1的相互作用是否在调控LXRα中发挥作用,研究人员比较了在存在或不存在胎牛血清(FBS)的情况下,ASGR1促进LXRα降解的情况。
结果显示,在无血清培养基中,ASGR1不能诱导LXRα降解。而ASGR1的高亲和力天然配体去唾液酸胎球蛋白A或去唾液酸血清类粘蛋白在ASGR1存在的无血清培养基中可诱导LXRα降解,并具有剂量依赖性。同时,去唾液酸胎球蛋白A和ASGR1协同增强LXRα的泛素化(图3b)。配体结合突变体ASGR1(6A)未能促进LXRα降解。另外,去唾液酸胎球蛋白A处理增加了内源性BRCA1和BARD1的表达,导致LXRα表达降低(图3c)。沉默ASGR1或BRCA1/BARD1可使LXRα水平持续升高,并消除去唾液酸胎球蛋白A诱导的LXRα降解(图3c)。以上结果表明,去唾液酸糖蛋白与ASGR1结合,增加BRCA1/BARD1,从而促进LXRα的降解。
Asgr1-/-小鼠通过调节AMPK改善代谢
研究人员设计了一系列的动物实验进行体内验证。首先,研究人员给WT小鼠静脉注射去唾液酸胎球蛋白A,结果显示小鼠肝脏p-S6K和p-4E-BP1升高,表明mTORC1被激活,而p-AMPK、p-Raptor、p-ACC和p-ULK1降低,表明肝脏中AMPK被抑制。同时BARD1升高,LXRα降低,Abcg5、Abcg8、Abca1和Cyp7a1的表达也均降低。Srebp1c、Fasn、Scd1mRNA表达上调。去唾液酸胎球蛋白A还显著升高了肝脏和血清中的TC和TG,减少了胆固醇和BAs向胆汁的外排。
相反的是,Asgr1-/-小鼠表现出的mTORC1受到抑制、AMPK激活,LXRα增加,脂肪酸生物合成基因表达降低和代谢特征改善,均未受到去唾液酸胎球蛋白A静脉注射的影响。其次,研究人员使用mTOR抑制剂雷帕霉素来模拟Asgr1缺失诱导的mTORC1抑制,p-AMPK、p-Raptor、p-ULK1和p-ACC在雷帕霉素作用下显著升高,表明抑制mTORC1可激活AMPK。
同时,LXRα、ABCG5、ABCG8、ABCA1和CYP7A1表达水平升高,而FASN表达水平降低,与AMPK抑制SREBP通路一致。另外,雷帕霉素不仅能降低血清和肝脏中的TC和TG,还能增加胆汁胆固醇和BAs以及粪便胆固醇含量。
最后,研究人员利用靶向Prkaa1和Prkaa2的AAV-shRNAs,发现AMPK缺失激活mTORC1,ASGR1缺乏小鼠肝脏中LXRα、ABCA1、ABCG5、ABCG8和CYP7A1的增加在很大程度上被逆转。肝脏AMPK缺失使血清和肝脏TC、TG水平升高。在WT和Asgr1-/-小鼠中,AMPK shRNAs均可降低胆汁胆固醇和BAs以及粪便胆固醇。
抑制ASGR1基因的治疗潜力
目前RNA抑制(RNAi)正成为一种有效的治疗方法。为了探究抑制ASGR1的治疗效果,研究人员使用AAV-shRNA在小鼠肝脏中沉默ASGR1。结果显示,LXRα、ABCG8、ABCA1和CYP7A1的蛋白质水平显著升高,而Srebp1c、Fasn和Scd1的mRNA显著降低。ASGR1敲除后,血清和肝脏中TC、TG水平显著降低。注射AAV-shAsgr1小鼠的胆汁胆固醇增加了1.4倍以上,总BAs随之增加。
但是AAV-shAsgr1没有改变小鼠体重或引起小鼠肝损伤。在Ldlr-/-小鼠中敲减ASGR1,可以有效地防止高脂(HF)/高胆固醇(HC)/胆盐(BS)饲料诱导的肝动脉粥样硬化斑块的形成和脂质沉积。4B9-免疫球蛋白G(IgG)可以以促进LXRα表达,并上调Abcg5和Abcg8的表达。进一步研究发现,4B9-IgG可以识别ASGR1上位于碳水化合物识别域的区域。
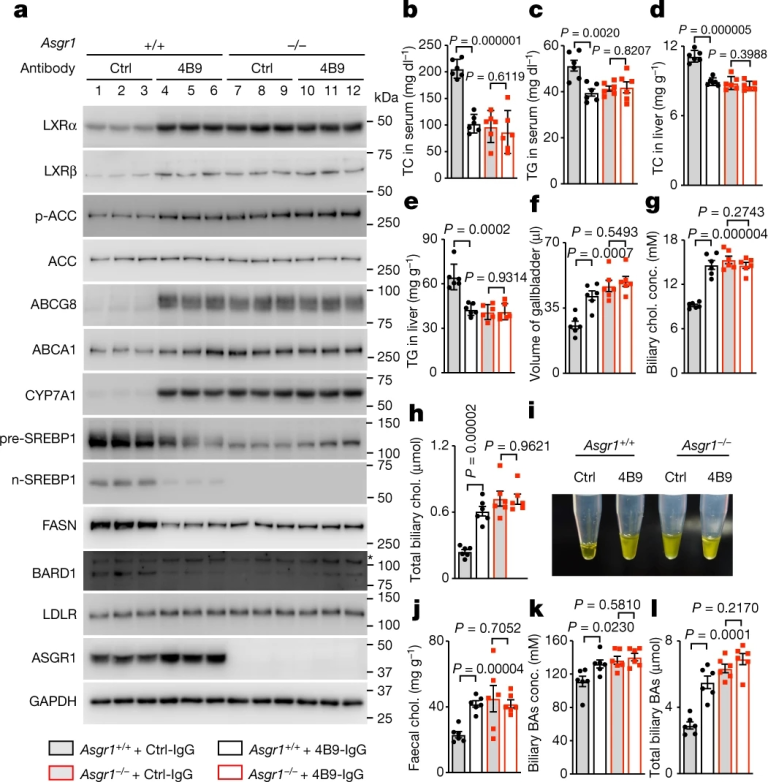
图4 ASGR1中和抗体促进胆固醇排泄
接下来,研究人员对WT和Asgr1-/-小鼠均进行对照和4B9-IgG处理。结果显示,4B9-IgG处理的WT小鼠LXRα明显升高,LXRβ轻微升高,ABCG8、CYP7A1和ABCA1显著升高(图4a)。同时4B9-IgG激活AMPK,降低SREBP1、FASN和BARD1,上调了WT小鼠肝脏中Abcg5、Abcg8、Abca1和Cyp7a1的转录,降低了Srebp1c、Fasn和Scd1的mRNA水平上的表达。而在Asgr1-/-小鼠中,4B9-IgG没有改变上述基因的表达以及AMPK活化(图4a)。4B9-IgG使WT小鼠血清TC和TG分别降低50%和22%,肝脏TC和TG也显著降低(图4b-e)。此外,4B9-IgG处理使胆囊内胆汁体积增加62%,胆汁胆固醇浓度增加67%,导致WT小鼠总胆汁胆固醇增加超过1倍(图4f-h)。
相比之下,接受对照IgG的WT小鼠的胆汁始终透明,而注射4B9-IgG或Asgr1-/-小鼠的胆汁则是不透明的(图4i)。另外,经4B9-IgG处理的WT小鼠的粪便胆固醇增加了约87%(图4j),胆道BAs浓度和总BAs也升高(图4k,l)。在实验过程中未检测到其他代谢变化或肝损伤。
单克隆抗ASGR1中和抗体与他汀/依折麦布协同效应
研究人员研究了4B9-IgG是否与现有药物阿托伐他汀和依折麦布(EZ)有协同降脂作用。结果发现,无论对WT小鼠是否使用阿托伐他汀治疗,4B9-IgG都会激活AMPK,增加LXRα,上调Abcg5、Abcg8、Abca1和Cyp7a1的表达,降低Srebp1c、Fasn和Scd1的表达(图5a)。使用4B9-IgG或阿托伐他汀单独治疗WT小鼠,TC和TG同样降低(图5b-e),体重和其他代谢指标类似。而当4B9-IgG和阿托伐他汀共同给药时,WT小鼠血清和肝脏脂质水平显著降低(图5b-e)。
相比之下,Asgr1-/-小鼠的TC和TG水平明显低于WT小鼠(图5b-e)。阿托伐他汀可进一步降低Asgr1-/-小鼠血清脂质水平,而4B9-IgG对其无影响(图5b,c)。无论是否使用阿托伐他汀治疗,4B9-IgG都显著提高了WT小鼠的总胆汁胆固醇、总BAs和粪便胆固醇(图5f-h)。而单独使用阿托伐他汀对胆汁胆固醇、BAs或粪便胆固醇水平没有影响(图5f-h)。
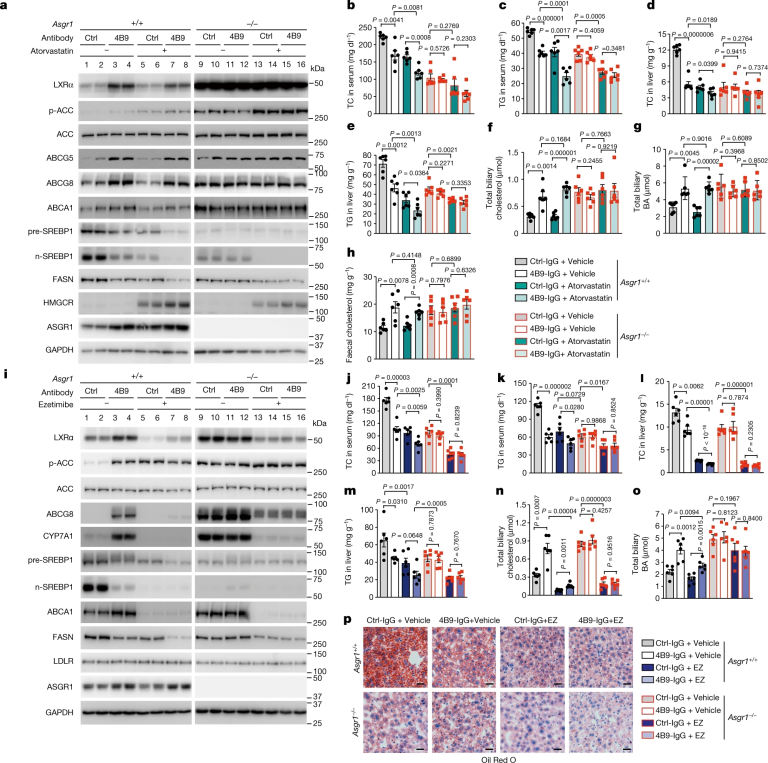
图5 ASGR1抗体与阿托伐他汀和依折麦布具有协同降脂作用
最后,研究人员用4B9-IgG和EZ治疗小鼠。结果显示,在WT小鼠中,无论是否使用EZ治疗,4B9-IgG均通过阻断ASGR1发挥作用,和之前实验发挥类似功能(图5i-p)。4B9-IgG和EZ可协同降低WT小鼠血清和肝脏中的TC和TG。在Asgr1-/-小鼠中,EZ仍能降低血清和肝脏中脂质含量,而4B9-IgG无效(图5j-m)。同时因为EZ可抑制膳食胆固醇的吸收,它可显著降低WT小鼠的总胆汁胆固醇(图5n)。即使在EZ作用下,4B9-IgG仍能增加WT小鼠的总胆汁胆固醇和BAs含量(图5n,o)。以上结果表明,4B9-IgG与阿托伐他汀和依折麦布(EZ)有协同降脂作用,并且比单独给药效果更好。
心血管疾病是威胁全球健康的一个极其重要的疾病,而高胆固醇是心血管疾病的主要危险因素。ASGR1功能缺失与低胆固醇和心血管疾病风险降低有关,抑制ASGR1促进胆固醇的分解代谢和排泄就成为治疗心血管疾病的潜在突破口。本项研究完整揭示了ASGR1在胆固醇外排中的作用,也在小鼠模型中证明了ASGR1抗体和小核酸药物的成药性。后续期待靶向ASGR1的药物也能够和他汀类药物、PCSK9类药物一样,为人类降血脂保护心脑血管开辟出新的道路。
当前,适用于中国人群的冠心病和脑卒中PRS模型已经建立并实现产品转化。国家心血管病中心研究团队基于过去20余年覆盖全国18省市12万人的大人群队列,根据长期随访冠心病和脑卒中的发病情况并检测与冠心病、脑卒中、血脂、血压、血糖、肥胖等相关600余个遗传变异基因位点,构建出综合风险评估模型(即metaPRS模型)。该风险评分模型综合考虑个体的遗传风险和临床风险,能够有效预测冠心病和脑卒中发病风险并描绘个体未来10年直至80岁的心血管疾病患病风险曲线。通过多基因的检测分析结合生理生化指标的风险评估模型,能精准的预测未来心血管事件的概率;在全生命周期健康管理中,能够更早的预测发病轨迹,实现个性化精准防控,实现检测人群的心血管病的精准风险分层。[查看链接:中国人群队列心脑血管疾病研究与成果转化(metaPRS的技术应用)]