JAMA Cardiology | WES助力自发性冠状动脉罕见遗传变异发掘
- boke
- 2022-12-22
- 8:01 上午
自发性冠状动脉夹层(SCAD)是一种引起非动脉粥样硬化的心肌梗死的原因,通常发生在年轻女性。目前大约有5%的SCAD患者患有与结缔组织病(CTDs)血管炎相关基因的某个单基因病因,包括血管型Ehlers-Danlos综合征(COL3A1致病突变)、马凡综合征(FBN1)、Loeys-Dietz综合征(LDS)(TGFB2, TGFB3, TGFBR1, TGFBR2, SMAD2, SMAD3)和纤维胶原蛋白(COL3A1, COL5A1)。纤维肌发育不良(FMD)是最常见的潜在动脉疾病,在25%-86%的SCAD患者中被发现。这些遗传影响尚未在SCAD的高危表型中被定义,对高危个体的识别将有助于指导SCAD临床上的遗传评估。
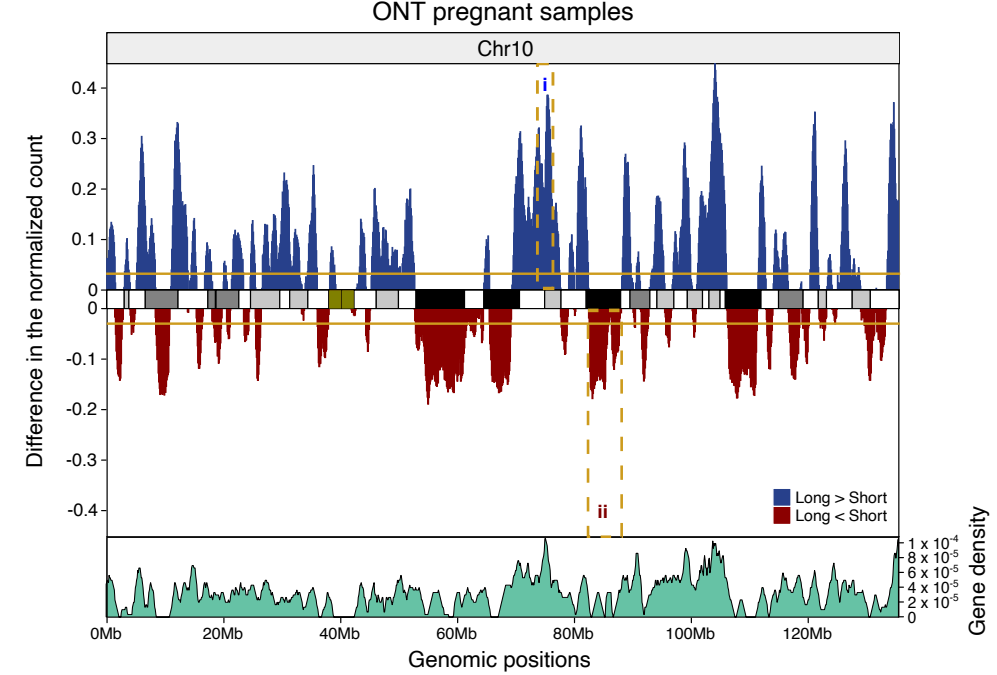
已经有研究通过SCAD的全外显子组测序(WES)发现了单基因动脉疾病的基因变异,并初步筛选出了TLN1、TSR1、PTGIR和PKD1基因。与SCAD相关的常见变异包括几个高效遗传位点,优势比(ORs)约为1.5 ~ 2.0。通过对全基因组关联研究(GWAS)与数百个人类动脉样本的基因型-组织表达普(GTEx)转录组数据联合分析,并且通过表达数量性状(eQTL)分析结果显示,在前3个GWAS识别的位点中各有1个基因存在强证据支撑:ADAMTSL4, PHACTR1和LRP1[1]。
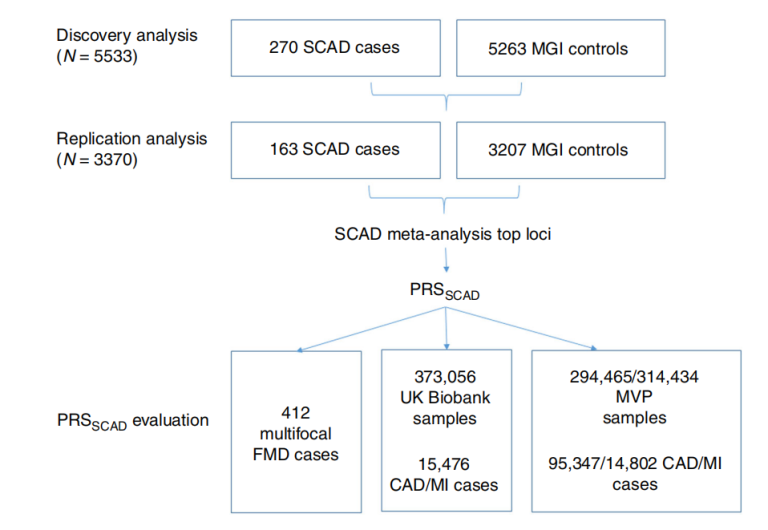
图1 SCAD全基因组关联分析(GWAS)和PRSSCAD开发设计[1]
2022年9月19日Santhi K. Ganesh团队在《JAMA Cardiology》上发表了题目为“Burden of Rare Genetic Variants in Spontaneous Coronary Artery Dissection With High-risk Features”的研究,确定和量化在具有高危临床特征的SCAD个体中罕见遗传突变负荷。WES用于病例-对照组关联分析和高危SCAD个体间的个体变异注释。通过对CTDs血管炎和/或SCAD测序确定的基因进行模拟分析,并且根据GWAS和eQTL确定的基因,对遗传变异的致病性进行注释。并通过比较SCAD个体的总体变异情况与健康对照或基因组聚合数据库(gnomAD)信息得到无偏好性GWAS WES数据[2]。
该研究共包含336名参与者(其中平均年龄53岁,301名女性参与者)。与gnomAD相比,17.0%的SCAD高危个体(16/94)在CTDs血管炎相关基因的变异被富集(OR:2.6;95%置信区间:1.6-4.2;P = 7.8×10−4),COL3A1 (OR:13.4;95%置信区间:4.9-36.2;P = 2.8×10−4)和Loeys-Dietz综合征基因(OR:7.9;95%置信区间:2.9-21.2;P = 2.0×10−3)存在显著信号。在6.4%的SCAD高危个体(6/94)中观察到GWAS优先候选基因变异也被富集(OR:3.6;95%置信区间:1.6-8.2;P = 7.4×10−3)。4个个体在COL3A1, TGFBR2和ADAMTSL4基因上被注释为可能致病或致病性的变异。
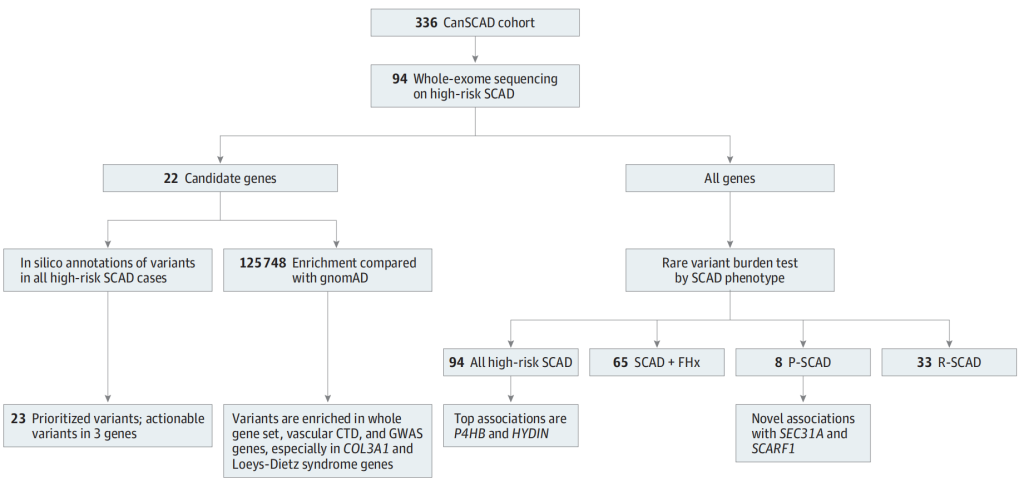
图2 工作流程[2]
该研究通过WES数据,发现了已知罕见变异和与SCAD高危表型相关的新基因。研究结果发现了潜在的CTDs血管炎的基因、与血管型LDS相关的基因,并新发现了GWAS优先候选基因ADAMTSL4和LRP1的罕见变异。尽管CTDs血管炎基因的单基因变异曾被认为影响SCAD队列中约5%的个体,但该研究报告认为存在更高的频率(约17%)。这些发现为SCAD的遗传基础提供了新的生物学见解,并支持对高危SCAD患者进行临床基因检测。
2020年9月伯科生物在液相基因芯片取得突破性进展,完成了首款全流程国产人全外显子液相基因芯片的研发与测试,正式推向市场,达到了国际领先水平,打破了海外巨头对该产品的垄断。该产品在实现优质性能的同时实现了模块化扩展,扩大全外显子液相基因芯片在科研、临床、大健康等领域的应用。

图3 伯科Target Cap® Core Exome Panel v3.0基本捕获表现和变异检测[参考链接:全面国产化,极致个性化 | 伯科Target Cap®靶向捕获技术助力基因组研究与转化]