Nature Biotechnology |更温和、更准确的DNA/RNA甲基化BS-Seq方法,UBS-Seq
- boke
- 2024-01-10
- 4:18 下午
在整个生命过程中,我们所有细胞都在积累着基因组的体细胞突变。这些突变中的大多数都是无害的,并对细胞的表型影响很小,但有时它们却为细胞提供了竞争优势,从而允许其增殖扩张,从而使得细胞开始走向癌症或引发心脑血管病等慢性疾病。
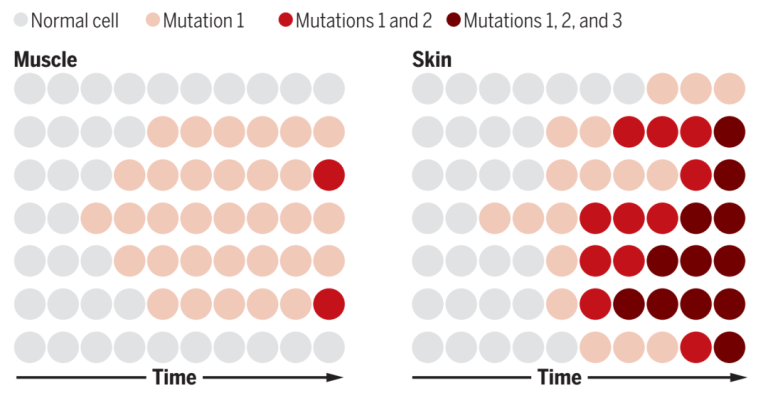
图1. 肌肉与皮肤中的体细胞变异积累[1]
一项有趣的研究发现,95%的个体至少有一个组织存在体细胞突变,包括已知的癌症基因突变,并且其中一些突变似乎与年龄、阳光或其他环境暴露有关。有3种人体组织的体细胞突变负荷高于其他组织,包括食道粘膜、肺和暴露在阳光下的皮肤[2]。
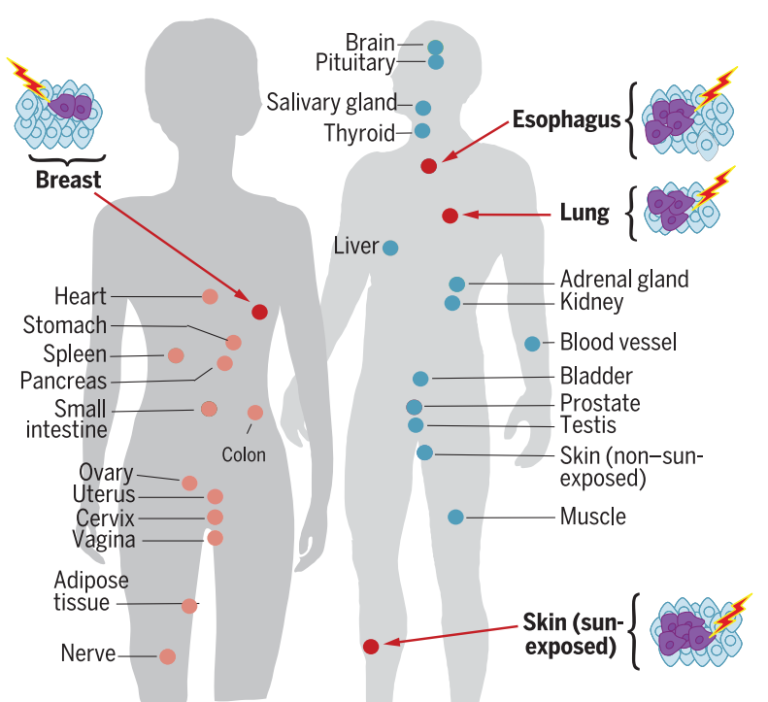
图2. 人体部分组织器官更容易发生体细胞变异[2]
体细胞变异的发现来自血液
由于体细胞变异可能赋予细胞更强大的生存能力,随着具有优势的细胞个体增殖,组织其实是由具有略微不同基因型的细胞组成,这一现象被称为体细胞嵌合。随着年龄的增长,我们的体细胞中积累着突变,因此体细胞嵌合可以被视为许多组织衰老的标志。
事实上,最早关于健康人类组织中体细胞嵌合的迹象来自于一项检查人类血液中染色体异常的细胞遗传学研究,该研究发表于1963年,距今正好六十年[3]。
在这项研究中,科研人员统计了247个个体血细胞中的染色体数量,他们发现人类血细胞中存在染色体异常的现象,并且随年龄增加而增多。研究发现,无论男性还是女性,随着年龄的增长,携带染色体非整倍体变异的细胞的比例都在增加,值得注意的是,低于正常染色体数(即<45条染色体)的细胞在男性中更为常见。尽管当时研究人员无法确切知道是哪些染色体产生的非整倍体,但根据有限的分析手段还是推测出是Y染色体的丢失。
的确,健康男性更容易在他们的血细胞中丢失Y染色体,且这种现象随年龄增长而频繁。这种现象被称为Y染色体的嵌合丢失(mLOY),我们现在知道了这是人类白细胞中最常观察到的体细胞变异。
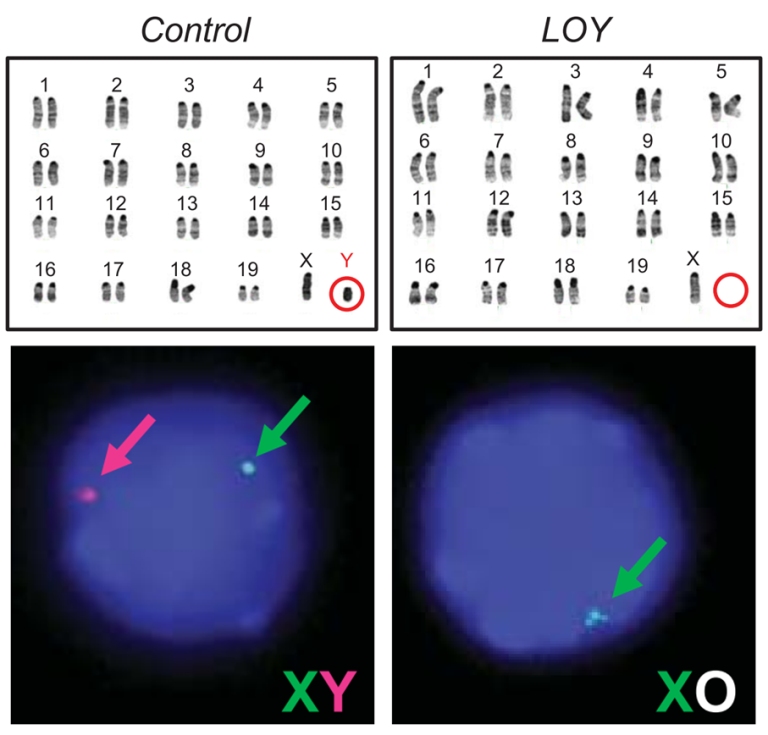
图3. 小鼠Y染色体丢失的FISH和核型分析图[4]
特别是到了70岁时,大约10%到40%的男性至少在他们10%的血细胞中丢失了Y染色体。一项前瞻性研究表明,mLOY与心脑血管疾病以及心力衰竭相关死亡率的风险增加有关[4]。其机制为,造血干细胞发生mLOY后,血源性巨噬细胞更加趋于纤维化表型,这导致心脏成纤维细胞和基质沉积升高,从而增加心脏纤维化。

图4. 造血干细胞的Y染色体嵌合丢失导致心脑血管疾病的可能机制[5]
体细胞突变分类
其实,Y染色体丢失只是基因组体细胞突变的一个类型,由于其突变规模大,更容易被观察到,随着技术的进步,更小规模的多种变异类型被发现。例如,小规模的突变通常影响单个基因或几个核苷酸,包括点突变(SNV)、插入和缺失(indels)等变异类型。大规模突变涉及染色体结构的改变,如扩增、缺失、重排、拷贝数变化。在人类组织中经常观察到的另一种突变是非整倍体,指的是由于染色体丢失或增加导致的染色体数量异常,其中最为常见的是男性Y染色体的嵌合丢失(mLOY)。
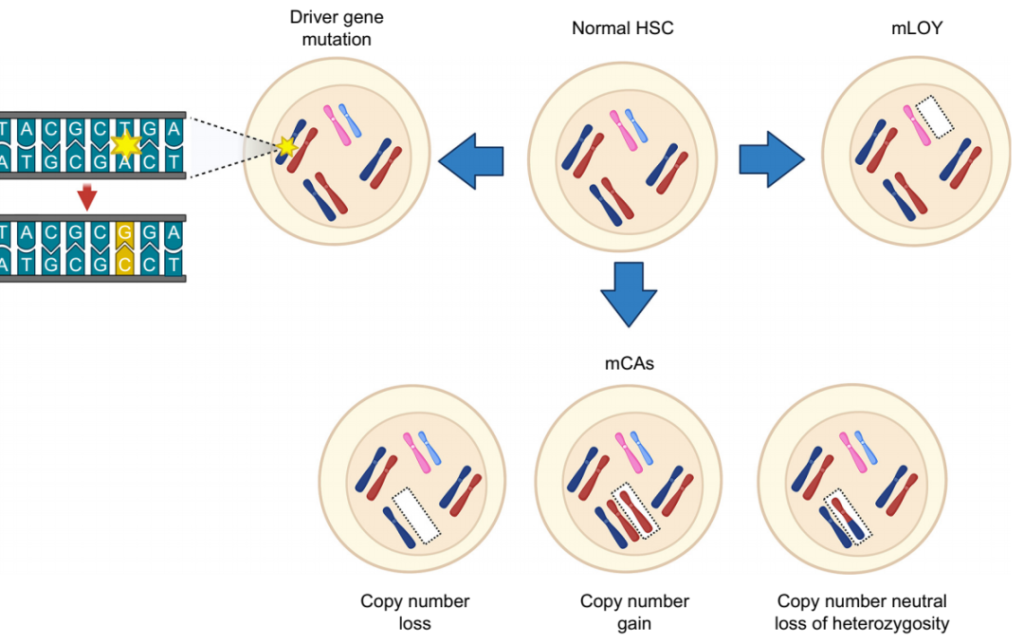
图5. 体细胞变异的不同类型[5]
克隆性造血(CH)
我国有句谚语-“七十古来稀”,人类尤其在70岁以后,各项器官功能会突然急剧衰退,其中,特别是血液成分的重大变化引起了科学家们的注意。一系列的研究表明,随着年龄的增长,人类造血干细胞中积累的基因突变也在一直积累,从理论分析,由于每个造血干细胞在每十年的生命中将产生约1个蛋白编码突变,预计到70岁时,人体造血干细胞库将携带多达140万个蛋白编码变异[6]。
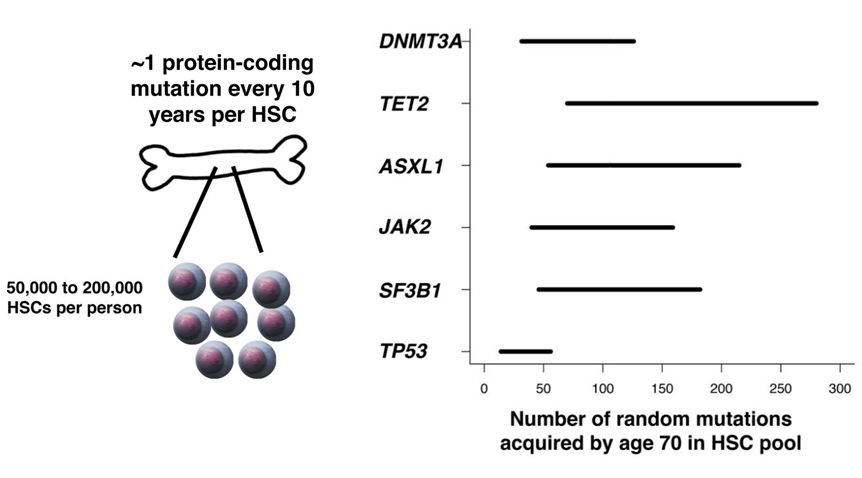
图6. 70岁时 人体造血干细胞将积累大量体细胞变异[6]
一项跨度为13年的研究证实,在出生后,造血干细胞以每年17个突变的速度积累体细胞变异,伴随着30bp/年的端粒长度减少。65岁之后,人的造血干细胞群体发生了巨大改变, 65岁以下成年人的血细胞来源于2-20 万个造血干细胞,同时造血干细胞具有高度多样性,并且每个造血干细胞贡献的量大致相同;相比之下,75岁以上个体的造血干细胞克隆多样性显著降低,甚至30-60%的造血仅仅是由12-18个独立的克隆产生的,每个克隆贡献多达1-34%的造血[7]。
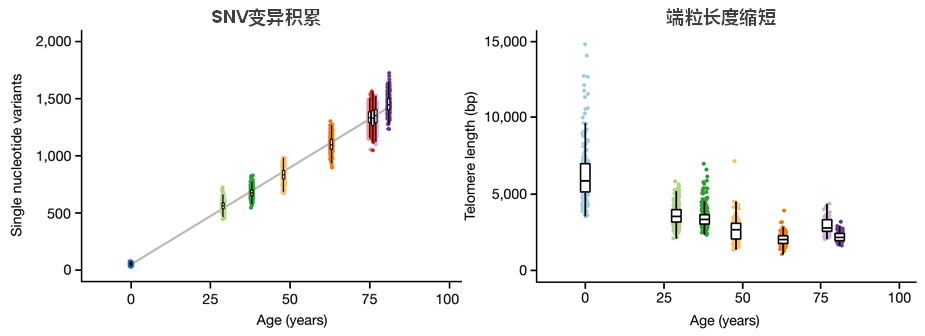
图7. 人体造血干细胞体细胞变异随年龄增加而改变[7]
极少数造血干细胞克隆贡献了很大一部分血液的产生,这就是克隆性造血现象。造血干细胞的体细胞突变将赋予某些克隆更具生长优势从而导致特定细胞谱系的扩张,该现象被称为克隆性造血(Clonal Haematopoiesis,CH)。克隆性造血在年轻人群中发生率很低,但在70岁以上老年群体中的发生率可达10%以上。
在克隆性造血中,有一类被称为潜能不明克隆性造血(Clonal haematopoiesis of indeterminate potential, CHIP)。尽管大多数明确的恶性肿瘤,如急性髓系白血病(AML)或骨髓增生异常综合征,都有几个驱动突变,但约90%的CHIP携带者只有一个。因此,CHIP可能代表一种癌前状态。
令人惊讶的是,部分CHIP携带者的冠心病和脑卒中的发病率显著增加,而不是血液恶性肿瘤,CHIP的风险程度甚至超过了传统风险因素高血压。后续,我们将进一步介绍这一新发现的心脑血管疾病风险因素-CHIP。
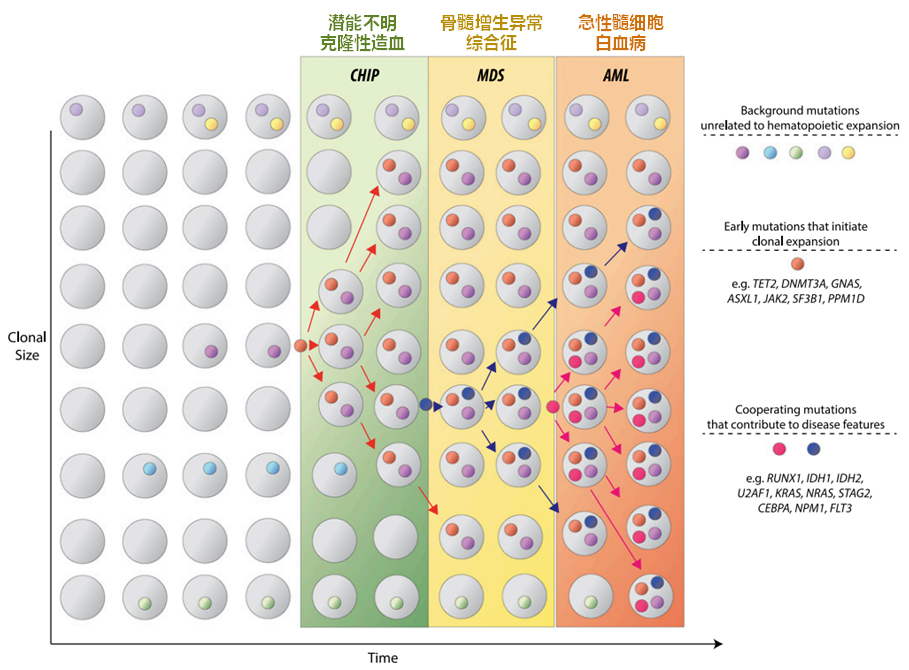
图8. 克隆性造血与潜能不明克隆性造血[8]
参考文献
1. Tomasetti C. Mutated clones are the new normal[J]. Science, 2019, 364(6444): 938-939.
2. Yizhak K, Aguet F, Kim J, et al. RNA sequence analysis reveals macroscopic somatic clonal expansion across normal tissues[J]. Science, 2019, 364(6444): eaaw0726.
3. Jacobs PA, Brunton M, Court Brown WM, Doll R, Goldstein H. Change of human chromosome count distribution with age: evidence for a sex differences. Nature 197: 1080–1081, 1963.
4. Sano S, Horitani K, Ogawa H, et al. Hematopoietic loss of Y chromosome leads to cardiac fibrosis and heart failure mortality[J]. Science, 2022, 377(6603): 292-297.
5. Evans M A, Walsh K. Clonal hematopoiesis, somatic mosaicism, and age-associated disease[J]. Physiological Reviews, 2023, 103(1): 649-716.
6. Jaiswal, S. & Ebert, B. L. Clonal hematopoiesis in human aging and disease. Science366, eaan4673 (2019).
7. Mitchell E, Spencer Chapman M, Williams N, et al. Clonal dynamics of haematopoiesis across the human lifespan[J]. Nature, 2022, 606(7913): 343-350.
8. Steensma D P, Bejar R, Jaiswal S, et al. Clonal hematopoiesis of indeterminate potential and its distinction from myelodysplastic syndromes[J]. Blood, The Journal of the American Society of Hematology, 2015, 126(1): 9-16.
推荐阅读