潜能不明克隆性造血(CHIP),危害更大的新型心血管危险因素 | 研究回顾
- boke
- 2024-01-12
- 4:56 下午
通过生活方式干预和危险因素防控可有效延缓或避免心脑血管事件的发生,1980-2000年,西方国家心血管病死亡下降约50%,主要归功于危险因素的控制[1]。
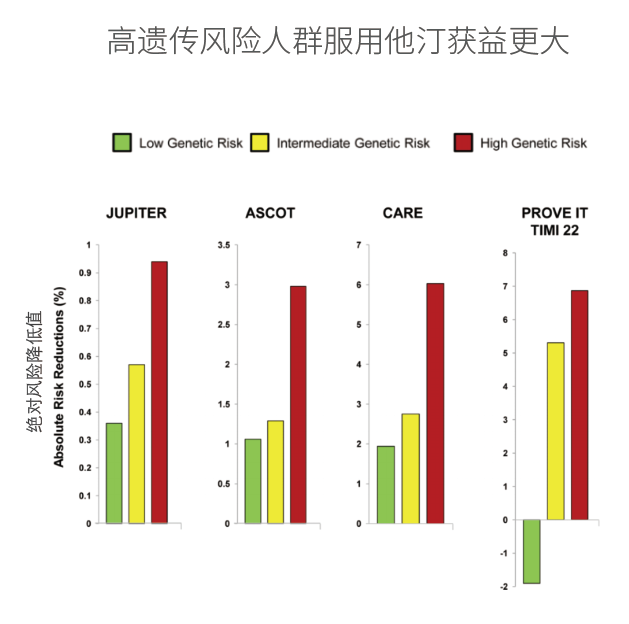
心脑血管疾病的危险因素包括年龄、性别、血压、血脂、血糖等生理生化因素,也包括以多基因遗传为主的遗传风险。近年来,一种全新的重要心脑血管风险因素进入人们的视野,被称为潜能不明克隆性造血(CHIP)。携带CHIP个体的冠心病和缺血性脑卒中风险增加1倍,且独立于传统心血管危险因素,在欧美人群中,其危害甚至超过了总胆固醇和高血压(图1)。
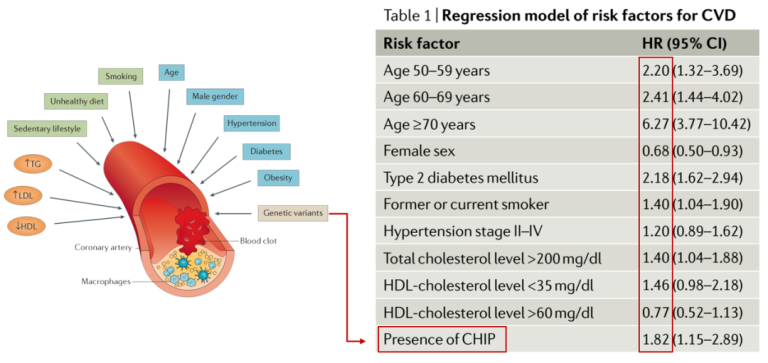
图1. 肌肉与皮肤中的体细胞变异积累[1]
CHIP定义
随着年龄的增长,我们可能会获得基因组体细胞突变,CHIP则是源于造血干细胞的体细胞突变。不过这种情况与恶性血液肿瘤不同,过渡到急性白血病通常需要获得2或3个白血病驱动基因突变,但约90%的CHIP携带者只有一个。而且,大多数携带这些克隆突变白细胞的个体永远不会发展为白血病,因此,这种情况被称为“潜能不明”。

CHIP与动脉粥样硬化,心肌梗死等多种心脑血管不良事件的发生相关,携带CHIP可以使心脑血管疾病发病风险增加40%,并独立于传统风险因素。CHIP与心脑血管疾病之间的联系,来自2014年一项研究的“意外”发现,接下来,我们简要梳理CHIP与心脑血管疾病的相关研究。
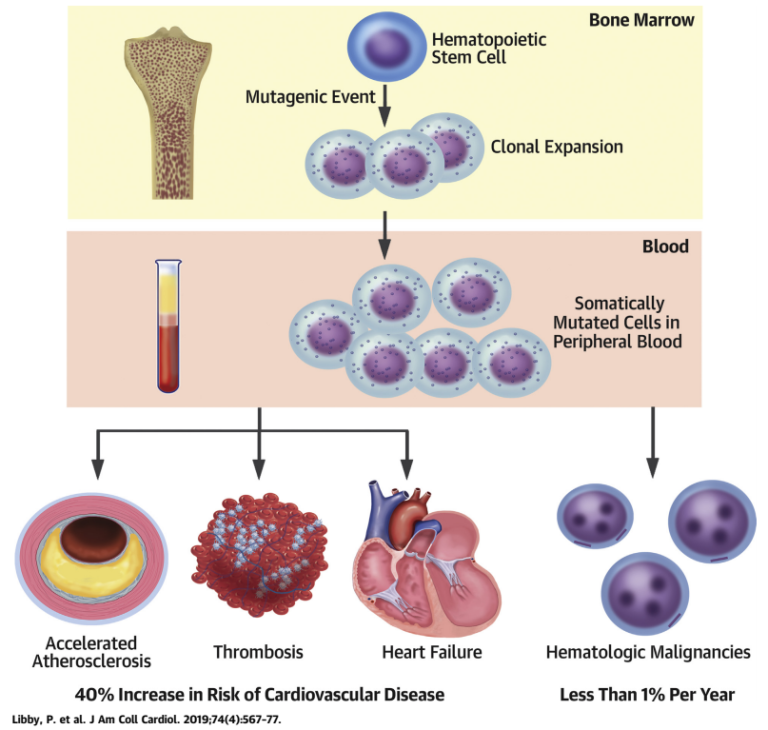
图2. CHIP导致心脑血管疾病风险增加[4]
CHIP与心脑血管疾病发病率
克隆性造血最初是在20世纪60年代慢性髓性白血病患者的细胞遗传学研究中被发现的。随着高通量测序技术的发展,到了2014年,三组研究人员分析了数万人的全外显子测序(WES)数据[5-7],证明了克隆性造血是常见的,这些突变主要发生在常见的髓系肿瘤相关的基因中,如DNMT3A、TET2、ASXL1、TP53、JAK2和SF3B1基因。这三项研究都揭示了克隆性造血与年龄之间的显著关联。
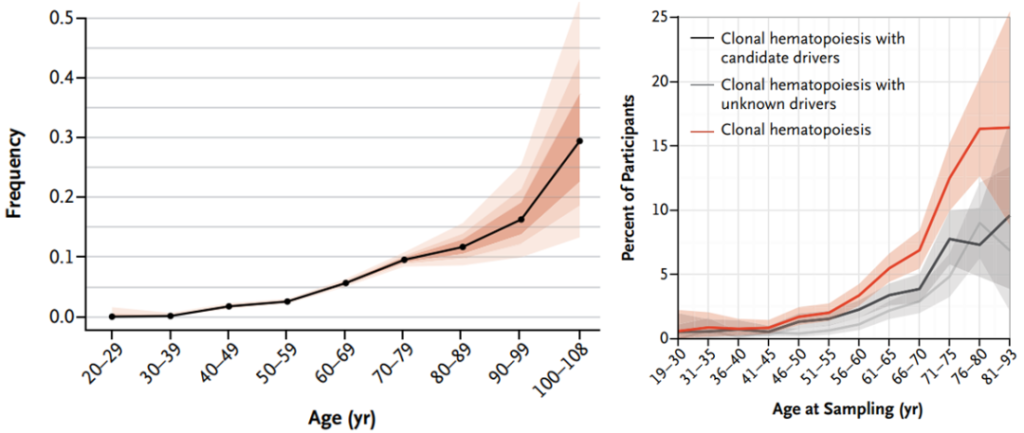
图3. 克隆性造血在40岁以下的人群中很少见,但在60-69岁的人群中约有6%,在70-89岁的人群中约有12%,在90岁及以上的人群中约有20%[5、6]。
而其中一个研究小组原本是希望探究克隆性造血与年龄相关的血液肿瘤发生风险以及全因死亡之间的关联[5],但他们却意外的发现,CHIP携带者死亡率更高的原因并不是血液恶性肿瘤的发病率更高,而是致命的脑卒中和心脏病发作。分析发现,携带CHIP的个体发生冠心病和缺血性脑卒中的风险直接翻倍,携带CHIP个体的冠心病未来十年风险约为14%,而不携带CHIP的个体约为7%。
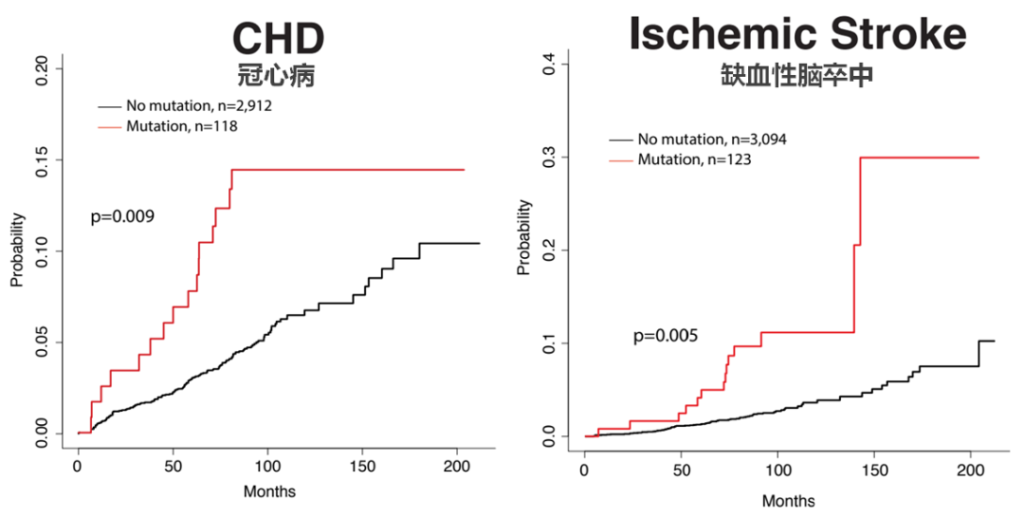
图4. 克隆性造血显著增加冠心病与缺血性脑卒中发病风险[5]
值得注意的是,CHIP携带者的冠心病和缺血性脑卒脑卒中险甚至高于具有传统心脑血管疾病危险因素的个体,比如高血压或高BMI(图5)。随后,更多的研究揭示这两种现象之间的关系。
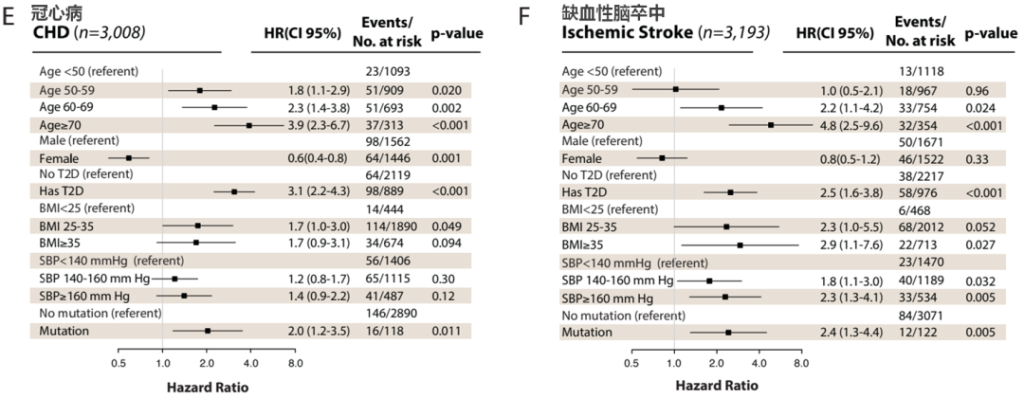
图5. CHIP是一种全新的心脑血管疾病风险因素[5]
为了验证上述研究的结果,该研究小组选择了额外的病例-对照队列,以直接测试CHIP是否与心脑血管疾病发病率增加相关[8]。对2个前瞻性和2个回顾性病例-对照研究中获得的血液样本进行了全外显子测序(WES)分析,包括4,726名冠心病患者和3,529名对照者。研究结果显示,较未携带者,CHIP携带者患冠心病和早发型心肌梗死的风险分别约为2倍和4倍(图6)。
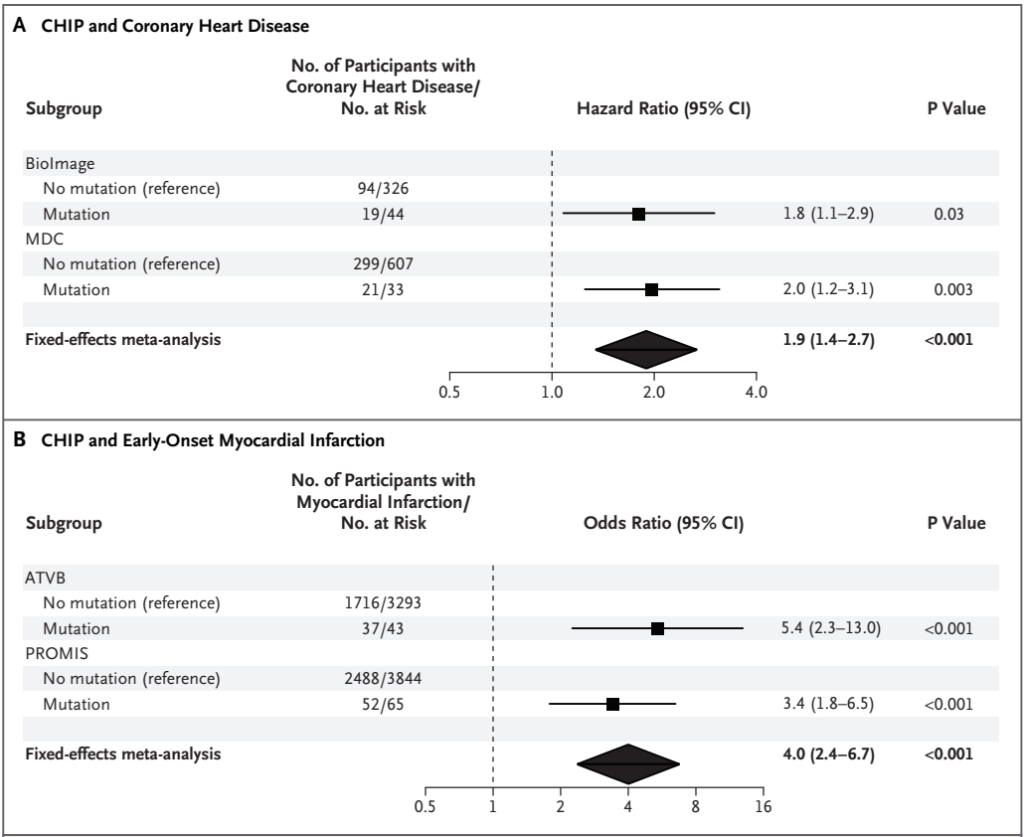
图6. CHIP与冠心病以及早发型心肌梗死的相关性[8]
与以前的研究一致,该研究发现大多数突变在DNMT3A、TET2、ASXL1和JAK2基因中检测到。虽然携带DNMT3A(hazard ratio:1.7)、TET2(hazard ratio:1.9)或ASXL1(hazard ratio:2.0)突变的个体患冠心病的风险增加没有统计学上的差异,但携带JAK2突变的个体与携带其他突变的个体相比,疾病风险显著增加(hazard ratio:12.0)。当然,这项研究工作还比较初步,因为JAK2突变携带者的样本量非常低。另一方面,对BioImage前瞻性研究中的个体进行的分析发现,CHIP携带者更有可能出现冠状动脉钙化,这取决于克隆大小(VAF)(图7)。
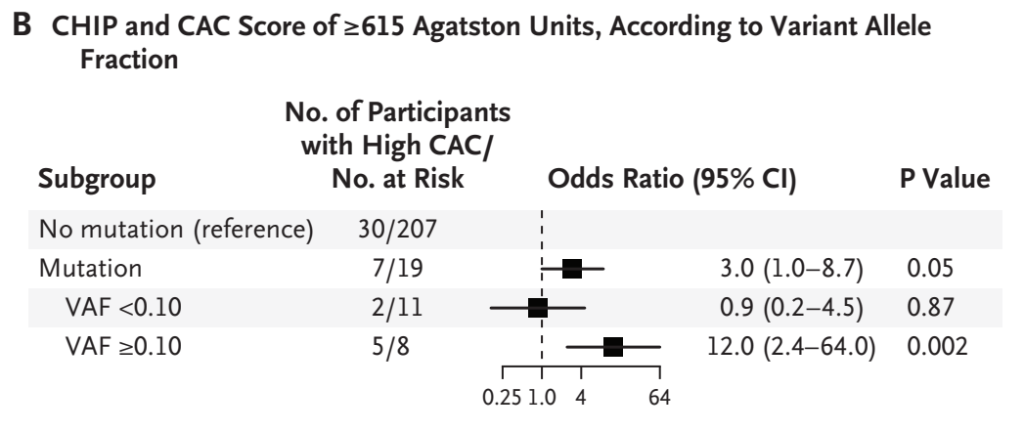
图7. CHIP的克隆大小(VAF)与冠状动脉钙化发生相关[8]
除了上述的重要发现之外,近年来,还有大量关于CHIP与心脑血管疾病之间关联的相关研究工作。首先,由Yu等人进行的研究使用了来自56,597名个体的全基因组/全外显子测序数据(WGS/WES),评估了CHIP与心力衰竭风险之间的关联。该研究使用了来自英国生物库和四个前瞻性人群队列(TOPMed)的数据,这使得研究者能够获得更大的统计学能力[9]。研究发现,CHIP使得心力衰竭风险增加了25%,并且独立于传统心脑血管疾病危险因素。与Jaiswal等人[8]的结果相似,研究者发现CHIP与心力衰竭风险之间的剂量依赖关系,克隆体越大,风险越大。在检查特定的CHIP驱动基因时,发现TET2、JAK2和ASXL1的突变与心力衰竭风险相关。
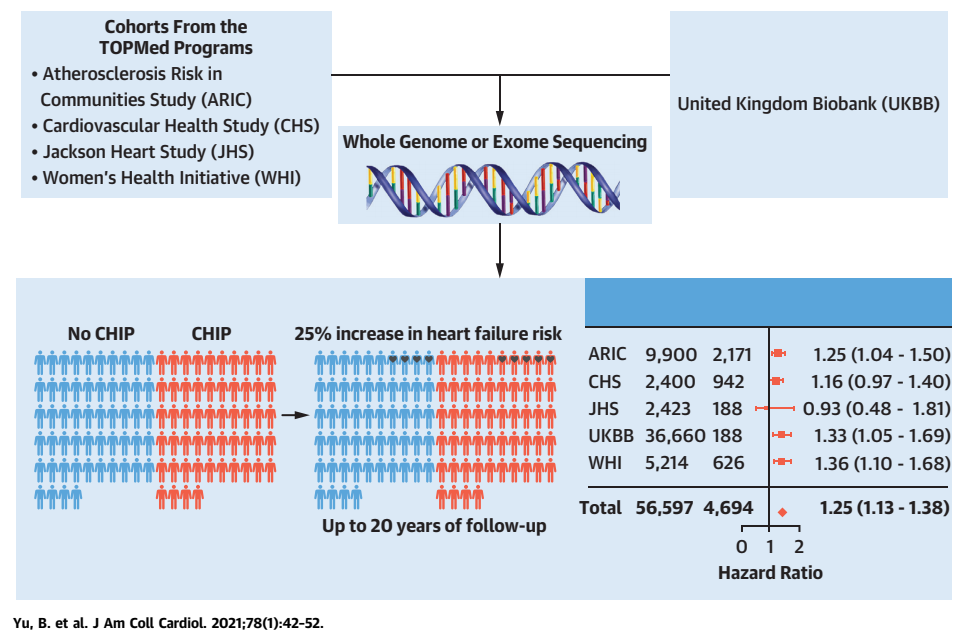
图8. CHIP与心力衰竭发生相关[9]
其次,另一项与之同时发表的研究报告了CHIP与绝经后女性冠心病发病率增加之间的关联[10]。使用来自英国生物库的总共19,606名绝经后女性的全外显子测序数据(WES)和来自女性健康计划的全基因组数据(WGS)进行分析,发现CHIP确实与女性绝经过早相关,还发现具有CHIP的绝经后女性患冠心病的发病率增加(odd ratio:1.36),对于具有较大克隆体(VAF >0.1)的妇女(图9),这种关联更为明显,再次表明CHIP与心脑血管疾病风险之间存在剂量依赖关系。
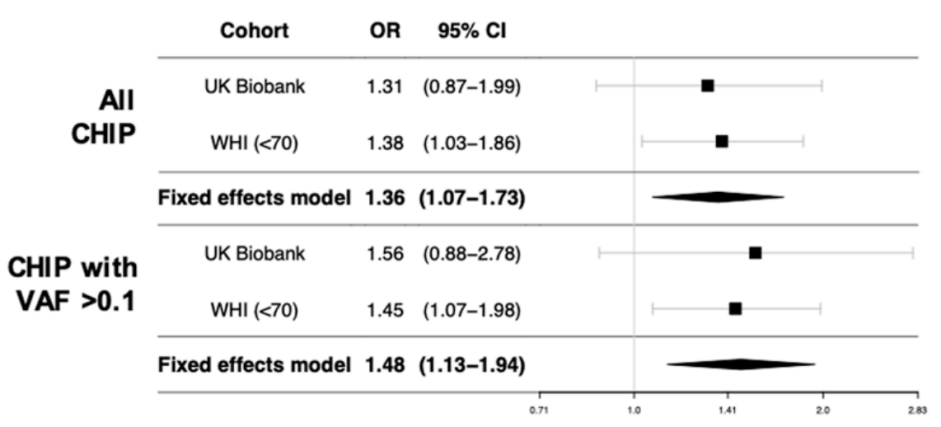
图9. CHIP与冠心病发病风险存在VAF剂量依赖关系[10]
第三,在一组进行髋关节置换手术的200名患者中,发现CHIP与心脑血管疾病显著相关,包括高血压、冠心病、心肌梗死、心律失常和脑卒中[11]。
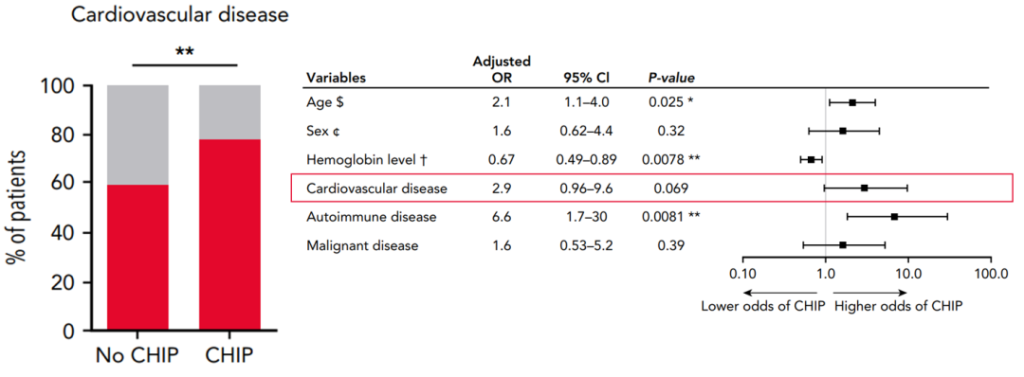
图10. CHIP与心脑血管疾病发生显著相关[11]
第四,在涉及来自两个不同生物库的50,122名个体的研究中,报告了CHIP与动脉疾病发病率之间的关联[12]。研究人员还记录了CHIP与其他动脉粥样硬化疾病,如冠心病、主动脉瘤和肠系膜缺血之间的关联,进一步支持了CHIP与动脉粥样硬化性心脑血管疾病之间的联系。基因特异性分析揭示了大多数常见的突变CHIP基因与周围动脉疾病相关,包括TET2、ASXL1、PPM1D、TP53和JAK2,但有趣的是,该研究没有发现DNMT3A与心脑血管疾病风险升高相关。
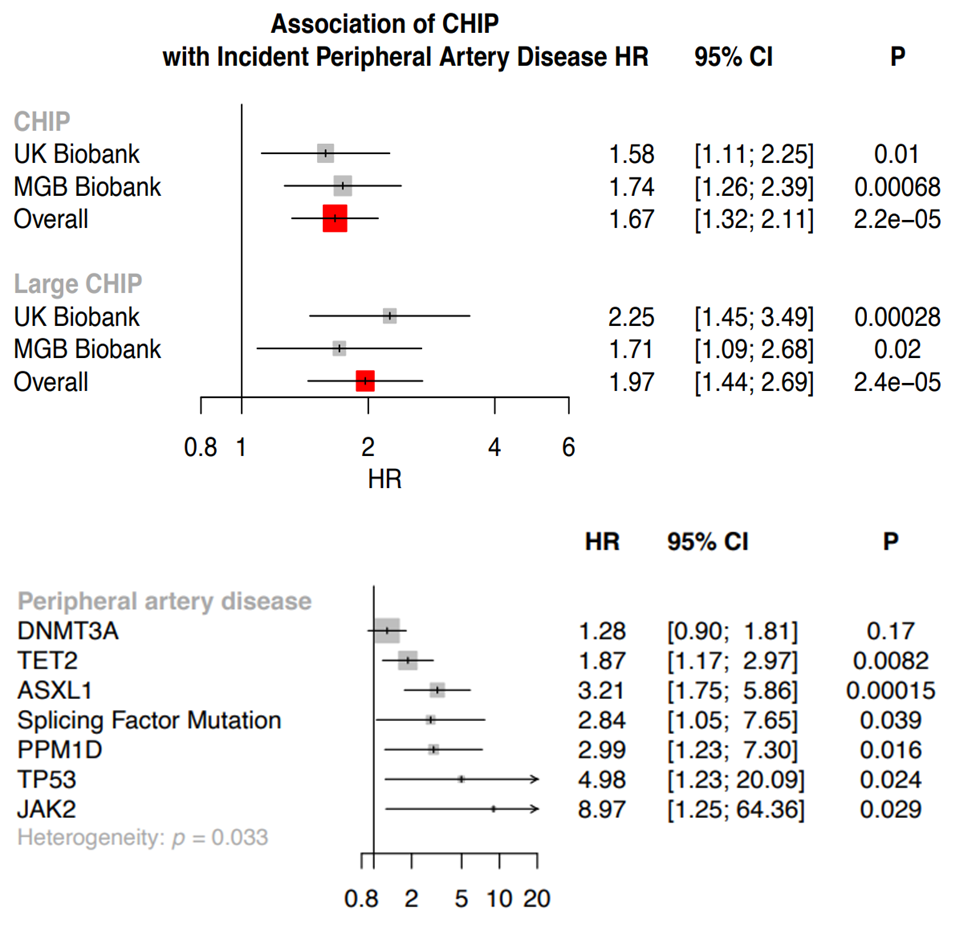
图11. CHIP与外周动脉疾病的基因特异性关联[12]
最后,一项使用来自8个前瞻性队列和生物库的78,752名个体的血液DNA基因组序列数据的研究发现,CHIP与脑卒中风险增加相关[13]。在检查主要类型的脑卒中时,携带CHIP个体的出血性脑卒中风险明显增加。对这些主要类型内的亚型分析显示,CHIP与所有出血类型以及小血管缺血性脑卒中的风险增加相关。在基因特异性关联结果中,TET2与缺血性脑卒中的关联最强,而DNMT3A与出血性脑卒中的风险升高相关。总的来说,这些发现进一步支持了最初的研究发现,即CHIP与心脑血管疾病的风险增加相关。
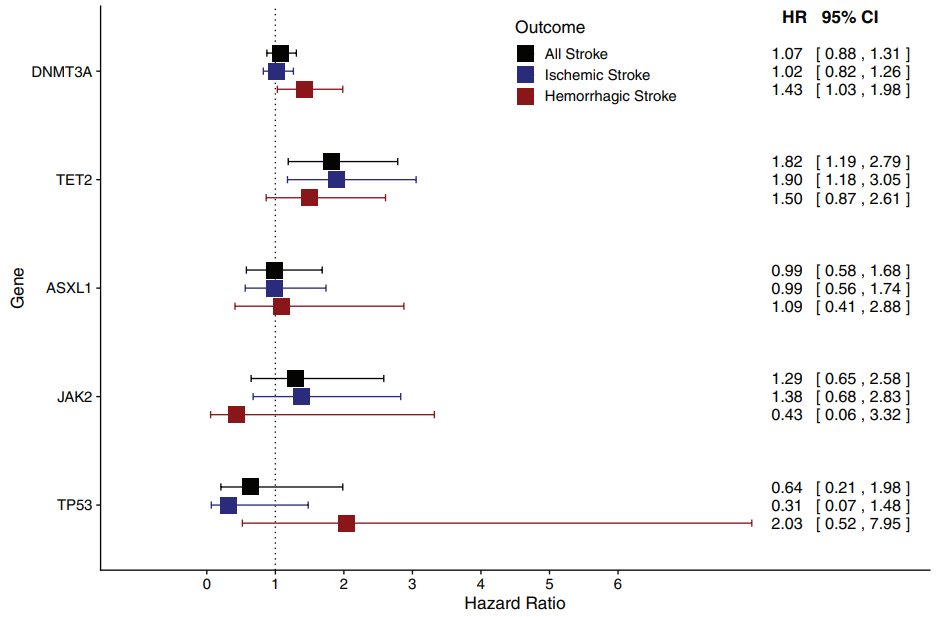
图12. 不同基因造血克隆变异与脑卒中的风险关联[13]
CHIP与心脑血管疾病预后
为了评估CHIP在患有心脑血管疾病人群中的潜在预后意义,Dorsheimer等人[14]研究了患有缺血性原因慢性心力衰竭(CHF)的CHIP携带者的长期预后。使用深度靶向测序分析了200名CHF患者的骨髓来源单核细胞中的CHIP相关基因频率,该Gene Panel涵盖了56个CHIP相关基因[14]。该研究发现,18.5%的患者携带至少2% VAF的CHIP克隆。与先前的研究一致,大多数都检测到了DNMT3A和TET2基因变异。研究还发现携带DNMT3A或TET2突变的患者在心力衰竭复发以及相关死亡方面的整体临床结果均较差。
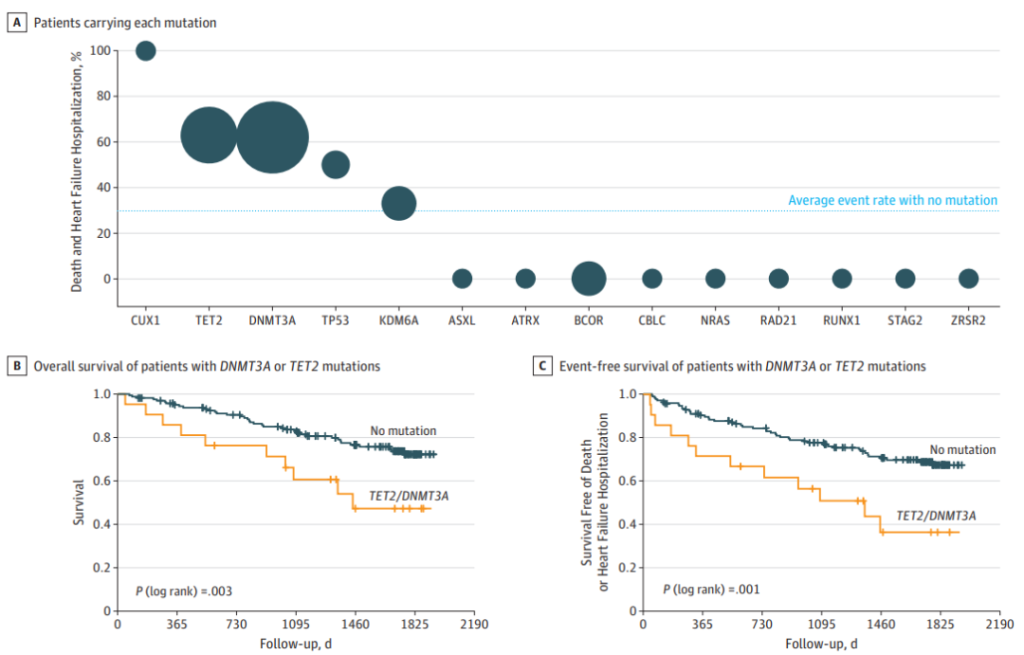
为了评估这种关联是否与克隆大小相关,突变的VAF阈值降低到0.5%。因此,额外的66名DNMT3A和53名TET2突变患者被识别出,其克隆大小VAF范围为0.5-2%。当根据VAF(TET2或DNMT3A中没有突变,VAF <1%;1-2%;>2%)对患者进行分组时,发现克隆大小与临床结果之间存在剂量依赖性关系。此外,这项分析表明,1%到2%的VAF之间的克隆大小,低于提出的CHIP阈值,与不良预后相关[14]。虽然这项研究规模较小,但支持了克隆性造血与CHF患者的进展和不良预后之间存在关联的假设。此外,额外的驱动基因也可能参与CHIP对心脑血管疾病的影响,例如PPM1D、GNB1等基因[15],因此,揭示不同基因突变的CHIP致病机制将为心脑血管疾病的预防和治疗提供新的思路。
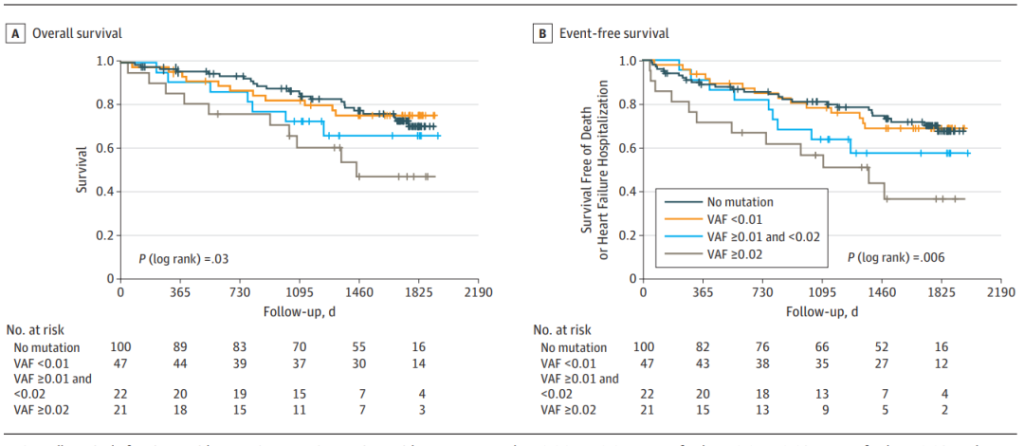
图14. 慢性心力衰竭患者预后与CHIP中DNMT3A或TET2基因突变克隆的大小存在剂量依赖关系[14]
CHIP与血栓形成
克隆性造血也与血栓形成相关联,而血栓是心肌梗死和缺血性卒中的最常见病理基础。具体而言,Wolach等人[16]的研究分析了11,527名个体参与的大型病例/对照研究的全外显子测序(WES)数据,其中包括健康对照组和患有精神分裂症的患者。他们发现,CHIP与主要血栓事件(如深静脉血栓或肺血栓)的发病率显著相关。在携带JAK2V617F突变的个体中,这种关联明显更强,有25%的携带者经历了血栓事件。此外,还记录了即使JAK2V617F克隆的VAF仅为2%,也会增加患血栓症的风险。
研究人员将这种血栓症风险增加归因于JAK2V617F突变中性粒细胞更容易形成细胞外陷阱,这可以促进血栓形成。JAK2V617F突变已与多种致病机制相关联,包括红细胞和血小板的异常功能以及整合素活性增强。无论如何,这些发现可能解释了与携带JAK2突变CHIP个体的心脑血管疾病风险显著增加,进一步的研究将更详细地揭示这种关联。
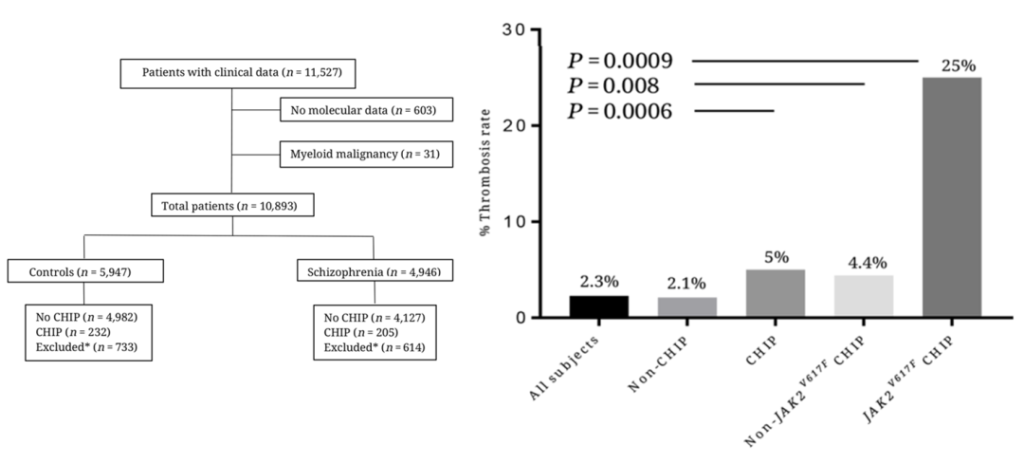
图15. 大规模人群队列数据揭示JAK2-CHIP与血栓发生显著相关[16]
尽管在过去5年中我们对CHIP的理解有了飞速的发展,但这一领域的研究仍然是新兴的并且在不断发展中。CHIP现象是许多慢性衰老性疾病的新兴风险因素。虽然它与心脑血管疾病的关联现在更加清晰,但目前尚不清楚CHIP所带来的不良后果是否可以逆转。
目前,我们对CHIP与心脑血管疾病之间联系的理解尚不完全,但早期结果表明,这种增加的风险可能是由于免疫系统紊乱造成。随着我们对CHIP致病机制研究的深入,将有望开发可以预防其有害影响的治疗方法,并最终形成针对CHIP这一心脑血管新兴危险因素的系统管理方案。
参考文献
1. Ford ES, Ajani UA, Croft JB, Critchley JA, Labarthe DR, Kottke TE, Giles WH, Capewell S. Explaining the decrease in U.S. deaths from coronary disease, 1980-2000. N Engl J Med. 2007 Jun 7;356(23):2388-98.
2. Khera AV, Kathiresan S. Genetics of coronary artery disease: discovery, biology and clinical translation. Nat Rev Genet. 2017 Jun;18(6):331-344.
3. Jaiswal S, Libby P. Clonal haematopoiesis: connecting ageing and inflammation in cardiovascular disease. Nat Rev Cardiol. 2020 Mar;17(3):137-144.
4. Libby P, Sidlow R, Lin A E, et al. Clonal hematopoiesis: crossroads of aging, cardiovascular disease, and cancer: JACC review topic of the week[J]. Journal of the American College of Cardiology, 2019, 74(4): 567-577.
5. Jaiswal, S. et al. Age-related clonal hematopoiesis associated with adverse outcomes. N. Engl. J. Med. 371, 2488–2498 (2014).
6. Genovese, G. et al. Clonal hematopoiesis and blood-cancer risk inferred from blood DNA sequence. N. Engl. J. Med. 371, 2477–2487 (2014).
7 Xie, M. et al. Age-related mutations associated with clonal hematopoietic expansion and malignancies. Nat. Med. 20, 1472–1478 (2014).
8. Jaiswal S, Natarajan P, Silver A J, et al. Clonal hematopoiesis and risk of atherosclerotic cardiovascular disease[J]. New England Journal of Medicine, 2017, 377(2): 111-121.
9. Yu B, Roberts M B, Raffield L M, et al. National Heart, Lung, and Blood Institute TOPMed Consortium. Supplemental association of clonal hematopoiesis with incident heart failure[J]. J Am Coll Cardiol, 2021, 78(1): 42-52.
10. Honigberg M C, Zekavat S M, Niroula A, et al. Premature menopause, clonal hematopoiesis, and coronary artery disease in postmenopausal women[J]. Circulation, 2021, 143(5): 410-423.
11. Hecker J S, Hartmann L, Riviere J. CHIP & HIPs: Clonal Hematopoiesis is Common 4 in Hip Arthroplasty Patients and Associates with Autoimmune Disease[J]. Blood, 2021, 5.
12. Zekavat S M, Viana-Huete V, Jorshery S D, et al. TP53-mediated clonal hematopoiesis confers increased risk for incident peripheral artery disease[J]. medRxiv, 2021: 2021.08. 22.21262430.
13. Bhattacharya R, Zekavat S M, Haessler J, et al. Clonal hematopoiesis is associated with higher risk of stroke[J]. Stroke, 2022, 53(3): 788-797.
14. Dorsheimer L, Assmus B, Rasper T, et al. Association of mutations contributing to clonal hematopoiesis with prognosis in chronic ischemic heart failure[J]. JAMA cardiology, 2019, 4(1): 25-33.
15. Cremer S, Kirschbaum K, Berkowitsch A, et al. Multiple somatic mutations for clonal hematopoiesis are associated with increased mortality in patients with chronic heart failure[J]. Circulation: Genomic and Precision Medicine, 2020, 13(4): e003003.]
16. Wolach O, Sellar R S, Martinod K, et al. Increased neutrophil extracellular trap formation promotes thrombosis in myeloproliferative neoplasms[J]. Science translational medicine, 2018, 10(436): eaan8292.
17. Evans M A, Walsh K. Clonal hematopoiesis, somatic mosaicism, and age-associated disease[J]. Physiological Reviews, 2023, 103(1): 649-716.
推荐阅读