柳叶刀子刊综述:mRNA癌症疫苗及其临床试验进展
- boke
- 2023-01-06
- 7:07 上午
mRNA新冠疫苗取得了惊人的成功,目前全球已有数十亿人接种了mRNA新冠疫苗。
mRNA癌症疫苗研究最早于1996年在树突细胞中进行了体外实验研究。如今30多年过去了,随着技术的进步,mRNA癌症疫苗行则将至,做则必成。2022年10月,4位癌症领域的专家在The Lancet Oncology期刊发表综述论文,概述了目前mRNA癌症疫苗的研发进展和临床试验情况。截止目前,处于临床实验阶段的mRNA癌症疫苗项目多达数十项。
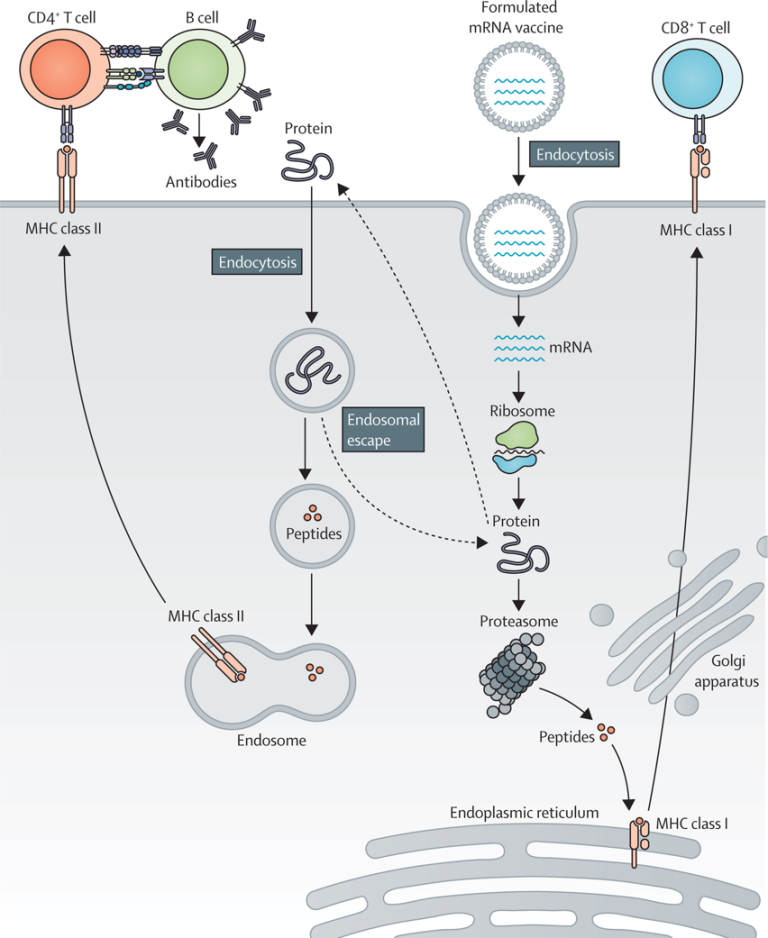
图1 mRNA的疫苗的工作原理
接种mRNA疫苗的目标是诱导或增强有效的抗肿瘤免疫反应。编码肿瘤相关或肿瘤特异性抗原的合成mRNA通过体内外设计有mRNA的自体树突状细胞或通过封装或非封装的mRNA注射进行传递。在接种疫苗并被抗原递呈细胞摄取后,mRNA被运送到细胞质中,经过抗原处理并进入主要组织相容性复合体(MHC)递呈级联反应。因此,抗原递呈细胞在MHC I和MHC II上呈现肿瘤相关的抗原,以激活CD8+和CD4+T细胞。此外,CD4+T细胞可以共同激活抗原特异性B细胞并诱导体液免疫反应。在细胞外蛋白内化并递呈到B细胞的MHC II后,B细胞可以作为抗原递呈细胞反过来激活CD4+T细胞(图1)。
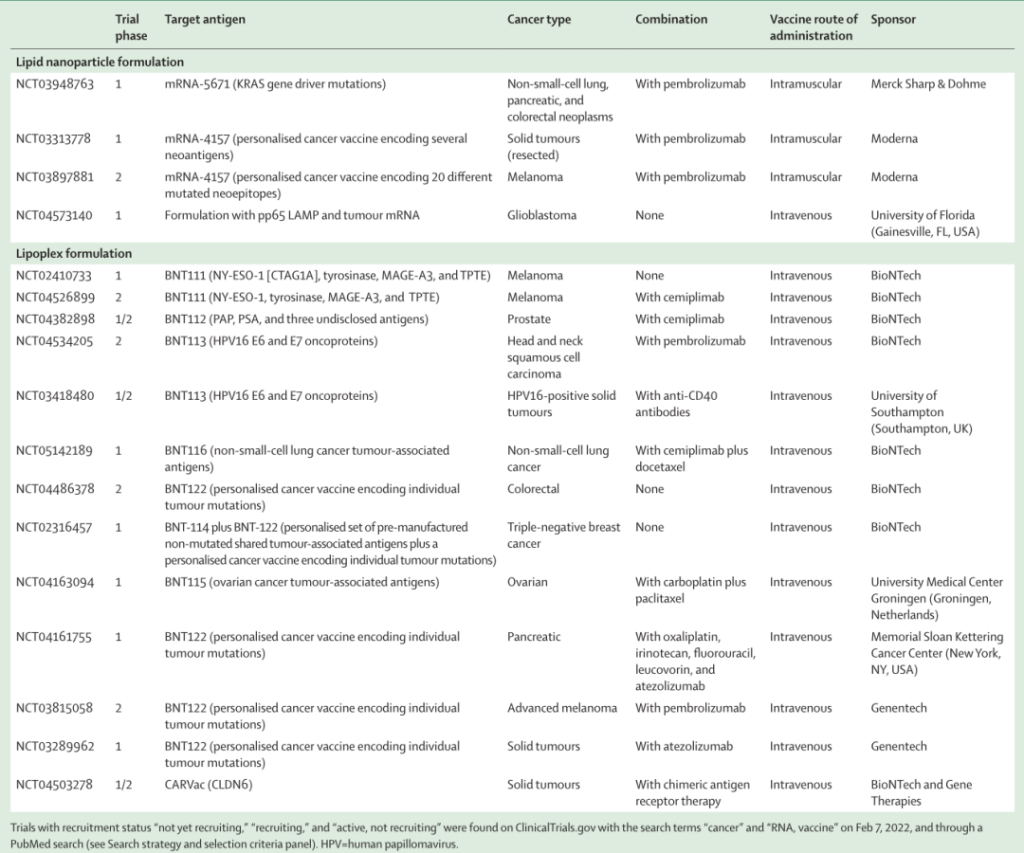
表1 ClinicalTrials.gov注册的mRNA的肿瘤疫苗试验(按剂型分类)
mRNA癌症疫苗的设计一般需要经过几个步骤。首先,进行患者健康组织(例如外周血单核细胞)和肿瘤活检样本的NGS测序,比较肿瘤和正常DNA的测序数据以鉴定肿瘤特异性突变。其次,通过计算方法,如MHC结合预测、突变转录物表达的定量、突变的克隆性和其他特征,根据其引发T细胞反应的可能性,将突变作为抗原候选。最后,使用所选择的疫苗平台(如mRNA或多肽),在GMP条件下按需生产个体化和特异性肿瘤新生抗原疫苗。

表2 不同制剂类型的mRNA肿瘤疫苗试验结果综述(2017-2022)
目前处于临床试验的阶段的mRNA肿瘤疫苗有3大类:裸露型mRNA癌症疫苗、封装型mRNA癌症疫苗以及树突细胞疫苗。
未封装(裸露)的mRNA疫苗将mRNA分子保存于缓冲溶液中,这种疫苗可以通过皮内或结节内注射给药。mRNA在结节内给药可以在T细胞激活的实际位置将抗原传递给抗原呈递细胞,从而避免了对抗原呈递细胞迁移的要求。几项研究表明,树突状细胞可以通过结内注射未封装的mRNA疫苗并诱导出强大的抗肿瘤T细胞反应。
在过去的5年中,只有少数临床试验采用此类疫苗。裸露的mRNA很容易被细胞外的RNA酶降解。为此研究人员开发了几种纳米载体系统来优化mRNA的保存并促进抗原呈递细胞对mRNA的摄取。目前有鱼精蛋白(Protamine)封装疫苗、脂质复合物封装疫苗和脂质纳米颗粒封装疫苗。
1、鱼精蛋白封装的mRNA癌症疫苗
鱼精蛋白是带正电荷的聚阳离子多肽,它与带负电荷的信使核糖核酸形成聚合物以提高蛋白质表达和免疫原性,并且保护分子免受降解。鱼精蛋白封装的mRNA疫苗以RNActive疫苗的形式在不同的临床试验中进行了评估。总体来看该类疫苗展示出较高的安全性,然而临床试验效果不是特别显著。
2、mRNA脂质复合体疫苗
mRNA脂质复合体疫苗是一种混合载体,将mRNA复合物与聚阳离子成分结合在脂质外壳内。带正电荷的阳离子脂质与带负电荷的mRNA自然形成复合物,促进抗原提呈细胞的内吞作用,因此该方法经常用于构建脂质复合物。表1列出了正在进行的mRNA脂质复合物疫苗试验。临床试验结果见表3。目前BioNtech和Genentech均有多个在研临床研究项目。
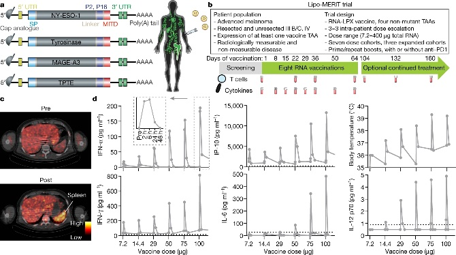
图2 mRNA肿瘤疫苗试验设计和疫苗介导的免疫激活[1]
1期剂量递增试验(NCTO2410733)评估了编码四种黑色素瘤肿瘤相关抗原的mRNA脂质复合物疫苗(BNT111)。在表达四种抗原中至少一种的晚期黑色素瘤患者中具备安全性和有效性。BNT111是共享癌症抗原(FixVac)mRNA疫苗的固定组合系列中的第一个试验,其中包括共享肿瘤相关抗原的固定组合。50名患者中,超过39名(75%)检测到针对一种或多种肿瘤相关抗原的免疫反应,并且BNT111诱导了CD4+和CD8+T细胞反应。17名患者接受了BNT111加标准抗PD-1治疗:这些患者中有6名(35%)有部分缓解,两名(12%)患者病情稳定。25名患者接受了BNT111单药治疗,其中3名(12%)达到部分缓解,7名(28%)患者达到疾病稳定。
3.mRNA-LNP疫苗
脂质纳米颗粒(Lipid nanoparticle, LNP)疫苗由可电离脂质、胆固醇、磷脂和脂质连接的聚乙二醇衍生物组成。胆固醇和脂增加了稳定性并保持脂质纳米颗粒疫苗的双层结构。聚乙二醇防止mRNA血浆蛋白结合,从而增加了纳米颗粒在体内的循环周期数。脂质纳米颖粒疫苗的特性受pH值变化的影响,这有利于mRNA封装和宿主细胞内吞作用。最近首批两种脂质纳米颗粒新型冠状病毒疫苗获得批准,mRNA纳米颗粒疫苗载体系统也受到了关注。
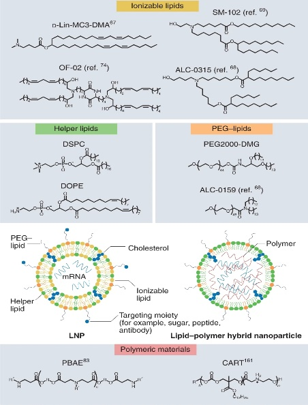
图3 脂质纳米颗粒mRNA疫苗结构[2]
有两种脂质纳米颗粒mRNA癌症疫苗正在接受评估。它们分别是两种编码几种新抗原(mRNA-4157)的脂质纳米颗粒mRNA癌症疫苗与pembrolizumab联合作为完全切除后高危皮肤黑色素瘤患者的辅助治疗(NCTO3313778和NCT03897881)方案。在完全切除的实体瘤(NCTO3313778患者中采用相同的疫苗模板(mRNA-4157)作为单药疗法进行了检查,并在不可切除的实体瘤患者中将其与pembrolizumab联合使用。该治疗诱导了新抗原特异性T细胞并且没有导致严重的不良事件。
13名患者接受mRNA-4157单药治疗,除1名患者外,所有患者在研究治疗中均未发现癌症,中位随访时间为8个月。接受联合治疗的19名可评估患者中,有1名(5%)患者在接种疫苗前处于完全缓解状态,2名(11%)患者为部分缓解,5名(36%)患者病情稳定,5名(36%)患者已确认疾病进展,2名(11%)患者未确认疾病进展。mRNA-5671疫苗针对4个KRAS突变,一期临床试验(NCT03948763),mRNA疫苗在KRAS突变的NSCLC、结直肠癌或胰腺癌患者或与K药联合使用。
树突细胞在免疫疗法中特别受关注,因为它们不仅具有启动免疫的独特能力,还具有控制和调节免疫反应类型的能力,这使它们成为mRNA递送载体的理想之选。在过去30年中,研究的重点是生成体外装载了抗原的树突状细胞群,这些细胞能够刺激癌症患者产生强大而持久的CD8+和CD4+ T细胞反应。与制备封装和非封装的mRNA疫苗相比,除了抗原制备和装载之外,获取树突细胞的来源并对其进行离体操作既费力又耗时。

表3 树突状细胞mRNA肿瘤疫苗试验项目汇总
一般而言,装载mRNA的树突状细胞疫苗可诱导适度T细胞反应,但临床疗效低。然而,一些研究表明,基于mRNA的树突细胞疫苗可预防或推迟疾病复发,并有可能延长总生存期。过去5年公布的试验研究了患有各种癌症诊断的患者使用树突细胞疫苗的情况,方法包括疫苗单一疗法或与化疗或免疫联合疗法。在一项3期试验中,转移性肾细胞癌患者接受了载有扩增的肿瘤RNA和编码CD40L的mRNA的树突状细胞与酪氨酸激酶抑制剂sunitinib联合用药,该疫苗并未显著提高患者的生存率。在一项2期实验中,45名转移性前列腺癌患者接受了装载编码肿瘤相关抗原的mRNA的树突细胞,但该疫苗未显著提高患者的生存率。在2期试验中,晚期黑色素瘤患者接受了具有编码肿瘤相关抗原mRNA的TriMix树突细胞与抗CTLA-4抗体ipilimumab的联合治疗。
39名接受治疗的患者中,15名(38%)患者联合治疗达到部分缓解或完全缓解,但对两种治疗的缓解情况之间没有进行直接比较。20名急性髓性白血病缓解期患者接种了装载有编码肿瘤相关抗原mRNA的树突细胞。与历史对照组相比,接种疫苗患者的5年总生存率较高,43%的患者可以预防复发或延迟复发。总体来看,装载mRNA的树突状细胞疫苗可以诱导适度的T细胞反应,只是临床疗效较低。
目前,临床试验项目快速增加推动了mRNA癌症疫苗的研发进程,但还是面临不少的挑战和难题。比如识别肿瘤特异性突变或不一致序列并预测单个HLA等位基因对应的新表位依旧十分困难。此外,为实现mRNA癌症疫苗快速大规模量产,技术和监管障碍将成为潜在制约瓶颈。另一个挑战是验证疫苗效果的给药方式。给药途径决定mRNA分布并影响疫苗效力。肌肉注射是一种常见且可行的接种途径,目前批准的mRNA SARS-CoV-2疫苗都是通过肌肉注射来进行递送。静脉注射则可以使mRNA到达许多淋巴器官,与局部注射相比,这种给药方法已被证明能激发强烈的CD8+T细胞应答,而CD8+T细胞在抗肿瘤反应中发挥核心作用,因此,静脉注射是活性治疗性mRNA癌症疫苗试验中最常见的直接给药途径。
目前多数mRNA的癌症疫苗是用于诊疗而非预防性的疫苗。当其作为单一疗法时需要足够的疫苗效力,并进行多次给药来诱导肿瘤产生反应。mRNA的疫苗用于单一治疗或者辅助治疗早期癌症患者时可能有效。而对于晚期癌症病灶高度免疫抑制性的肿瘤微环境,单一给药mRNA癌症疫苗治疗晚期癌症目前来看并不现实。
mRNA癌症疫苗的未来是充满希望的。治疗性mRNA癌症疫苗与免疫检查点抑制剂、溶瘤病毒、过继性细胞疗法等联合应用更有可能获得成功。一些试验已经将mRNA疫苗与检查点抑制剂结合起来(表1-3),Moderna最近扩大了其疫苗开发计划,开发了一种新的检查点靶向癌症疫苗mRNA-4359。mRNA疫苗编码吲哚胺2,3-双加氧酶和PD-L1抗原,将用于NSCLC和晚期或转移性皮肤黑色素瘤的患者。此外,BioNTech将基于mRNA的FixVac平台与cemiplimab (anti-PD-1)相结合,用于各种癌症患者 (即NCTO4526899、NCT04382898和NCT05142189)。
目前接受这些联合治疗的患者在研究中的确表现出令人鼓舞的临床疗效。虽然许多mRNA癌症疫苗的临床试验仍处于早期研究阶段,该领域正处于高速发展阶段。针对新型冠状病毒病毒的mRNA疫苗的快速发展和世界范围内的批准展示了mRNA技术的巨大潜力。早期临床试验结果仅显示了有限的临床疗效指标。然而,随着mRNA疫苗结构、稳定性和递送方法的优化,以及个性化制备、成本经济以及可以针对病情快速进展的患者群体开展快速、规模化生产的相关优势,mRNA疫苗在未来可能成为癌症治疗的关键。