从他汀药物到PCSK9抑制剂,降脂药物的百年征途 | 向科研工作者致敬(上)
- boke
- 2023-04-14
- 7:07 上午
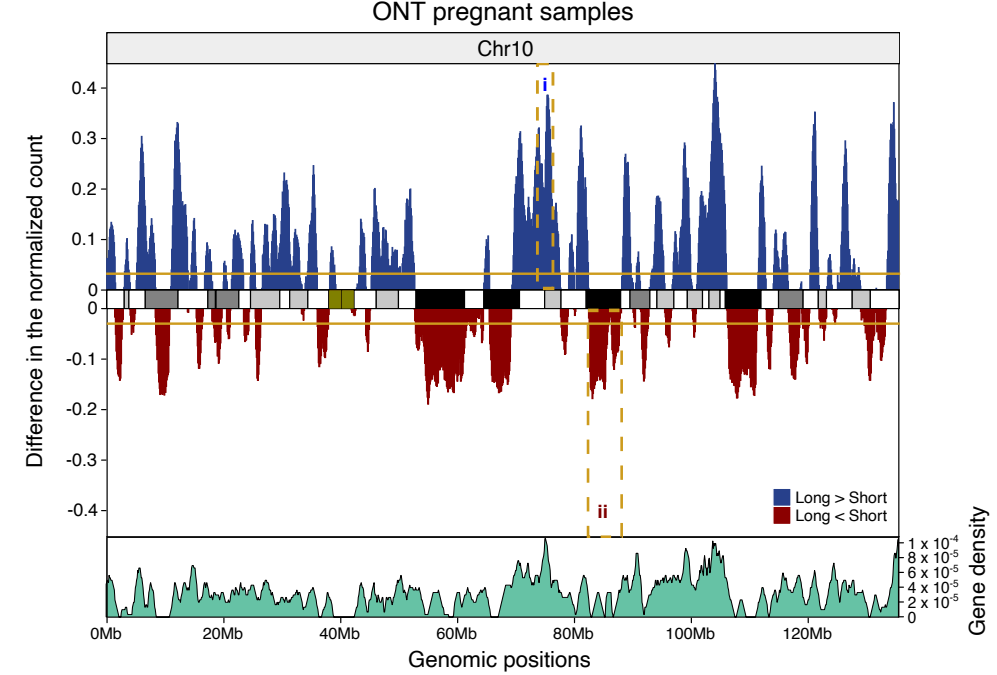
心血管疾病(cardiovascular disease,CVD)是全球范围内威胁人类生命健康的最主要的慢性非传染性疾病[1]。在我国,心血管疾病长期占据死因排名前两位,是人民健康的“头号杀手”。其中,动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)为主的心血管疾病(如缺血性心脏病和缺血性脑卒中等)是我国城乡居民第一位死亡原因,占死因构成的40%以上[2]。

图1. 2009-2019年,我国死因排名[3]
现在,流行病学、遗传学和临床干预研究证据已经充分证实,胆固醇,尤其是低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)是 ASCVD 的重要致病性危险因素[4]。
20世纪,美国年龄标化冠心病死亡率自1968年呈现下降拐点,1980~2000年下降40%以上,其中控制危险因素的贡献占44%,贡献率最大的为总胆固醇(total cholesterol,TC)水平的降低,权重占24% [1、5]。虽然现在看来血脂管理对于心血管健康是理所当然的,但这却凝结了人类上百年的探索与求证;让我们把时间线拉回到上个世纪初。
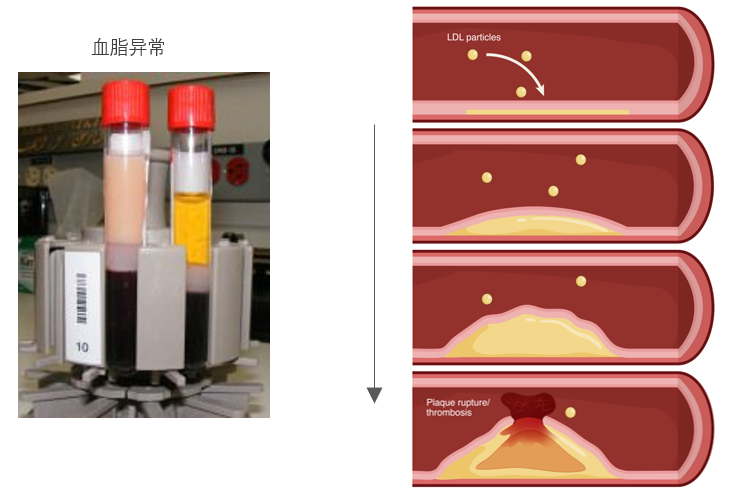
图2. 危险因素暴露积累与动脉粥样硬化发生[6、13]
关键实验: Anitschkow与“蛋黄兔”
对于动脉粥样硬化的发病机制,当时的主流观点认为是过度摄入蛋白导致,并被认为是衰老的必然结果,无法治疗。
1908年,Ignatowski报道称,在对兔子喂食牛奶、鸡蛋和肉之后,兔子们很快就出现了明显的主动脉动脉粥样硬化;1910年,德国结构化学家阿道夫·温道斯(因为研究甾醇和维生素的关系并发现了维生素D而获得1928年的诺贝尔化学奖)报告称,人类主动脉动脉粥样硬化斑块中的胆固醇浓度是正常主动脉的20倍以上,这是首个胆固醇与动脉粥样硬化关联的线索;1913年,圣彼得堡的一位年轻的俄国病理学家Nikolai N. Anitschkow发现,在喂食兔子的食物中,关键在于胆固醇。
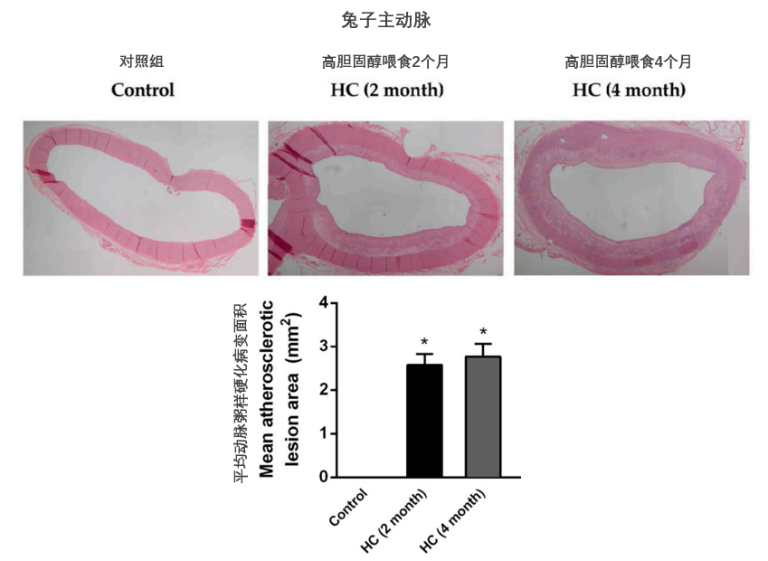
图3. 高胆固醇食物诱导兔主动脉的动脉粥样硬化病变形成[7]
基于蛋白质致病的观点,科学家们一开始是希望找到某种特定的蛋白质参与其中。不过,Anitschkow和他的一名医学生S.Chalatow发现,单独使用全蛋或蛋黄就可以了,但单用蛋白质,即使是大量的蛋白质,也无济于事!Anitschkow从蛋黄中纯化出胆固醇,并将其溶解在葵花籽油中,再将其喂给正常的兔子。几周内,兔子的血液胆固醇水平急剧上升,它们的动脉开始出现富含“类脂”的黄色病变,这与人类疾病的结构特征非常相似。
Anitschkow使用胆固醇喂养的兔子也成为现代动脉粥样硬化研究中广泛使用的动物模型,但由于科学发展的局限性,以及在其他动物中无法重现实验结果,这项研究在当时并未得到重视。几十年后,新证据的出现才让人们重新审视Anitschkow的实验。

图4. 退休后的Anitschkow与他在1913年发表的 “蛋黄兔”研究经典论文[8]
1939年,挪威临床医生Carl Müller首次发现了胆固醇与心脏病发作之间的遗传学联系,他描述了几个大家系,在这些家系中,高血胆固醇水平和过早心脏病发作是其遗传特征,也就是家族性高胆固醇血症(FH)。
在20世纪60年代中期,Avedis K.Khachadurian对FH的遗传学进行了更广泛的研究,他描述了两种临床上不同形式的FH——纯合FH,受影响的个体在出生时表现出严重的高胆固醇血症(血浆胆固醇水平约为800mg/dl)和早在5岁时发生心脏病,以及杂合子FH,其特征是血浆胆固醇水平在300至400mg/dl范围内,以及通常在35至60岁之间发生心脏病。也就是说,血浆胆固醇水平越高,其临床症状越严重,这些证据强烈表明,胆固醇与动脉粥样硬化之间存在因果关系。
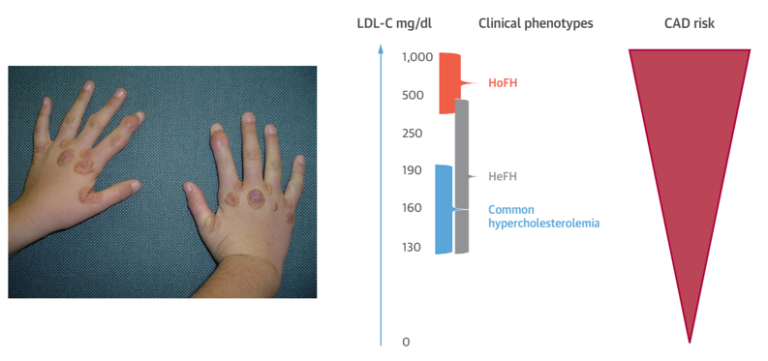
图5. 皮肤黄色瘤是纯合性FH的病理特征[9、10]
直到20世纪50年代,加州大学伯克利分校的美国科学家John Gofman才开始注意到Anitschkow的“蛋黄兔”研究,与那个时代大多数其他科学家不同,John Gofman敏锐的认识到,胆固醇与动脉粥样硬化之间应该是有关联的[11],他开始思考胆固醇在血液中的存在和运输方式。他使用新开发的超速离心机浮选分离血浆脂蛋白,首次发现了血液中的胆固醇存在于不同形式的脂蛋白中,并开展了胆固醇与心脏病的流行病学研究。
John Gofman发现,不同形式的胆固醇对心脏病的影响不同,心脏病的发生不仅与血液胆固醇水平升高有关,而且低密度脂蛋白(LDL)中也含有胆固醇。他还观察到,当血液中高密度脂蛋白(HDL)水平升高时,心脏病发作的频率会降低[12]。随后,Seven Countries Study、Framingham Heart Study流行病学研究充分的证明了血液中胆固醇水平与心血管疾病之间的关联。
脂肪和胆固醇不能溶于水或血液,于是身体将脂肪和胆固醇包裹成微小的被蛋白质覆盖的颗粒,称为脂蛋白。脂蛋白可以很容易与血液混合并随之流动,从而运输大量的脂肪到身体各处。有好几种类型的脂蛋白,但与心脏健康最相关的两种是低密度脂蛋白 (low-density lipoprotein,LDL) 和高密度脂蛋白 (high-density lipoprotein,HDL),LDL携带的胆固醇被认为是“坏胆固醇”,HDL携带的则是“良性胆固醇”。
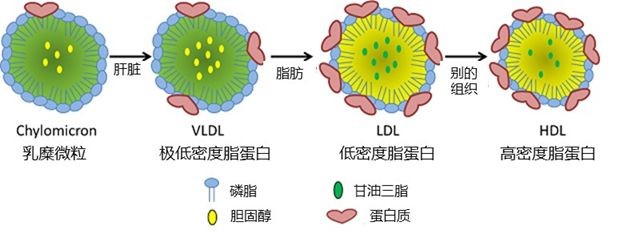
图6. 携带胆固醇的不同形式的脂蛋白[13]
同样在20世纪50年代,胆固醇的临床研究促使人们急切的希望能够了解胆固醇在体内的合成途径,这一复杂途径包括30个酶促反应,大多数关键步骤由四位生物化学家解析(Konrad E.Bloch、Feodor Lynen、John Cornforth和George Popják,图7)。随后,科学家们希望通过阻断胆固醇合成来降低血液中的胆固醇水平,但这些尝试都不成功。
1959年,美国对胆固醇生物合成抑制剂Triparanol (MER-29) 开展了临床试验,它是第一个限制胆固醇合成步骤的降胆固醇药物,但是随后由于严重的副作用退市。随后,人们转向了其他类型的降脂药物。
烟酸的降脂功能在1955年由加拿大病理学家Rudolf Altschul发现,氯贝特由英国公司ICI合成并于1958年上市,虽然此后氯贝特的衍生物显示出更有效和更安全的优势,但是,上述这些药物的降脂功能较弱,很难到达临床需要。1959年生产的消胆胺,是一种高分子阴离子交换树脂,在肠道内与胆酸结合,减少胆固醇吸收并增强其粪便排泄,进而降低血液胆固醇水平,但不幸的是,并非所有患者都能耐受。因此,就疗效或安全性而言,这些药物都不理想。

图7. Konrad Bloch等研究胆固醇生物合成的科学家以及胆固醇生物合成的关键步骤[14、15]
20世纪60年代,美国几位科学家对胆固醇代谢调控进行了广泛研究。体内的胆固醇可以来源于膳食(外源性),也可以在体内合成,主要是肝脏。如果不能达到身体所需的水平,则体内合成补充,但如果“外源性”胆固醇达到所需水平,肝脏的合成功能就会受到抑制,以防止胆固醇的过度产生。膳食胆固醇对肝脏胆固醇合成的反馈调节是通过HMG-CoA还原酶活性的变化介导的。
总之,HMG-CoA还原酶活性的改变与胆固醇合成总速率的变化密切相关。这些发现表明,抑制HMG-CoA还原酶活性将是降低血液胆固醇水平的潜在有效手段。之前的降脂药物失败并没有阻止科学家们的不断探索,黎明即将来临。
远藤章(Akira Endo)出生于日本北部秋田县附近的一个农场,在那里远藤章和包括祖父母在内的大家庭生活了17年。他的祖父十分热衷于钻研医学和科学,会教远藤章如何辨别农场里生长的真菌,算是远藤章从小的家庭教师。远藤章对那些毒死了苍蝇,却毒不了人的蘑菇很着迷,惊叹于天然物质竟然会产生如此微妙的效果[15、16]。
在秋田读完高中后,远藤章于1953年进入了位于仙台的东北大学农学院学习,在那里远藤章受到弗莱明(青霉素的发现者,于1945年获得诺贝尔奖)传记的激励,除了学习有机化学,远藤章还重点学习了生物化学和应用微生物学。
1957年毕业后,远藤章加入了位于东京的制药公司——三共制药公司(Sankyo,即今天的第一三共株式会社),在那里,他的第一个课题就与“蘑菇”有关,开发一种新的果胶酶来分解污染葡萄酒和苹果酒的果胶,在筛选了250种真菌之后,远藤章发现了一种能生产果胶酶的葡萄寄生真菌,并成功商业化。
1966年博士毕业后,远藤章来到美国深造,这里还有一个插曲,远藤章本来是想加入Bloch(图7)团队研究胆固醇的生物合成,但由于课程原因未能如愿。来到美国后,他注意到心脏病的巨大危害,在他居住的小区,时常可以看到救护车将心脏病发作的老人送往医院。
正如上文提到的,HMG-CoA还原酶抑制剂可能是降脂药物开发的突破点,回到三共制药后,受到弗莱明发现青霉素的启发,远藤章提出了一个大胆的想法,真菌中可能存在抑制胆固醇合成的抗菌防御机制,他要从真菌中找到HMG-CoA还原酶的抑制剂。

图8. 不同时期的远藤章(左、中)与弗莱明(右)[16、17]
经过一年夜以继日的艰苦工作,在筛选了3800株真菌之后,远藤章的四人团队发现霉菌培养液显示出了强大的抑制活性,其活性成分是一种已知的物质-桔霉素(citrinin)。桔霉素能强烈抑制HMG-CoA还原酶活性,此外还能降低大鼠的血清胆固醇水平。然而,由于其对肾脏的毒性,该研究被暂停。尽管如此,桔霉素的表现却更加坚定了远藤章的研究思路,真菌中一定会有更好的活性物质。
时间来到1972年仲夏,在筛选了6000株真菌后,远藤章团队发现了第二种蓝-绿霉菌的活性培养液(桔青霉,Penicillium citrinum Pen-51),它是从京都一家谷物店采集的大米样本中分离出来的,与橙子等水果上常见的霉菌相似。
又花了一年时间,终于在1973年,他们从培养液中分离出三种活性成分,其中最具活性的产物就是美伐他汀(ML-236B/Compactin)。随后发现,美伐他汀的酸式结构与HMG-CoA相似,是HMG-CoA还原酶的竞争性抑制剂。远藤章激动的表示,美伐他汀是来自大自然的馈赠[15]。
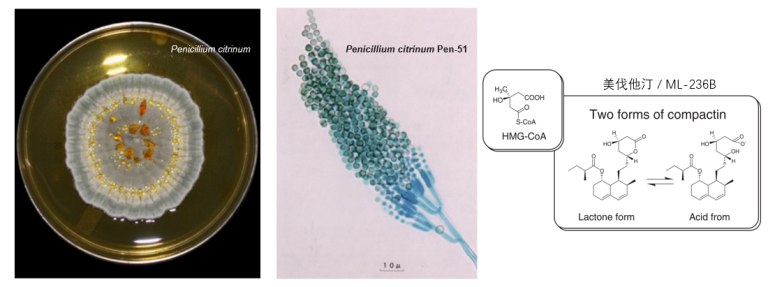
图9. 产生美伐他汀的真菌(Penicillium citrinum Pen-51)以及美伐他汀结构式[15、18-19]
在体外,美伐他汀的细胞实验非常顺利,但动物实验却很快遇到了挑战。1974年,三共制药的生物学家发现美伐他汀对大鼠不起任何作用,远藤章非常沮丧,这意味着其他动物实验也无法开展了(狗和猴子)。随后的两年后,远藤章一直在探究美伐他汀对大鼠降脂失效的原因,事实证明,胆固醇代谢十分复杂。
在一开始使用美伐他汀时,的确是有效的,在3-8小时内,动物的血浆胆固醇水平出现了下降,但8小时后,肝脏中HMG-CoA还原酶的活性却增加了,此外,在重复给药后,HMG-CoA还原酶大幅度增加(8-10倍),总体看来,胆固醇合成抑制后对HMG-CoA还原酶的反馈调节中和了美伐他汀的抑制效果。不过此时,动物实验却出现了转机。
1976年初春,三共制药的病理学家北野纪敏(Noritoshi Kitano)一直在用母鸡做研究,他好心的提供了一些母鸡给远藤章做美伐他汀的实验。出人意料的是,接受美伐他汀一个月后的母鸡血浆胆固醇降低了50%,随后,他们又在狗和猴子身上证明了美伐他汀具有显著的降胆固醇作用,这些结果表明美伐他汀是一种新型的降胆固醇候选药物[15]。
基于美伐他汀的开创性研究,首个商品化他汀药物-洛伐他汀在1987年上市。随后,他汀类药物Zocor(辛伐他汀)、Liptor(阿托伐他汀)和Crestor(瑞舒伐他汀)的效力和特异性相继提高,可以有效降低密度脂蛋白胆固醇(LDLc)25% – 50%,减少心血管不良事件的发生,并改善心血管病预后。美伐他汀的发现开创了心血管疾病防治的新纪元,被认为是与青霉素比肩的伟大发现,远藤章也被誉为“他汀之父”。
不过,他汀药物并不是对所有人都有效,提高剂量也收效甚微,存在量效瓶颈(剂量倍增,降脂幅度仅仅增加6%),同时还有肌毒性等副作用,此外,每天服用导致依从性不高。因此,人们希望有更加强效、长效和安全的降脂药物。作为人体的重要组成部分,胆固醇的代谢机制十分复杂,而他汀的降脂机制也远不是抑制胆固醇合成这么简单,人类与心血管疾病的斗争刚刚拉开帷幕。