中国智造又下一城,最高可达12毫摩尔;伯科生物推出全自动毫摩级寡核苷酸合成仪
- boke
- 2023-09-28
- 7:07 上午
高品质的DNA/RNA合成技术与设备是基因测序,基因调控,基因合成方向的基础设施。2023年9月26日,伯科生物科技有限公司(下文简称:伯科生物)发布了单通道寡核苷酸合成仪,该合成仪是一款全自动的DNA/RNA合成设备,支持大规格合成,最高可达12mmol,适用于科学研究,药物开发等领域寡核苷酸的合成。

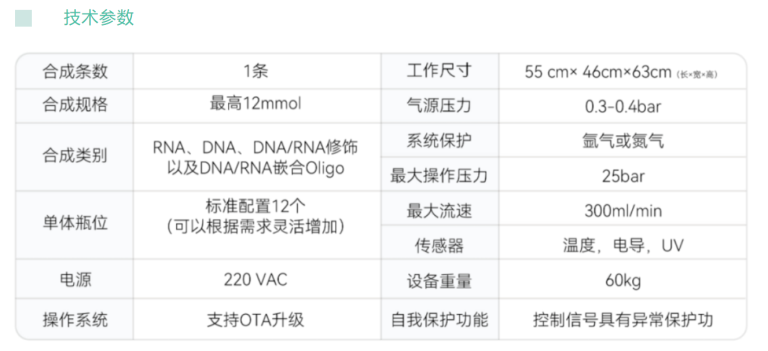
该款单通道寡核苷酸合成仪采用流穿合成体系,这是用于DNA/RNA合成工艺开发及数百千克甚至更大规模放大生产时的通用技术。通过高精度泵作为动力系统,确保流速与流量的准确与稳定,系统优化的管路,有效减少滞留体积,为工艺开发和放大生产提供稳定的底层体系。合成仪采用开放式前端设计,使得各个模块都可轻松触摸,便于观察。设备的再循环回路,提高了试剂的利用率及反应效率。伯科生物自研开发的设备软件具有强大的数据处理能力,能够在线监测紫外,电导与压力,实时监测合成反应。
该款单通道寡核苷酸合成仪操作简便,性能稳健,是寡核苷酸药物的工艺开发与放大生产的理想设备。从蛋白合成的上游,调控基因表达是一种安全、有效的治疗手段;目前,FDA已经批准了十余款寡核苷酸药物,以siRNA、ASO为代表的寡核苷酸药物有望成为继小分子药物和抗体药物后的第三大类药物。
寡核苷酸药物的开发离不开遗传学与基因组学的积累;随着基因测序、基因调控以及基因合成技术(“读-改-写”)的迭代升级,基因组学正在改变疾病筛诊治和健康管理理念,促进了遗传信息与常规临床实践的整合,应用于疾病风险评估、药物反应预测和治疗方案选择等方面,并推动了以遗传信息为蓝本的“精准医疗”进程。目前,伯科生物已建立满足不同规格、通量和应用的全品类DNA/RNA合成设备系列,包括单通道寡核苷酸合成仪、SynStar23-768高通量合成仪、SynStar21多功能Oligo合成仪,打破了上游DNA/RNA合成设备领域一直受制于国际大厂的局面。
伯科SynStar23-768高通量合成仪是一款用于合成DNA/RNA以及类似结构寡核苷酸的自动化仪器,容纳最高200nmol合成规格,是一款经济,高效的DNA/RNA合成设备,适用于液相基因芯片分子检测生物素探针、基因合成,高通量筛选Oligo等的合成。

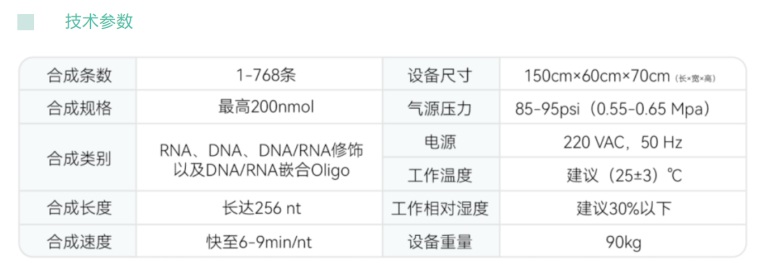
SynStar21多功能Oligo合成仪具有48个合成通道,容纳最高2000nmol的合成规格。该合成仪满足高通量测序文库Adapter/Index引物、液相基因芯片封闭试剂(Blocker)、分子检测荧光PCR探针、特殊修饰引物以及siRNA、sgRNA、tRNA等核酸制品的合成。

随着基因测序技术的进步和基因组学研究的积累,让我们对许多罕见病和常见疾病的致病机制有了更加深刻的认识。基因组学与常规临床实践的结合越来紧密,同时也加速了药物靶点发现和RNA药物的开发。
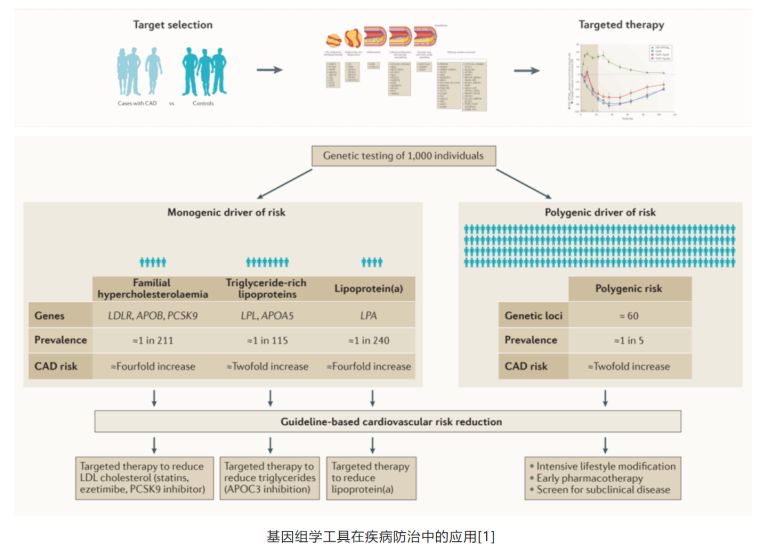
以心脑血管疾病的个体化精准医疗进程为例,心脑血管疾病相关的基因组信息不但可以用于疾病风险评估,发现高危人群,还能够指导生活方式/药物干预,对心脑血管健康进行全生命周期管理[2、3]。研究表明,高遗传风险人群服用他汀降低冠心病发生的获益更大[4];此外,高遗传风险的冠心病患者服用PCSK9抑制剂获益更大[5]。
个体化治疗与在不同年龄阶段的精准治疗方式,结合持续完善的风险分层评估工具,包括遗传风险评分,以及整合各影像研究进行健康管理与临床决策,已是发展趋势。

2023年8月22日,PCSK9 siRNA药物-英克司兰在中国获批上市,与每日服用的他汀药物相比,英克司兰一年仅需两针,即可强效持久降低低密度脂蛋白胆固醇(LDL-C)水平,为冠心病患者的长期血脂管理带来新的选择。目前,针对不同的适应症,450多种RNAi疗法正在临床开发中[6],寡核苷酸药物的需求和市场都将快速增长。

伯科生物致力于面向合成生物学与基因组学的新技术开发与应用转化,为构建精准诊疗与临床转化体系提供工具平台。现在,伯科同时在生物酶促合成等方面进行技术转化;未来,将持续进行合成技术与设备软硬件的自研自造,打造坚实的基础设施平台,为不同规格、通量和应用的DNA/RNA合成提供完整产品解决方案,为合成生物学与基因组学的技术与应用创新贡献力量。
参考资料
1. Khera A V , Kathiresan S . Genetics of coronary artery disease: discovery, biology and clinical translation[J]. Nature Reviews Genetics, 2017.2. Lu X, Niu X, Shen C, et al. Development and Validation of a Polygenic Risk Score for Stroke in the Chinese Population. Neurology. 2021;97(6):e619-e628.
3. Lu X, Liu Z, Cui Q, et al. A polygenic risk score improves risk stratification of coronary artery disease: a large-scale prospective Chinese cohort study. Eur Heart J. 2022;43(18):1702-1711.
4. Mega JL, Stitziel NO, Smith JG, et al. Genetic risk, coronary heart disease events, and the clinical benefit of statin therapy: an analysis of primary and secondary prevention trials. Lancet. 2015;385(9984):2264-2271.
5. Marston NA, Kamanu FK, Nordio F, Gurmu Y, Roselli C, Sever PS, Pedersen TR, Keech AC, Wang H, Lira Pineda A, Giugliano RP, Lubitz SA, Ellinor PT, Sabatine MS, Ruff CT. Predicting Benefit From Evolocumab Therapy in Patients With Atherosclerotic Disease Using a Genetic Risk Score: Results From the FOURIER Trial. Circulation. 2020 Feb 25;141(8):616-623.
6.https://www.codexis.com/investors/news-events/press-releases/detail/361/codexis-announces-enhanced-strategic-focus-and-extends
7. Tokgözoğlu L, Libby P. The dawn of a new era of targeted lipid-lowering therapies[J]. European Heart Journal, 2022, 43(34): 3198-3208.