Cross-Contamination≤0.05% | 伯科 UltraPu DNA Oligos超纯工艺
2021-11-26
记得好多年前小编刚学习NGS,实验中,前辈时常告诫,“用长枪头啊,不然容易串”, “Adapter别加多了,容易串”,苦口婆心的告诫翻译一下便是,样本交叉污染后无法区分,接头残留有Index-Hopping隐患,千万别让样本交叉污染了。
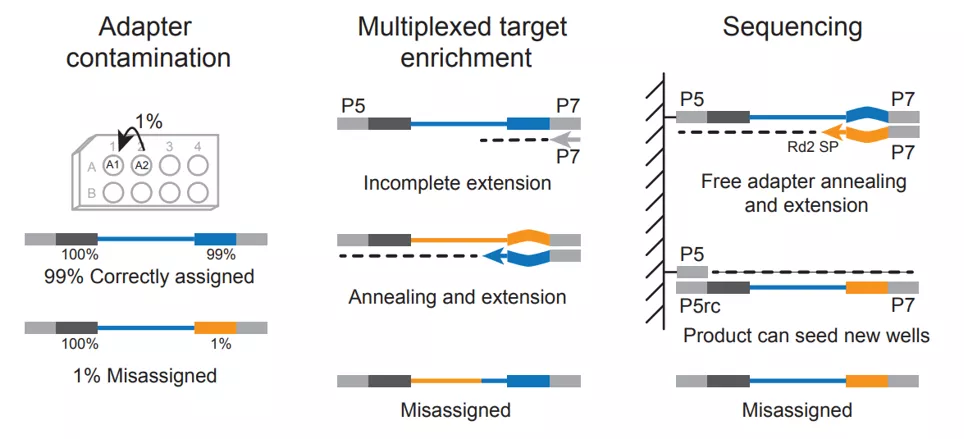
图1. NGS样本串扰来源[1]
高通量是NGS的技术特征,如今的测序仪一次运行便能同时检测上百份样本的上万个基因,但如何有效区分样本,充分发挥NGS高通量的优势,还需要精雕细琢。以碱基序列为基础的样本辨识系统,Index准确性是NGS发挥高通量优势的关键,UDI的使用从理论上极大降低了Index-Hopping带来的样本串扰风险,但DNA Oligos底层生产工艺依然决定着UDI能否充分发挥作用,特别是一些特殊场景,比如检测超低频突变的MRD应用。
HPLC是一种性价比较高的Oligos纯化方式,Adapter/Index Primer一般采用HPLC进行纯化,不同引物在纯化后,仍然会少量残留在纯化柱中。如图2所示,依次纯化A,B,C三条DNA Oligos,然后对收集的oligos进行NGS测序,数据分析结果显示Oligos之间存在最高约0.1%的交叉污染,证明如果不对生产工艺进行优化很难达到更低的交叉污染率。那么,独立纯化Oligos是否能有效降低交叉污染呢?
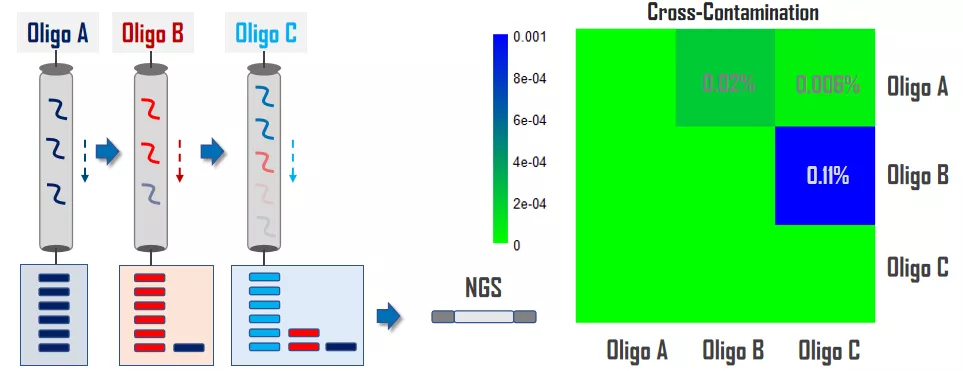
图2. HPLC依次纯化产生约0.1%的交叉污染
我们尝试独立纯化A/B/C三条Oligos,同时,为验证气溶胶污染,分别将三条Oligos在同一个或各自独立的密闭空间内加热,如图3所示,NGS结果显示,独立纯化并在独立密闭空间的组合将交叉污染降低至0.01%以下,同一密闭空间的实验组(气溶胶)交叉污染有微弱提升,但并不明显。上述结果表明,纯化柱残留是HPLC纯化的主要污染源,气溶胶其次。
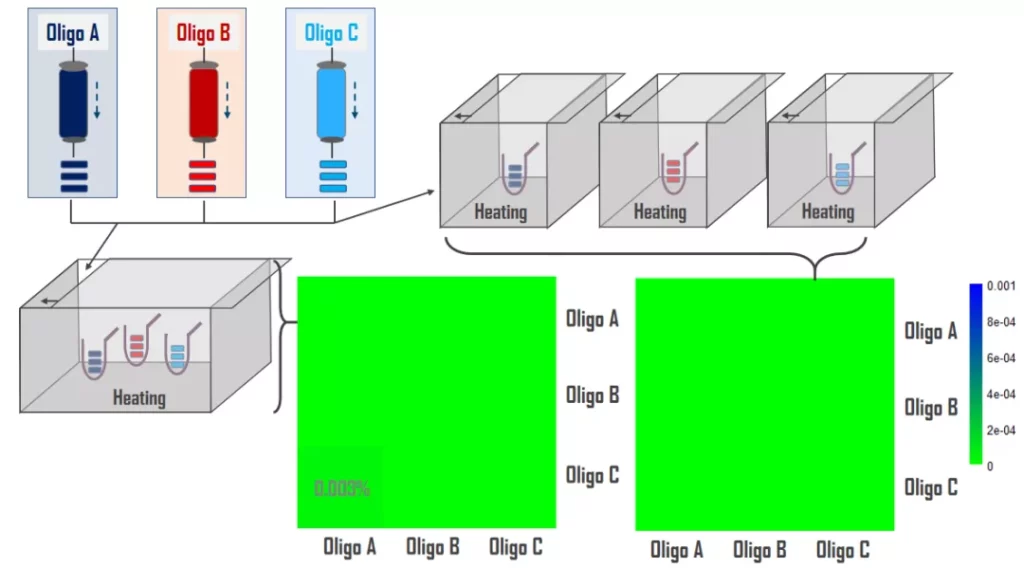
图3. 独立纯化能够明显降低oligo之间的交叉污染
明确了工艺关键点,伯科开发出一套超低交叉污染Oligos生产工艺,推出UltraPu DNA Oligos,该工艺生产的DNA Oligos能够达到≤0.05%的污染率,如图4所示,使用UltraPu DNA Oligos工艺生产24个单端Index PCR Primer,采用NGS对上述24条Index PCR Primer以及同批质控Oligos和交叉污染阳性(0.6%)阴性(~0.01%)对照Index PCR Primer进行测序,结果显示,除编辑距离较小的两条Index PCR Primer交叉污染达到0.05%外,其余Index PCR Primer均≤0.04%,对照Oligos表现符合预期。
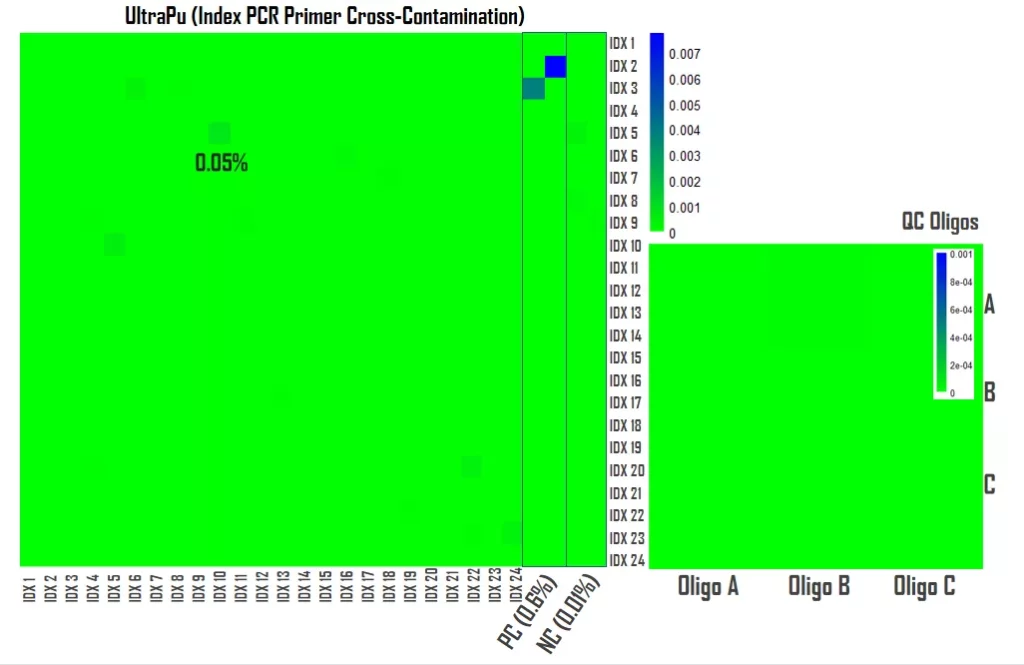
图4. UltraPu DNA Oligos 工艺单端Index PCR Primer交叉污染表现
结语
降低Oligo之间的交叉污染,是从源头上保证下游样本测序质量的关键,UltraPu DNA Oligos的超高性能表现,将为NGS应用提供稳定的底层技术助力。除了Oligos纯度外,NGS的很多环节都可能引入样本的串扰问题,例如使用单端Index进行多样本杂交时,最高可引入0.4%的样本串扰[1],因此,在检测体细胞突变时应更为谨慎,而超低频突变检测(0.02%)采用1对1捕获更为稳妥。
参考文献
[1] Macconaill L E , Burns R T , Anwesha N , et al. Unique, dual-indexed sequencing adapters with UMIs effectively eliminate index cross-talk and significantly improve sensitivity of massively parallel sequencing[J]. BMC Genomics, 2018