RNA药物:心血管疾病的新一代疗法
- boke
- 2023-03-24
- 7:07 上午
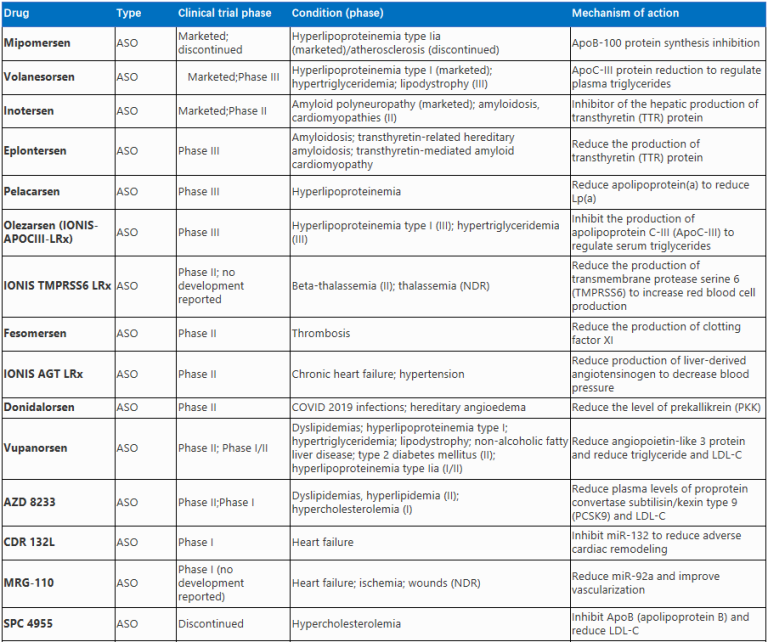
RNA疗法是一种使用RNA分子来预防或治疗疾病的手段,可预防或治疗广泛的疾病,目前已经成为药物研发新热点。用于治疗的RNA药物分子类型包括反义寡核苷酸(ASOs)、小干扰RNA(siRNAs)、微小RNA(miRNAs)、RNA适配体(aptamers)和mRNA等[1-11]。
心血管病是心脏血管和脑血管疾病的统称,泛指由于高血脂、血液粘稠、动脉粥样硬化、高血压等诱因导致的心脏、大脑及全身组织发生缺血性或出血性疾病。在全世界范围内,心血管疾病已逐渐升至为威胁人类健康的“第一杀手”。心血管病巨大的社会危害催生了一系列创新药研发项目。2022年发表的一篇综述文章[12]总结了用于心血管疾病治疗的RNA药物,并介绍了一些RNA药物的作用机制。
反义寡核苷酸(Antisense oligonucleotides,ASOs)
反义寡核苷酸(ASOs)是一种短的单链寡核苷酸分子(约18~30nt),本身是DNA、RNA或DNA与RNA的杂合单链。ASOs通过序列互补与靶标mRNA结合,在核糖核酸酶H1(RNase H1)的作用下引起mRNA的降解,从而抑制蛋白的表达;或者通过空间位阻效应调控基因的翻译,实现RNA可变剪切并调控蛋白的表达,从而起到治疗疾病的作用。
在体内,未经修饰的ASOs会迅速被血清核酸酶破坏并经由肾脏排出[13]。为此,人们引入大量化学修饰,以提升ASOs的药代动力学参数和药效。同时,许多ASOs经过序列修饰和结构改造,不再需要专门的载体做递送,因此降低了生产难度和成本。然而,有证据表明某些化学修饰会引起强烈的免疫反应或降低ASOs与靶序列的亲和力,所以为ASOs引入化学修饰仍需谨慎。
目前已知与心血管和代谢性疾病遗传相关的靶点有蛋白酶PCSK9、脂蛋白Lp(a)和血管生成素样蛋白ANGPTL3。针对此类靶点的ASOs已进入临床试验,其中的AKCEA-ANGPTL3-LRx(针对ANGPTL3)和AKCEA-APO(a)-LRx(通过APO(a)抑制Lp(a))[9]已显示出治疗杂合子家族性高胆固醇血症和动脉硬化性心血管疾病的潜力。
ASOs能够有效地递送到包括心脏在内的所有组织。目前已有多款ASOs获得FDA批准,Mimopersen(第二代名称为Kynamro,图1)是唯一获批用于心血管疾病治疗的ASO药物(NCT00770146)。该药被用于治疗同型家族性高胆固醇血症(HoFH)这一罕见遗传病。在肝脏中,这种药物启动了载脂蛋白(Apo)B-100 mRNA的降解过程,促使血液中的低密度脂蛋白胆固醇和脂蛋白(a)(Lp(a))水平降低[14, 15]。
2010年完成的一项III期临床试验(NCT00607373)结果显示,Mipomersen可有效抑制载脂蛋白产生约25%,并降低已经接受降脂药物治疗的HoFH患者的低密度脂蛋白胆固醇水平。然而,由于Mipomersen存在肝脏毒性和不良反应,该药物于2021年在公开市场上停用。
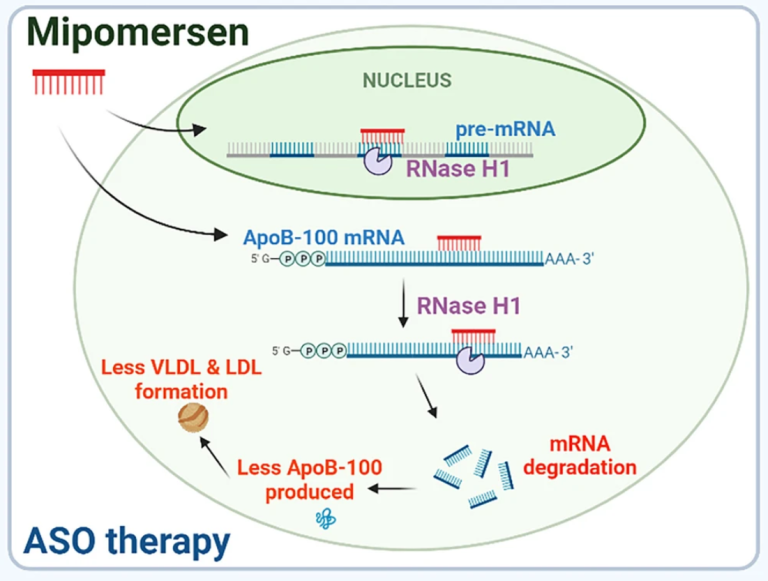
图1 RNA药物通过靶向关键的mRNA来治疗心血管疾病。ASO药物Mipomersen(红色)与ApoB-100 mRNA杂交并招募RNase H1酶裂解目标mRNA,抑制载脂蛋白B的合成,从而减少VLDL和LDL的合成。
Volanesorsen是靶向肝脏脂蛋白C-III(APOC3)mRNA的ASO,已被证明可以降低血浆甘油三酯水平,并已获得FDA审批[16, 17]。在家族性乳糜微粒血症综合征(familial chylomicronemia syndrome,FCS)患者中,每周使用Volanesorsen可明显降低甘油三酯(与安慰剂治疗相比,下降1700 mg/dL vs 90 mg/dL)。2019年,III期APPROACH研究显示Volanesorsen治疗的患者平均甘油三酯水平下降77%,而安慰剂组的患者则增加18%。Volanesorsen的不良反应为血小板减少和出血风险。Volanesorsen是2019年唯一获欧盟委员会批准用于治疗FCS的药物。
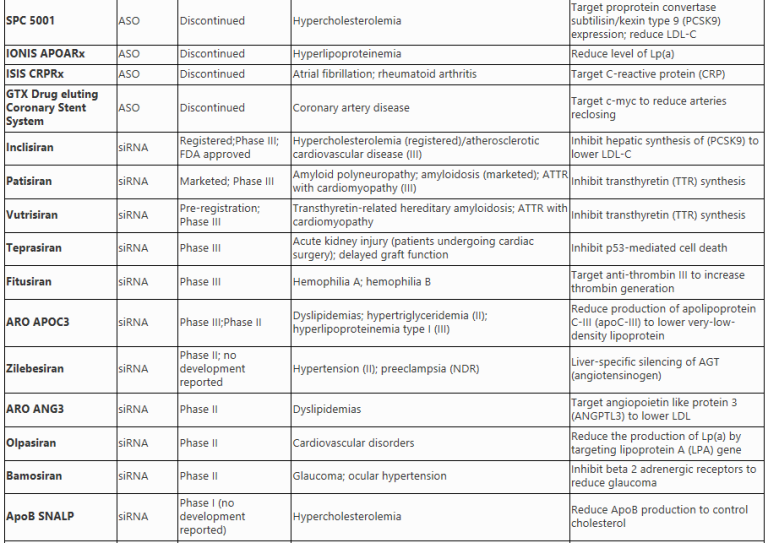
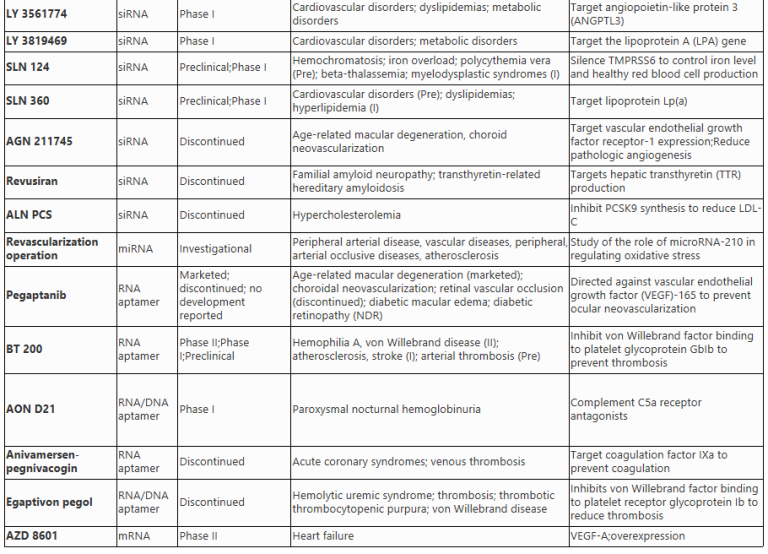
RNA干扰:使基因沉默的RNA干扰技术
RNA干扰是一种自然界存在的转录后调控机制,既可以调节内源基因的表达,还可以保护生物免受外来核酸的侵害。RNA干扰的发现彻底改变了人们对基因表达和调控的认识。在哺乳动物中,RNA干扰可由内源性或外源性(合成的RNA、病原体)双链RNA(dsRNA)触发。RNA干扰主要有两种类型:小干扰RNA(siRNA)和微小RNA(miRNA)。它们都利用碱基配对识别mRNA并引发mRNA降解,从而降低靶蛋白的表达水平。
小干扰RNA(siRNA)
siRNAs是21到25个核苷酸的双链RNA,通过Dicer酶的剪切,被加工成为siRNA前体,进入RNA诱导沉默复合物(RISC),利用AGO2酶的内切酶活性识别并切割mRNA,导致其降解,从而降低蛋白质水平。目前已有多个siRNA药物获得FDA批准,另外还有一些正在临床试验中。大多数针对心血管系统的siRNA药物都是通过肝脏定向递送来治疗疾病。例如,Inclisiran(图2)通过GalNAc修饰实现定向递送进入肝细胞,靶向抑制PCSK9蛋白的表达促使细胞表面的LDL受体增多,从而提高肝脏吸收脂蛋白的能力,并降低血脂水平。
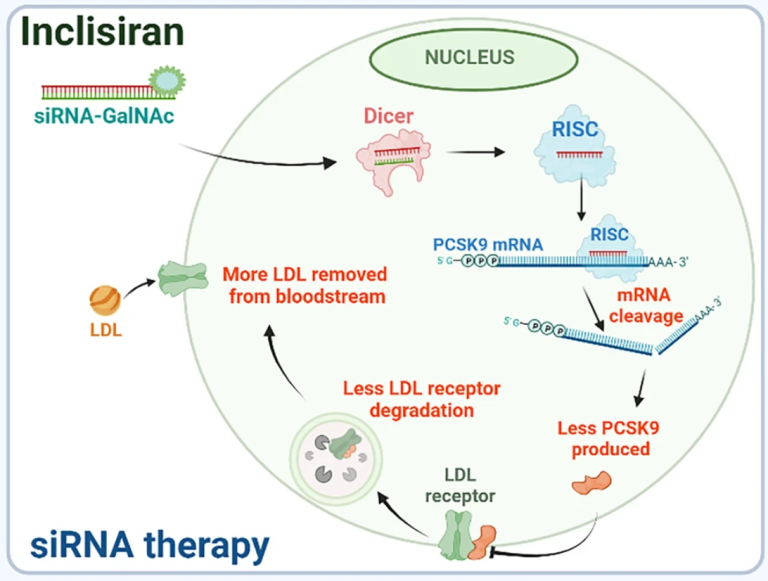
图2 RNA药物Inclisiran是一种靶向PCSK9 mRNA的siRNA,纳入RISC复合物中识别目标mRNA并启动降解程序。Inclisiran阻断了PCSK9驱动的LDL受体降解从而促使血液中的LDL水平降低。
MicroRNAs(miRNAs)
miRNAs是一类短小的非编码RNA,通过转录后基因调控在细胞功能中发挥着至关重要的作用。它们通常与mRNA的3’UTR结合,抑制其翻译或招募降解酶降解目标mRNA。miRNAs可以同时靶向多个不同的mRNA,具有潜在的治疗价值。miRNA药物包括miRNA抑制剂(Anti-miRs)和miRNA模拟物两种人工合成的RNA。miRNA抑制剂(Anti-miRs)通过隔离或者靶向降解miRNA阻断miRNA对mRNA的异常调控,而miRNA模拟物(miRNA Mimics)通过替换或增加有益的miRNA,进而降低特定基因的表达水平。
RNA适配体(aptamers)
RNA aptamers是一类利用三维构象而非特定序列识别目标分子的RNA药物。它们可以选择性地组合所需的配体,并具有灵活的靶向性,可用于靶向特定分子、细胞或组织。与其他RNA药物相比,RNA aptamer不受限于细胞内靶标,且可设计用于结合细胞区域内的任何分子。RNA aptamer的生产成本更低,更容易与其他递送载体组合实现靶向递送。
2004年FDA批准Pegaptanib用于治疗老年性黄斑变性症。该药为28个核苷酸组成的RNA aptamer,通过结合血管内皮生长因子(VEGF)蛋白并阻断其在患者中的炎症反应,从而防止严重的视力并发症[18, 19]。更多RNA aptamer候选药物正在进行临床试验中。例如,BT200(图3)是一种聚乙二醇化的RNA aptamer药物,用于治疗血友病A、动脉粥样硬化和中风,目前正处于I/II期临床试验中。BT200显示出良好的疗效,通过结合von Willebrand因子(VWF)的A1结构域实现抗血栓效果。
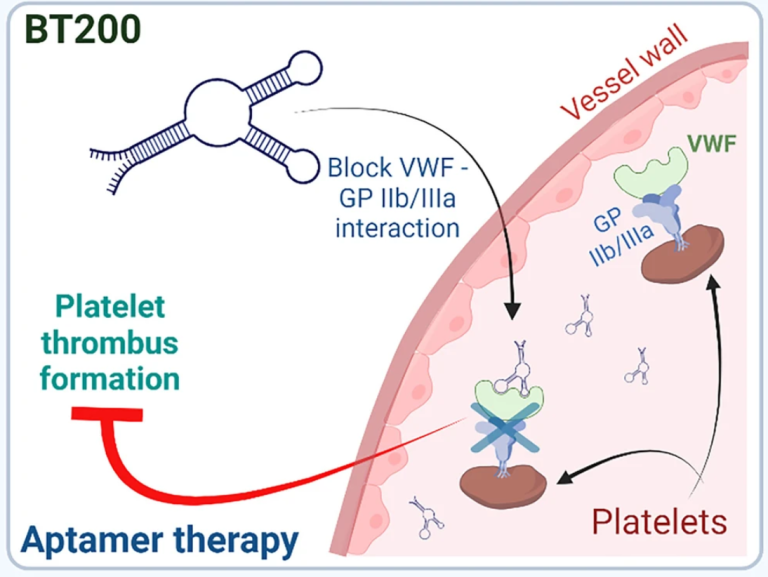
图3 RNA药物BT200是一种RNA适配体,可以抑制VWF(von Willebrand因子)与血小板膜上的GP IIb/IIIa受体结合形成的异常血栓。
信使RNA(mRNA)
三十多年前,Wolff等人发现在小鼠骨骼肌内注射体外转录(in vitro transcribed,IVT)mRNA可以在体内表达所需蛋白质。20世纪90年代,人们开展了多项IVT mRNA临床前试验,研究其治疗或预防癌症和传染病的效果。研究发现了mRNA疗法存在半衰期短和非特异免疫原性等缺点。经过几十年的发展,这些问题已经得到解决。IVT mRNA疗法具有多种优势,包括安全性高、生产成本低等,因此在各领域都有广泛的应用前景。
目前,IVT mRNA可以通过两种方法进行递送。一种是在体外将IVT mRNA转移到患者的细胞中,然后将携带IVT mRNA的细胞输送回患者体内;另一种是使用不同的递送载体直接将IVT mRNA输入体内。人们可以根据治疗目的设计或改变IVT mRNA的免疫刺激特性从而实现针对性治疗。
冠状动脉疾病是由于血管的阻塞导致对心肌的供血不足,导致患者心脏病发作或者心力衰竭。目前有一种名为AZD8601(图4)的mRNA药物正在EPICCURE二期临床试验中进行评估。该药成份为编码血管内皮生长因子-A(VEGF-A)的mRNA,经过序列改造(165位变为A)后实现了过表达VEGF-A和降低免疫刺激的效果。VEGF-A具有促进血管增生的功能,AZD8601通过在局部诱导VEGF-A蛋白的表达促进供血不足心肌区域的新血管再生,从而改善心脏功能并减轻心脏损伤。
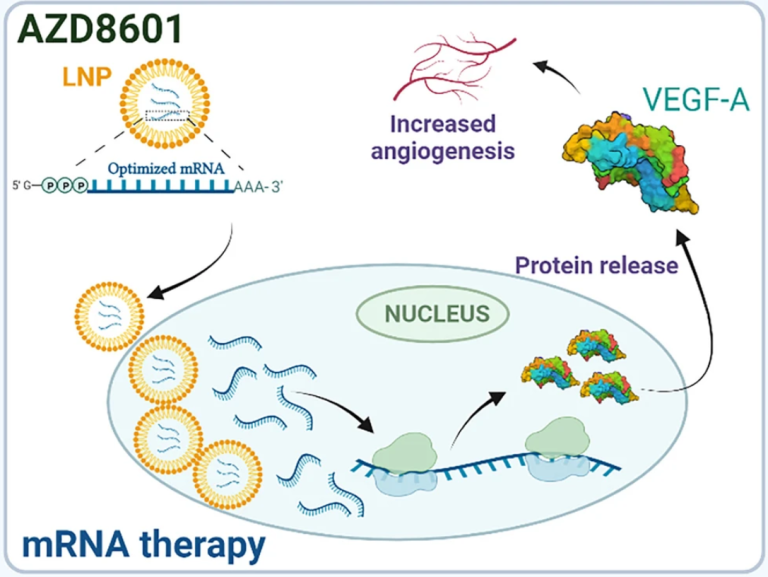
图4 RNA药物AZD8601的VEGF-A mRNA由脂质纳米颗粒(LNPs)包裹,通过细胞内吞进入靶细胞。mRNA随后被翻译成VEGF-A蛋白,从而促进血管生成。
RNA药物为心血管疾病的治疗提供了新途径,目前有多款针对心血管疾病的RNA药物处于临床试验评估阶段,预计心血管疾病治疗将加速进入RNA药物时代。