PCSK9抑制剂有效逆转斑块?冥顽不“化”的脂蛋白(a)如“鲠”在喉
- boke
- 2024-12-24
- 3:33 下午
近期,Circulation: Cardiovascular Imaging期刊发表的一项名为ARCHITECT的研究结果表明,通过阿利西尤单抗(alirocumab)联合高强度他汀治疗家族性高胆固醇血症(FH)患者,可有效逆转动脉粥样硬化[1]。
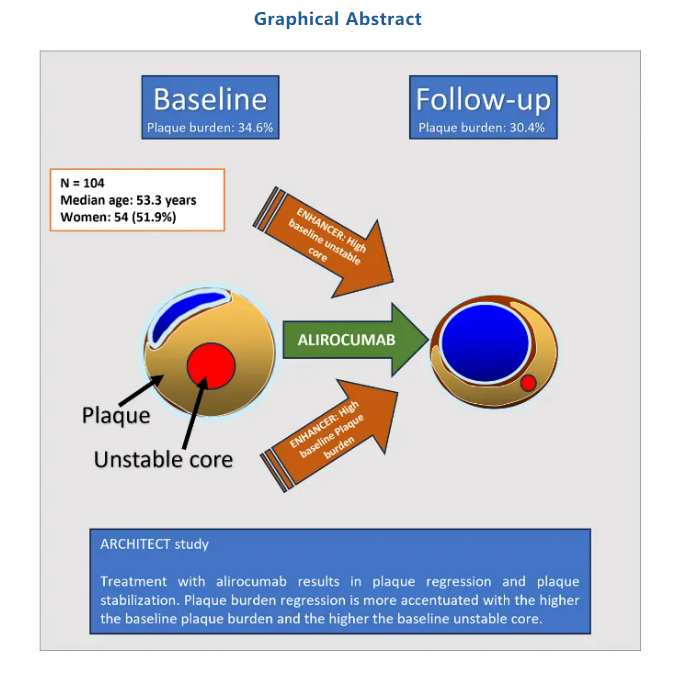
ARCHITECT研究是一项IV期、开放标签、多中心、单臂临床试验,旨在评估阿来库单抗治疗78周对无临床动脉粥样硬化性心血管疾病的FH受试者冠状动脉粥样硬化PB(斑块负荷)及其特征的影响。104位参与者在基线时接受了冠状动脉计算机断层血管造影,在78周时接受了最终血管造影。除了高强度他汀类药物治疗外,每位患者每14天接受一次150mg的阿利西尤单抗皮下注射。
研究发现总体冠状动脉PB从入院时的34.6%变为随访时的30.4%,降低了-4.6%。不稳定核心(纤维脂肪和坏死斑块之和)从14.1%降至8.0%。
该研究认为,对于基线斑块负荷较大和不稳定脂质核心比例较高的FH患者,这一治疗方案能显著减少冠状动脉斑块负荷。
不过,事情好像并不简单。
近日,Circulation发表的一项研究[2]表明,Lp(a)和LDL-C对心血管风险是独立且可累加的影响,即使使用他汀类药物开展降LDL-C治疗,LDL-C的降低并不能完全抵消Lp(a)介导的风险
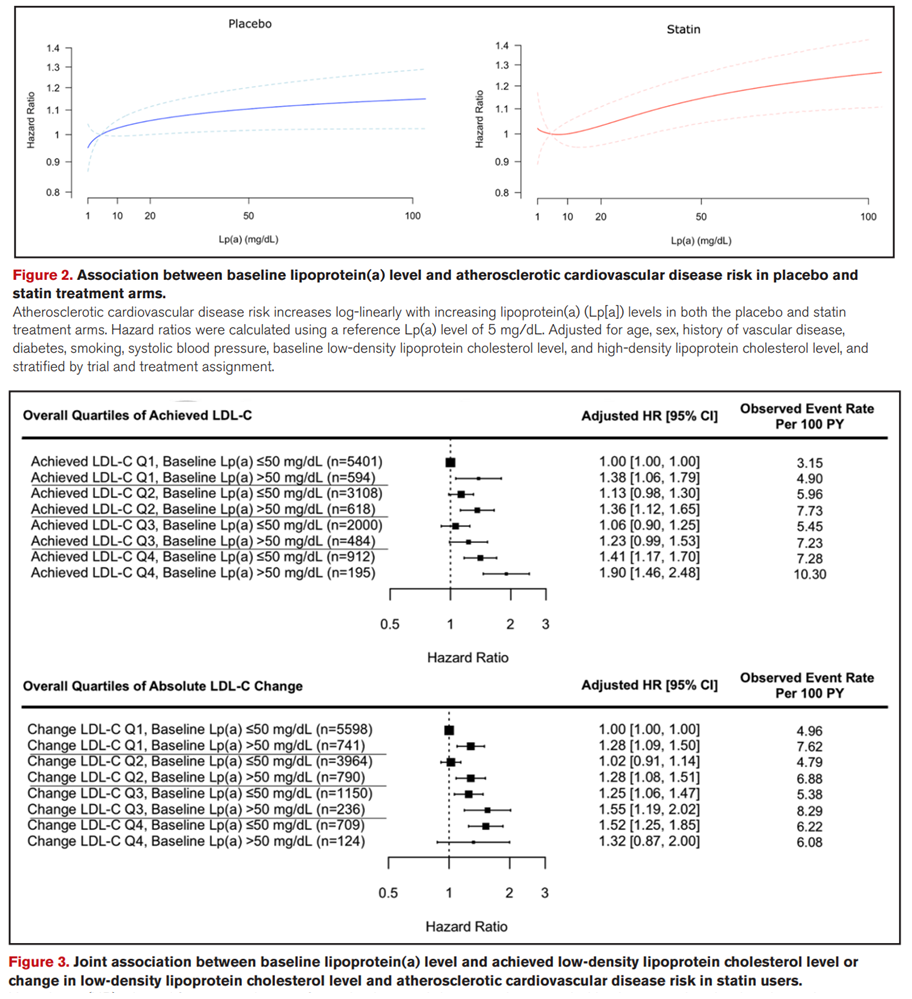
此外,有研究发现,对于临床FH患者的心肌梗死和ASCVD风险,Lp(a)水平与LDL-C具有同样的风险[3]。

然而,PCSK9抑制剂(阿利西尤单抗和依洛尤单抗)可以降LDL-C降低约60%,但它们对Lp(a)的降低幅度有限,在20-30%左右。
那么,对Lp(a)降幅有限的PCSK9抑制剂的斑块逆转效果是否会受到Lp(a)影响呢?近期,同样发表在Circulation: Cardiovascular Imaging期刊上的研究[4]回答了这一问题。
研究方法
在PACMAN-AMI试验(评估PCSK9抗体阿利西尤单抗对急性心肌梗塞患者冠状动脉粥样硬化的影响)中,300例急性心肌梗塞患者被随机分配接受每两周一次150mg阿利西尤单抗或安慰剂组,同时所有患者均接受每日 20 mg 的瑞舒伐他汀治疗。患者在基线和52周后,使用血管内超声(IVUS)、光学相干断层扫描(OCT)和近红外光谱(NIRS)对非梗死相关冠脉进行连续成像,以评估粥样斑块体积、纤维帽厚度和脂质核心负荷。

研究结果
共有265名患者接受了连续血管内超声检查(平均年龄58岁±9岁;女性占16%)。
与安慰剂组相比,阿利西尤单抗组的斑块体积百分比和脂质核心负荷(maxLCBI4mm)降低幅度,以及最小纤维帽厚度增加幅度,均显著大于安慰剂组。
在阿利西尤单抗组中,基线Lp(a)水平较高(定义为最高四分位数(Q4,≥98 nmol/L)的患者,其脂质核心负荷降低幅度显著低于基线Lp(a)水平较低的患者(Q1-Q3,<98 nmol/L)。
具体而言,高Lp(a)组的脂质核心负荷降低幅度为-40.2,而低Lp(a)组的降低幅度为-91.4。并且与安慰剂组的降低幅度相当(-37.60,n=134)。
当基线Lp(a)水平较高(定义为≥75 nmol/L对比<75 nmol/L,阿利西尤单抗组中分别为n=35对比94,以及≥125 nmol/L对比<125 nmol/L,分别为n=23对比106)时,这些结果保持一致。斑块体积百分比和最小纤维帽厚度变化与基线Lp(a)水平之间无显著关联。

研究结论
在急性心肌梗死患者中,尽管使用阿利西尤单抗联合高强度他汀进行强化治疗,但基线期升高的Lp(a)与斑块脂质含量逆转减弱相关。这一发现可能解释了尽管LDL-C水平得到良好控制,但高Lp(a)水平仍然存在的残余心血管风险。
实际上,高水平Lp(a)将导致早发性动脉粥样硬化性心血管疾病(ASCVD),尤其是心肌梗死风险相应增加。这一点,与家族性高胆固醇血症(FH)往往终生伴随高水平低密度脂蛋白胆固醇(LDL-C)诱发过早心肌梗死和ASCVD非常相似,这强调了早期诊断和治疗的重要性。
此外,由于Lp(a)具有类似LDL的核心结构,通过β定量法或使用不同方程估算的LDL-C测量值会同时捕捉到LDL颗粒和Lp(a)颗粒的胆固醇含量。因此,当Lp(a)水平较高时,测得的LDL-C水平也可能升高。
未来,需要开发新的检测方法来测量不含Lp(a)成分的LDL-C水平以及分子分型评估遗传风险,以便在早期更好地评估LDL-C和Lp(a)各自的风险,并更有效地管理LDL-C和Lp(a)水平都较高的人群,尤其是在有针对性治疗Lp(a)升高的药物问世后。

参考资料
1.Perez de Isla, Lepoldo et al. “Characteristics of Coronary Atherosclerosis Related to Plaque Burden Regression During Treatment With Alirocumab: The ARCHITECT Study.” Circulation: Cardiovascular Imaging 17 (2024): e016206.
2.Harpreet S. Bhatia , Simon Wandel , Peter Willeit,etal.Independence of Lipoprotein(a) and Low-Density Lipoprotein Cholesterol–Mediated Cardiovascular Risk: A Participant-Level Meta-Analysis.Circulation. 2024;150:00–00.
3. Hedegaard BS, Bork CS, Kaltoft M, et al. Equivalent Impact of Elevated Lipoprotein(a) and Familial Hypercholesterolemia in Patients With Atherosclerotic Cardiovascular Disease. J Am Coll Cardiol. 2022;80(21):1998-2010.
4. Koskinas KC, Häner J, Ueki Y, et al. Association of Lipoprotein(a) With Changes in Coronary Atherosclerosis in Patients Treated With Alirocumab. Circ Cardiovasc Imaging. 2024;17(11):e016683. doi:10.1161/CIRCIMAGING.124.016683
5. Averna MR, Cefalù AB. Lp(a): a genetic cause of clinical FH in children. Eur Heart J. 2023;44(16):1429-1431.


