Tumor-informed Safe-SeqS MRD技术梳理
- boke
- 2022-07-21
- 7:21 上午
2021年,美国食品及药物管理局(FDA)药品评价研究中心(CDER)批准了50种药物。从2012年到2021年,CDER平均每年有43种新药获得批准。2018年获批药物最多,其次是2020年,2021年位于第三位。2021年批准的50种新药中有27种(54%)定义为“first-in-class”新药;26种(52%)用于罕见病或孤儿病;49种(98%)在处方药使用者付费法案(PDUFA)目标日期或之前获批;43种(86%)在第一周期获批;38种(76%)首先在美国获批。
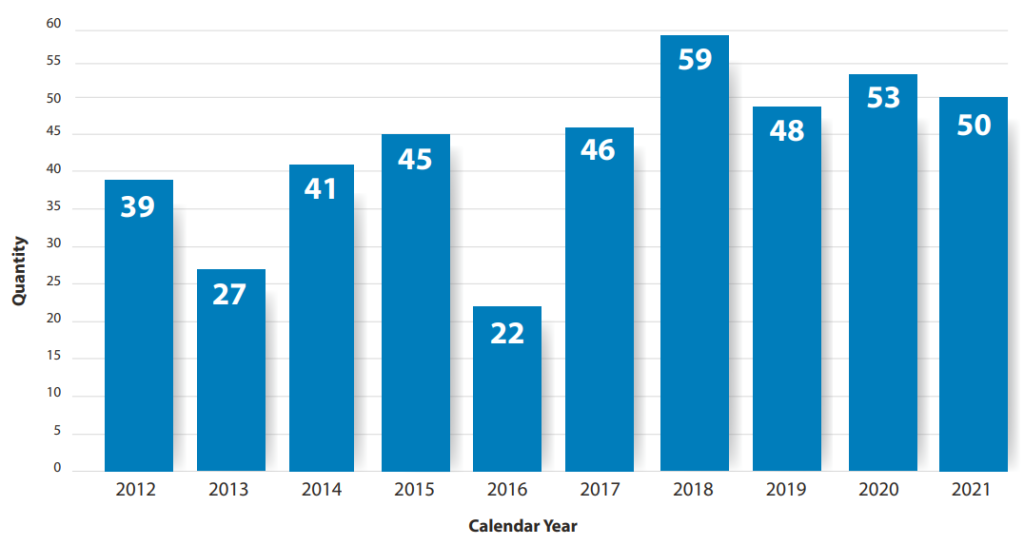
图1 2012年到2021年FDA获批药物数目
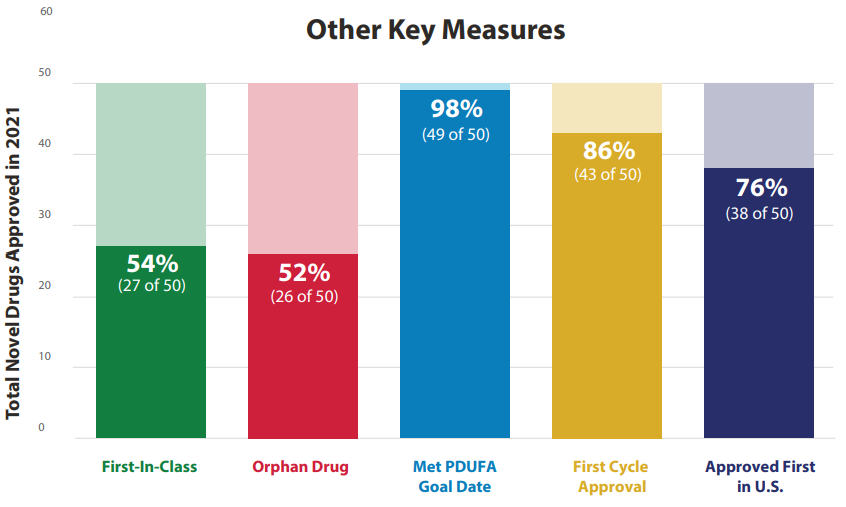
图2 2021年FDA获批药物情况
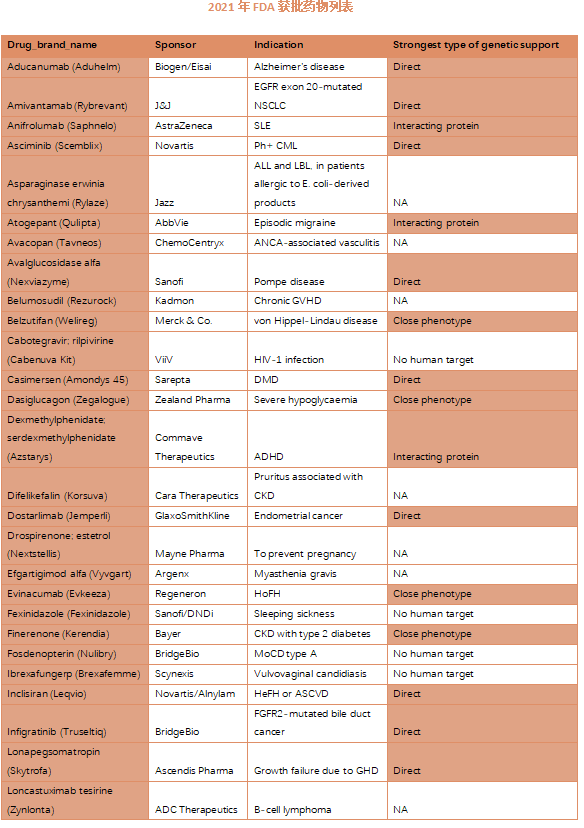
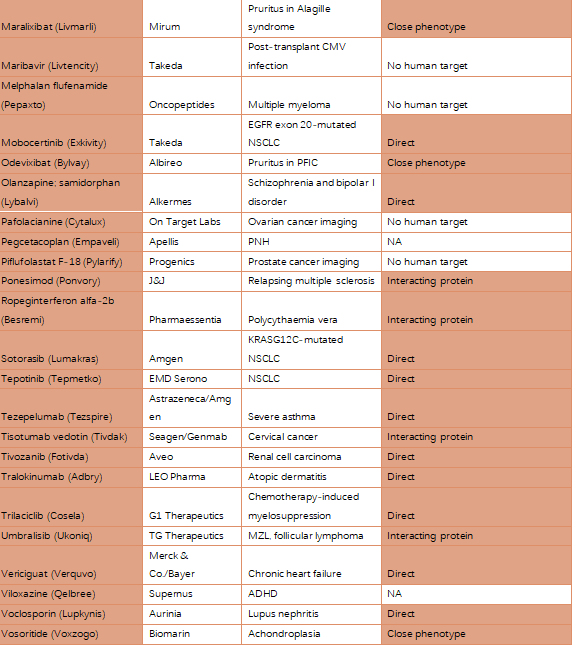
回顾过去的观察结果,有人类基因组学研究证据支持的靶向药物更有可能通过临床试验取得进展。该研究人员调查了在2021年FDA批准的50种新药中可以根据公开的人类基因组学信息进行回顾性解释的比例。研究发现,2021年FDA批准的50种新药中有33种(66%)直接指向靶标的编码基因或与这些靶标相互作用的蛋白质。

图3 2021年FDA获批新药的人类基因组学证据
最流行的疾病特征相关基因信号识别方法之一是全基因组关联分析(GWAS)。在药物研究中,GWAS信号的解释通常需要整合基因组数据与的临床表型。Finerenone是一种NR3C2拮抗剂,2021年获批用于治疗慢性肾脏疾病(CKD)。GWAS和功能基因组分析表明NR3C2的内含子变异与CKD的早期症状—微量白蛋白尿相关。利用现有的基因组学数据可以用来确定性状相关变异和NR3C2之间的联系,以及评估微量白蛋白尿与CKD患者的临床相关性。
一些获批的药理靶点没有直接的基因组学研究证据,但与基因相关的产物在物质上或功能上相互作用。例如,IFNAR1拮抗剂Anifrolumab于2021年获批用于治疗系统性红斑狼疮(SLE)。虽然没有发现直接的基因证据支持IFNAR1与SLE之间的关联,但TYK2激酶错义突变与IFNAR1的相互作用已被证实与SLE相关。
在肿瘤学中,特异的生物标记物的识别最大限度地提高了药物疗效。2021年批准的四种肿瘤药物适用于携带EGFR、KRAS或FGFR2体细胞突变的肺癌或胆管癌患者。Sotorasib专门用于治疗KRASG12C非小细胞肺癌患者。基因驱动的患者分层在罕见的孟德尔遗传病中也越来越普遍,反义寡核苷酸Casimersen用于治疗携带DMD突变的杜氏肌营养不良患者。
长期的基因组学证据的调查,可以更全面地了解基因在药物审批中的相对重要性。虽然基因组学证据可能不会影响某些获批药物背后的决策,但此类证据可以帮助理解治疗疗效或安全性等。在未来,基因组学研究提供的治疗策略需要进行严格评估,以避免确认偏差的风险。