NEJM | siRNA降低脂蛋白(a)对于心血管疾病的治疗作用
- boke
- 2022-12-05
- 7:07 上午
脂蛋白(a)被认为是动脉粥样硬化性心血管疾病(ASCVD)的危险因素。脂蛋白(a)由含有载脂蛋白B的脂蛋白组成,与载脂蛋白(a)共价结合。过去30年大量流行病学研究表明,血液中较高的脂蛋白(a)浓度与ASCVD风险增加有关。同时,越来越多的全基因组和遗传学研究发现脂蛋白(a)浓度与ASCVD和钙化性主动脉瓣狭窄有关。
血液中脂蛋白(a)浓度主要由基因决定,其表达受载脂蛋白(a)基因(LPA)控制。Olpasiran是一种siRNA分子,它可以扰乱LPA的表达,降解载脂蛋白(a) mRNA,从而阻止脂蛋白(a)颗粒在肝细胞内的组装[1,2]。
近日,来自哈佛大学布莱根妇女医院的Michelle L. O’Donoghue教授团队将一项名为OCEAN[a]-DOSE,针对脂蛋白(a)的降血脂药物olpasiran的最新临床试验结果公布于《新英格兰医学杂志》上。该实验通过将患有ASCVD且脂蛋白(a)浓度超过150nmol/L的患者随机分配接受四种剂量的olpasiran(每12周10mg,每12周75mg,每12周225mg,每24周225mg)或等量安慰剂,进行皮下注射。观察第36周脂蛋白(a)浓度的变化百分比,从而进行安全性评估[1]。

在281名研究调查的患者中,基线脂蛋白(a)中位浓度为260.3 nmol/l,低密度脂蛋白(LDL)胆固醇中位浓度67.5 mg/dl,88%的患者服用他汀类药物,52%的患者服用依折麦布,23%的患者服用前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂。通过数据分析发现,36周时,安慰剂组的脂蛋白(a)浓度平均增加了3.6%。与安慰剂组相比,每12周接受75mg或更高剂量olpasiran的患者,脂蛋白(a)浓度显著降低。接受每12周10mg剂量olpasiran药物治疗的患者脂蛋白(a)水平降低70.5%;接受每12周75mg或225mg剂量olpasiran药物治疗的患者,脂蛋白(a)水平降低97.4%、101.1%;接受每24周225 mg剂量olpasiran药物治疗的患者脂蛋白(a)降低100.5%。Olpasiran对其他脂类也有一定的治疗效果。36周后,LDL胆固醇浓度降低了22.6%~24.8%。载脂蛋白B浓度降低了16.7%~18.9%。最常见治疗相关副作用为注射部位反应如疼痛。
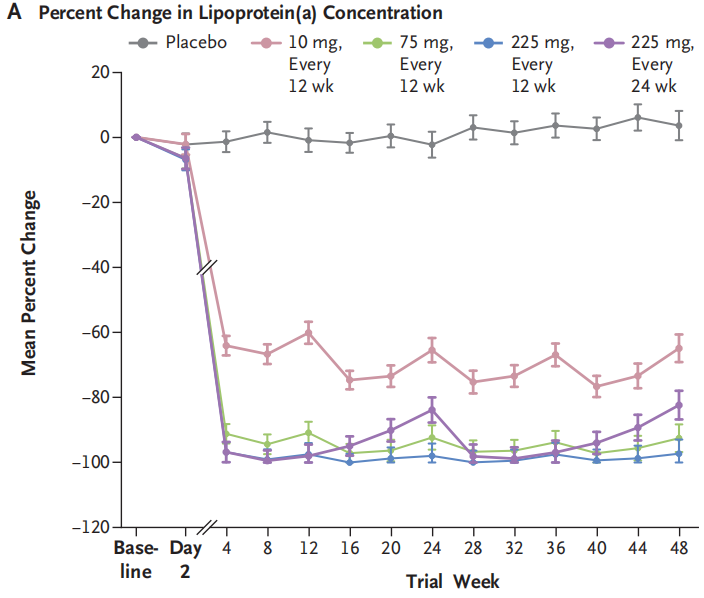
图1 与安慰剂相比,olpasiran药物治疗降低脂蛋白(a)的效果
siRNA疗法
与传统的蛋白质靶向药物和DNA药物相比,基于RNA的治疗药物因其独特的物理化学和生理学特性而具有广阔的前景。RNA在三种基本的生物大分子中发挥作用。DNA、RNA和蛋白质。RNA分子如ASO、小分子干扰RNA(siRNA)和microRNA(miRNA)可以通过Watson-Crick碱基配对直接针对mRNA和非编码RNA(ncRNA)。因此,理论上可以通过匹配目标RNA的核苷酸序列来靶向任何感兴趣的基因。
RNAi是一个内源性的细胞过程,诱导双链(ds)RNAs触发的特定RNA靶点的降解过程,它是对抗入侵的病毒和转录本的一种内在的防御机制。siRNA是短的dsRNA(20-24 nt),具有独特的结构,含有5′-磷酸/3’羟基末端,每条双链上有两个3′-突出的核糖核苷酸。siRNA能在哺乳动物细胞中诱导RNAi。
因此,研究人员可以利用这种简单的基因沉默工具来研究基因功能和推进疾病治疗。从机制上讲,内切核酸酶Dicer切割dsRNA,并在RNA诱导的沉默·复合物(RISC)中分离出引导链和搭载链。argonaute2(AGO2)蛋白降解乘客siRNA链,而引导siRNA链直接与目标RNA结合,导致AGO2介导的裂解。除了降解细胞质RNA,当siRNA与启动子区域结合时,还能在细胞核中引发染色质重塑和组蛋白修饰,导致转录沉默。[参考链接:RNA疗法扬帆起航,星辰大海]
Olpasiran的发现
美国杰克逊维尔临床研究中心的Michael J. Koren等研究人员完成新型siRNA靶向脂蛋白(a)的临床前开发和1期试验,并发表在《Nature Medicine》上。研究设计了108个针对人类LPA的初始siRNA序列,并在合成后偶联到GalNAc并且纯化用于体外试验,以评估108个siRNA分子的基因沉默效果。从最初的体外筛选中筛选出的十个最有效的候选siRNA基因进行进一步的鉴定和优化,其中就包括Olpasiran。如图3所示,效率最高的siRNA靶向LPA的KIV-3和KIV-9结构域[4]。
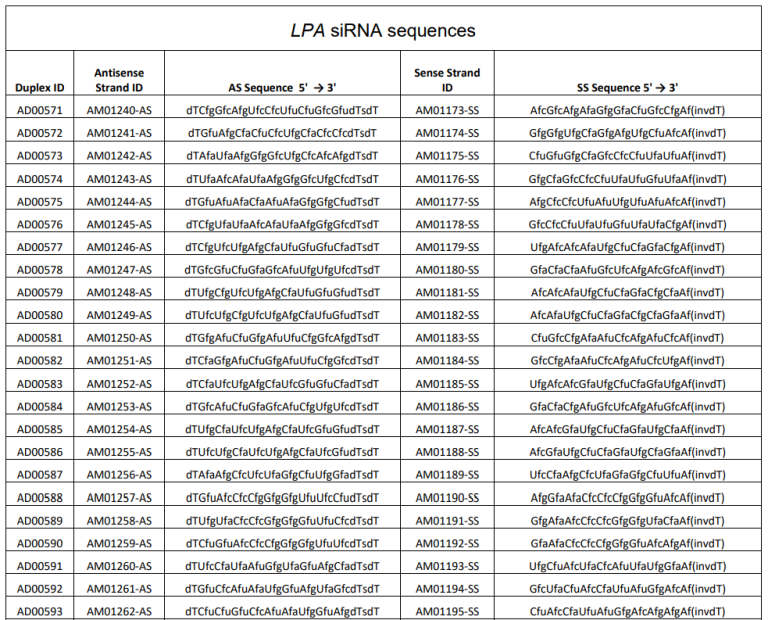
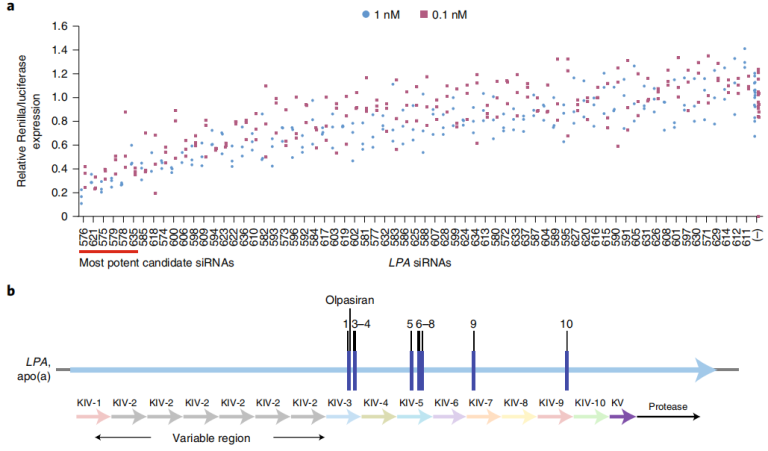
图3 LPA基因siRNA筛选(LPA siRNA候选序列及筛选后效率前十siRNA)
根据《新英格兰医学杂志》最新报道降脂新药olpasiran在OCEAN[a]-DOSE临床结果来看,对于脂蛋白(a)浓度较高的动脉粥样硬化患者来说,每12周75mg或更高剂量的olpasiran药物治疗能够显著降低脂蛋白(a)浓度,并且具有良好的安全性。
siRNA在治疗多种疾病方面有巨大潜力。随着许多其他候选药物三期临床试验的进行,可以预测在未来几年FDA将批准更多基于siRNA的治疗药物。结合目标基因和siRNA传递系统的精准设计,希望未来能够实现对更多致病基因的“敲除”,从而消除如早衰症、系统性狼疮、阿尔茨海默症、恶性脑瘤等不治之症[5]。
伯科生物RNA合成平台
伯科生物研发团队自主开发的SynStar21多功能Oligo合成仪,硬件和软件系统可以满足从科学试验到药物研发等不同DNA和RNA序列的合成需求;能够提供nmol~μmol合成规格,可进行不同类别不同长度不同修饰的核酸合成,其中RNA序列的合成长度可以达到100nt,能够满足不同长度和修饰的RNA开发需求。






