NCCN 2025 V3.0|胃癌诊断与精准治疗
- boke
- 2026-02-03
- 10:37 上午
一、疾病概述
胃癌(Gastric Cancer,GC)是指起源于胃黏膜上皮细胞的恶性肿瘤,超过95%的胃癌为腺癌,通常根据解剖位置(贲门或非贲门)和组织学类型(弥漫型或肠型)进行分类。GC是全球最常见的恶性肿瘤之一,也是癌症相关死亡的第四大原因。GC是一种多因素疾病,环境和遗传因素都会影响其发生和发展,大约50%的癌症事件可能由环境因素诱发。胃癌可发生于任何年龄,但以40-60岁人群多见,男性发病率高于女性(男女比例约2:1)。此外,长期不良饮食习惯、幽门螺杆菌感染、胃部慢性疾病患者以及有胃癌家族史的人群,发病风险较高[1]。
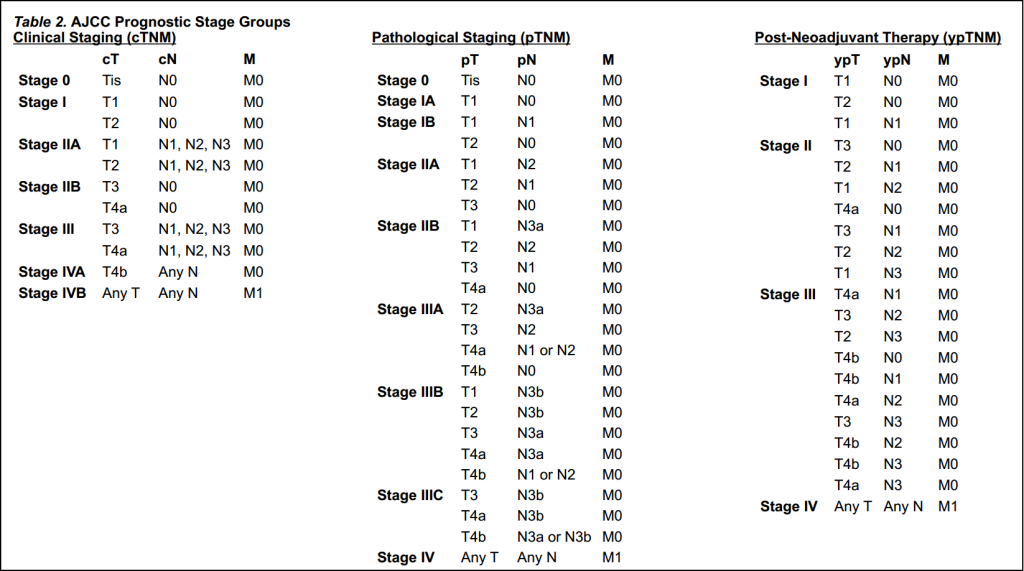
二、胃癌TNM分期
NCCN指南采用美国癌症联合委员会(AJCC)胃癌TNM分期分类:




三、胃癌诊断与治疗
1
初始评估与诊断
检查项目:
病史与体格检查(H&P)
食管胃十二指肠镜检查(EGD)及活检
胸部/腹部/盆腔增强CT(口服+静脉造影剂)
FDG-PET/CT)评估(扫描范围:颅底至大腿中段;对于局部进展期或转移性疾病,或临床有指征时)
全血细胞计数(CBC)及全面生化检查
内镜超声检查(EUS)(怀疑早期病变或需要区分早期与局部进展期病变时,首选方式)
内镜下切除术(ER)
建议所有新诊断患者均进行微卫星不稳定性(MSI)检测(采用PCR/二代测序(NGS)技术)、错配修复蛋白(MMR)免疫组化(IHC)检测、程序性死亡配体1(PD-L1)检测
若确诊/怀疑存在晚期/转移性病变,需进行人类表皮生长因子受体2(HER2)检测和CLDN18.2检测
评估Siewert分型
营养评估与咨询、戒烟建议、咨询及必要时药物治疗、筛查家族史
检测幽门螺杆菌(H. pylori)感染,早期胃癌患者若结果为阳性则予以根除治疗;必要时进行基因检测,并建议对直系亲属行幽门螺杆菌检测
2
初始治疗
(1)根据临床分期和患者身体状态分层进行不同的治疗路径
① cTis/cT1a
非手术候选者:内镜下切除(ER)
医学适合者:内镜下切除(ER)或手术
② 局部疾病(cM0, Any N)
医学适合且潜在可切除:cT1b直接手术;cT2及以上者:推荐围手术期系统治疗,若为 MSI-H/dMMR可考虑围手术期免疫检查点抑制剂(ICI)。
医学适合但不可切除:推荐放化疗或全身治疗
非手术候选者:姑息治疗
③ 转移性疾病(cM1)
姑息治疗
(2)对接受围手术期/新辅助治疗的患者进行评估疗效,再分流进行治疗
①围手术期全身治疗
反应评估方法:胸部/腹部/骨盆CT、FDG-PET/CT(根据临床指征)
可切除:手术(首选)或姑息治疗
不可切除/转移:姑息治疗
②肿瘤为微卫星不稳定性高(MSI-H)/错配修复缺陷(dMMR),则为新辅助或围手术期ICI
反应评估方法:FDG-PET/CT(临床指征)、胸部/腹部CT、EGD和活检。
无疾病证据:观察或手术→随访
持续性局部疾病:手术(首选)或姑息治疗
新发转移性疾病:姑息治疗
(3)根据手术切缘状态(R0/R1/R2)、病理分期,制定术后治疗方案(未接受术前系统治疗患者)
① R0切除(切缘无肿瘤残留)
pTis或pT1,N0:观察
pT2,N0:观察或氟尿嘧啶类单药/放化疗(针对高风险患者)
pT3、pT4、任意N或任意pT、N+:氟尿嘧啶类为基础的放化疗(若D2淋巴结清扫不足),或D2术后单纯化疗
② R1切除(镜下残留肿瘤)
放化疗(根据临床指征)
③ R2切除(肉眼残留肿瘤)
放化疗(根据临床指征)或姑息治疗
④ pM1(术后病理证实远处转移)
姑息治疗
(4)根据手术切缘状态(R0/R1/R2)、病理分期,制定术后治疗方案(接受过术前系统治疗患者)
① R0切除:全身治疗
② R1切除:放化疗,或考虑再次切除
③ R2切除:放化疗(根据临床指征)或姑息治疗
④ ypM1:姑息治疗
(5)初始治疗后无法切除/非手术候选者
重新分期:胸部/腹部/骨盆CT,口服和静脉造影,全血细胞计数(CBC)和全面的化学特征,根据临床指征进行FDG-PET/CT
可切除且可进行医学手术:手术(首选),或进入随访流程
不可切除/医学上无法手术/转移性疾病:姑息治疗
(6)不同分期/治疗方式胃癌患者的随访方案
① Tis(内镜下成功切除者)
病史与体格检查(H&P):第1–2年每3–6个月一次,第3–5年每6–12个月一次。
实验室检查:血常规(CBC)和生化全项,根据临床症状按需安排。
内镜检查:上消化道内镜(EGD)第1年每6个月一次,之后第2–4年每年一次。
影像检查:胸/腹/盆增强CT(口服+静脉造影)仅在出现症状或怀疑复发时按需进行。
② p期I(T1a/T1bN0,手术/内镜切除者)
病史与体格检查(H&P):同上
实验室检查:同上
内镜检查:经ER治疗的患者:第1年每6个月一次EGD,之后至第5年每年一次,后续按需进行。
影像检查:胸/腹/盆增强CT按需安排。
营养监测:对接受手术切除(尤其是全胃切除)的患者,需监测营养缺乏并按需干预。
③ p期II/III或yp期I-III(新辅助±辅助治疗后)
病史与体格检查(H&P):同上
实验室检查:同上
内镜检查:接受部分或次全胃切除的患者,EGD按需安排。
影像检查:胸/腹/盆增强CT第1–2年每6个月一次,之后至第5年每年一次。
营养监测:同上
(7)复发后治疗方案
① 局部复发
可切除且可进行医学手术:考虑手术或姑息治疗
不可切除或医学上不可手术:姑息治疗
② 转移性疾病
姑息治疗
(8)姑息治疗方案
① Karnofsky体能评分≥60%或ECOG体能评分≤2
治疗前需完成生物标志物检测(HER2、CLDN18.2、PD-L1、MSI,未检测过者)
治疗方案:放化疗(仅当局部不可切除且既往未接受过化疗)、全身治疗、腹膜癌作为唯一疾病(包括细胞学阳性)、最佳支持治疗
② 检测Karnofsky体力评分<60%或ECOG体力评分≥3
最佳支持治疗
(9)仅腹膜转移性疾病(包括细胞学阳性)患者治疗方案
检查:H&P、CT胸部/腹部/骨盆分期、考虑诊断性腹腔镜检查、根据临床指征进行FDG-PET/CT、病理学检查
治疗:全身治疗三个月
治疗后评估:CT、诊断性腹腔镜( 腹腔冲洗 + PCI 评分±活检 )、考虑FDG-PET/CT/内镜
重新分期:
低PCI(≤10)、疾病稳定/改善、无转移进展/腹腔外病变:经多学科会诊后,若预测完全细胞减少,可选临床试验、胃切除+细胞减灭术+腹腔化疗(HIPEC)或继续全身治疗;若预测细胞减少不完全,可选临床试验或继续全身治疗。
高PCI(>10)、疾病进展、腹腔外转移:全身治疗、临床试验或最佳支持治疗
3
全身治疗具体方案

不可切除的局部晚期、复发或转移性疾病的全身治疗方案


四、生物标志物检测与靶向治疗
1
生物标志物检测
(1)微卫星不稳定性(MSI)/错配修复(MMR)
检测方式:PCR、NGS、IHC
(2)PD-L1检测
检测方式:IHC
(3)HER2过表达/扩增、CLDN18.2、肿瘤突变负荷(TMB)、NTRK基因融合、RET基因融合、BRAF V600E突变
检测方式:IHC、ISH、靶向PCR、NGS
(4)循环肿瘤DNA(ctDNA)
检测方式:NGS
(5)Epstein-Barr病毒
EBV感染驱动胃癌发生,同时上调PD-L1/PD-L2表达,增强免疫原性。目前不推荐在常规临床护理中进行EBV检测。但是,如果肿瘤形态学中含有明显的淋巴样间质,则应进行EBV检测。
2
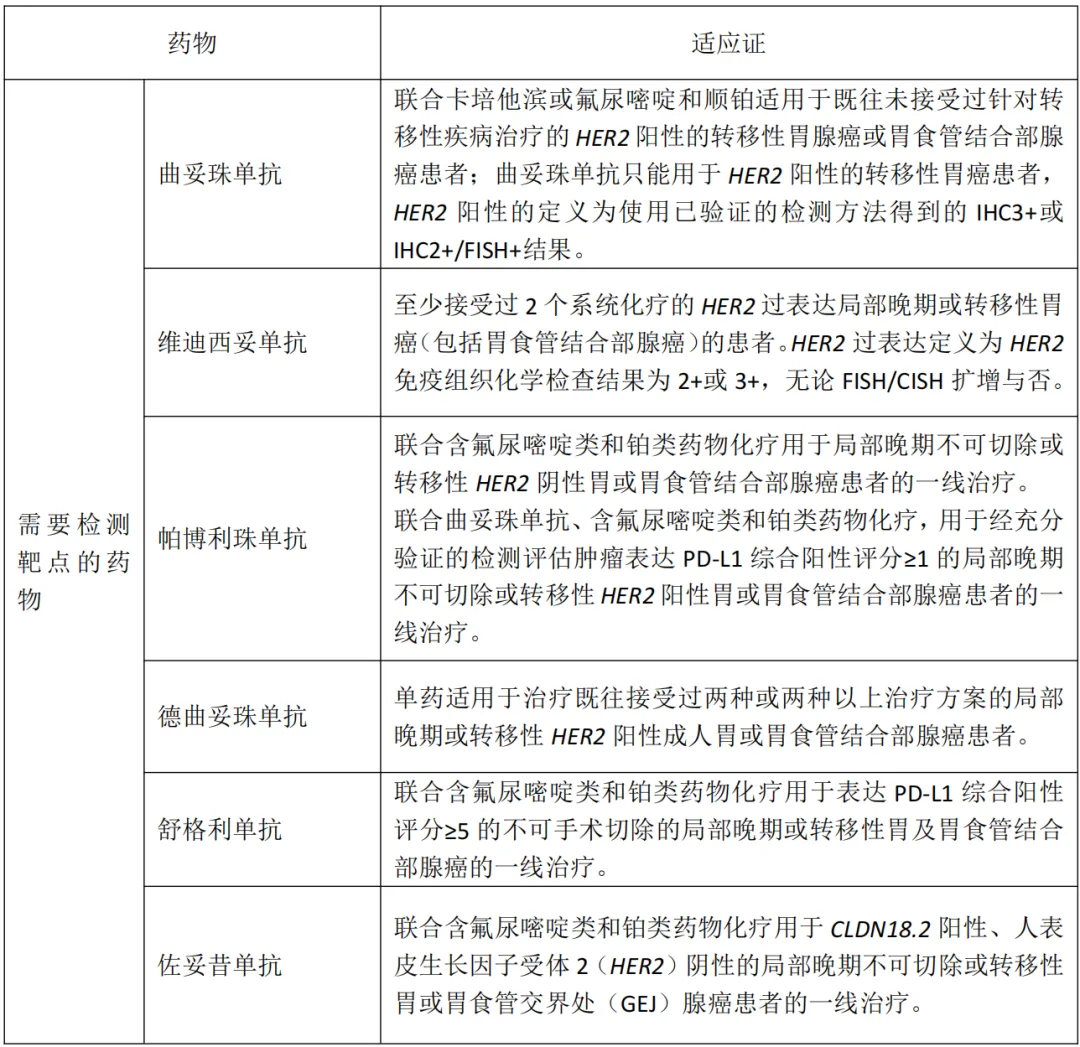
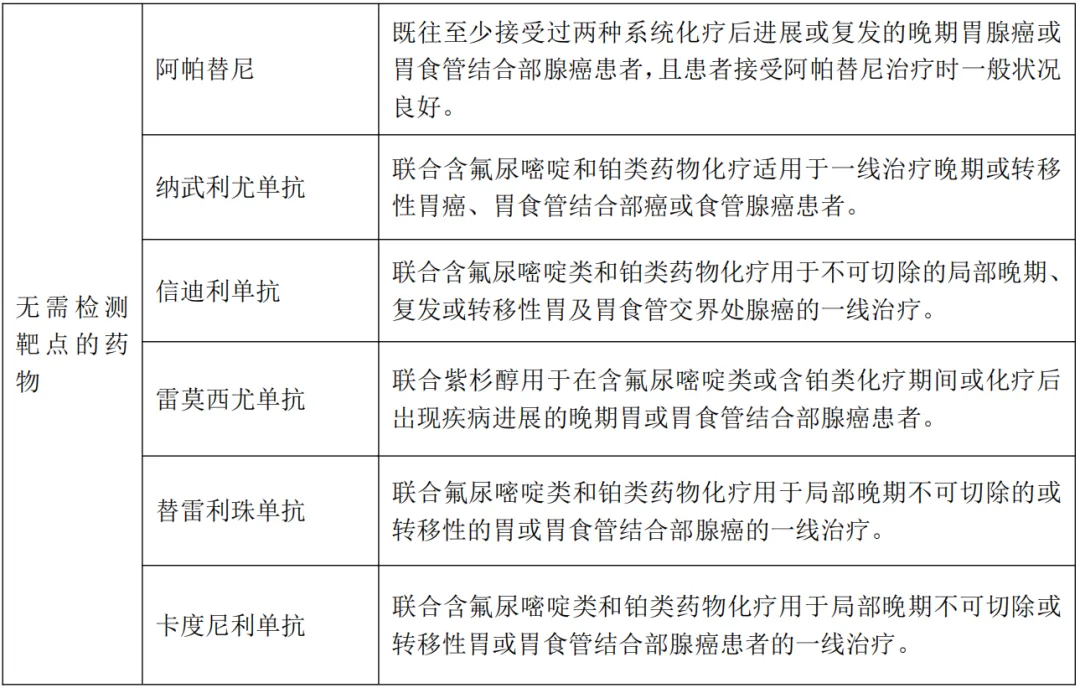
靶向治疗
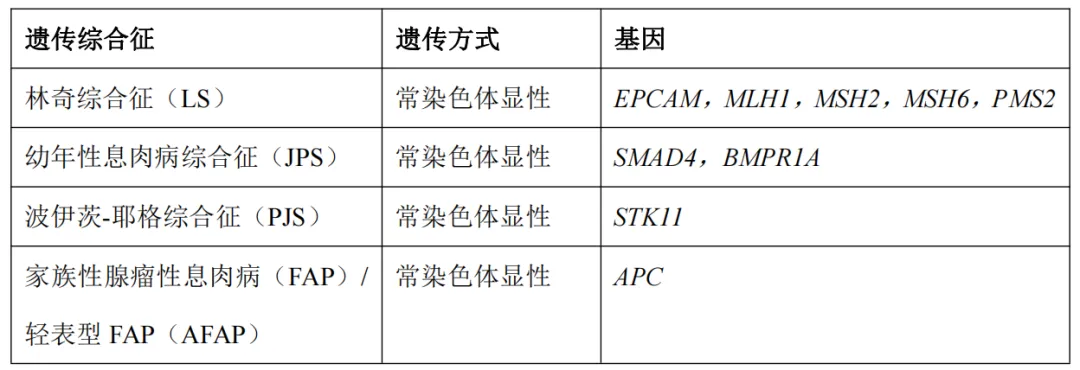
五、遗传相关胃癌筛查与诊断[4]
绝大多数胃癌是散发性的,5%~10%的胃癌患者存在家族聚集现象,3%~5%的患者可能存在遗传倾向。
遗传性胃癌包括3种类型:
遗传性弥漫性胃癌(HDGC):常染色体显性遗传,通常由抑癌基因CDH1胚系突变失活导致,也有报道CTNNA1致病性突变与 HDGC 发病相关。
家族性肠型胃癌(FIGC):易感基因不明确,家族性肠型胃癌的诊断主要依靠临床诊断,家族史中有常染色体显性遗传特征的家族性肠型胃癌患者均应考虑。
胃腺癌和胃近端息肉病(GAPPS):胃腺癌和胃近端息肉病的诊断主要靠临床诊断。
高通量测序在胃癌诊疗中应用广泛,可通过检测CDH1、CTNNA1等基因胚系突变辅助遗传性胃癌筛查与家族风险评估;结合病理等结果识别EBV阳性、MSI-H等分子亚型对胃癌精准分型;能够检测ERBB2扩增、NTRK融合指导靶向治疗;还可通过ctDNA检测动态监测肿瘤负荷、评估疗效并提示复发,为治疗方案调整提供依据。
伯科生物在国内已经建设了全流程国产化的高通量核酸合成与应用技术转化中心,建立了GMP厂房和ISO9001、ISO13485质量体系。已经为国内外数百家知名医院、科学研究机构、临床检验所开发了上千款Gene Panel(液相基因芯片),并配套完整的检测试剂,各项性能参数均与国际竞品相当或优于(详见附表1),在基因组、转录组、甲基化组及病原体的检测应用方向均有成熟的产品管线。
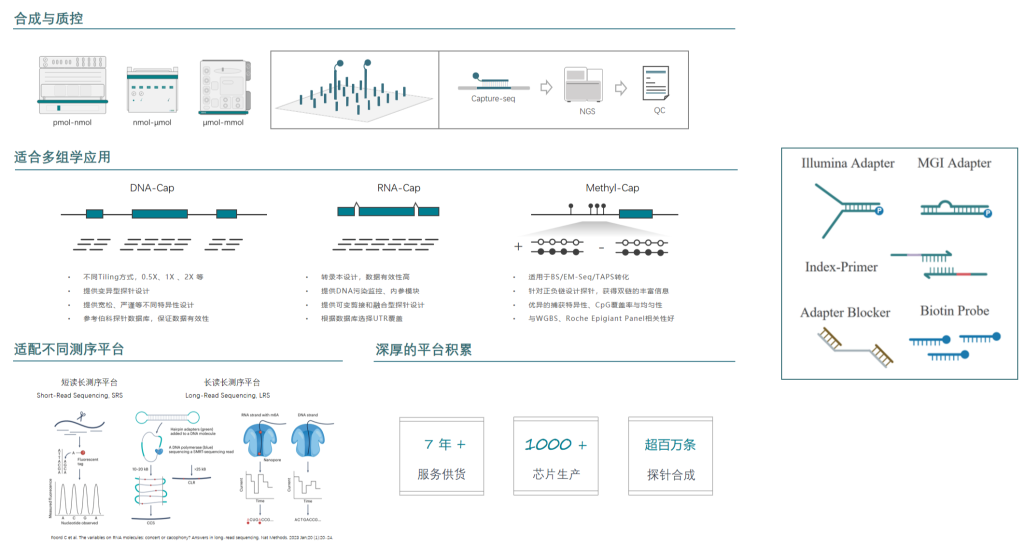
附表1: 产品简介
肿瘤液相基因芯片
伯科设计的TargetCap® OncoGene Plus Research Panel基于美国食品药品监督管理局(FDA)批准的用于肿瘤基因检测的FoundationOne CDxTM与MSK-IMPACTTM,其覆盖702个肿瘤相关基因编码区和34个基因的非编码区(融合基因),含有6个MSI和53个化药相关位点,探针覆盖2.32Mb区间。这些区域涵盖更多基因,检测范围更泛,涉及肿瘤高频突变、肿瘤易感、药物靶向、药物耐受等多种类型基因。
性能表现
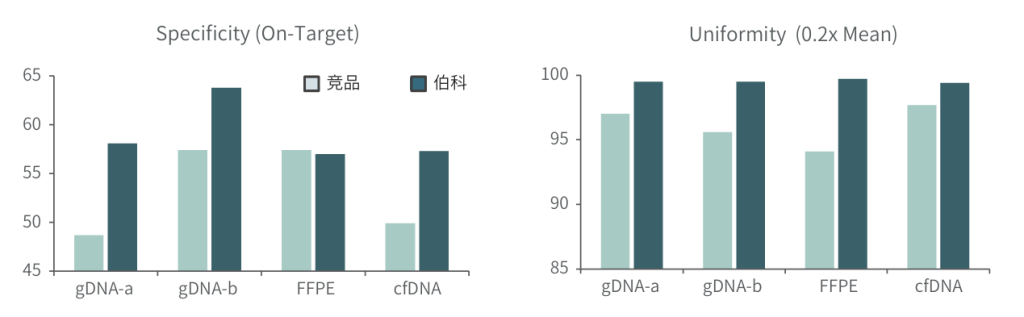
竞品评测
采用gDNA/cfDNA/FFPE/泛肿瘤800gDNA标准品文库,分别使用伯科商品化肿瘤大Panel-OncoGene Plus Research Panel与竞品肿瘤大Panel进行性能比较(二者大小相近),在捕获特异性上(On-Target)和覆盖均一性(0.2XMean)上,伯科均优于竞品。
对于gDNA标准品,竞品测序35.9Gb,伯科测序19.6Gb,虽然伯科测序数据少,深度低,但二者的突变频率检出无明显差异,伯科对EGFR的19号外显子缺失变异的检出优于竞品。
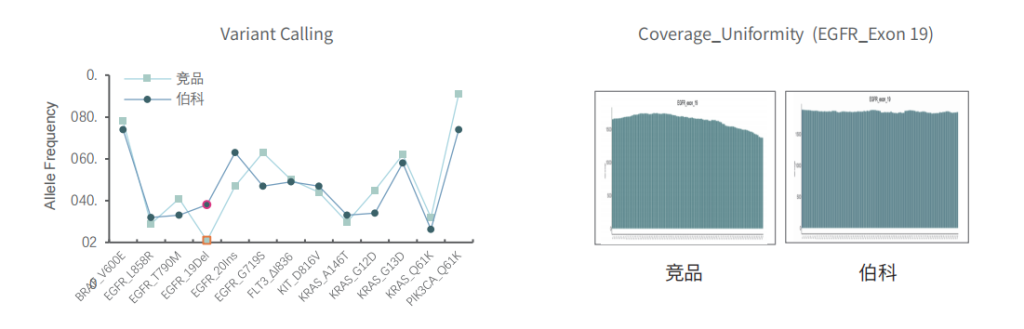
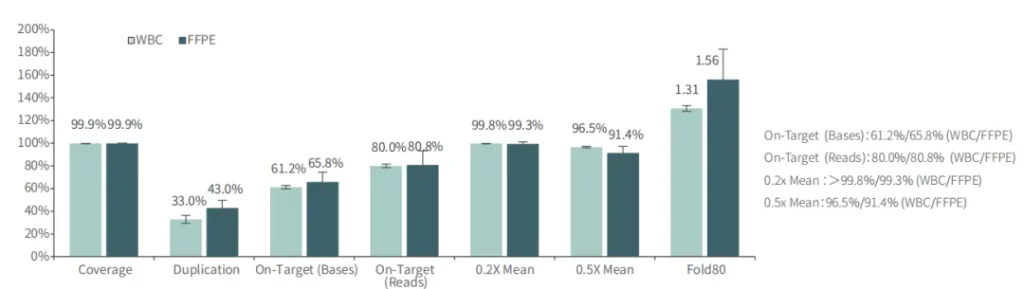
不同样本类型表现
对不同质量的gDNA样本 (WBC/FFPE, >150例),TargetCap® OncoGene Plus Research Panel表现稳定。
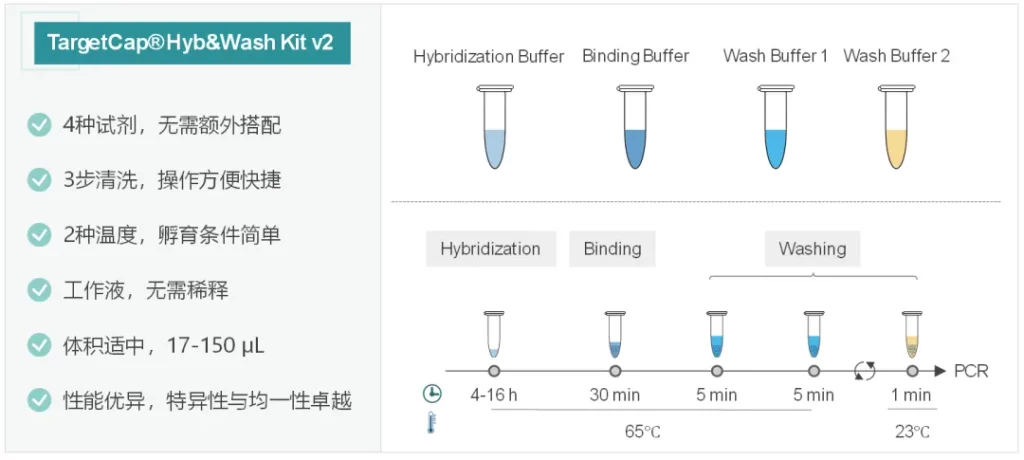
杂交与清洗试剂盒v2 简介
试剂盒概述
伯科杂交与清洗试剂盒v2 (TargetCap® Hybridization and Wash Kit v2,下文简称Hyb&Wash Kit v2)简化了试剂组分和操作流程,同时仍保持优异的捕获性能。Hyb&Wash Kit v2包含4种缓冲液组分,仅需3步清洗,操作流程更加便捷。
性能表现介绍
Ⅰ. 基本QC表现
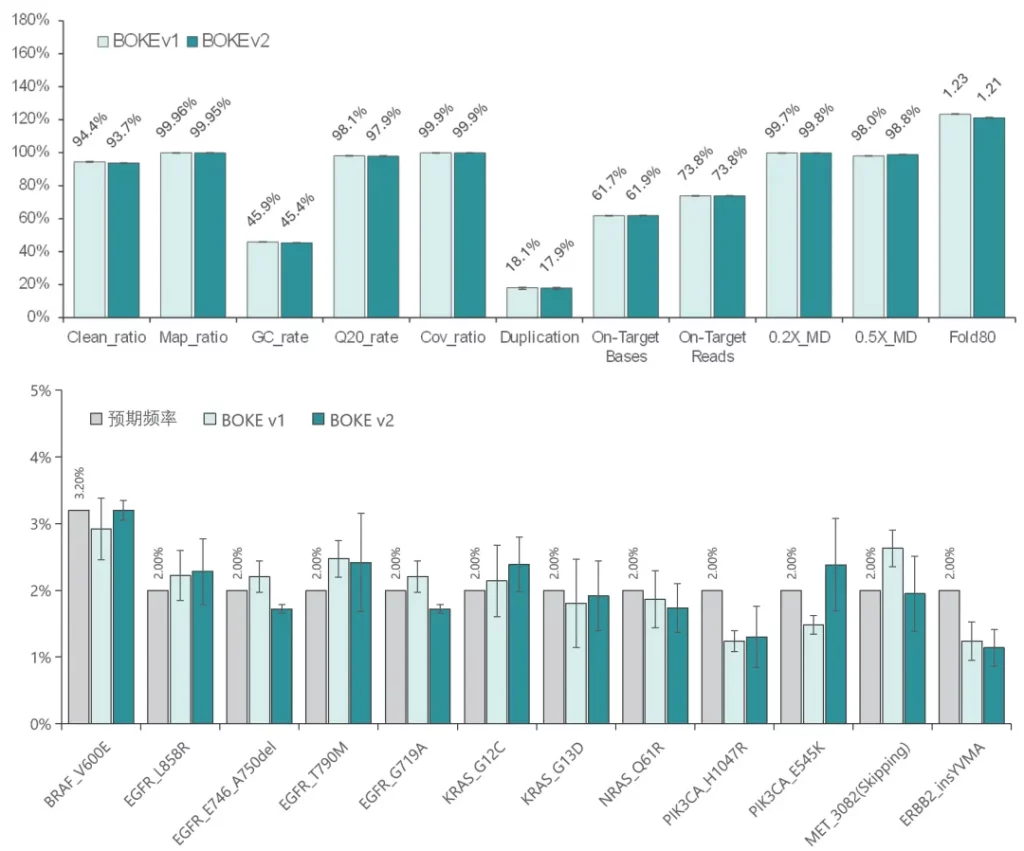
使用NA12878和NA24694 gDNA标准品,采用三款不同大小的Gene Panel (650Kb、2.3Mb和42Mb) 对Hyb&Wash Kit v2 和 v1 进行比较测试。
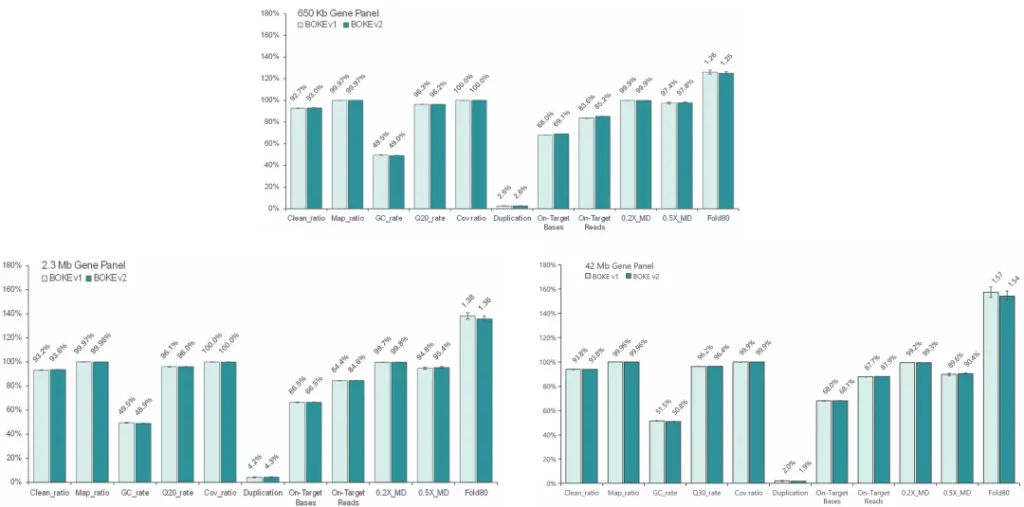
结果显示,在不同大小的Gene Panel中,对于杂交与清洗试剂盒的关键参数-中靶率和均一性,v2与v1试剂盒表现相当,v2试剂盒表现更好的均一性(0.2X_MD、0.5X_MD和Fold80)。
Clean_ratio、Map_ratio等基本参数两款试剂盒表现一致,由于v2试剂盒对低GC目标区域覆盖更佳,其GC_rate率略低于v1。
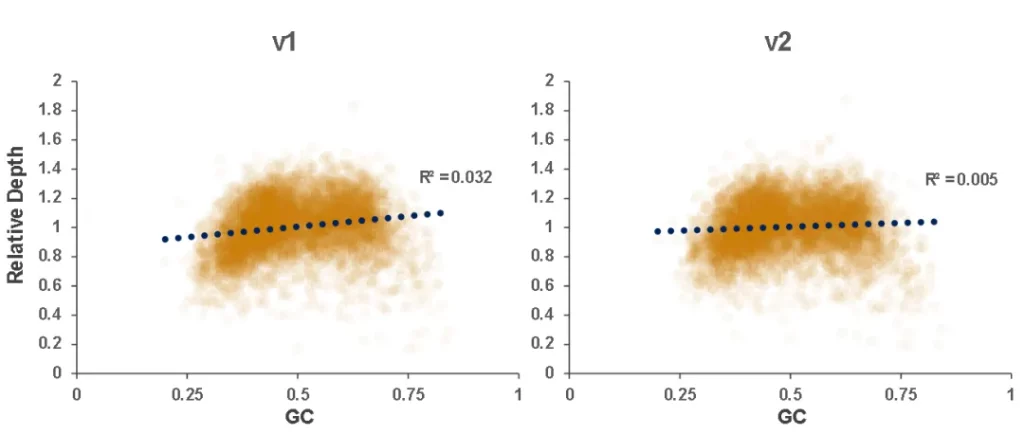
Ⅱ. 低频变异检测
使用肿瘤 SNV gDNA 标准品Ⅱ (GW-OGTM006) 对Hyb&Wash Kit v2的低频变异检测性能进行验证。GW-OGTM006 DNA标准品包含 EGFR、KRAS、NRAS、BRAF、PIK3CA、FGFR3、Her2、MET 等多个常见伴随诊断基因及位点,包含点突变、插入和缺失等多种变异类型。
采用300 Kb Gene Panel对该标准品进行捕获,捕获数据显示,v1与v2试剂盒的基本捕获性能表现相当,v2的中靶率与均一性略优于v1。同时,v1与v2试剂盒均能对12个已知变异准确检出。
参考文献:
1.Thrift AP, Wenker TN, El-Serag HB. Global burden of gastric cancer: epidemiological trends, risk factors, screening and prevention. Nat Rev Clin Oncol. 2023 May;20(5):338-349.
2.NCCN Clinical Practice Guidelines in Gastric Cancer (2025 Version 3).
3.新型抗肿瘤药物临床应用指导原则(2025年版),国家卫生健康委
4.中国临床肿瘤学会(CSCO)胃癌诊疗指南2025


