柳叶刀最新综述关注脂蛋白(a)-影响全球20%人口的心脑血管风险因素
- boke
- 2024-09-23
- 4:56 下午

摘要
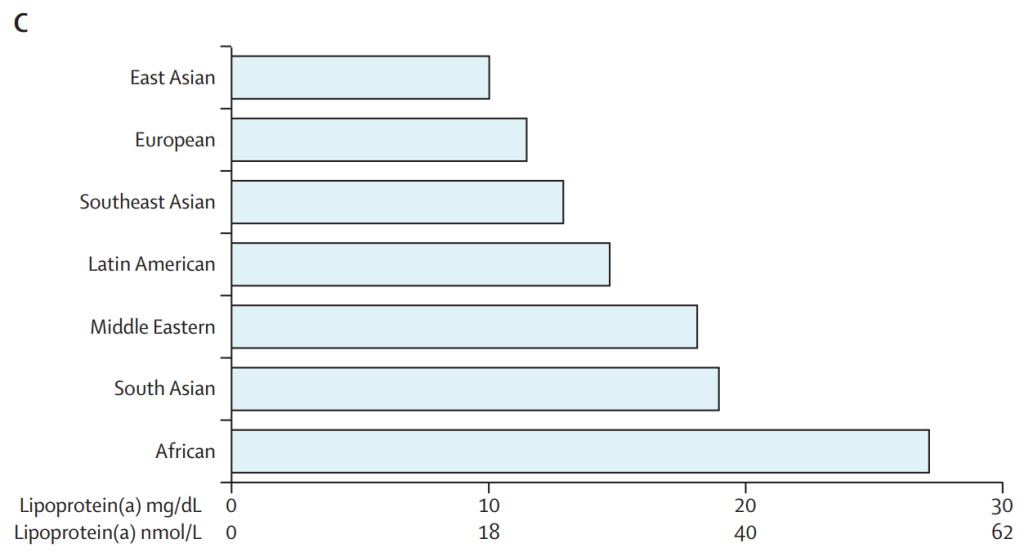
全世界有20%的人口具有高脂蛋白(a)[Lp(a)]浓度,高Lp(a)将导致动脉粥样硬化性心血管疾病和主动脉瓣狭窄的发病明显升高。Lp(a)浓度在东亚、欧洲和东南亚人群中最低,南亚、中东和拉丁美洲人群中居中,非洲人群中最高。
Lp(a)浓度超过90%是由基因决定的,绝经后女性的浓度比男性高17%。心脑血管高风险个体的一生中应测量一次Lp(a)浓度,以知晓风险并坚持健康的生活方式以及接受药物治疗来降低其他心血管风险因素。
目前没有批准的降低Lp(a)浓度的药物,开发中的至少五种药物将Lp(a)浓度降低了65-98%,目前有三种药物正在进行3期临床试验。
本综述涵盖了Lp(a)的发现历史、生理学和病理生理学、因果关系的遗传证据、流行病学、在家族性高胆固醇血症和糖尿病中的作用、管理、筛查、诊断、测量、预防和未来的降脂蛋白(a)药物。
引言
高浓度的脂蛋白(a)[Lp(a)]是心血管疾病的因果风险因素,类似于高浓度的低密度脂蛋白 (LDL)。虽然高浓度的Lp(a)和LDL都会导致动脉粥样硬化性心脏病,但高浓度的Lp(a)也会导致主动脉瓣狭窄。
LDL的因果关系证据来自人类遗传学和随机试验,但Lp(a)的因果关系证据仅来自人类遗传学。Lp(a)的浓度超过90%是由基因决定的,生活方式的影响很小,而LDL的浓度则受生活方式和遗传学的共同驱动。
许多制药公司开发的降低Lp(a)药物正处于不同阶段。目前正在开发的药物要么使用LPA基因沉默技术来降低血浆Lp(a)浓度,LPA基因编码的载脂蛋白(a)是Lp(a)组装所必须的,从而使血浆Lp(a)浓度降低80-98%,要么通过阻断载脂蛋白(a)与载脂蛋白B的结合来抑制脂蛋白(a)的形成,从而使血浆Lp(a)浓度降低65%。
对高Lp(a)的重新关注促使全球指南和共识声明建议筛查Lp(a)浓度,特别是对于高心血管风险人群和每个人一生中至少一次。需要识别出高心脑血管风险人群,以便从降低Lp(a)的治疗中获益。在这样的治疗方法出现之前,被识别为高心脑血管风险的人群应该被建议改变生活方式,并在必要时进行药物干预,以改变和控制其他心血管危险因素。
本综述重点关注与高Lp(a)相关的心脑血管疾病发展中的病理生理学,高脂Lp(a)的筛查,在没有有效降低脂蛋白(a)药物的情况下可能的干预措施,以及新药研发管线。
什么是脂蛋白(a)?
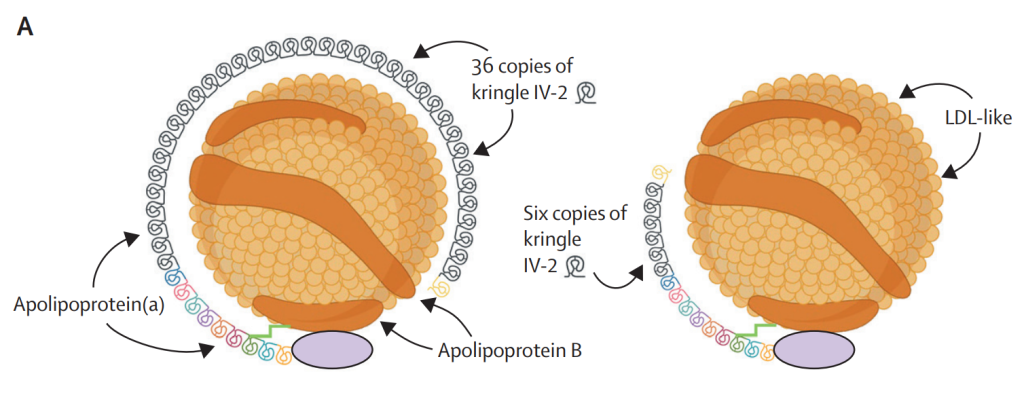
脂蛋白(a) [Lp(a)]是血浆中的一种颗粒,和LDL一样,含有胆固醇、甘油三酯、磷脂和载脂蛋白B。它含有一种独特的载脂蛋白(a),该载脂蛋白通过二硫键共价结合到LDL颗粒的载脂蛋白B组分上。在进化过程中,编码载脂蛋白(a)的LPA基因是从编码纤溶酶原的PLG基因发展而来的。
载脂蛋白(a)和纤溶酶原共享IV型和V型环状结构以及蛋白酶结构域。环状结构由于其结构而以丹麦酥皮甜饼命名,存在于凝血和纤溶系统的许多蛋白质中,可以与血凝块中的纤维蛋白结合。
载脂蛋白(a)与纤溶酶原不同,首先是载脂蛋白(a)有十种 IV 型环状结构(亚型 1-10),而纤溶酶原只有一型,其次是载脂蛋白(a)在 IV 型环状结构亚型 2 (KIV-2)中的基因拷贝数变化,范围从 1-40 多个拷贝,对应于血浆中不同的载脂蛋白(a)亚型大小,最后是载脂蛋白(a)具有无活性的蛋白酶结构域。
载脂蛋白(a)不会促进纤维蛋白溶解,因为其蛋白酶结构域失活。另一方面,体外研究表明,载脂蛋白(a)在Lp(a)上能够抑制血栓溶解。
发展历程
1963年,挪威医生Kåre Berg首次在血浆中描述了Lp(a)。然而,直到Richard Lawn, Angelo Scanu及其同事在1987年描述了LPA基因后,人们对这种脂蛋白的科学兴趣才开始增加。
在20世纪90年代初,两项前瞻性研究发现,在冷冻样本中使用统计效力较低且验证不足的Lp(a)检测方法,高脂Lp(a)浓度并非高心血管风险的预测指标,这与之前或同时进行的横断面研究和病例对照研究的结果形成对比。然而,用经过良好验证的血浆Lp(a)检测方法重新检测其中一项前瞻性研究中使用的样本后,研究人员发现高Lp(a)是未来心血管疾病的良好预测指标。
从1998年到2010年,对将高Lp(a)与心血管疾病联系起来的前瞻性研究的荟萃分析证实,高脂蛋白(a)是心血管疾病的强有力且可靠的风险因素。
2009年,两项遗传学研究重新引起了人们对高脂Lp(a)的关注。这两项研究使用了LPA基因中KIV-2的重复次数和单核苷酸多态性,结果表明,遗传性高脂蛋白(a)是冠心病的致病风险因素。这些发现后来被类似或不同设计的遗传学研究证实。此外,2013年,遗传性高Lp(a)被确定为主动脉瓣钙化和狭窄的致病风险因素,后来也证明了高浓度Lp(a)也是如此。
基于这些证据,2010年欧洲共识建议,高心脑血管风险人群应进行血浆脂蛋白(a)检测。这一建议如今已被全球脂类指南和共识声明所采纳。2019年,欧洲指南提出了进一步的建议,指出每个人都应该在一生中进行一次脂蛋白(a)检测,这一建议后来得到了印度、加拿大、中国和美国指南的认可。同年,第一项旨在降低心血管疾病风险的降低Lp(a)的3期临床试验正式启动。
生理学和病理生理学
尽管Lp(a)的生理作用通常被认为不清楚,但遗传证据表明,高浓度的Lp(a)与心脑血管发病率和死亡率相关,尤其是在50岁以后(下图)。
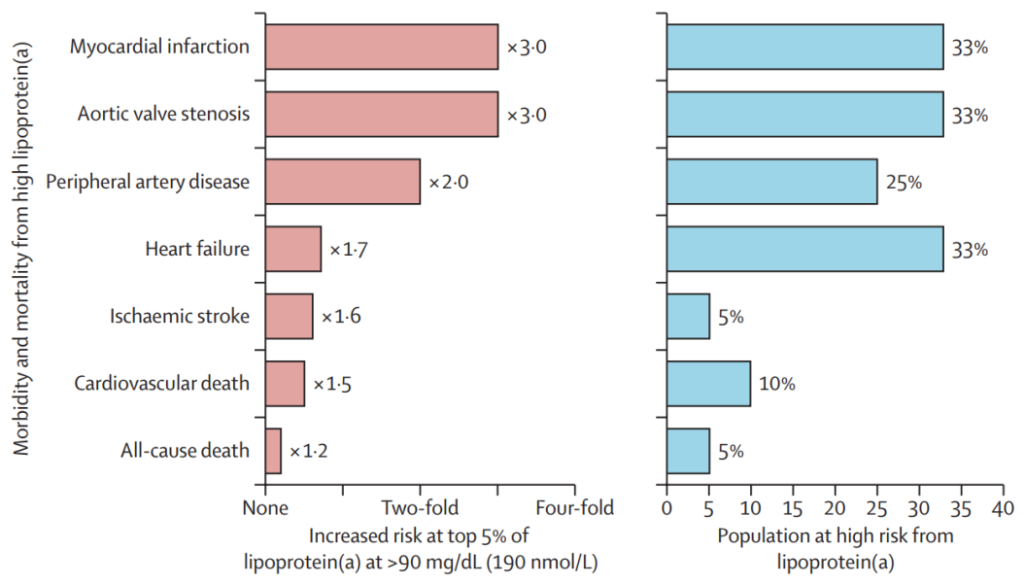
图2. 心脑血管疾病发病率和死亡率与最高血浆脂蛋白(a)浓度有因果关系
载脂蛋白(a)独立进化了两次(一次在刺猬中,一次在旧大陆的猴子、猿类和人类中),这表明高Lp(a)在没有现代医学的年轻哺乳动物中具有生存优势。载脂蛋白(a)与纤溶酶原的同源性表明其在纤溶作用中的作用,而纤溶作用的抑制会导致更好的伤口愈合,这可能代表一种生存优势——例如,在分娩期间。
支持这一观点的是,脂蛋白(a)附着在动脉损伤和纤维蛋白积聚的部位。
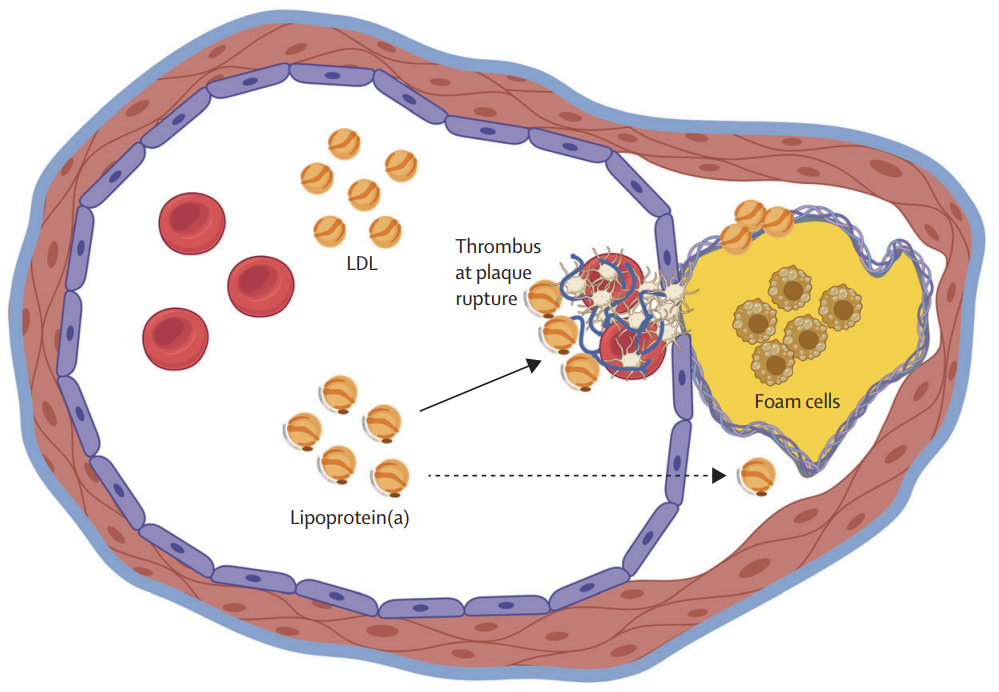
图3. 高血浆脂蛋白(a)浓度在动脉粥样硬化斑块破裂部位血栓生长中的作用
50岁以后,在Lp(a)浓度高(>30 mg/dL [62 nmol/L])的人群中,类似的病理生理机制会导致血栓在动脉粥样硬化斑块破裂部位通过纤溶作用抑制而生长,最终导致心肌梗死和缺血性卒中风险增加。在轻微动脉损伤部位,包括湍流期间,微血栓可能会被纳入动脉壁,导致动脉狭窄和主动脉瓣狭窄。
与高LDL胆固醇类似,高Lp(a)理论上也可能导致胆固醇沉积在动脉粥样硬化斑块中。然而,高Lp(a)导致心血管疾病风险的增加远大于高Lp(a)中胆固醇和载脂蛋白B含量的增加,这支持了Lp(a)和LDL胆固醇导致心血管疾病的机制不同的观点。
人群分布:种族和性别
东亚、欧洲和东南亚人群的脂蛋白(a)浓度最低,拉丁美洲、中东和南亚人群的脂蛋白(a)浓度中等,非洲人群的脂蛋白(a)浓度最高。
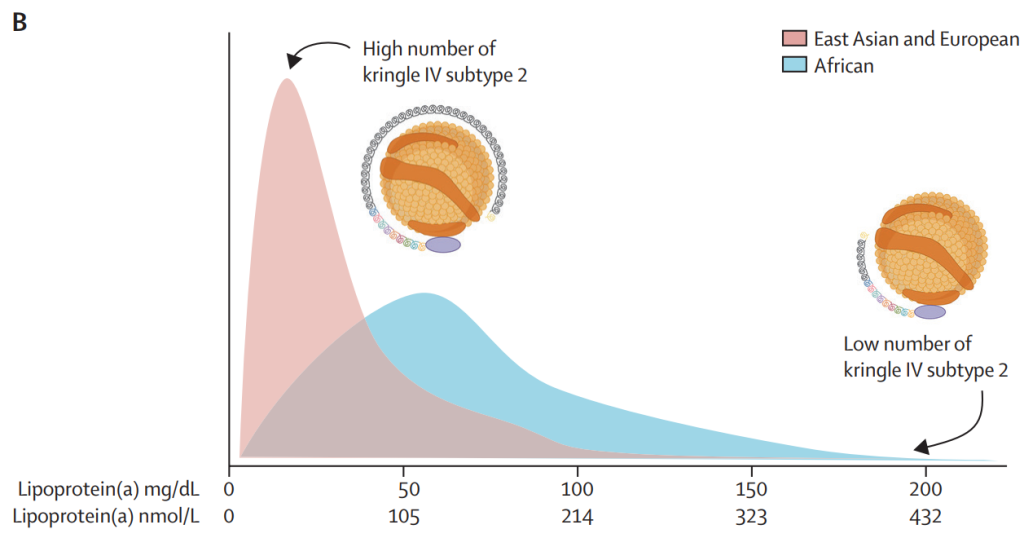
图4. Lp(a)浓度主要由LPA基因中的KIV-2拷贝数决定
所有种族人群的Lp(a)浓度超过90%是由基因决定的,最重要的是由Kringle IV Subtype 2(KIV-2)的重复次数决定。KIV-2重复次数较多时,载脂蛋白(a)分子在肝细胞内被降解;而重复次数较少时,这些分子则被自由分泌到肝细胞外,与低密度脂蛋白颗粒结合形成脂蛋白(a)。因此,KIV-2重复次数与Lp(a)浓度呈负相关。此外,LPA基因座中许多常见的和罕见的单核苷酸多态性会影响KIV-2重复次数与脂蛋白(a)浓度之间的负相关性。最后,女性的Lp(a)浓度在50岁以后比男性高17%,这通常与更年期年龄一致。
脂蛋白(a)的测量
因为Lp(a)浓度在人的一生中保持相似,因此理想情况下,应该在任何接受检测的个体首次进行脂质谱检测时测量其浓度。对于以前测量过脂质谱的人群,应在下次脂质谱检测中加入Lp(a)的测量。在更年期之前测量过Lp(a)的女性,应该在50岁或更年期后大约5年进行一次额外的测量。当有降低Lp(a)的治疗方法可用时,应监测其浓度以记录治疗效果。
所有化学病理学和临床化学实验室都应提供新鲜样本的Lp(a)测量,以便及时报告标准脂质谱中的Lp(a)浓度。长期冷冻样本会导致浓度偏低。实验室应使用一种不受载脂蛋白(a)异构体大小(KIV-2的重复次数;图1)影响的检测方法,例如使用五到六种不同载脂蛋白(a)异构体大小的校准物的检测方法。
理论上,用 nmol/L 报告脂蛋白(a) 浓度是首选,而 mg/dL 在临床用途上同样有效。截至 2024 年,Denka试剂盒在全球大多数Lp(a)测量中普遍使用。
我们使用该试剂盒对 14,000 名个体进行了测量,同时使用两种单位,并观察到它们之间高度相关(R²=0.996):nmol/L=2·18 × lipoprotein(a) in mg/dL – 3·83。
在本综述中,使用该公式以两种单位显示所有脂蛋白(a) 浓度。
实验室报告应标注为异常超过 105 nmol/L 或超过 50 mg/dL 的浓度,以提醒患者和临床医生高心血管风险状况。该浓度阈值代表不同种族人群的一般人群中略微不同的百分位数),但仍然表明无论种族或性别,个体都处于临床上重要的较高心血管疾病风险中。由于不同种族人群在相似浓度下心血管疾病风险相似,因此实验室报告中应对所有种族和所有性别使用相同的阈值。
在许多国家,Lp(a)意识的最大障碍是缺乏对检测的普遍资助以及患者支付的费用。应尽快解决这个问题,特别是因为测量Lp(a)的实验室费用并不高于许多其他临床生化检测。另一个障碍是Lp(a)测定的差异。
脂蛋白(a) 什么时候算高?
与较高的Lp(a)浓度相关的心脑血管疾病风险是逐渐增加的,没有正式的临界值。然而,出于实际目的,可以提及一些阈值。血浆Lp(a)浓度超过30 mg/dL (62 nmol/L) 的人,患心脑血管疾病的风险比Lp(a)浓度低的人要高,尽管在30 mg/dL和50 mg/dL (62-105 nmol/L)之间,风险增加可能很小。
欧洲动脉粥样硬化学会关于Lp(a)的第一个共识声明同意将Lp(a)浓度高于50 mg/dL (105 nmol/L) 视为临床上重要的,并表明高心血管疾病风险,也就是说,全球差不多五分之一的人都有高风险。Lp(a)浓度超过90 mg/dL (190 nmol/L) 通常被认为是严重的高心脑血管疾病风险,而Lp(a)浓度为130-391 mg/dL (280-849 nmol/L) 则对应于家族高胆固醇患者的心脑血管疾病风险。
脂蛋白(a)作为急性期反应蛋白
心肌梗死后,Lp(a)浓度可能立即下降,后来的浓度在接下来的1-2周内可能会升高到患者正常浓度的三倍。这些变化可能是因为Lp(a)附着在损伤部位以修复受损组织(图3)。患者在约1个月后浓度恢复正常。
应在急性冠脉综合征或缺血性卒中患者入院时立即测量Lp(a)以及标准脂质谱,并在事件发生后1-3个月再次测量。入院时进行的初始测量可以确保对患者脂质异常的最佳诊断,而第二次测量可以确认初始值是正确的,并且不受事件发生后立即的急性期反应的影响。
家族性筛查
也应为家族性高胆固醇血症患者的父母、兄弟姐妹和子女,或有家族史或个人史为高Lp(a)或早期动脉粥样硬化性心血管疾病的个人提供Lp(a)检测。对家族性高胆固醇血症和高Lp(a)的索引病例进行系统性筛查,发现每筛查2.4个家庭成员就发现一个新的高Lp(a)病例。
脂蛋白(a)作为心脑血管疾病的危险因素
-
遗传因果关系的证据
孟德尔随机化研究,不受反向因果关系和混杂因素的影响,在记录高Lp(a)浓度与心血管疾病之间存在因果关系方面发挥了重要作用。这一发现之所以成为可能,是因为Lp(a)浓度超过90%是由遗传决定的,并且因为编码KIV-2重复次数的 LPA 基因内的变异可能是解释整个基因组中潜在致病因素最大变异的遗传变异。此外,LPA 位点及其周围的许多单核苷酸多态性可以解释血浆Lp(a)浓度的很大差异,包括对于具有相同数量的KIV-2重复次数的人。
这种独特的可能性导致了以下发现:遗传上高或低Lp(a)浓度分别与心肌梗死、冠心病、主动脉瓣狭窄、外周动脉疾病、心力衰竭、缺血性卒中以及心血管和全因死亡率的高或低风险存在因果关系(图 2)。正在进行的药物试验将需要证明因果关系,并调查是否通过强力降低Lp(a)可以降低心脑血管疾病的风险。
-
高脂蛋白(a)的临床意义
需要观察高血浆Lp(a)浓度与发病率和死亡率之间的关系,以了解因果关系遗传证据的临床意义。根据丹麦哥本哈根的研究,在相对风险量上,最高风险是心肌梗死和主动脉瓣狭窄,其他外周动脉疾病和心力衰竭,缺血性卒中和心血管及全因死亡率的风险逐渐下降(图2)。
这一排名在所有性别中都是相似的,并且基于UKB的数据也是相似的。对于心肌梗死、主动脉瓣狭窄、外周动脉疾病和心力衰竭,Lp(a)浓度最高的5%的人的相对风险高达1.7至3倍,全球大约三分之一的人口在某种程度上处于高风险状态,而对于缺血性卒中和心血管及全因死亡率,相对风险为1.2-1.6倍,最高的5-10%的人也是如此(图2)。
由于Lp(a)浓度超过90%是由基因决定的,因此可以说,使用血浆Lp(a)的流行病学观察性研究也代表了孟德尔随机化研究。通常,心血管疾病和其他发病率和死亡率的风险随着血浆Lp(a)浓度的升高而增加,其中风险最大的是Lp(a)浓度极高的人群,这一点也体现在英国生物样本库的数据中。
这种关系对于所有已记录因果关系的发病率和死亡率终点来说都是真实的(图 2)。在较小的研究中,由于统计效力低,这种关系很难显示出来。在最大的研究中,例如来自哥本哈根(图 2)和英国生物样本库的研究,高脂蛋白 (a) 浓度会导致心脑血管疾病风险增加。重要的是,心血管疾病发病率和死亡率的风险随着所有种族和所有性别的Lp(a)浓度的升高而增加。
尽管大多数将高Lp(a)浓度与心脑血管疾病风险增加联系起来的证据来自没有基线心血管疾病的个体,但高Lp(a)也与心血管事件复发相关。高Lp(a)导致的心脑血管疾病风险独立于其他心血管风险因素,包括LDL-C和C反应蛋白的浓度,以及他汀类药物治疗的有无,这与根据孟德尔随机化原理,很大程度上由基因决定的性状的预期一致。
患有家族性高胆固醇血症的个体中的脂蛋白(a)
许多早期的病例对照研究和横断面研究表明,与没有家族性高胆固醇血症的人群相比,杂合子和纯合子家族性高胆固醇血症患者的脂蛋白(a)浓度更高,并且家族性高胆固醇血症患者的高Lp(a)会增加冠心病的风险。
因为Lp(a)含有胆固醇,而胆固醇被包含在LDL-C的测量或计算中,所以高Lp(a)通过其胆固醇含量,在25%的已诊断患者中,导致了家族性高胆固醇血症的诊断。因此,LPA基因的遗传变异导致高Lp(a),可以说是继编码低密度脂蛋白受体的LDLR基因的基因突变之后,家族性高胆固醇血症的第二常见遗传原因。家族性高胆固醇血症的不太常见的病因是编码载脂蛋白B的APOB基因和编码PCSK9的PCSK9基因的基因变异。然而,并非所有专家都同意LPA基因的基因变异是家族性高胆固醇血症的直接病因,因为大多数专家认为高脂蛋白(a)是家族性高胆固醇血症中一个独立的额外风险增强因子。
由于25%患有家族性高胆固醇血症且高Lp(a)浓度高的患者,其冠心病风险高于75%没有高脂蛋白(a)的患者,因此,高Lp(a)患者需要积极控制其他心血管风险因素。
儿童的脂蛋白(a)
在生命的最初两年内,Lp(a)的浓度会上升到一个人一生中其他时间的浓度。Lp(a)浓度超过30 mg/dL (62 nmol/L)与儿童和青少年首次和复发性缺血性卒中的高风险相关,因此,一些诊治这些年轻患者的中心会筛查高Lp(a)。然而,高Lp(a)浓度与儿童和青少年缺血性卒中高风险之间的关系应谨慎解读,因为基础研究规模较小,儿童和青少年发生缺血性卒中是罕见的。在患有家族性高胆固醇血症和高LDL-C的儿童和青少年中,高Lp(a)与颈动脉内膜中层厚度快速进展相关。如前所述,应测量任何患有或疑似患有家族性高胆固醇血症的人的Lp(a),包括儿童和青少年。
指南和筛查
总体而言,特别是英国、法国、波兰、加拿大、美国、印度和中国的心脑血管预防指南和共识声明建议,要么对心脑血管风险最高的人群测量血浆脂蛋白(a)浓度,要么在任何可能存在心脑血管风险的人群中终生测量一次脂蛋白(a)。这些指南和声明中提到的最常见的心脑血管风险因素包括:个人或家族动脉粥样硬化性心血管疾病史、家族性高胆固醇血症、中度至高度心脑血管风险、家族成员Lp(a)水平高、钙化主动脉瓣狭窄以及尽管进行积极治疗(他汀类药物抵抗)但 LDL-C水平仍未降低。
为了进行风险区分,对于Lp(a)浓度超过50 mg/dL(105 nmol/L)的个体,23% 的首次心肌梗死事件患者被正确地重新分类到更高的风险类别,而没有患者被错误地重新分类到更低的风险类别。然而,如果考虑脂蛋白(a)的整个浓度范围,Lp(a)只会略微改善风险区分。因此,只有在Lp(a)浓度较高时才应考虑重新分类动脉粥样硬化性心脑血管疾病风险,例如,通过同时考虑Lp(a)和动脉粥样硬化性心脑血管疾病的基线绝对风险。
Lp(a)水平高和冠状动脉钙化评分高相结合,也可以识别出动脉粥样硬化性心血管疾病风险极高的人群。
当前管理:通过风险因素控制进行预防
在高效、安全且获批的降Lp(a)药物上市之前,应考虑对Lp(a)水平高的人群积极降低其他已知的心血管风险因素。尽管大多数这些干预措施对Lp(a)浓度没有影响,但这些干预措施可以降低患者的心血管疾病绝对风险,从而间接降低Lp(a)水平高带来的遗传性心脑血管风险的影响。
除了健康的生活方式外,积极降低LDL-C至关重要,因为Lp(a)水平高会影响由于 LDL-C和残余胆固醇水平高而导致的已有动脉粥样硬化的心脑血管疾病风险。应遵循降低 LDL-C的标准方案,例如,服用高强度他汀类药物,然后添加依折麦布和PCSK9抑制剂,以达到所需的LDL-C目标。
对于不能或不同意服用他汀类药物的患者,可以在依折麦布和PCSK9抑制剂中添加贝派地酸。
高强度他汀类药物治疗是给予贝派地酸水平高且心血管疾病风险高的患者最重要的药物,然而,他汀类药物对降低Lp(a)没有影响。
虽然根据较小研究的结果,他汀类药物被认为会略微增加Lp(a)浓度,但对七项随机、安慰剂对照他汀类药物结局试验的参与者进行的个体水平数据发现,他汀类药物对Lp(a)浓度没有影响。值得注意的是,即使他汀类药物略微增加了Lp(a)浓度,与他汀类药物在降低心脑血管疾病和死亡率方面的良好记录效果相比,这种影响对临床的影响微乎其微。
PCSK9 抑制剂可将LDL-C降低 50-60%,将Lp(a)降低25%,Lp(a)浓度最高的患者从PCSK9抑制中获益显著。在二级预防中,新的证据表明,使用单克隆PCSK9 抑制剂进行强化LDL-C降低可以使高Lp(a)浓度患者受益,尽管目前尚无证据表明高Lp(a)患者在初级预防中也适用。此外,Lp(a)的降低与PCSK9抑制的心血管益处相关。然而,由于 PCSK9 抑制从未在高Lp(a)浓度和高心脑血管疾病风险患者中进行过选择性测试,因此该类药物没有获得批准的适应症,即Lp(a)降低可以预防心脑血管疾病。
在少数国家,主要是在德国,每周或每两周为患有反复心脑血管事件且Lp(a)浓度超过 60 mg/dL(>127 nmol/L)的患者提供降低 LDL-C和Lp(a)的血浆置换疗法。该疗法平均降低Lp(a)浓度 35%,血浆置换后立即最大降低 70%。然而,与改变脂蛋白浓度的药理学方法相比,血浆置换在专业血浆置换中心的可获得性、患者所需的访问频率以及高昂的年度成本方面存在相对限制。
烟酸可降低Lp(a) 25%,并降低 LDL-C、残余胆固醇和甘油三酯。然而,由于烟酸有许多副作用,并且烟酸与他汀类药物治疗并未降低心血管疾病事件,因此大多数国家已减少或停止使用烟酸。
对于高Lp(a)患者,应考虑降低血压、甘油三酯、残余胆固醇、肥胖减重和糖尿病控制的药物治疗。降低其他心血管危险因素应遵循一般指南建议。没有证据或指南建议在初级预防环境中使用阿司匹林预防高Lp(a)患者的动脉粥样硬化性心血管疾病;然而,对于已经患有动脉粥样硬化性心血管疾病的患者,应使用阿司匹林。与本节讨论的其他治疗方式一样,没有随机试验直接针对高脂蛋白 (a) 患者的各种治疗方法。
针对高脂蛋白(a)个体进行特定干预以降低总体心脑血管风险
健康的生活方式
• 戒烟:无变化
• 被认为健康的植物性食物:无变化
• 避免超重:无变化
• 体育锻炼:无变化
降低低密度脂蛋白胆固醇
• 高强度他汀类药物:无变化
• 依折麦布:无变化
• PCSK9抑制剂:降低25%
• 贝派地酸:无变化
• 脂蛋白去除术:降低35%
• 烟酸:降低25%
降低血压
• 指南建议的治疗:无变化
控制糖尿病
• 指南建议的治疗:无变化
降低甘油三酯和残余胆固醇
• 指南建议的治疗:无变化
减轻体重
• 指南建议的治疗:无变化
无变化=脂蛋白(a)浓度无变化
未来疗法
在过去的十年中,许多降低Lp(a)的药物处于不同的开发阶段。其中五种药物已通过注册试验或发表1、2、3期临床试验结果。这些正在开发的药物都旨在通过基因沉默技术或抑制载脂蛋白(a)[LPA基因]与类LDL颗粒结合来减少脂蛋白(a)的产生。olpasiran, zerlasiran, and lepodisiran
据报道,Pelacarsen(ASO)的Lp(a)最大降幅为80%,Olpasiran、Zerlasiran和Lepodisiran(siRNA)为98%,Muvalaplin(小分子)为65%(图6)。Pelacarsen、Olpasiran和Lepodisiran已在3期心脑血管疾病终点试验中进行测试,Zerlasiran和Muvalaplin未达到这一阶段(图6)。
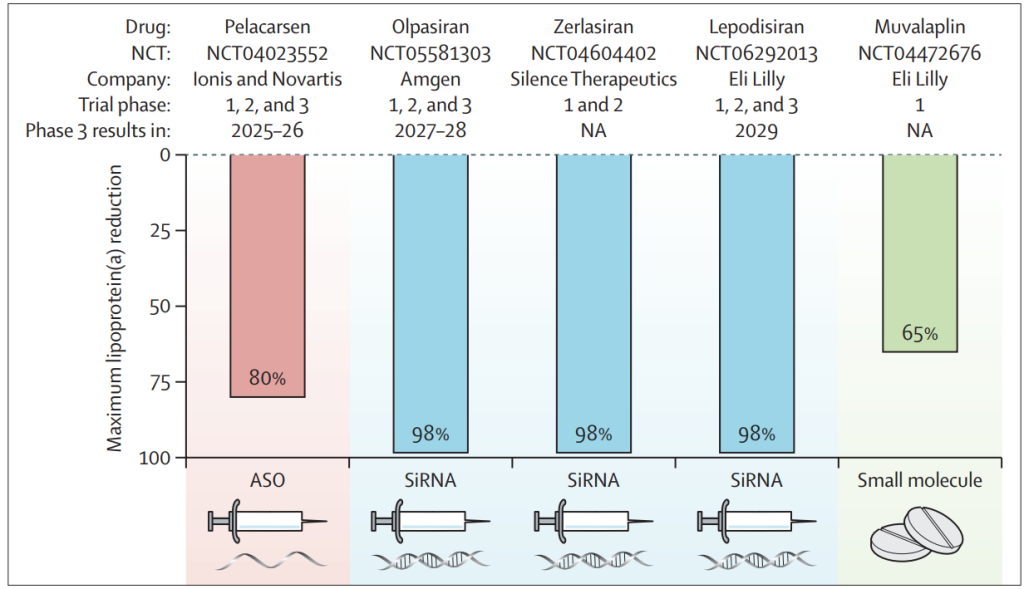
图6:五种正在开发的降Lp(a)药物的最大降幅
Pelacarsen使用反义寡核苷酸(ASO)抑制肝细胞核中编码载脂蛋白(a)的LPA基因的mRNA产生,并通过每月一次的皮下注射给药(图4)。Olpasiran, Zerlasiran和Lepodisiran (siRNA)降解肝细胞胞质内LPA的mRNA,并每年皮下注射2-4次。Muvalaplin抑制载脂蛋白(a)在肝细胞外与类LDL颗粒上的载脂蛋白B共价结合,需要每天口服。
Pelacarsen的随机双盲Lp(a)HORIZON试验(NCT04023552)已招募了8323名患有已确立的动脉粥样硬化性心脑血管疾病且Lp(a)浓度为70 mg/dL或更高(≥145 nmol/L)的患者。主要复合终点是心脑血管死亡、非致命性心肌梗塞、非致命性卒中和紧急冠状动脉血运重建。
Olpasiran的随机双盲OCEAN(a)试验(NCT05581303)已招募了7297名患有已确立的动脉粥样硬化性心脑血管疾病且Lp(a)浓度为200 nmol/L或更高(≥94 mg/dL)的患者。主要终点是心脑血管死亡、非致命性心肌梗塞和紧急冠状动脉血运重建。
Lepodisiran的随机双盲ACCLAIM-Lp(a)试验(NCT06292013)计划招募12500名患有已确立的动脉粥样硬化性心脑血管疾病或有患心脑血管事件高风险,且Lp(a)浓度为175 nmol/L或更高(≥82 mg/dL)的患者。主要终点是冠心病死亡、非致命性心肌梗塞、卒中和紧急冠状动脉血运重建。
其他药物也正在研究其降低高脂蛋白(a)浓度的作用,例如口服PCSK9抑制剂、胆固醇酯转移蛋白抑制剂和基因编辑,这些药物目前均处于临床试验阶段。然而,这些其他新型药物都没有测试降低高浓度Lp(a)是否会降低心血管疾病的风险。
结论
高浓度脂蛋白(a)是全球20%人口心血管疾病的因果风险因素,正在开发的新疗法有可能降低高脂蛋白(a)的风险。因此,及时测量所有有患心脑血管疾病风险的人的终生血浆脂蛋白(a),为这些人提供最大程度的心脑血管风险因素控制,并识别可能从降低脂蛋白(a)治疗中获益的个体。
参考资料
1. Nordestgaard BG, Langsted A. Lipoprotein(a) and cardiovascular disease. Lancet. Published online September 12, 2024.


