Nature子刊 | RNA疗法扬帆起航,星辰大海
- boke
- 2022-09-01
- 7:21 上午
小分子和抗体药物只针对人类基因组的0.05%,而且大多数疾病靶点缺乏确定的小分子结合活性位点。
丰富的RNA可以选择性作用于蛋白质、转录本和基因,这扩大了可药用的靶点范围。特定排序的RNA序列使RNA疗法的设计更加容易。
多种RNA药物已获批准,还有十几种药物正在进行第三期试验,以治疗各种罕见和常见疾病。
20世纪80年代初,抑制蛋白质合成的反义寡核苷酸(ASO)促进了基于RNA的治疗方法的快速发展。在2000年,RNAi的提出和使用siRNA沉默人类基因,导致RNA治疗的投入增加。其他RNA分子调节分子和相关机制也得到了很好的阐明。目前已有有几种RNA药物获批,还有许多处于三期研究中(图1)。
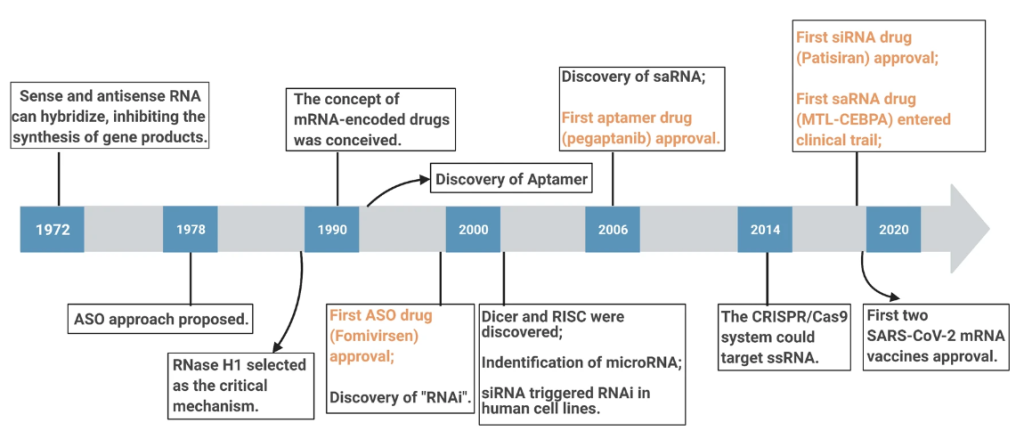
图1 RNA靶向领域的主要发展概述
与传统的蛋白质靶向药物和DNA药物相比,基于RNA的治疗药物因其独特的物理化学和生理学特性而具有广阔的前景。RNA在三种基本的生物大分子中发挥作用。DNA、RNA和蛋白质。RNA分子如ASO、小分子干扰RNA(siRNA)和microRNA(miRNA)可以通过Watson-Crick碱基配对直接针对mRNA和非编码RNA(ncRNA)。因此,理论上可以通过匹配目标RNA的核苷酸序列来靶向任何感兴趣的基因。
相比之下,只有0.05%的人类基因组被目前批准的蛋白质靶向治疗药物(小分子化学品和抗体)给药,因为人类基因组的大多数DNA序列被转录为非编码转录产物。此外,大约85%的蛋白质缺乏特定的裂隙和口袋与小分子结合。此外,体外转录(IVT)的mRNA在进入细胞质后可以应用于蛋白质替代治疗或免疫。这个过程不会像基于DNA的治疗方法那样引起不可逆的基因组变化导致遗传风险。此外,基于CRISPR的基因组编辑可以直接修改目标RNA序列以治疗特定疾病。RNA配体也可以阻断蛋白质的活性,类似于小分子抑制剂和抗体。基于RNA的疗法可以扩展用药范围,因此被认为是最具吸引力的治疗方式。
本综述概述了基于RNA的治疗方法的重要进展以及分类和它们的作用方式。本综述还包括应用这些RNA疗法的关键挑战和可能的解决方案。最后,还总结了目前RNA疗法的临床前和临床试验的情况。
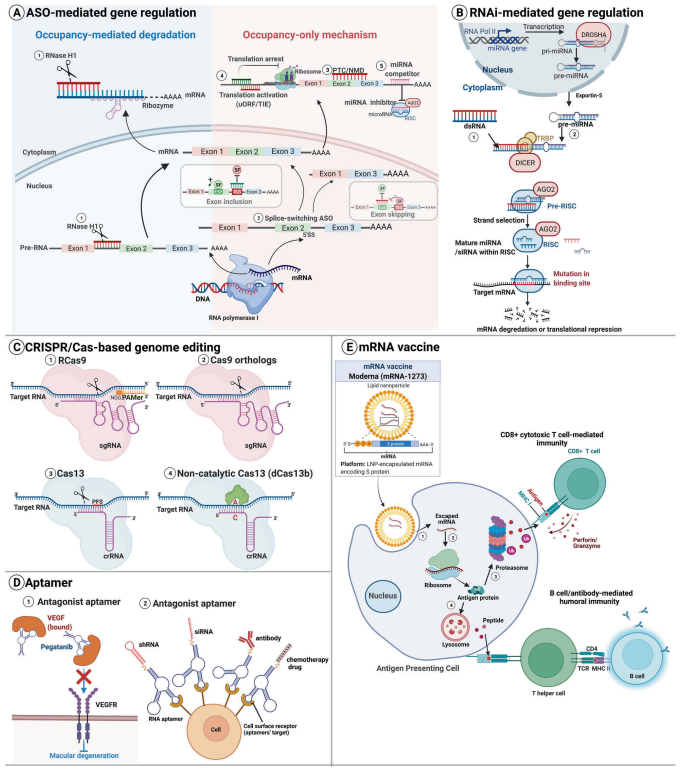
图2 基于RNA的治疗方法的类型和作用方式
RNA治疗方法的分类和作用方式
反义寡核苷酸(ASO)
ASO是短的单链寡核苷酸(12-24个核苷酸),通过Watson-Crick碱基配对与特定RNA互补。它们可以改变RNA,减少、恢复或修改蛋白质的表达。根据不同的杂交后机制,ASO被分为占位介导的降解和仅占位的模型(图2A)。
在占位介导的降解中,ASO与目标RNA结合并通过内源酶在ASO结合位点上进行裂解,增强目标转录物的下调(图2A①)。这种机制也被称为酶促RNA降解,因为它依赖于特定的酶。RNase H1介导的降解是最明确的机制,RNase H1作为一种高选择性的内切酶,直接裂解异源RNA-DNA双链。由于RNase H1无处不在,它很容易针对细胞质和核内转录本。其他酶,如核糖核酸酶,也可以介导占位介导的降解。核酸酶通过锤头或发夹结构裂解目标RNA。
在只占位机制中,ASO通过与靶标转录物的结合来控制靶标转录物的下调/上调,而不需要特定酶的辅助。有时这种机制也被称为立体阻断机制。改变RNA剪接是最广泛使用的策略。剪接转换ASO可以通过靶向剪接调节顺式元素来改变剪接模式。
只占位的ASO也可以激活内源性的细胞监调控机制啦来清除异常的mRNAs。当ASO作用于pre-mRNAs产生具有过早终止密码子(PTCs)的mRNA时,目标可以通过无义介导的mRNA衰变(NMD)而被降解(图2A③)。此外,ASO可以抑制或激活翻译。一方面,ASO可以通过翻译停止、5’帽抑制或聚腺苷酸化变化来下调目标RNA。另一方面,ASO也可以与抑制性元件结合,如上游开放阅读框(uORFs)或其他翻译抑制性元件(TIEs),从而上调目标RNA(图2A④)。
此外,ASO可以通过直接与miRNA结合(miRNA抑制剂或antagomirs)或在miRNA结合位点与mRNA结合以抑制miRNA相互作用(miRNA竞争者或block-mir)来抑制miRNA介导的下调(图2A⑤)。
RNA干扰(RNAi)
RNAi是一个内源性的细胞过程,诱导双链(ds)RNAs触发的特定RNA靶点的降解过程,它是对抗入侵的病毒和转录本的一种内在的防御机制。siRNA是短的dsRNA(20-24 nt),具有独特的结构,含有5′-磷酸/3’羟基末端,每条双链上有两个3′-突出的核糖核苷酸。siRNA能在哺乳动物细胞中诱导RNAi。
因此,研究人员可以利用这种简单的基因沉默工具来研究基因功能和推进疾病治疗。从机制上讲,内切核酸酶Dicer切割dsRNA,并在RNA诱导的沉默复合物(RISC)中分离出引导链和搭载链。argonaute2(AGO2)蛋白降解乘客siRNA链,而引导siRNA链直接与目标RNA结合,导致AGO2介导的裂解(图2B)。除了降解细胞质RNA,当siRNA与启动子区域结合时,还能在细胞核中引发染色质重塑和组蛋白修饰,导致转录沉默。
miRNAs是内源性单链小ncRNAs,通过RNAi影响基因表达。miRNAs的生物合成遵循一个系统的过程。首先,miRNAs由冗长的初级前体miRNAs(pri-miRNAs)产生,在核内被RNase III-家族核酸酶Drosha裂解。然后游离的pre-miRNAs被运送到细胞质,在那里它们的环状区域被Dicer裂解以产生成熟的miRNA。成熟的miRNA双链(由两条链组成)被装入preRISC进行链筛选。
两条miRNA链中的一条被选择性地装入miRNA诱导的沉默复合物(miRISC),而另一条链则被从复合物中弹出并被降解。两条链都可能以相似的频率被装入RISC,而不同的链的使用情况则取决于生物背景。来自茎环5′端的链和3′端的链分别被命名为”5p”和”3p”。最后,miRNA通过与特定的RNA序列(通常为3′非翻译区(UTR))碱基配对,在miRNA诱导的沉默复合物(miRISC)中引发mRNA的翻译抑制或降解(图2B)。
有趣的是,最新证据表明,miRNA可以通过增加mRNA稳定性或/和翻译来上调目标基因。例如,miR-346靶向淀粉样β肽前体蛋白(APP)mRNA 5′-UTR,上调APP翻译和淀粉样β的产生。化学修饰的、完全碱基配对的siRNA与内源性miRNA的引导链序列相同,被广泛用作模拟的miRNA。
基于CRISPR的基因组编辑
源自原核生物的CRISPR相关蛋白(Cas)系统已被广泛用于哺乳动物细胞和生物体中,以精确编辑基因组序列,导致目标基因的不可逆敲除或敲除。从机制上讲,该系统依赖于一个设计好的引导RNA(gRNA)和一个RNA引导的Cas核酸酶。gRNA通过与Cas结合形成Cas-gRNA核糖核蛋白复合物。该复合物能识别目标序列中的一个原位相邻图案(PAM)元素和一个20nt的序列。然后,Cas核酸酶在特定部位裂解dsDNA或ssRNA,以实现高效的基因组编辑。
初步的成功促进了靶向和操纵核酸的新方法的发展,如Cas9和Cas13同源衍生物的方法。Cas9系统可以针对dsDNA和ssRNA。酿脓链球菌的Cas9靶向RNA(RCas9)需要匹配的gRNA和互补的PAM呈现寡核苷酸(PAMmer)(图2C①)。
Cas9直系同源产物(空肠弯曲菌和金黄色葡萄球菌的Cas9)可以在没有PAM的情况下裂解ssRNA(图2C②)。Cas13介导的系统只针对RNA,其中CRISPR RNA(crRNA)引导Cas13裂解特定RNA。Cas13a、Cas13b和Cas13d已被验证在体外干扰和沉默哺乳动物细胞中的目标RNA。CasRx(RfxCas13d)是Cas13d的一个亚型,在HEK293T细胞中显示出最强的RNA敲除效率。(图2C)
Aptamer
Aptamer是单链寡核苷酸,具有明确的三维结构,能特异性地与蛋白质结合并抑制蛋白质。由于它们的合成来源和类似于抗体的作用模式,它们也被称为化学抗体。通过指数富集的配体的系统进化(SELEX)被用来选择适体。
基于适配体的治疗方法包括:(1)拮抗剂配体破坏疾病相关目标之间的相互作用,如蛋白质-蛋白质或受体-配体的相互作用。目前所有临床试验的诱导剂都采用这种策略(图2D①);(2)细胞类型特异性合剂作为载体,将其他治疗药物输送到目标细胞或组织(图2D②)。
mRNA和mRNA疫苗
mRNA编码药物的概念是在20世纪90年代提出的,当时将IVT mRNA直接注射到小鼠骨骼肌中显示出编码的蛋白质表达。对IVT mRNA的临床前研究促进了基于mRNA的抗癌和传染病疫苗的开发。从机制上讲,注射的mRNA疫苗被送入宿主细胞(通常是抗原呈递细胞(APCs))的细胞质中,并被翻译成目标抗原。随后,MHCs将表达的抗原呈现在APCs的表面,以激活B细胞/抗体介导的体液免疫和CD4+T/CD8+细胞毒性T细胞介导的免疫。此外,注射编码免疫刺激剂(细胞因子、趋化因子等)的mRNA可以促进APC的成熟和激活,从而诱导T细胞介导的反应,改善免疫肿瘤微环境(图2E)。
克服RNA疗法发展中的挑战
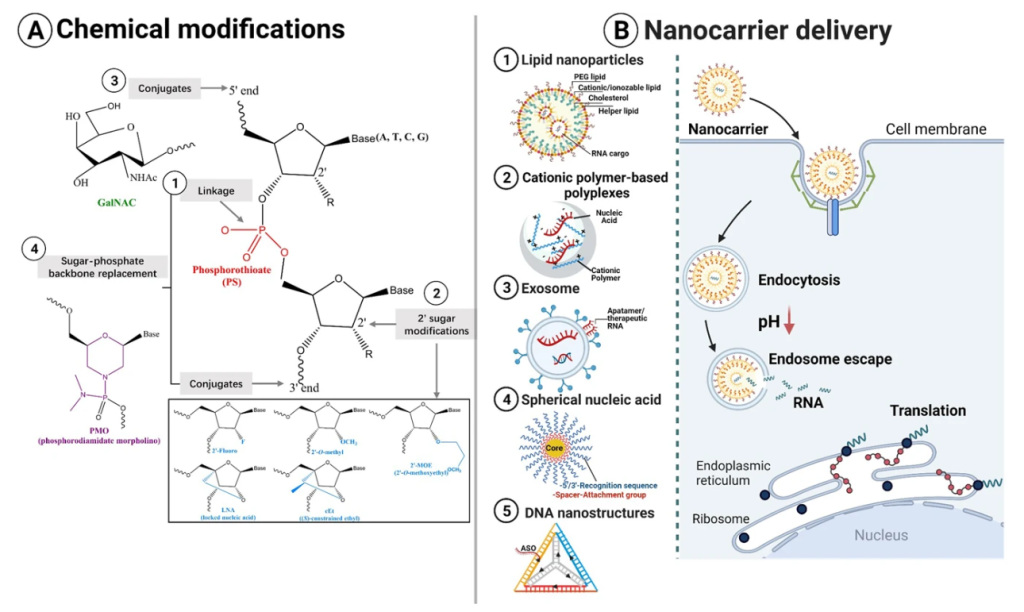
图3 克服RNA治剂开发中的挑战
化学修饰
ASOs和siRNAs的化学修饰
磷酸骨架、核糖环和3′和5′末端的化学修饰可以提高底物特异性,抗核酸酶和传递。此外,它还能减少毒性和免疫原性。硫代磷酸酯(PS)骨架的修饰(图3A①)是ASO中最早和最常用的化学修饰。在这种修饰中,核苷酸间磷酸盐基团中的一个非桥接氧原子被替换成硫。PS骨架修饰可以通过增加疏水性、抗磷酸二酯酶和结合血清蛋白来促进细胞的吸收和体内的生物利用。核糖上的2′糖的修饰,包括2′-氟(F)、2′-甲氧基乙基(MOE)、2′-甲基(O-Me)或带有O-亚甲基桥的2′,4′-双环或锁定核酸(LNA),可以提高结合亲和力,增加碱基配对熔化温度(图3A②)。2′-F和2′-O-Me修饰模仿了2′-OH的生物物理特征,可以稳定siRNA对抗RNases,同时也可以防止siRNA激活先天免疫受体(TLR、MDA-5和RIGI)。
mRNA的化学修饰、CRISPR-Cas引导RNA和Aptamer
IVT mRNA是一种ssRNA,包含5′帽结构、ORF、侧面的5′和3′UTR以及3′poly(A)尾巴。mRNA疫苗的优化通常从这五个结构开始,通过序列优化、核苷修饰或UTR的序列替换来提高RNA的翻译能力。各种化学修饰核苷,包括假尿苷(Ψ)、N1-甲基假尿苷(m1Ψ)、5-甲基胞苷(m5C)、5-羟甲基胞苷(5hmC)、5-甲基尿苷(m5U)和2-硫尿苷(s2U)已被引入mRNA中,以尽量减少IVT mRNAs引发的先天免疫反应。尽管CRISPR系统稳定而且简单,但其治疗性使用仍有许多障碍,包括有效传递、可检测的脱靶效应、潜在的免疫原性等。
用于ASO和siRNA的化学修饰模式可以应用于gRNA和Cas9 mRNA。例如,含有2′-O-M-3′PS(MS)、2′-O-M,或2′-OM- 3′ thioPACE(MSP)的化学修饰可以在5′和3′两端的三个末端核苷酸上整合到单gRNAs(sgRNAs)中,以提高人类初级T细胞和CD34+造血干细胞和祖细胞的基因组编辑效率。具有2′-OM-3′-磷酰基乙酸盐(MP)修饰的gRNA的核糖磷酸酯骨架可以大大减少脱靶裂解,同时保持强大的靶向性能。sgRNAs的5′-H组修饰可以有很强的活性,并能逃避先天免疫反应。在crRNA的特定部位加入桥接核酸(2′,4′-BNANC[N-Me])和LNA可以大大减少Cas9对DNA的非目标裂解。IVT mRNA的化学修饰可以用在Cas9 mRNA上。
纳米颗粒的递送体系
纳米技术和材料科学的发展为寡核苷酸药物输递送提供了解决方案,特别是对于跨越生物屏障和膜的细胞内输送。纳米颗粒药物递送系统的主要优点包括定制优化纳米粒子的生物物理学(如尺寸、形状和化学/材料组成)和生物特性(如靶向配体功能化),允许高度定制的递送平台。这里介绍两种主流的递送方法–脂质纳米颗粒和基于阳离子聚合物的多聚物,以及第三种新型纳米载体。表1总结了RNA治疗剂的递送方式,如表1所示。
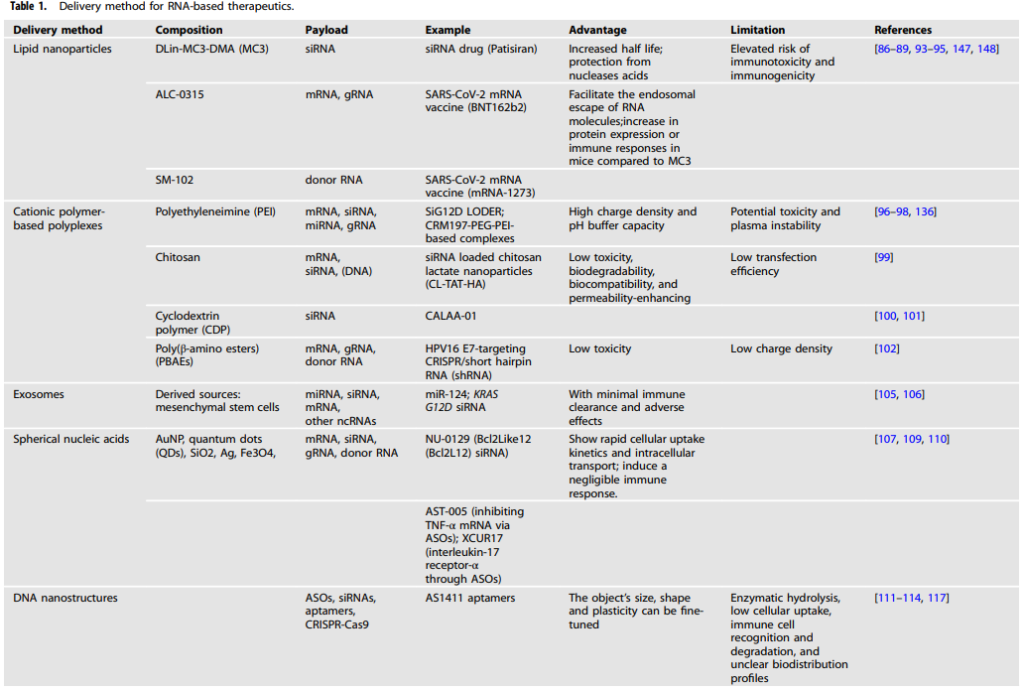
表1 RNA制剂的递送方式
脂质纳米颗粒(LNPs)
LNPs是最广泛使用的传递寡核苷酸药物的载体。LNPs由可电离的阳离子脂类、胆固醇、磷脂和PEG脂类组成(图3B①)。可离子化的阳离子脂质是核心成分。阳离子脂质通过与带负电荷的核酸静电结合形成”脂质体”,它已被广泛用于体外核酸转染(例如Lipofectamine™ RNAiMAX转染试剂)。辅助脂质、磷脂和胆固醇可以促进制剂的稳定性和传递效率。PEG-脂质可以控制颗粒大小,防止颗粒聚集,并延长体内循环寿命。已有综述全面讨论了LNPs的体系的特点和生产方法。
以LNP介导的siRNA传递为例(图3B)。酸解常数(pKa)决定了纳米粒子的电离行为和表面电荷,从而影响了传递过程。首先,带正电荷的LNPs通过包裹RNA防止阴离子RNA被核酸酶破坏,并通过受体介导的内吞作用帮助RNA穿过细胞膜。进入细胞后,纳米粒子上的电荷随着内体成熟过程中pH值的降低(从7到5.5)而增加。pKa在此范围内的纳米粒子被质子化并产生缓冲能力。纳米粒子的缓冲能力和/或膜的不稳定引起渗透性膨胀和内体破裂。纳米粒子上的电荷在细胞液中减少,削弱了与siRNA的结合。
此外,利用新技术,LNP负载的RNA实体可以安全有效地传递到特定的细胞、器官和组织中。枝尾型LNP可以在体内充分地递送三种不同的mRNA,并且对肝脏没有免疫原性或毒性。设计的可电离的LNP已被开发用于选择性地将RNA输送到各种肝细胞。选择性器官靶向(SORT)技术通过在LNP中加入一种SORT分子,可以特异性地靶向肝脏和肝外组织(肺和脾)。这项技术使特定组织中的mRNA传递和CRISPR-Cas基因编辑成为可能。因此,基于LNP的基因治疗可以治疗肝病和其他罕见疾病。
阳离子聚合物基多聚物
多聚物是用于核酸递送的标准体系。它们是由阳离子聚合物和带负电荷的核酸之间的静电作用自发形成的(图3B②)。聚乙烯亚胺(PEI)聚合物家族是研究最广泛的用于核酸递送的聚合物材料。它们由线性或支链多聚阳离子组成,可与miRNA或siRNA形成纳米级的复合物,从而实现RNA保护和细胞传递。一种市售的线性PEI衍生物,jetPEI™,被广泛用于DNA、siRNA和mRNA的转染。
此外,从PEI功能化的氧化石墨烯水凝胶原位转化RNA疫苗已被有效用于癌症免疫治疗。靶向的CRM197PEG-PEI基复合物用于体内的siRNA递送,通过敲除胶质母细胞瘤的生长因子pleiotrophin显示出治疗效果。然而,PEI具有相对的细胞毒性,而且不能降解。壳聚糖是一种生物聚合物,存在于甲壳类动物的外骨骼中。由于其生物降解性、生物相容性和渗透性增强的特性,壳聚糖及其变体已被开发用于DNA和siRNA的传递。
新兴的创新型方案–外泌体、球形核酸(SNAs)和DNA纳米结构
外泌体是脂质膜封闭的囊泡,直径为40至160纳米(图3B③)。它们存在于所有的体液中,由大多数细胞分泌。外泌体是关键的细胞间交流媒介,影响着许多细胞生物学过程。它们可以运输生物活性成分并克服生物屏障(血脑屏障)。工程化的外泌体可以传递不同的RNA物种,并将免疫清除和不良影响降到最低。
SNAs的外层是密集的、径向的核酸,并与无机纳米粒子核心共价结合。金纳米粒子(10-15纳米)是最常用的SNA核心。烷基硫醇或环状二硫的化学连接基团被用来将核酸连接到核心表面。识别序列(15-25 nt)与目标序列互补,间隔物(10 nt)连接纳米粒子表面和识别序列(图3B④)。SNAs可以有效地传递核酸,因为:(1)它们显示出快速的细胞吸收动力学和细胞内运输。它们的三维结构可以被A类清道夫受体所识别。然后,SNAs、A类清道夫受体和脂质接枝微域的接近使SNAs通过内吞作用以脂质接枝依赖性和洞穴驱动的方式被迅速内化;(2)它们诱发的免疫反应可以忽略不计。
SNAs表面的高密度核酸抑制了核酸酶介导的降解。因此,它们几乎可以进入任何细胞类型和各种生物屏障(皮肤、肿瘤和血脑屏障),而无需使用转染剂。通过外泌体递送SNAs,修改寡核苷酸糖骨架或对纳米颗粒进行PEG化,可以进一步提高SNAs的有效性。
Exicure公司已经开发出SNA治疗平台,目前有四种SNA负载的药物正在进行临床试验。携带Bcl2Like12(Bcl2L12)siRNA(NU-0129)的SNAs的系统性递送可以作为脑内胶质母细胞瘤多发症治疗的脑渗透精准治疗策略。AST-005可以通过ASO抑制TNF-α mRNA来治疗银屑病病变。XCUR17可以通过ASO靶向白细胞介素-17受体-α,用于治疗银屑病微小斑块。ST-008、TLR9激动剂SNA与免疫检查点抑制剂相结合,用于免疫肿瘤学治疗。
基于DNA的纳米结构也被广泛用作传递载体(图3B⑤)。DNA纳米结构通过在结构表面加入ASO或siRNA来传递RNA。AS1411适配体也可以插入DNA三维结构中,以促进细胞内的吸收和抗核酸酶降解。纱线状的DNA纳米环可以通过滚动圈扩增和与Cas9/sgRNA复合物的碱基配对来传递CRISPR-Cas9。此外,胞嘧啶-磷ateguanine(CpG)寡核苷酸被纳入DNA纳米管后,可以通过增强巨噬细胞的免疫刺激来靶向组织巨噬细胞。当然,DNA的高成本和自组装的高错误率会限制DNA纳米结构在新兴复杂结构中的应用。
应用
以RNA为基础的治疗方法首先被用于有明确病理的疾病,如肿瘤学、神经系统疾病和传染病。最近,COVID-19有8个ASO、3个siRNA和2个mRNA疫苗在紧急使用授权计划下获得批准(表2)。除此之外,其他药物目前正在进行临床前或临床试验。此外,最近还开发了更多基于RNA的治疗药物。
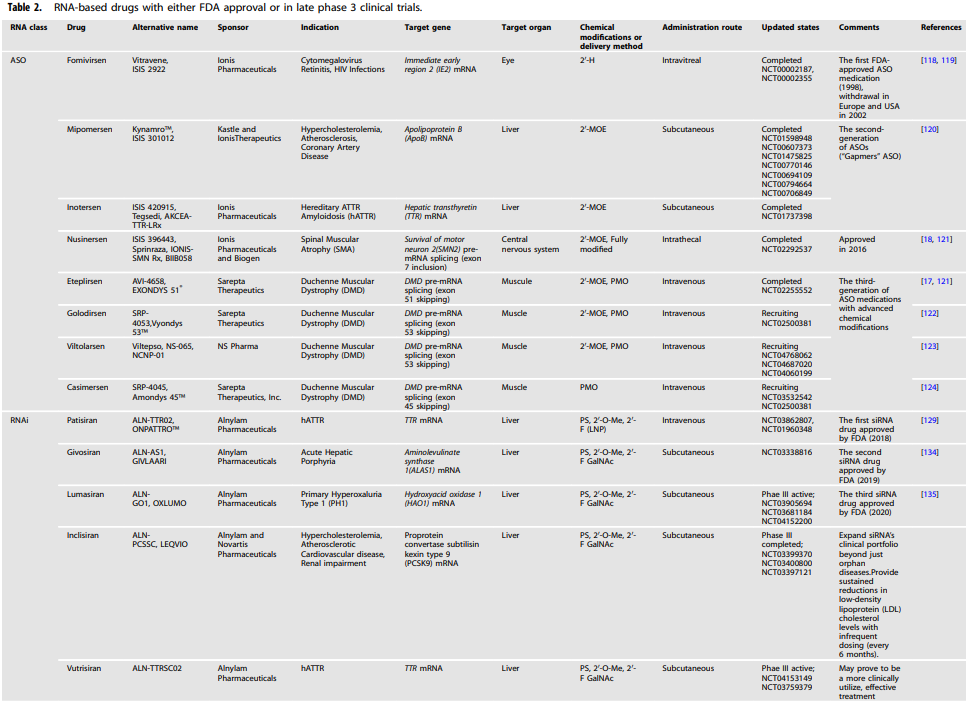
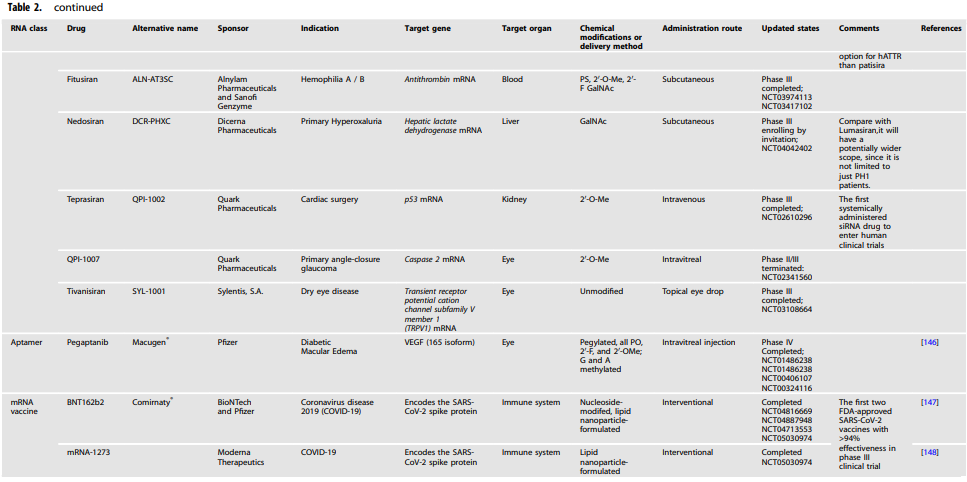
表2 RNA药物临床试验一览表
ASO在临床试验中的表现
在过去5年中,基于ASO的疗法进行了100项I期试验,其中有四分之一已经进入II/III期试验,用于治疗罕见和常见疾病,如孤儿基因改变和癌症。Fomivirsen是FDA批准的第一个ASO药物,用于治疗艾滋病患者的巨细胞病毒视网膜炎(CMV)。这种与人类CMV immediat-early mRNA互补的PS ASO可以抑制病毒蛋白的合成并中断病毒的复制。
自从引入高活性抗逆转录病毒疗法后,CMV的病例明显减少。因此,fomivirsen于2002年在欧洲和美国退出了市场。Mipomersen和Inotersen是第二代ASO药物,被称为”Gapmers”或嵌合型ASO。Mipomersen能有效地降解载脂蛋白B(ApoB)mRNA。
同样,inotersen介导RNase H1介导的肝脏转甲状腺素(TTR)mRNA的降解,以减少TTR蛋白合成和血清TTR水平。2016年,两个剪接调节ASO(nusinersen和eteplirsen)被批准用于治疗剪接缺陷。Nusinersen是第一个被批准用于脊髓性肌肉萎缩症(SMA)治疗的剪接矫正ASO。2′-MOE ASO通过与第7号内含子的剪接抑制剂结合,促进第7号外显子的纳入,增加SMN蛋白的表达。
Eteplirsen是另一种用于治疗杜兴氏肌肉萎缩症(DMD)患者的剪接调节寡核苷酸。它与51号外显子中的剪接增强序列杂交,使剪接体忽略51号外显子而直接读取框架中的52号外显子,从而产生较短但半功能性的Dystrophin蛋白。由于eteplirsen仅适用于13%-14%的具有特定突变的DMD患者,golodirsen、viltolarsen和casimersen已经被批准用于治疗具有特定剪接缺陷的DMD。这些药物诱导53号外显子或45号外显子的跳跃,从而促进了肌营养蛋白的表达。这四种药物与eteplirsen一起,属于第三代ASO药物,属于PMO精密化学修饰。
由于患者临床情况的紧迫性和ASO药物可以以序列特异性的方式进行修改,患者定制的寡核苷酸治疗已经被开发出来。Milasen是第一个病人定制的ASO,用于治疗神经元类脂变性7病(一种致命的神经退行性疾病)。它在治疗过程中表现出可接受的副作用。
目前正在进行一些临床试验,以测试核糖核酸在治疗实体瘤、HIV和其他疾病方面的疗效。RPI.4610(Angiozyme)是一种核酶,通过靶向血管内皮生长因子受体一(VEGFR1)mRNA来抑制血管生成。然而,糟糕的疗效阻碍了其临床开发。细胞介导的基因递送对HIV患者来说是一种安全的治疗方法,并有可能成为HIV的一种常规治疗方法。虽然初步的临床试验取得了积极的结果,但还需要进一步研究,以确定核糖核酸的稳定性、体内活性、组织特异性递送和长期表达。
基于RNAi的治疗
Patisiran和GalNAc结合的siRNAs
到目前为止,FDA已经批准了三种siRNA药物(Patisiran、givosiran和Lumasiran),而七种siRNA候选药物(inclisiran、vutrisiran、fitusiran、Cosdosiran、nedosiran、tivanisiran和teprsiran)正在进行第三阶段临床试验。
Patisiran是FDA批准的第一种基于RNAi的药物,用于治疗患有多发性神经病的HTTR,开创了RNAi疗法的蓬勃发展的新纪元。与inotersen类似,Patisiran siRNA(ALN-18328)通过靶向TTR 3′UTR129]沉默所有潜在的编码区突变的mRNAs。
Alnylam开发了稳定化学-GalNAc递送平台,以提高siRNA药物的临床疗效。到目前为止,临床试验中大约三分之一的RNAi药物是GalNAc偶联的siRNAs。Revusiran是第一个显著增加去唾液酸糖蛋白受体摄取的GalNAc-siRNA药物。不幸的是,由于“奋进”第三阶段临床试验(NCT02319005)中死亡人数的不平衡,它被终止了。
尽管Revusiran失败了,Alnylam通过在siRNA中战略性地定位化学修饰,可以针对核酸酶活性提供额外的稳定性,继续开发用于治疗用途的GalNAc-siRNA结合物。FDA批准的第二和第三种siRNA药物Givosiran和Lumasiran已经证明,这些GalNAc结合的皮下递送siRNA具有良好的耐受性,显著降低目标mRNA水平,并且风险较低。
其他知名公司也开发出完全化学修饰、代谢稳定的RNAi,具有不同的二级结构和化学修饰模式。RNAi疗法从肝脏延伸到其他器官,针对从罕见到影响更大患者群体的常见疾病的各种疾病。例如,夸克制药公司已经开发出治疗肾脏损伤(QPI-1002)和眼睛疾病(QPI-1007)的药物。目前,制药业的重点已迅速转向用于癌症治疗的RNAi药物。
SiG12D Loder(Local Drug EluteR)是一种可生物降解的聚合物基质,含有KrasG12D siRNA(SiG12D)药物,用于治疗胰腺癌(NCT01188785)。此外,TKM-080301(Plk1抑制剂)已被开发用于肝细胞癌,Atu027(针对蛋白激酶N3)已被开发用于晚期实体瘤。
siRNA之外的药物研发
miRNA抑制剂(Anti-miRs)和miRNA模拟物也可用于下调或上调miRNAs。Miravirsen (SPC3649)和RG-101是针对miR-122的抗miRs,用于治疗丙型肝炎病毒感染。miR-34a模拟物MRX34是第一个针对癌症的miRNA药物。然而,它们目前都没有进入临床使用,MTL-CEBPA是第一个进入临床试验的saRNA。它通过上调转录因子CCAAT/增强子结合蛋白α(C/EBP-α)来调节肝脏和骨髓功能,以及众多的致癌过程。令人鼓舞的结果促进了MTLCEBPA与抗PD-1检查点抑制剂或射频消融术相结合的临床试验的建立,以治疗实体瘤。
基于CRISPR/Cas的基因组编辑疗法
第一个应用CRISPR/Cas基因编辑的人类临床试验涉及使用体外Cas9敲除自体T细胞的PD-1(NCT03399448)。此外,β-地中海贫血症是第一个将CRISPR/Cas应用于遗传病的人类试验(NCT03655678)。第一个使用CRISPR/Cas基因组编辑来治疗视网膜缺陷的临床试验是EDIT-101(NCT03872479)。这些基于CRISPR/Cas的临床试验为锌指核酸酶的进一步基因组编辑临床试验奠定了基础。
适配体方面的研发
Pegaptanib(Macugen)是FDA批准的第一个针对血管内皮生长因子的合剂药物,用于治疗老年性黄斑变性。许多其他的适配体正处于临床前或临床开发阶段,可能用于治疗疾病,如视觉障碍、凝血、肿瘤和炎症。
mRNA疫苗
在过去的几十年里,mRNA疫苗已经获得了广泛的应用。2020年,2019年冠状病毒病(COVID-19)的爆发刺激了mRNA疫苗的历史上最快速的发展。
针对传染病的疫苗代表了mRNA疗法的最先进应用。到目前为止,已经开发了针对各种传染病的mRNA疫苗,包括流感、寨卡和呼吸道合胞病毒。针对COVID-19病毒,基于mRNA的疫苗已被证明对严重急性呼吸系统综合症冠状病毒2(SARS-CoV-2)有效。辉瑞-生物技术公司的疫苗BNT162b2(Comirnaty®)和Moderna疫苗mRNA-1273是FDA批准的前两种SARS-CoV-2疫苗,在III期临床试验中有效率超过94%。这两种疫苗都采用可离子化脂质和核苷修饰的mRNA配制的LNPs。
mRNA中的所有尿苷被N1甲基假尿苷取代,以改善mRNA的翻译。mRNA序列编码的SARS-CoV-2穗状蛋白有两个脯氨酸的改变,使蛋白具有预融合形状。最近对基于mRNA的癌症疫苗的应用进行了回顾。迄今为止,超过20种基于mRNA的疫苗已经进行了临床试验,作为固体肿瘤的潜在预防策略,如黑色素瘤、非小细胞肺癌和结直肠癌。在大多数临床试验中,mRNA癌症疫苗与检查点调节剂(PD-1、CTLA-4和TIM3)或细胞因子联合使用,以提高抗肿瘤的功效。
基于RNA的疗法的更多最新进展
除了miRNA antagomir和miRNA mimic,人工环状RNA(circRNA)海绵(circmiRs)是有前途的治疗性miRNA拮抗剂。circRNA是ncRNA的一个亚类,由于缺乏自由的3′和5′末端,以连续环状RNA存在。
它们对核酸酶的降解有抵抗力,比线性RNA更稳定。最常描述的circRNAs的功能是作为miRNA的海绵体。这些circRNAs含有多个miRNA结合位点供miRNAs结合,阻止miRNA与其典范的mRNA靶基因之间的相互作用。最近的研究表明,工程化的circmiRs是miR-132和-212的有效载体,可在小鼠模型中减弱压力过载引起的体内肥大。这些circmiRs在体外也显示出抑制miRNA功能方面更大的功效。
此外,免疫原性最小的circRNA是强效的蛋白激酶R抑制剂,其有效抑制蛋白激酶R的激活比已报道的化学化合物(C16和2-AP)高103至106倍。此外,针对SARS-CoV-2和新出现的变种的circRNA疫苗引起了更高和更持久的免疫反应。实际上,越来越多的研究集中在非编码RNA疗法上,这些研究已得到广泛关注。
以Cas13d介导的基因组疗法的研究进展为另一个例子。Cas13d已被证明可以在体外有效地下调哺乳动物细胞的RNAs。腺相关病毒(AAV)介导的CasRx和Pcsk9 sgRNAs进入小鼠肝脏,成功降低了血清PCSK9和血清胆固醇水平。此外,CasRx介导的Vegfa体内敲除可以防止老年性黄斑变性小鼠模型中脉络膜新生血管的发展。CasRx系统衍生的方法比RNAi介导的基因敲除更具特异性和效率。因此,CasRx介导的治疗提供了一种强大的方法来沉默体内肝细胞和其他细胞中的基因。最近,有人提议将其用于治疗RNA病毒感染(如SARS-Cov-2)。
结论和未来展望
各种基于RNA的方法已被应用于实验和临床试验。商品化的ASO、siRNA、antiagomirs和aptamers被广泛用于细胞和动物实验。一些ASO、siRNA、aptamer和mRNA疫苗已被批准用于临床应用。这些方法可以通过靶向特定的RNA序列来下调或上调特定的mRNA表达和抑制ncRNA的功能。化学修饰是传递基于RNA的药物的最有希望的策略之一。
核酸骨架、核糖环和核碱基本身的修饰已被广泛用于优化类药物特性以增强递送。然而,一些非天然的核苷酸可能是有害的。开发用于RNA药物输送的纳米载体可以提供良好的肝脏运输。非肝脏系统性给药的纳米药物需要进一步研究。除了基于序列的方法外,在许多情况下,基于小分子的疗法来靶向RNA将是首选。总之,将RNA的化学修饰和共轭与纳米载体系统相结合可以提高RNA给药的效率。