MRD检测在乳腺癌治疗干预中的研究进展
- boke
- 2022-04-22
- 7:07 上午
MRD的概念源自于血液肿瘤。近年来,MRD的应用已从血液肿瘤扩展到实体肿瘤(如乳腺癌,肺癌,结直肠癌)。MRD有着不同表述,比如微小残留病灶(Minimal Residual Disease),但“微小”的描述可能与检测分辨率有关,还不够严谨,因此也称为可测量残留病灶(Measurable Residual Disease),在实体肿瘤中的MRD也称为分子残留病灶(Molecular Residual Disease)。
ctDNA(循环肿瘤DNA)液体活检是监测肿瘤克隆进化和预测疗效的一种非常有前景的工具。ctDNA从癌细胞中释放并在肝、肾或血浆中迅速清除,其短的半衰期为数分钟至数小时,为定量和动态评估提供了理论依据,这就使得通过监测微观ctDNA分子的动态变化来预测临床疗效并实施干预成为可能[1]。
尽管治疗技术的不断发展,乳腺癌仍是女性癌症的主要死因[2]。通过优化治疗策略来改善治疗效果需要开发可靠的生物标志物,让患者匹配与最可能获益的治疗方式。在乳腺癌患者中,通过ctDNA评估MRD(molecular residual disease)以及耐药性变异可以帮助临床医生调整辅助治疗方案,并在临床进展前及时获得耐药性信息来改善对病情的控制。但将这种ctDNA-based MRD检测引入临床实践之前需要证明其分析有效性、临床有效性和临床效用[3]。
NGS(二代测序)技术的出现,显著提高了ctDNA液体活检的检测灵敏度,临床医生也正在将基于NGS技术的ctDNA液体活检作应用于临床实践。基于肿瘤组织突变信息先验方式的Tumor-informed MRD检测,在理论上对ctDNA分子具有更强的针对性,Tumor-naïve/Tumor-agnostic/Tumor-uninformed是指不基于肿瘤组织先验的检测方式,该技术路线在针对无肿瘤组织样本的患者时具有优势。
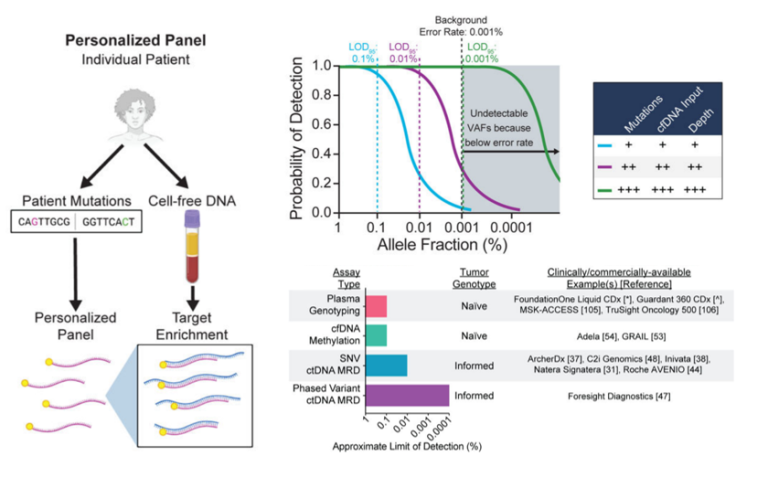
图1 基于NGS技术的MRD检测性能[4]
在早期乳腺癌研究中,几项观察性研究证明了ctDNA MRD动态评估在识别复发风险较高的患者方面的临床有效性(表1)。特别是随访期间的ctDNA MRD监测显示,ctDNA阳性患者的无病生存期(DFS)低于未检测到ctDNA的患者,ctDNA动力学预测复发的灵敏度为79-100%,特异性为100%,比标准影像学提前了半年以上(7.9-11.0)。
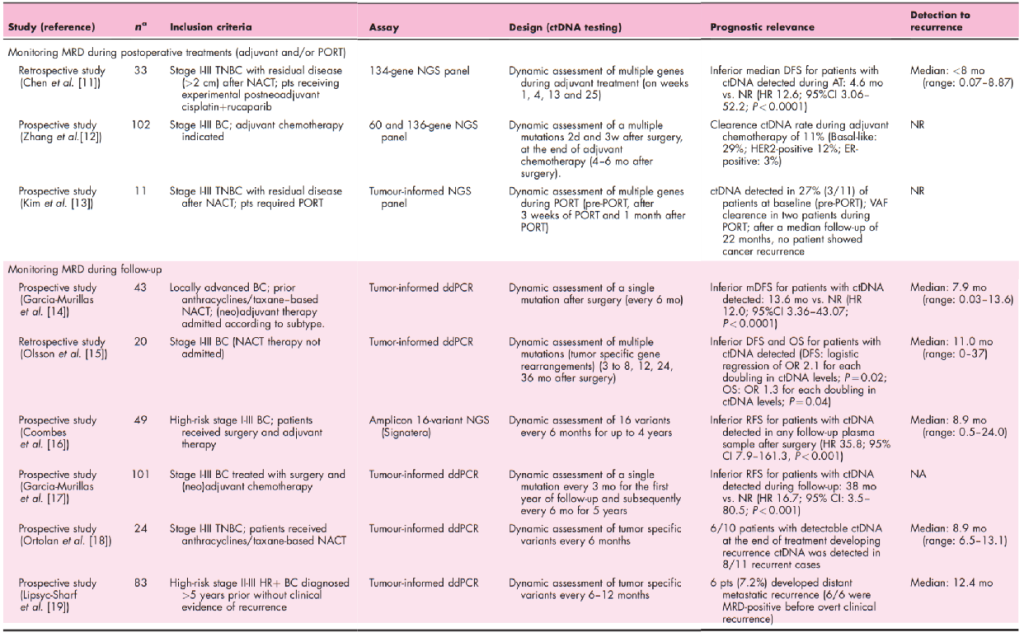
表1 评估ctDNA MRD检测临床有效性的研究[3]
在证明了ctDNA-based MRD检测可以提前发现癌症的复发的作用后,其临床效用还尚待明确。事实上,没有强有力的证据表明ctDNA指导的治疗可以根除MRD并预防或延缓癌症复发,从而改善临床结局,换而言之,如何使用ctDNA MRD检测才能让患者获益?
为证明ctDNA MRD检测对早期乳腺癌患者的临床效用,相关临床试验已经在开展,例如旨在评估MRD指导的治疗策略升级以及复发治疗的相关临床试验(PERSEVER、ARTEMIS、c-TRAK-TN、ZEST、DARE、TRAK-ER)。由于激素受体(HR)和人表皮生长因子2受体(HER2)阴性,三阴乳腺癌无法进行靶向和内分泌治疗,通常只能进行化疗。三阴乳腺癌侵袭性强,复发快,常规影像学检查较难及时发现疾病复发和进展,因此急需新的技术对治疗反应进行监测,以便选择适合的治疗方法。
BRE12-158临床试验招募了在新辅助化疗后存在残留病灶(手术时)的早期三阴性乳腺癌患者,旨在比较基因组靶向的辅助治疗与医生推荐治疗。PERSEVER研究对来自BRE12-158临床试验的数据进行二次分析,结果显示ctDNA(142例)与CTC(循环肿瘤细胞,123例)检测均与疾病复发独立相关,为未来新辅助治疗后的临床试验提供了新的重要风险分层因子[5]。
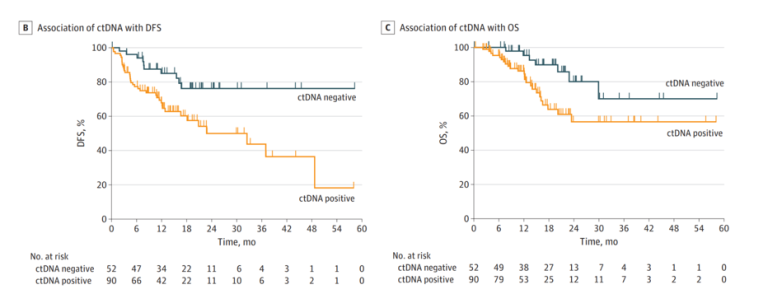
图2 c-TRAK-TN研究[6]
c-TRAK-TN是一项多中心、Ⅱ期、综合性前瞻性临床试验,该研究纳入了完成新辅助治疗后的中-高风险三阴性乳腺癌患者,在前期开展ctDNA监测(频次:3-12个月)后,对ctDNA阳性患者进行前瞻性强化治疗干预(帕博利珠单抗治疗)。但是,高达72%的ctDNA阳性患者在开展帕博利珠单抗治疗治疗前已有转移,这导致最终入组使用帕博利珠单抗治疗的患者仅有5例,最终结果显示,5例患者均未实现ctDNA清除,其中4例复发。该研究进一步强调了ctDNA检测平台和监测密度的重要性,能够一次监测大量变异位点的技术平台可能更有优势,比如NGS技术。不过,该研究再次证实了ctDNA的预警效能,利用ctDNA能够成功地鉴别出高复发风险的三阴型乳腺癌患者,ctDNA在临床上的预后预测价值得到进一步的证实。

表2 ctDNA MRD检测临床效用评估(正在开展的临床试验)[3]
耐药性是癌症进展的主要原因,乳腺癌的基因组进化是复杂的,并且具有时空异质性特征;尤其是在多发性转移性癌症患者中,单个组织活检可能无法提供关于这种复杂突变的完整全景信息。ctDNA理论上是来由自不同转移部位的肿瘤ctDNA组成,可以更充分地代表肿瘤的异质性,ctDNA靶向测序技术已被证明能够提供精准的肿瘤基因变异信息,有助乳腺癌患者选择靶向疗法[7]。2019年,FDA批准PIK3CA基因突变检测试剂盒,用于乳腺癌靶向药物Alpelisib的组织和血浆ctDNA伴随诊断。因此,ctDNA-Based MRD还可用监测乳腺癌耐药性基因变异,优化治疗方法。
应用NGS靶向测序和数字PCR(ddPCR)技术对ctDNA的动态监测,大量研究进一步确认了CDK4/6抑制剂、PIK3CA抑制剂等药物已知的耐药性证据。一项使用激素受体(HR)阳性和HER2阴性 (HR+/HER2-) 转移性乳腺癌患者每3个月采血一次的研究表明,ESR1突变导致了30%-40%的获得性芳香化酶抑制剂耐药性,HR阳性转移性乳腺癌患者在进行芳香化酶抑制剂一线治疗时,56%(22/39)的患者在疾病进展前6.7个月可检测到ESR1m[8] 。
PADA-1 是首个如何利用ESR1突变的ctDNA监测来进行临床干预的研究[9]。芳香化酶抑制剂(AI)耐药后,氟维司群和CDK4/6抑制剂仍然可以使用,但既往研究显示AI进展之后的ESR1突变患者,使用氟维司群单药治疗的无进展生存期(PFS)较短(2.2-3.5个月)。PADA-1研究旨在探索ESR1突变出现但疾病尚未进展前,联合使用氟维司群(Ful)和CDK4/6抑制剂(PAL)能否预防或延缓疾病的进展。
PADA-1研究分为三个阶段,第一阶段,AI + PAL治疗的患者每2个月接受一次ESR1 突变(bESR1mut)的ctDNA监测;在疾病进展前检测到ESR1突变(bESR1mut)或原有的ESR1突变频率上升患者,纳入第二阶段,并随机分组,对照组继续接受AI + PAL治疗,试验组接受Ful转换治疗。对照组疾病进展后可选的交叉使用Ful + PAL(第三阶段)。

图3 PADA-1研究[9]
该研究共纳入1017名患者,279例患者在治疗期间出现bESR1mut,其中,172名无疾病进展的患者纳入第二阶段并进行随机分组,接受对照组或试验组的转换治疗。试验组的转换治疗较对照组的中位PFS增加了一倍[5.7比11.9个月]。对照组中,69名患者中有47名出现疾病进展,随后纳入可选的交叉使用Ful + PAL,其二线PFS的中位数为3.5个月,与前线的5.7个月相加也不如转换治疗试验组。需要注意的是,ESR1点突变主要发生在配体结合区域(ligand binding domain,LBD),位点包括D538G、Y537S、L536Q、S463P和E380Q等。PADA-1研究采用ddPCR技术监测ESR1的4个常见突变,该技术具有周期短、灵敏度高且经济的优势,但是检测通量低,对于非热点突变可能有漏检的可能。
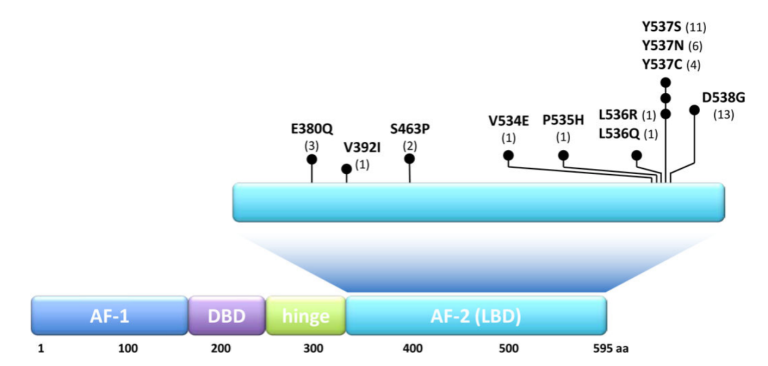
图4 ERS1基因结构、功能区及突变位点[10]
通过ctDNA监测MRD变化,有望对癌症患者针对性的实施个性化辅助治疗,并根据耐药突变选择最佳的治疗方案。目前,大量临床试验正在开展,期待ctDNA MRD检测可以使更多患者获益。
目前,伯科公司已经为众多临床医学检验所以及临床研究团队开发了用于ctDNA MRD检测的液相基因芯片(Gene Panel),涵盖Tumor-agnostic和Tumor-informed不同的策略方案,并且能快速提供个体化位点Panel的设计与合成服务;该产品以及相关配套试剂在各NGS测序平台的检测性能参数均表现优异。





