LAMP2、MYBPC3、CaMKIIδ | 心脏病基因疗法的新时代
- boke
- 2023-05-05
- 7:07 上午
在2022年,FDA批准了百时美施贵宝(Bristol Myers Squibb)用于治疗梗阻性肥厚型心肌病(oHCM)成人患者的口服心肌肌球蛋白抑制剂Camzyos(mavacamten)。Camzyos是第一种针对在遗传性心脏病中最常见的潜在病理学的疗法,该药物通过调节心肌肌球蛋白 (控制心肌收缩的运动蛋白) 的功能,降低肥厚性心肌病患者(HCM)的心脏收缩力并促进舒张从而改善其心脏功能。
Camzyos最初由哈佛大学心血管遗传学家Christine Seidman和他丈夫Jonathan Seidman创立的MyoKardia公司开发。另一种口服肌球蛋白抑制剂(aficamten)目前处于临床3期。但是,这两种药物都不适合那些由于不同遗传缺陷致病的患者,不过,广泛用于治疗其他基因驱动的心肌病和心脏病的疗法正在开始成熟。基因治疗、基因编辑和反义寡核苷酸方法预示着心脏医学的新时代的到来,这些方法可以用于治疗某些至今难以治疗的心脏病患者。
首批治疗心力衰竭的基因疗法正在临床上取得进展。Rocket制药公司(Rocket Pharmaceuticals)将很快开始一项针对Danon病患者基因治疗的关键2期研究。Danon病是一种X连锁显性疾病,一般会在30岁前死亡,死因多为猝死或严重的心力衰竭。该试验如果成功,将鼓励大量基因药物的开发人员相信,在不同的疾病环境中,利用基因疗法阻止甚至逆转进行性心力衰竭是可行的(表1)。
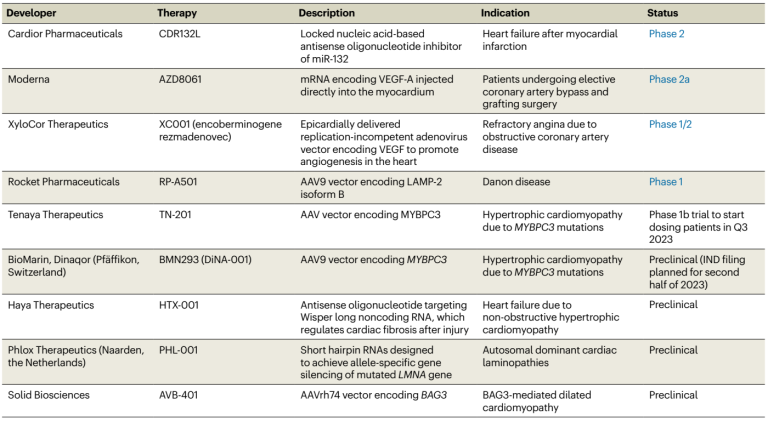
表1. 心脏病相关的基因疗法[1]
此外,得克萨斯大学西南医学中心Eric Olson实验室和哈佛医学院Christine Seidman实验室的研究表明,包括CRISPR–Cas9 editing、Base editing和Prime editing在内的基因编辑技术都可以用来纠正小鼠的心脏病遗传模型。现在,技术的概念验证已经完成,包括用于解决由MYH7和RBM20基因突变引起的心肌病,以及由于钙/钙调素依赖性蛋白激酶IIδ(CaMKIIδ)的慢性过度激活导致的心力衰竭。
Danon病是由LAMP2基因突变引起的,LAMP2参与溶酶体运输及降解蛋白质。当LAMP2缺失时,自噬受损,导致自噬泡在心脏和骨骼肌细胞中积聚。Rocket制药公司的RP-A501疗法利用AAV9载体为人体补充LAMP-2蛋白。RP-A501的1期试验是积极的,包括六名年轻成人和儿童患者。尽管在不同患者的转导效率各不相同,但即使是低水平的基因表达也是有益的。
Rocket制药公司的首席医疗官Jonathan Schwartz指出:“心脏组织学有着显著的改善,患者的心脏应激性生物标志物水平下降(肌钙蛋白和脑钠肽),自噬泡和左心室壁厚度明显减少,这些都伴随着心脏功能和生活质量的改善。”
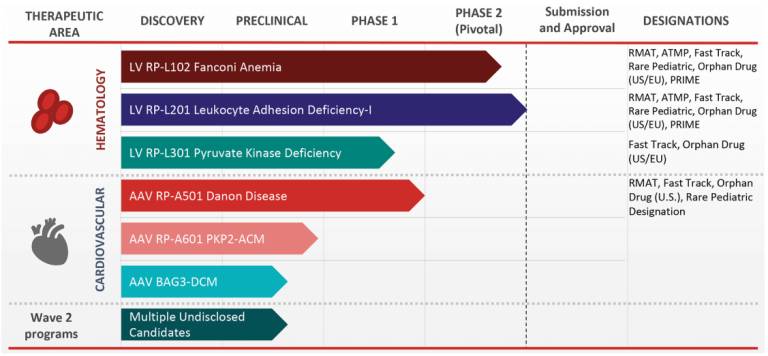
图1. Rocket制药公司研发管线[2]
Tenaya Therapeutics公司要落后于Rocket制药公司,不过该公司开发的TN-201疗法正在进入治疗HCM患者的1b期试验。MYBPC3基因(myosin-binding protein C3)编码肌球结合蛋白,参与到心肌的收缩过程,该基因突变可能发展为心力衰竭并导致猝死。在这一人群中,目标是将MYBPC3的表达提高到健康水平——小鼠和非人灵长类动物的临床前数据表明这是可能的。
首席执行官Faraz Ali表示:“我们能够实现野生型水平甚至高于野生型水平的MYBPC3蛋白表达。”Tenaya Therapeutics正在效仿Rocket,采用AAV9载体,因为它对心脏组织具有倾向性。此外,该公司优化了载体的启动子和调控区,使其能够包装全长MYBPC3基因。
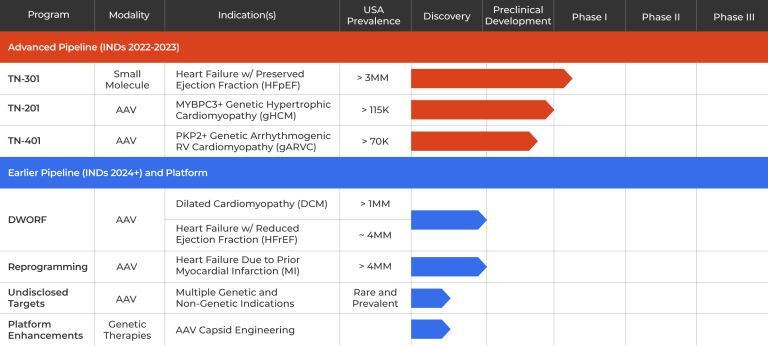
图2. Tenaya公司研发管线[3]
Tenaya Therapeutics最初的目标是在少数成年患者中建立安全性和有效性,然后将转向突变纯合的新生儿,这些新生儿鲜有能在没有心脏移植的情况下存活到婴儿期之后。同样在今年,Tenaya计划为其第二个基因治疗项目TN-401提交一份研究性新药申请,该项目针对PKP2基因突变引起的遗传性心律失常性右心室心肌病患者。PKP2基因的缺失会导致细胞相互分离,随后导致细胞死亡和纤维化。
Olson是Tenaya公司的联合创始人,Olson团队通过ABE编辑器和Prime编辑器来纠正RBM20基因的致病突变,RBM20基因编码RNA binding motif 20 protein。他们表明,ABE编辑器可以在RBM20突变扩张型心肌病的小鼠模型中挽救心脏功能并延长寿命。他的团队还开发了基因编辑器来纠正MYH7基因中的Dominant-negative突变,该突变会导致严重的HCM、早发性心脏功能障碍和心源性猝死,并在小鼠模型中证明可以预防HCM的发生。
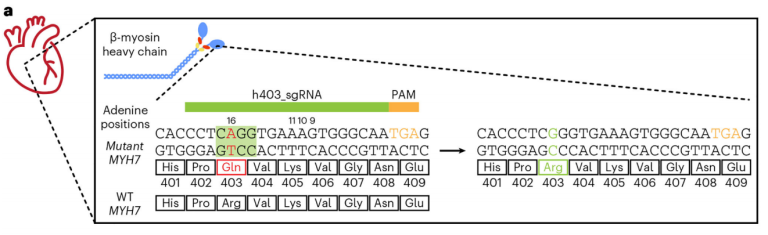
图3. 修复MYH7基因的错义突变[4]
此外,Olson团队的第三种基因编辑疗法应用更为广泛,通过基因编辑技术改变CaMKIIδ的调节结构域使之对氧化胁迫信号的敏感度降低,进而治疗心脏病,这一策略在转基因小鼠的早期实验中被证明是安全的。他们使用AAV9载体通过局部注射递送编辑组分,载体的表达由心脏特异性启动子控制,以最大限度地降低其他组织中不必要编辑的风险。基因编辑促进了小鼠心脏功能的恢复,而对照小鼠表现出心脏功能受损。然而,在临床测试之前,需要在猪模型中进行进一步的评估。
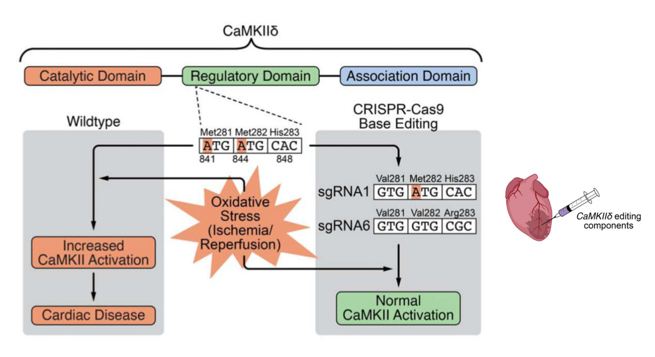
图4. 利用CRISPR-Cas9 adenine base editing (ABE) 编辑器修改CaMKIIδ基因来抑制其活性,从而治疗心脏病[5]。
其他一些可能广泛适用的项目也在进行中。例如,XyloCor Therapeutics正在临床开发一种基于腺病毒的基因治疗载体XC001(编码血管内皮生长因子(VEGF))。该疗法针对的是顽固性心绞痛和严重冠状动脉疾病患者,他们不符合冠状动脉搭桥术或经皮冠状动脉介入治疗(如血管成形术和支架植入术)的条件。这种治疗的目的不是打开堵塞的动脉,而是让新的血管生长,从而恢复受伤部位的血流。它使用腺病毒载体来确保效果是短暂的。
XyloCor首席执行官Albert Gianchetti表示:“我们不希望VEGF在心脏中长期表达。”该载体通过直接注射进入心外膜,即覆盖心脏表面的上皮层。XyloCor的首席医疗官Howard Dittrich说:“我们专门将其输送到心脏,这样我们就可以降低输送剂量。”1/2期试验的初步数据令人鼓舞,该试验达到了所有的安全性和探索性目标,显示出对患者的益处。
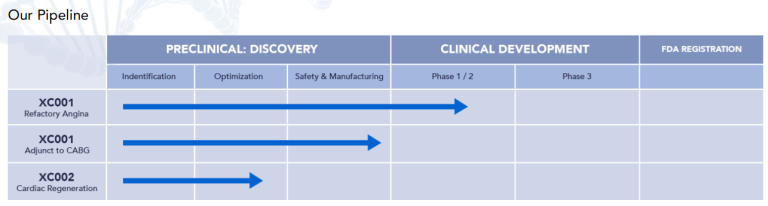
图5. XyloCor Therapeutics 研发管线[6]
XloCor的项目有着很长的临床历史:20多年前,该公司的创始人、威尔康奈尔医学院的Ronald Crystal和贝勒医学院的Todd Rosengart就开始了初步试验。其他几个小组也采取了类似的做法,结果喜忧参半。比如,递送的有效载荷不足一直是一个问题。Moderna公司曾试图通过直接向接受冠状动脉搭桥手术的患者的心外膜注射mRNA来达到类似的目的,而阿斯利康公司已经放弃了该项目。
一些公司正在使用反义寡核苷酸(ASO)来靶向非编码RNA。如果成功,这些治疗心脏病的方法将比基因治疗和基因编辑方法具有更大的成本优势。总部位于德国汉诺威的Cardior Pharmaceuticals公司使用CDR132L(一种针对miR132的反义寡核苷酸)治疗在心肌梗死后射血分数降低的患者,目前处于2期试验。Cardior公司的创始人兼CSO Thomas Thum表示:“这类患者大约占所有心肌梗死患者的10-15%。”
十多年前,Thum及其同事发现miR-132以及miR-212是导致小鼠HCM的非常重要的因素,他们表明可以通过拮抗miR-132来阻止这一过程。一项针对慢性缺血性心力衰竭患者的初步研究表明,CDR132L安全有效地降低了血浆中miR-132和几种相关生物标志物的水平。这项研究无法证明临床疗效,但正在进行的280名患者的2期试验的最新数据预计将在2024年末公布。
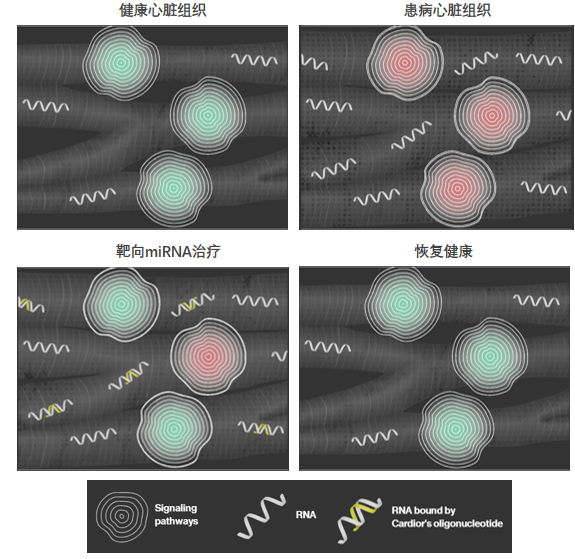
图6. 靶向miR-132药物CDR132L作用机制[7]
瑞士的Haya Therapeutics公司正在使用ASO靶向一种长的非编码RNA(lncRNA,Wisper),以阻止或逆转心肌梗死或其他形式的心脏损伤后的心脏纤维化。在蛋白水平靶向纤维化存在安全性和耐受性问题,而靶向Wisper具有明显优势,其在心脏成纤维细胞中特异性表达并影响心肌纤维化。Haya公司距离研究新药(HTX-001)申请还有12到18个月,但已经选择非梗阻性HCM作为其主要适应症。
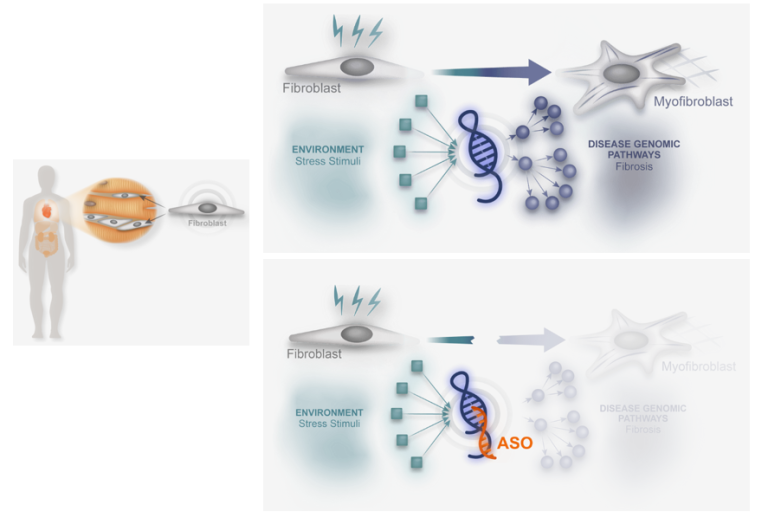
图7. 靶向lncRNA Wisper药物HTX-001作用机制[8]
尽管之前Celladon公司的心脏病基因治疗药物Mydicar遭遇了彻底失败,现在这个领域也没有成功的药物,但科学家们仍然保持着一种乐观。与其他药物相比,基因治疗可以修复基因的功能,这是无与伦比的优势。虽然仍然需要大量的工作才能实现目标,但心脏医学的新时代充满了希望。





