伯科用户文章 | ctDNA TTN基因突变可作为晚期非小细胞肺癌免疫治疗预测标志物
- boke
- 2022-06-16
- 4:52 下午
已知TTN(肌联蛋白,Titin)突变在非小细胞肺癌的肿瘤组织中,被用作免疫检查点抑制剂(ICB治疗)的预测性标志物,可以用来筛选能够从免疫治疗中获益的患者。但是晚期非小细胞肺癌患者的组织样本通常较难获取且存在异质性,更为方便的液体活检近几年被广泛采用。陆军医科大学附属新桥医院与仁东医学等合作者,在Translational Lung Cancer Research(IF: 5.13)上发表题为“Titin mutation in circulatory tumor DNA is associated with efficacy to immune checkpoint blockade in advanced non-small cell lung cancer”的回顾性分析研究。该方法克服获取组织样本的困难,通过对外周血中的循环肿瘤DNA(ctDNA)进行测序,检测TTN突变,揭示了晚期NSCLC患者经ICB治疗的客观缓解以及生存情况。通过这一方法,希望能让更多患者从ICB治疗获益。

研究路线
在这项回顾性研究中,92名晚期非小细胞肺癌患者(不包含80岁以上患者)来自两个独立队列,均接受了ICB治疗。
队列1:29名患者,来自新桥医院
队列2:63名患者,来自同济大学医学院
患者招募时间:2017年7月——2019年2月
随访时间:随访时间中位值为12个月(3-21个月)
患者对ICB治疗的临床响应通过基于RESCIST 1.1标准的影像学评估。
样本采集
对92名患者在第一次免疫治疗前采集5ml外周血。
对其中24名患者采集FFPE样本和配对的外周血样本,执行TTN突变测序。为了进一步验证分析一致性,对6名患者同时进行TTN Panel测序和WES测序。其余18名患者进行外周血和FFPE组织的TTN Panel测序。
目标捕获和测序
用于TTN测序的TTN Panel,仁东医学设计定制,伯科生物BOKE TargetCap™进行合成。
TTN Panel设计与验证
针对实验目的和需求,该团队研发一款覆盖TTN基因所有编码区的定制化的靶向捕获Panel(伯科生物提供Panel合成服务)。为了验证TTN Panel结果的可靠性,对6例NSCLC患者的肿瘤组织,同时采用TTN Panel和WES Panel两种捕获测序路线进行分析,WES的结果被作为参考进行比较。通过目标区域测序深度(图1A)、TTN外显子区域的突变数目和突变频率与WES方法结果进行一致性评估(图1B)。此外,TTN Panel的突变位点总数与WES Panel的TMB之间呈正相关(图1C)。
最后,研究团队又在额外的18名患者的FFPE组织和外周血样品中,进一步验证TTN Panel的性能。基于TTN Panel的ctDNA测序检测到的10个突变位点,在肿瘤组织的测序中都能被重现。相比之下,16例没有ctDNA TTN突变患者中有14例(87.5%)通过肿瘤组织测序得到验证,这表明相对肿瘤组织,ctDNA的TTN突变检测存在合理的假阴性率(图1D)。
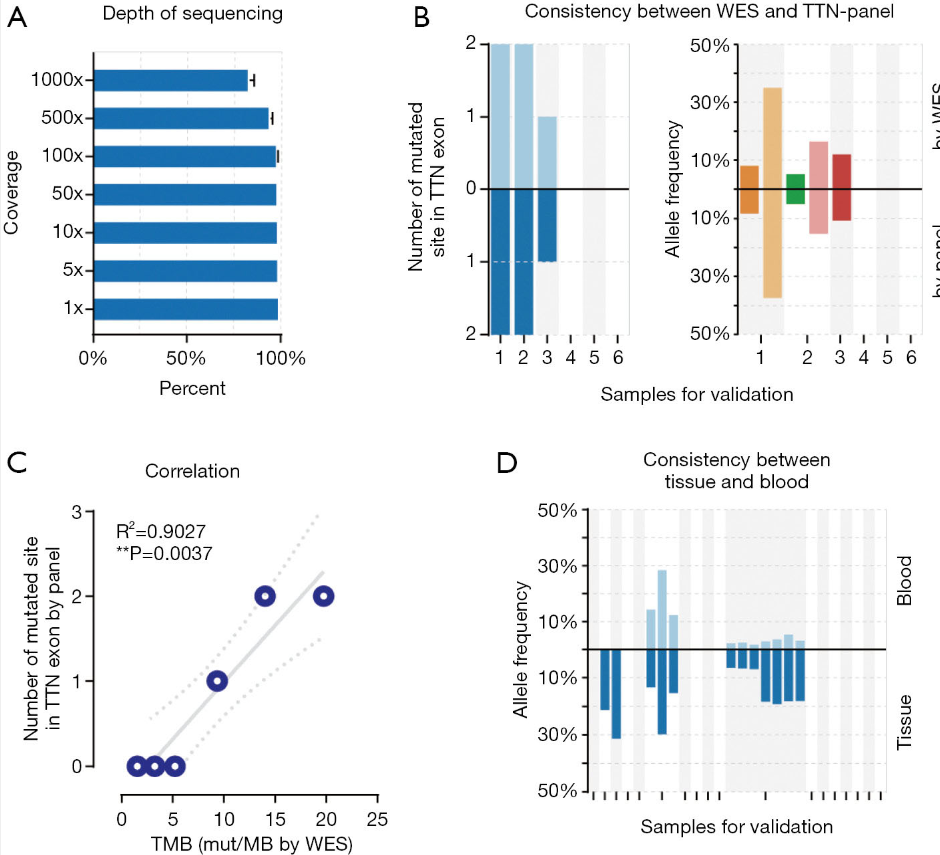
图1. 在ctDNA样本中TTN突变检测方法的Panel性能验证
研究结果
为了验证ctDNA中的发现TTN突变的患者是否能从ICB治疗获益,该研究团队招募了两个研究队列,共92名患者,在28.3%的患者的基线ctDNA中检测到TTN突变。携带TTN突变的患者的无进展生存期(队列1为212天,队列2为334.5天)显著高于未携带TTN突变的患者(队列1为113天,队列2为147天)。ICB治疗的客观响应普遍出现在携带TTN突变的患者中,在队列1中,TTN 突变的患者中客观缓解率占40%,在TTN野生型患者占15.8%;在队列2中,TTN 突变的患者客观缓解率占50%,TTN野生型患者有23.4%显示得到客观缓解(图2.A,B,C)。
此外,与TTN突变阴性患者相比,TTN突变阳性患者的无进展生存期(PFS)更长。队列1中,阳性患者的PFS中位数为212天,阴性患者的PFS中位数为113天。队列2中阳性患者和阴性患者的PFS中位数分别为334.5天和147天。整体的阳性患者和阴性患者的PFS中位数分别为212天和135天(图2.D,E,F)。
综上所述,以上结果表明了在ctDNA中检测TTN突变有可能是在晚期NSCLC中ICB免疫治疗的生物标志物。
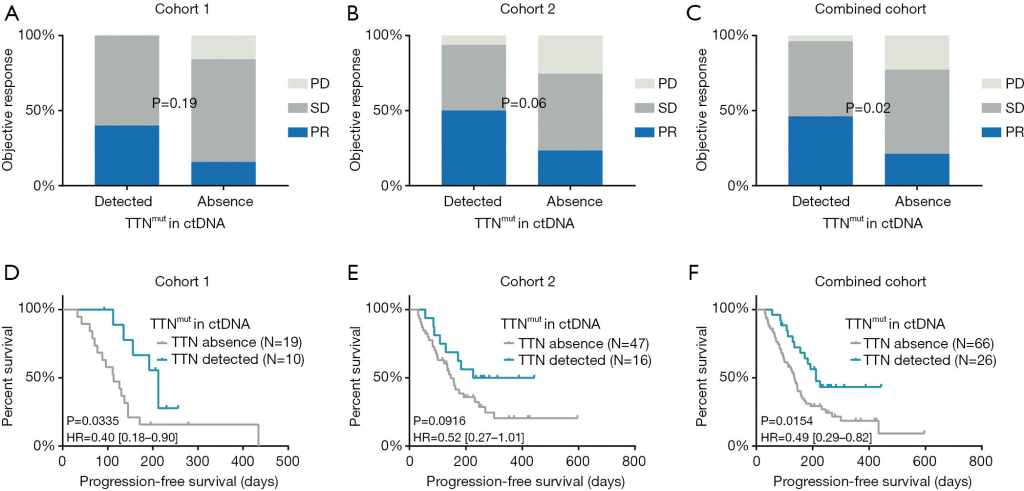
图2. 在ctDNA样本中检测TTN突变,可预测ICB治疗晚期NSCLC患者的临床疗效
研究意义
在本研究中,研究团队借助开发的TTN Panel,实现了一种无创、经济有效、易于完成的方法来检测外周血样本中的TTN突变。并证明了ctDNA中的TTN突变与晚期NSCLC患者ICB疗效的相关性。