Nature Biotechnology丨靶向甲基化组测序方法的系统评估
- boke
- 2022-06-06
- 9:02 上午

2022年6月2日,Nature Biotechnology杂志报道了一项对靶向甲基化组测序方法的综合评估研究。
在过去十年中,甲基化组的分析方法已从低分辨率的半定量方法(MeDIP和MRE-seq)发展到基于亚硫酸氢盐转化的单碱基分辨率方法,比如甲基化芯片和下一代测序(NGS)。NGS的单分子分析(Single-Molecule Analysis)和片段分型(Read Phasing)优势,可以更好的研究样本的异质性和表观等位基因组成。
靶向亚硫酸氢盐测序(TBS)将测序限制在基因组中的部分区域,从而降低了测序成本。
TBS可以通过使用探针杂交捕获(Hybridization Capture, HC)方法对含有CpG位点的区域进行靶向特异性富集,或通过由识别CG Motif的限制性内切酶介导的简化亚硫酸氢盐测序(Reduced-Representation Bisulfite Sequencing, RRBS)对CpG密集区域进行非特异性富集来实现。现在,TBS已成为在单碱基分辨率下对人类基因组甲基化进行经济高效的靶向分析首选方法。
在这项研究中,研究人员使用11种样本,对五个商业化TBS平台进行了系统测试,其中三个是基于杂交捕获原理(Agilent、Roche和Illumina),两个是简化亚硫酸氢盐测序(Diagenode和NuGen)。如图1所示,样本包括作为技术重复测试使用的Coriell-NA12878(2个文库)、HeLa细胞系(2个文库)以及健康人外周血混合样本(Reference gDNA,Ref.gDNA),Ref.gDNA分别按照试剂盒推荐input以及500ng input进行实验(4个文库);4种DNA甲基化标准品(商业化,4个文库);一对遗传背景、表型均不同的膀胱癌细胞系样本(T24, 253J,2个文库)以及一组对Cisplatin敏感性不同的同源膀胱癌细胞系样本(RT112,RT112-CP,2个文库),用于差异甲基化位点或区域测评。
5种TBS平台均包含16个文库,共80个文库,HiSeq2500进行2x 100 bp测序,此外,Ref.gDNA再使用illumina二代测序平台进行WGBS测序,Coriell-NA12878用Oxford Nanopore三代测序平台开展全基因组甲基化测序,用于后期对上述5种TBS平台获得的甲基化数据进行一致性分析。
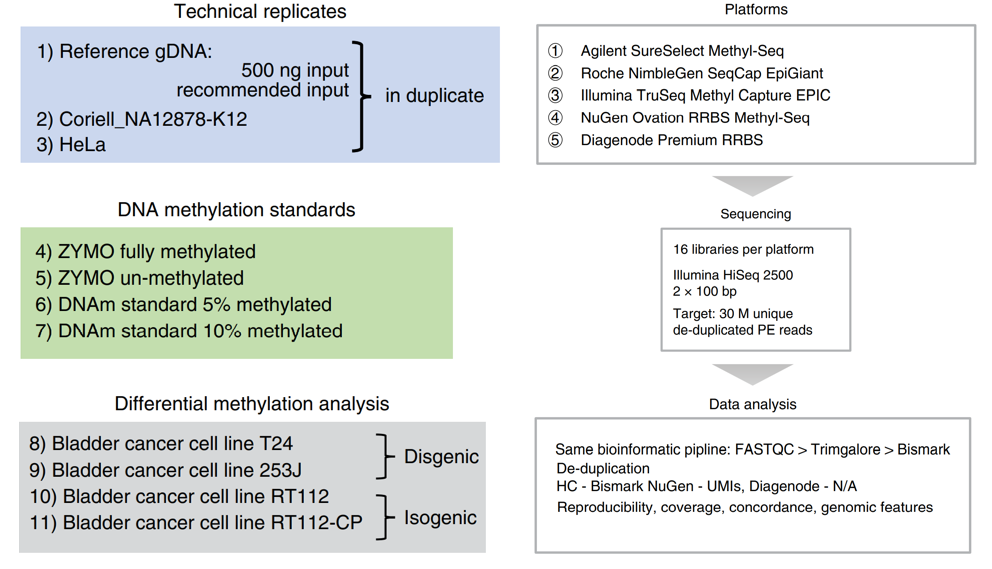
图1. 实验设计
5种平台实验方法差异较大,包括DNA片段化方式,杂交探针类型,甲基化组覆盖大小,目标CpGs数量,链特异性,DNA起始量要求,实验方法复杂性,操作时间,总耗时以及每个样本成本等方面的差异(表1)。-说明:R公司为双链捕获,实际CpGs数量为5.6M。双链捕获有利于多组学的共检测分析,比如同时检测甲基化和SNV变异。
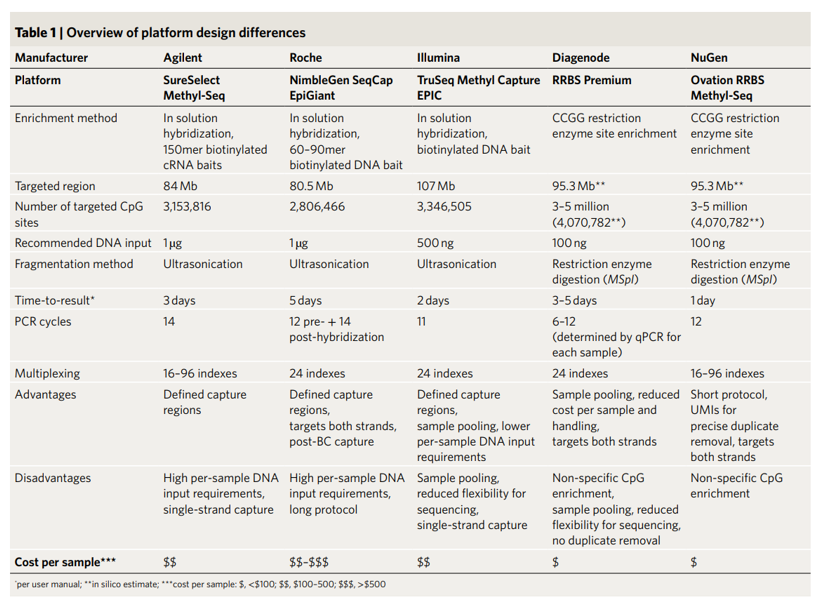
表1. 5种TBS商品化试剂盒设计参数
对于不同平台覆盖的区间以及CpG位点,对RRBS按照酶切和片段大小筛选进行模拟评估,最终,每个平台覆盖的CpGs数量为2.8- 4M,所有平台均覆盖的区域大小约为9Mb,共有的CpGs数量为70万个左右(图2)。
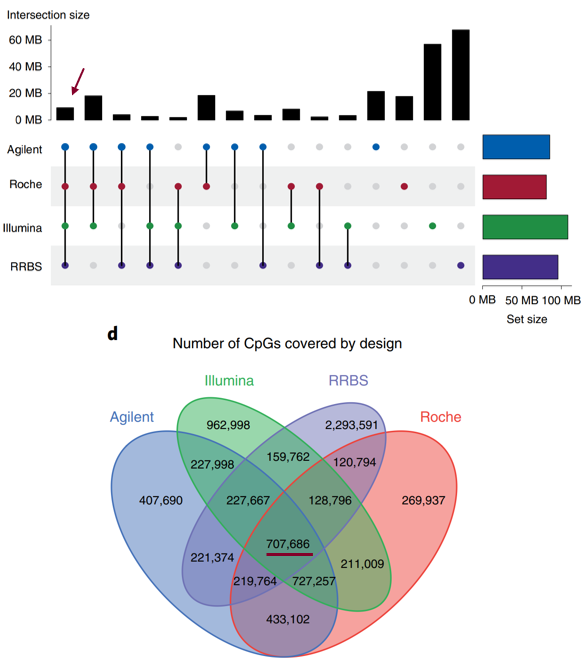
图2. 5种商业化试剂盒的覆盖区域大小以及CpGs数量统计
如图3所示,2018年Thadeous J. Kacmarczyk等报道了一篇思路相近的研究[1, Epigenetics&Chromatin杂志],但只使用了一种样本(IMR90 cells)。而本研究的样本类型更为丰富,比如商品化甲基化标准品和已知甲基化差异性样本对,后面我们再介绍。由于研究内容较多,小编挑选几处进行介绍,详细的内容大家可以阅读原文。

图3. 不同TBS方法研究[1]
如图4所示,三种基于HC的TBS方法中,I试剂盒Duplication最高,可能是其投入量只有其他试剂盒1/2的缘故。在Hybridization efficiency(捕获效率)方面,I试剂盒也是最高,可能与其流程采用2次捕获有关。在Uniformity(Fold80)上,I和R试剂盒表现更好,可能与A试剂盒的杂交时间最短的原因。综合来看,三种TBS方法基本表现并没有本质差异。
近几年的研究已经证明[2],针对低起始量DNA的应用,例如cfDNA,BS处理后(Post-BS)的单链建库方法是克服BS损伤和偏好的有效手段[2]。而在捕获环节,PCR-free Capture的模板利用率是值得考虑的问题。
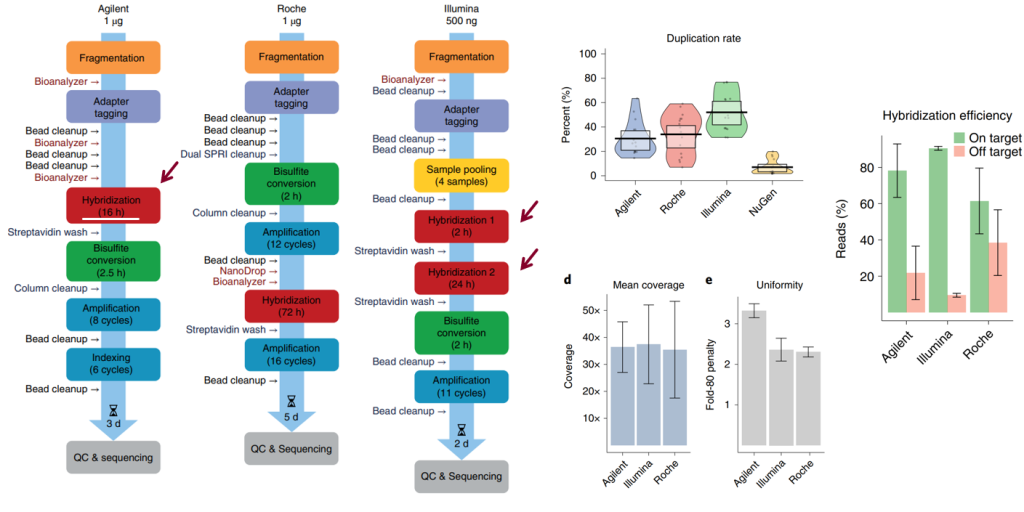
图4. 三种HC路径的TBS方法流程示意图及其部分参数表现
接下来,我们看看甲基化标准品的结果。ZYMO-UM DNA来自DNMT1/DNMT3b基因敲除细胞系,其DNA甲基化水平已知低于5%。所有的TBS技术的检测结果似乎都轻微虚高,此外,D试剂盒低估了ZYMO-FM(100%甲基化,HCT116 DKO DNA经M.SssI甲基转移酶处理)的甲基化水平,可能与D试剂盒的冗余判定方法有关(图5)。
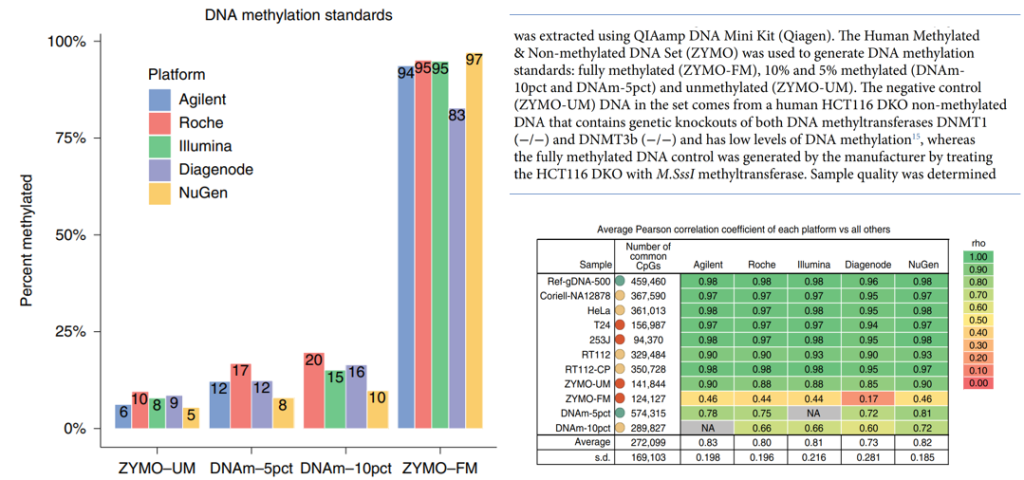
图5. 甲基化标准品甲基化水平评估结果
除上述内容外,研究者还对不同平台的甲基化位点区域进行了详尽的分类注释,平台内以及平台间甲基化检测的重复性进行了统计,最后,还利用基因组填充思路对不同平台的甲基化区间进行了协统评估,改善了不同方法之间的可比较性,为不同甲基化应用的TBS平台选择提供了指导。
最后,文中还有几个地方值得关注,1)R试剂盒Hela-1样本捕获失败;2)A试剂盒并未检测到R112和R112-CP的甲基化差异区域;3)所有平台的甲基化转化率均大于99%,除R试剂盒为98%以上;由此可见,靶向甲基化测序技术的开发并不容易,其稳定性以及性能还有很多值得探索的地方,而组织、FFPE和cfDNA这类临床挑战样本的数据积累,将进一步促进相关技术的发展。伯科在甲基化Panel的设计与合成积累了完整的工艺技术与产品转化能力。未来,随着更多的甲基化标志物研究与发现,伯科将为其在精准医学的转化积极助力。