Genome Research | 单细胞长读长靶向捕获技术scRaCH-seq,高效检测基因编码突变与异构体组成
- boke
- 2025-03-28
- 2:56 下午

单细胞RNA测序(scRNA-seq)已被广泛用于单个细胞的转录组分析,彻底改变了我们对异构体组成和细胞间突变异质性的理解。但由于文库制备步骤中片段化引起的5’和3’偏好以及短读长测序技术的广泛应用,其在突变鉴定和转录本异构体丰度的定量方面存在局限性。
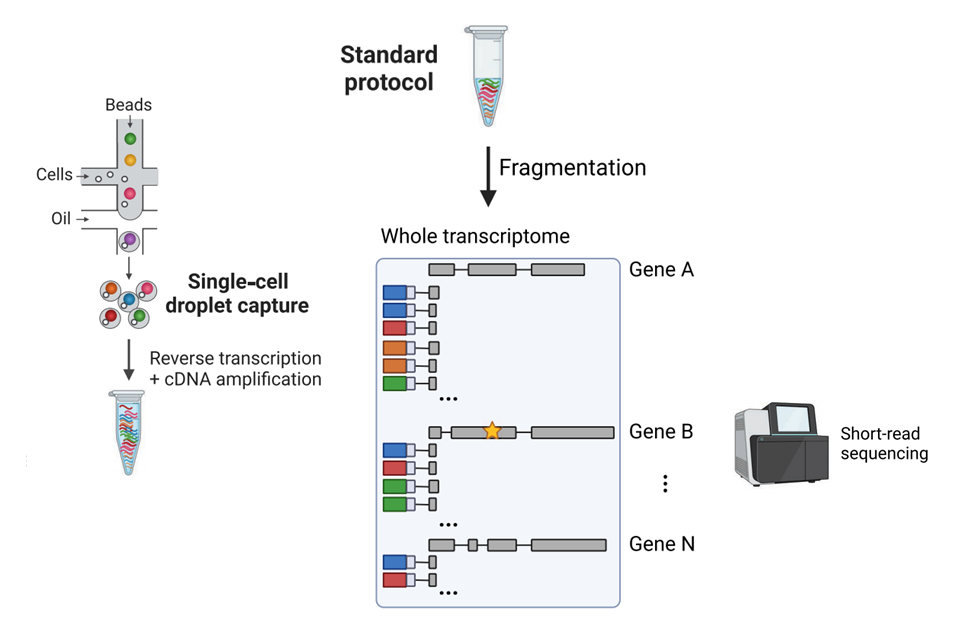
近年来,已开发出几种高通量测序方法来实现单细胞的长读长测序。这些方法通常涉及对cDNA进行文库构建,使用现有方法(如10x Genomics或Drop-seq)进行条形码标记,并在PacBio或Oxford Nanopore Technologies(ONT)等平台上测序标记的全长cDNA。虽然这些无偏单细胞长读长测序方法能够检测更多单个细胞水平上的转录本异构体,但每个细胞的整体测序覆盖度降低,从而降低了准确量化转录本异构体丰度和突变鉴定的能力。
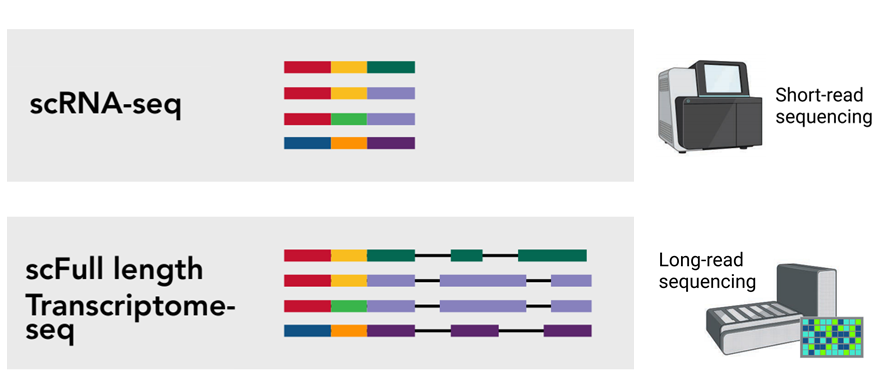
在这项研究中,我们开发了一种单细胞快速捕获杂交测序 (scRaCH-seq) 方法,该方法通过长读测序,在捕获靶向转录本方面表现出高特异性和效率,允许深入分析目标基因的突变情况和转录本使用情况。
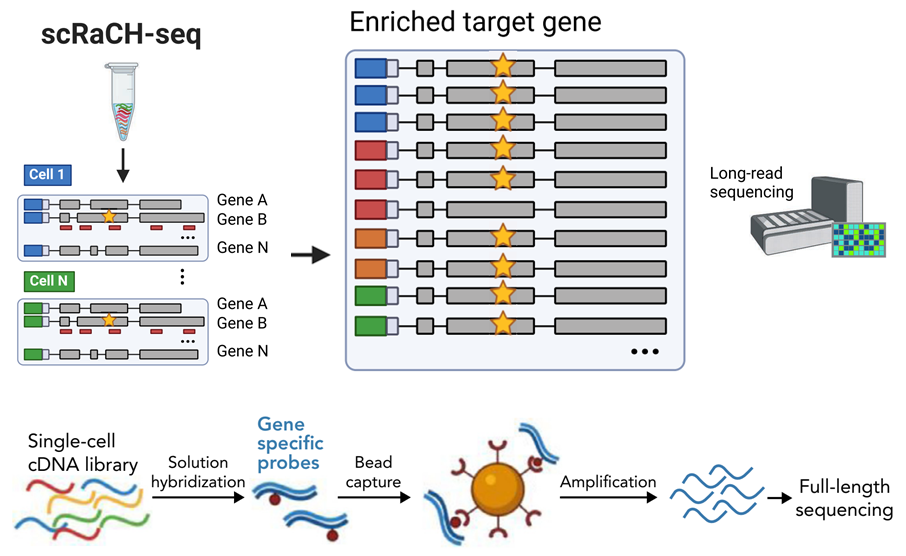
该方法包括创建转录本捕获探针组,使用条形码引物进行文库制备和通过 Oxford Nanopore 技术平台进行高效测序。scRaCH-seq 还可以应用于已储存和标记的单细胞cDNA,这使得分析能够与现有的短读RNA测序数据结合。
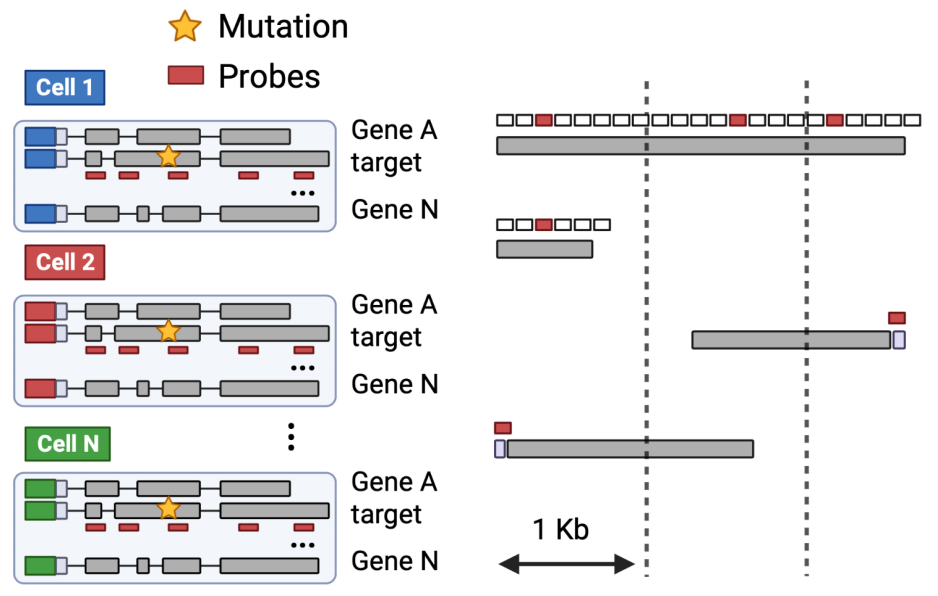
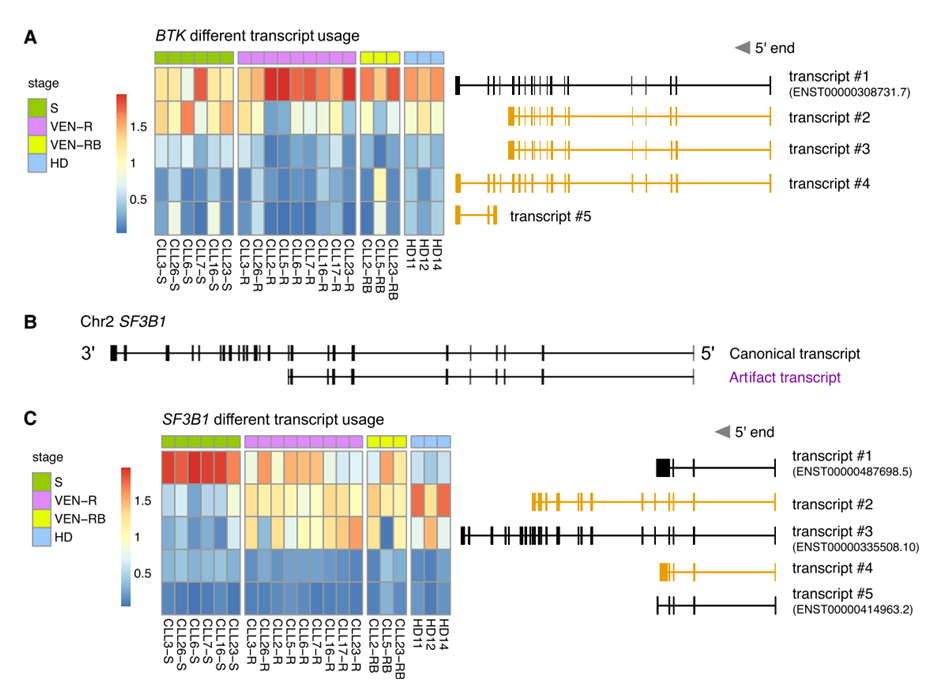
探针设计策略
在我们对慢性淋巴细胞白血病 (CLL) 患者样本中 BTK 和 SF3B1 基因的研究中,我们高灵敏度地检测到了SF3B1异构体和突变。与短读单细胞RNA测序 (scRNA-seq) 数据的整合揭示了SF3B1突变CLL细胞中显著的基因表达差异,尽管它不影响venetoclax的疗效。scRaCH-seq能够研究多个基因的长读长转录本,使其成为单细胞基因组学研究的有力工具。
延展阅读:
单细胞RNA全序列研究更进一步 | scFAST-seq值得期待
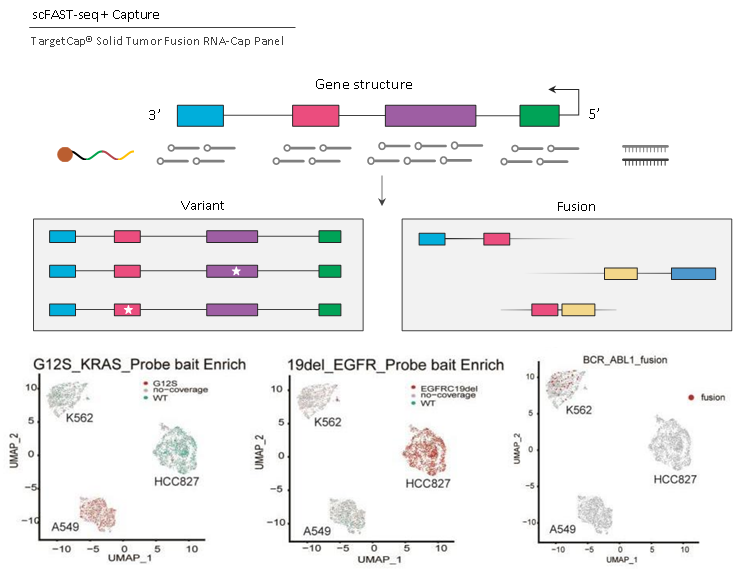
scFAST seq是中国研发团队的创新型高通量单细胞RNA全序列转录组测序方法[2],结合了具有高逆转录效率的半随机引物、模板切换和便捷的rRNA去除方法,可以在8小时内构建多达12000个细胞的全序列RNA文库。
scFAST seq具有检测RNA全序列的能力,是研究单细胞突变的理想方法,尤其是在与靶向测序结合后,scFAST-seq的检测性能明显提升。
结合伯科液相基因芯片靶向捕获技术(BOKE,TargetCap® Solid Tumor Fusion RNA-Cap Panel),对点突变KRAS G12S以及Deletion变异EGFR 19del的检测得到了明显改善,6.77%/28.5%(KRAS G12S)和30.53%/70.01%(EGFR 19del),同时,仅为2.86%的BCR-ABL1融合变异也被检出。
参考资料
[1] Peng H, Jabbari JS, Tian L, et al. Single-cell Rapid Capture Hybridization sequencing reliably detects isoform usage and coding mutations in targeted genes. Genome Res. Published online March 14, 2025.
[2] https://doi.org/10.1101/2023.03.19.533382


