近万例样本Target Cap®捕获技术表现
- boke
- 2022-05-20
- 7:00 上午
首先我们看看高温处理时间对探针完整度的影响。将探针在95℃条件下分别处理0、2、5、10、20和30min,经变性胶检测,与不处理探针相比(0min),95℃变性2min时就可以观测到弥散片段出现。弥散程度随着处理时间逐渐增加。
那么探针受到这种程度的破坏,对于捕获表现是否有影响呢?接下来,用预文库独立变性10min后加入探针作为对照,对预文库和探针共同变性0.1-2min后进行杂交并测序。结果显示,2min以内的探针变性均未明显影响捕获的基本表现,各方面参数与对照相似。
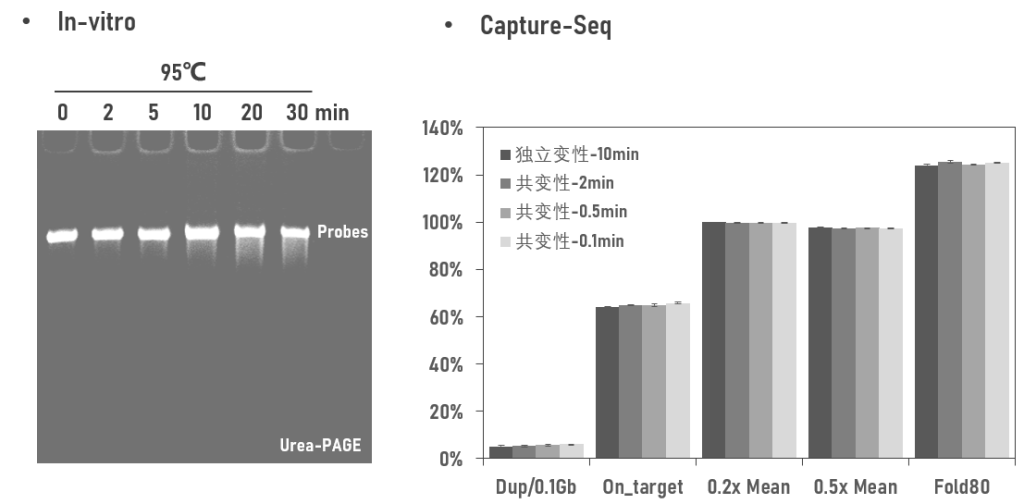
图1 高温处理的探针对捕获表现的影响
为什么探针受高温变性,捕获表现没有明显影响?
在杂交捕获过程中,模板和探针都是相对过量的,可以理解为“双保险”。首先,预文库构建时,通常都会经过PCR扩增,每个Unique的DNA模板有几十或是几百倍以上的拷贝;按照120bp长度对人类基因组进行划分(3Gb),每个120bp区域的基因组占比为120bp/3Gb=0.00000004。按照500ng的预文库杂交用量,预文库的总摩尔量(120bp Insert+120bp Adapter)约为3200fmol,基因组每120bp区域的片段加上文库接头部分的摩尔量为0.00000004*3200fmol=0.128amol(含扩增后的拷贝)。杂交捕获时,120nt探针用量为400amol each。对于每120bp区域的目标序列,探针与目标预文库的比例为3120倍。所以,靶向捕获其实是用过量的探针对Unique片段扩增后的大量拷贝进行富集,保证“万无一失”。
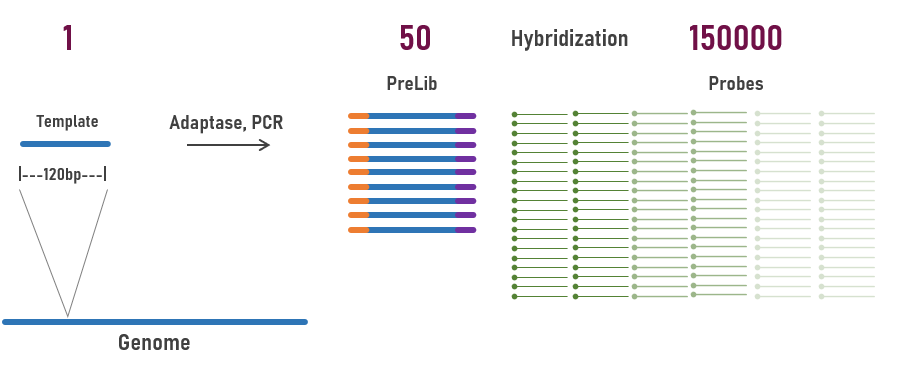
图2 杂交捕获中,原始模板与探针的分子数量示意图
所以,在预文库和探针均过量的条件下,一定程度的DNA损失不会对整体的捕获性能产生明显影响。此外,在极短时间的高温变性条件下(0.1min),其捕获表现也基本正常,可能是由于杂交缓冲液中含有DMSO,甲酰胺等化学变性试剂,并且处于弱碱性环境,所以,DNA更容易解链的缘故。
有一种情况比较特殊,如果我们采用PCR-free的预文库进行杂交,其实是去掉一个模板副本的“保险”,即Unique片段没有副本存在,那么,探针的亲和性偏好将被放大,表现出整体的覆盖均一性明显降低以及冗余的增加。
最后,我们的小伙伴在研发实验时,发现刚杂交上的PCR仪故障,或是断电,或是核对实验发现少加了一部分探针,这时候可以根据上文介绍的结果和原理进行灵活处理。





