NEJM | Tumor-informed Safe-SeqS MRD检测指导II期结肠癌辅助治疗
- boke
- 2022-07-11
- 7:21 上午
摘要
辅助化疗对Ⅱ期结肠癌患者的有效性仍存在争议。手术后循环肿瘤DNA(ctDNA)阳性预示着无复发生存率很低,而阴性则预示着复发风险低。然而ctDNA阳性患者辅助化疗是否受益则尚不清楚。
为此New England Journal of Medicine近期发表了一项临床数据,发现利用ctDNA来判断II期结肠癌治疗是否使用辅助化疗,可以实现减少辅助化疗使用的同时保持无复发生存率不降低。这项名为DYNAMIC的研究旨在评估ctDNA指导的治疗方法可否减少辅助化疗的使用,同时不增加复发风险。
研究人员将455名患者进行随机分组,302例被分配至ctDNA指导的治疗组,153例被分配至标准治疗组。中位随访期为37个月。在ctDNA指导的治疗组中,如果手术后4或7周时ctDNA结果呈阳性,则采用基于奥沙利铂或氟嘧啶的化疗。ctDNA阴性患者不接受治疗。主要疗效终点是2年无复发生存率。ctDNA指导组接受辅助化疗的患者比例低于标准治疗组(15% vs 28%)。在2年无复发生存率的评估中,ctDNA指导的治疗不显著低于标准治疗(分别为93.5%和92.4%)。3年无复发生存率如下:接受辅助化疗的ctDNA阳性患者为86.4%,而未接受辅助化疗的ctDNA阴性患者为92.5%。
背景
全球范围内,结直肠癌是第三位最常见的恶性肿瘤。目前对非转移性结肠癌的标准治疗是手术,通过组织病理学分期来指导使用长达6个月的术后辅助化疗。虽然辅助化疗对III期结肠癌患者的益处已被确认,但其对II期疾病患者的有效性仍存在争议。仅手术就可以治愈80%以上的II期结肠癌患者,在辅助治疗试验中没有观察到明显的总体生存获益。因此,治疗指南目前仅建议对具有高风险临床病理特征的II期结肠癌患者考虑辅助化疗,这些患者可能更有可能从辅助治疗中受益。
然而,所谓的“高风险”定义并不完善,因为许多高风险患者没有复发,而一些被认为是低风险的癌症患者却会复发。此外,即使对高危疾病患者进行选择性治疗,辅助化疗带来的生存获益却并不大(<5%),因此,许多患者经受了不必要的化疗。对II期结肠癌手术后复发风险进行更准确的预测可以解决这一临床困境,将治疗限制在那些疾病具有明确的高风险特征并最有可能获益的患者。这种方法还将使复发风险较低的患者免于不必要的化疗。
到目前为止,研究非转移性结肠癌复发风险主要依靠对切除的肿瘤进行各种生物标志物的检测。尽管这种以组织为基础的生物标记物已被报道与复发风险有关,但风险获益比通常不高,因此它们的临床应用仍有争议。
循环肿瘤DNA(ctDNA)检测是一种很有前途的替代策略,在这种方法中,直接评估外周血以寻找肿瘤微小残留的证据,这些微小残留病灶最终可能是后来临床复发的来源。几项涉及实体肿瘤患者的观察性研究已经证实,没有进一步辅助治疗的情况下,治疗后检测到ctDNA阳性时,包括II期结肠癌在内的患者复发率非常高(>80%)。然而,辅助治疗是否对这些ctDNA阳性的患者有益仍然是不确定的,他们有很高的复发风险。
DYNAMIC试验作为一项随机试验,旨在调查II期结肠癌标准治疗方法相比,ctDNA指导方法是否可以在不降低复发风险的情况下减少辅助治疗的使用。研究人员进一步检查了接受辅助化疗的ctDNA阳性患者的结果,以评估治疗这类高危患者的益处,同时比较了ctDNA阴性患者的结果。
方法
该试验患者按2:1的比例随机分配,根据ctDNA结果进行疾病治疗(ctDNA指导治疗)或由治疗临床医生根据标准临床病理标准进行治疗(标准治疗)。个别患者被分配到试验组,并根据参与中心的位置和肿瘤分期(T3或T4)进行分层随机分组。本项研究纳入了II期(T3或T4,N0,M0)结肠癌或直肠腺癌患者。要符合登记资格,患者需要ECOG的状态评分为0至2,并且必须在医学上能够接受基于奥沙利铂或单剂氟嘧啶的辅助化疗。在登记前8周内对胸部、腹部和骨盆进行CT扫描有转移疾病的患者被排除在外。其他排除标准包括在过去3年内有其他原发癌病史、同时存在原发结直肠癌或接受新辅助化疗和放射治疗。患者在术后3周内入选,需要在术后4周前提供足够的切除肿瘤标本用于突变分析。
分别于术后4周和7周采集血浆标本进行ctDNA分析。患者在通过病理复查确认足够的肿瘤组织和确认足够的第4周血液样本后进行随机分组。对于被分配到ctDNA指导治疗组的患者,同时分析第4周和第7周的样本,并在手术后8至10周向临床医生提供ctDNA结果。ctDNA结果在第4周或第7周呈阳性的患者接受单剂氟嘧啶或奥沙利铂为基础的化疗,治疗方案由临床医生自行选择。在第4周和第7周ctDNA结果均为阴性的患者不接受辅助化疗。主要疗效终点是2年内无复发生存。无复发生存时间是从随机分组之日起至确认疾病复发或因任何原因死亡之日或患者已知无病的最后日期计算的。复发被定义为局部、区域性或远端复发。一个关键的次要终点是辅助性化疗。其他次要终点包括ctDNA指导组中ctDNA阳性和ctDNA阴性患者的无复发生存率、复发时间和总生存率。
主要疗效终点是在意向治疗人群中评估的,包括所有接受随机分组的符合条件的患者,并在术后第4周和第7周同时采集血样。在按方案进行的人群中进行了敏感性分析,其中包括接受了24个月监测成像的患者,对于ctDNA指导的治疗,包括接受至少12周化疗的ctDNA阳性患者或接受不超过4周化疗的ctDNA阴性患者。此外,根据Kaplan-Meier生存曲线和相关的95%可信区间计算无复发生存率和1、2和3年内复发患者的百分比。在使用Schoenfeld residuals test对风险假设进行评估后,估算了风险比和相关的95%可信区间。两组间使用辅助化疗的差异以每组患者的百分比和相对风险来评估。这项分析是在最后一位患者达到至少2年的随访期时进行的。使用R 3.6.1和SAS 9.4进行统计分析。
结果
2015年8月10日至2019年8月2日期间,共有459名患者从23个澳大利亚中心招募,其中455人接受了随机分组。在被分配到ctDNA指导治疗的302名患者中,8名(3%)被排除在意向治疗人群之外,而在被分配到标准治疗组的153名患者中,6名(4%)被排除在意向治疗人群之外。在ctDNA指导组的294例患者中,291例(99%)成功地进行了ctDNA分析。在这些患者中,只有2人没有接受ctDNA指导的疾病治疗。在45例ctDNA阳性患者中,1例未接受辅助化疗,1例ctDNA阴性患者接受化疗。病例从随机化筛选到入组进行分析的中位随访期(2021年10月15日)为37个月(ctDNA指导组37个月,标准管理组38个月)。
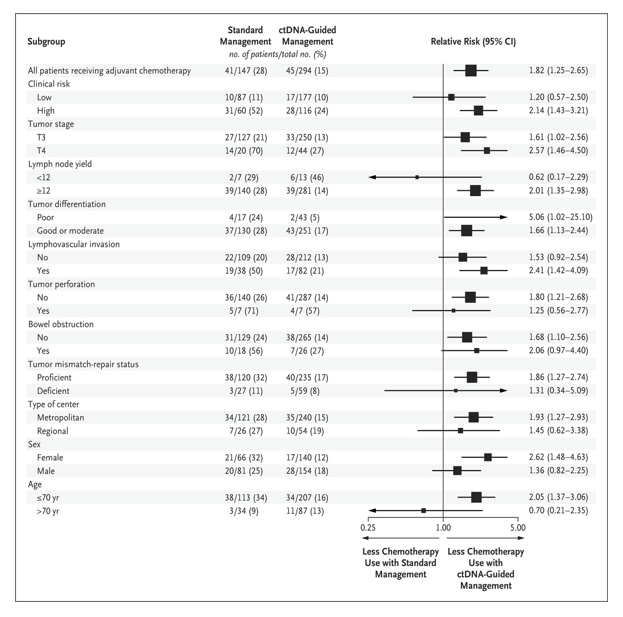
图1 按细化分组的意向治疗人群中接受辅助化疗的情况
主要分析人群中患者的基线特征在两组之间基本平衡,除了ctDNA指导组中右侧肿瘤患者的比例高于标准管理组。患者的中位年龄为64岁,大多数患者(99%)的ECOG功能状态评分为0或1。15%的患者存在T4病,5%的患者的淋巴结转移低于12。临床高危疾病的定义为一个或多个临床病理风险特征(T4、肿瘤分化不良、淋巴结转移<12、淋巴管侵犯、肿瘤穿孔或肠梗阻)与非错配修复缺陷肿瘤相关(40%)(表1)。表2提供了两个试验组提供的治疗和依从性的统计。ctDNA指导组接受辅助化疗的患者百分比低于标准管理组(15%比28%)。在几乎所有的患者亚组中都观察到了这种差异,除了淋巴结转移率低于12的患者和70岁以上的患者(图1);最显著的差异出现在T4或低分化肿瘤患者(相对风险分别为2.57和5.06)。对于具有高危临床病理特征的患者,标准管理组接受辅助化疗的可能性是ctDNA指导组的2.14倍(表2)。
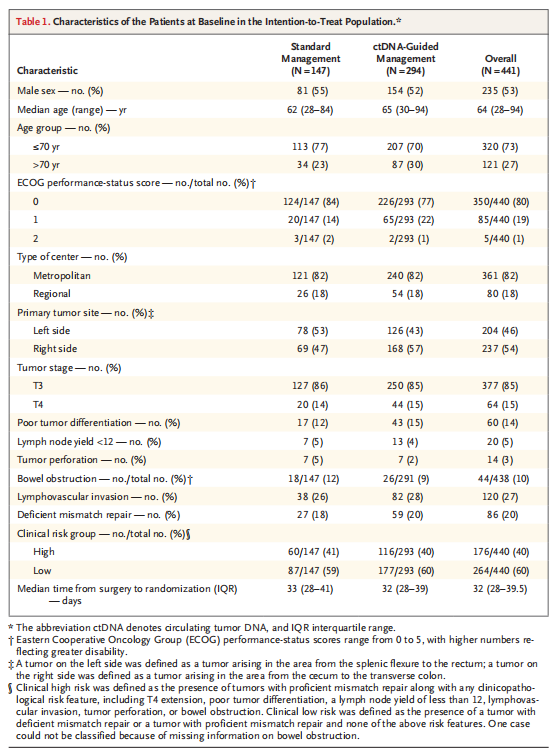
表1 意向治疗人群中基线患者的特征
在那些接受辅助化疗的患者中,ctDNA指导组中接受奥沙利铂治疗的患者比例高于标准治疗组(62% vs 10%)。86例错配修复缺陷肿瘤患者中,8例(9%)接受了辅助化疗,其中6例(75%)接受了以草酸铂为基础的联合化疗。ctDNA指导组术后开始治疗的中位时间比标准管理组更长(83 vs 53天);这一差异是由等待ctDNA结果的时间造成的。在这段等待期间内,患者没有复发。
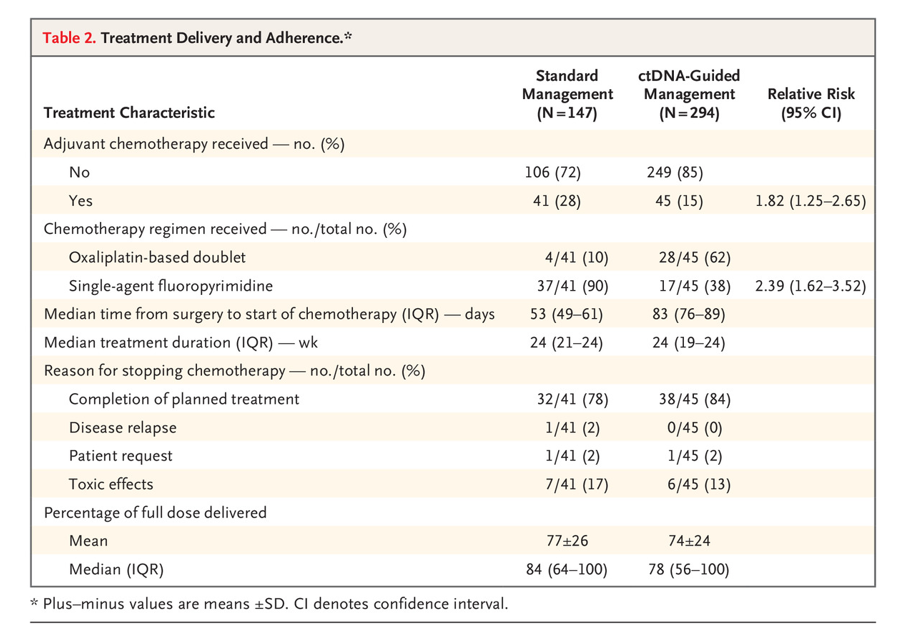
表2 治疗的实施和患者依从性统计
疗效按治疗组锁定数据库时,已发生43例疾病复发或死亡事件。在意向治疗人群中,在两年无复发生存和两年内复发患者百分比中,ctDNA指导治疗相对于标准治疗并不差(图2)。2年和3年无复发生存率在ctDNA指导组和标准管理组相似(2年无复发生存率分别为93.5%和92.4%;3年无复发生存率分别为91.7%和92.4%,图2B)。涉及每种方案的群体分析得出了相似的结果。在预先指定的亚组分析中,结果也大体相似。
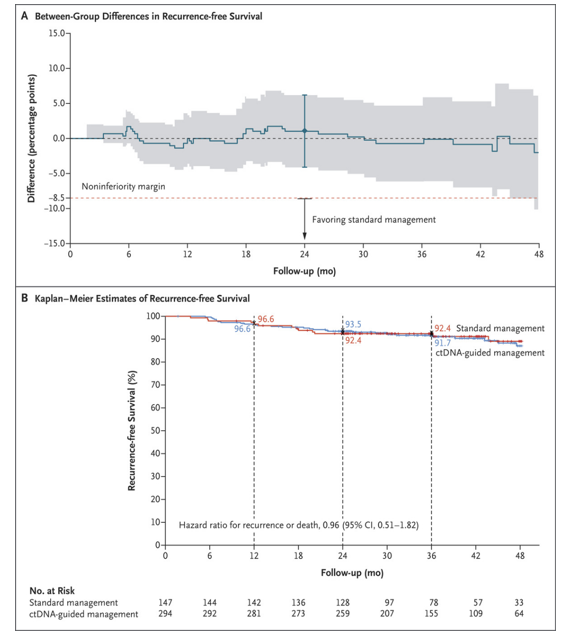
图2 ctDNA指导治疗组和标准治疗组的效果比较
在ctDNA指导组中,246例ctDNA阴性患者中有15例复发或死亡(6%),45例ctDNA阳性患者中有8例复发或死亡(18%)。ctDNA阴性患者的3年无复发生存率估计为92.5%,ctDNA阳性患者的3年无复发生存率为86.4%(风险比1.83),ctDNA阴性患者中3年复发患者的百分比为7%,而ctDNA阳性患者的3年无复发生存率为14%(风险比2.45)。在接受辅助化疗的ctDNA阳性患者中,以奥沙利铂为主的化疗患者的3年无复发生存率为92.6%,单药氟嘧啶化疗患者的3年无复发生存率为76.0%(图3)。
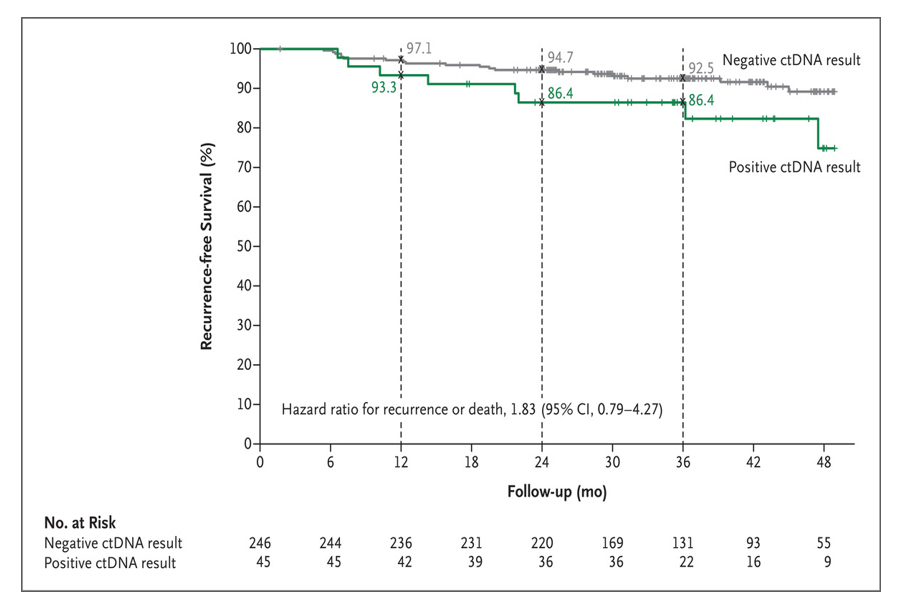
图3 根据ctDNA状态分别统计ctDNA指导组的无复发生存率比较
根据目前的指南,临床医生通常根据临床风险提出治疗建议,其中T4肿瘤是最大的风险因素。在一项特别的探索性分析中,作者研究了ctDNA阴性状态对低风险或高风险疾病患者以及T3或T4肿瘤患者无复发生存率的影响。在ctDNA阴性的患者中,临床低风险癌症患者的3年无复发生存率高于高风险癌症患者(96.7%比85.1%;风险比3.04)。同样,T3肿瘤患者的3年无复发生存率高于T4肿瘤患者(94.2%比81.3%;风险比2.60)。
讨论
传统中实体瘤治疗性手术后癌症复发的风险是根据切除标本的组织学评估来评价的。这种分析定义了肿瘤的分期并界定了各种不良特征,这些特征为辅助化疗的使用提供了依据。为了改善II期结肠癌的治疗和结果,研究人员已经探索了各种辅助治疗组合的效果,旨在确定最有可能从治疗中受益的患者人群。到目前为止,这些方法取得的进展仍然有限。
在本项试验中,作者发现ctDNA指导的方法减少了接受辅助治疗的患者数量,同时没有改变复发的风险。此外,ctDNA阳性患者似乎从辅助治疗中获得了相当大的益处,因为与之前报道的未进行辅助化疗的这类患者的高复发率相比,本试验中复发率较低。
在不同的非转移性结肠癌和切除的结直肠癌肝转移患者队列中,可检测到ctDNA且未接受辅助治疗的患者中,疾病复发的百分比一直超过80%。在以往的研究中,复发时间也很短;在作者以往的II期结肠癌研究中,所有未经治疗的ctDNA阳性患者都在2年内复发。在这方面,在本试验中接受治疗的ctDNA阳性患者中,3年内复发的患者比例(14%)较低。
尽管ctDNA指导组开始化疗的中位数时间较长,为11.9周,而指南建议的术后时间为8周或更短。当然,研究人员需要更多的数据来排除在某些情况下,对ctDNA阳性患者进行化疗的治疗可能是推迟了,而不是预防了复发。
可以想象,对ctDNA阳性患者及早开始化疗可能会导致更有利的结果。由于从获得血液样本到获得ctDNA结果的周转时间大约为2周,因此对于未来的研究来说,考虑在术后第4周和第7周连续分析血液样本更为合理,第4周的ctDNA阳性结果将在指南建议的时间范围内触发辅助化疗的开始。此外,对术后ctDNA阴性的患者进行连续ctDNA分析可能降低最初ctDNA结果为假阴性而未得到充分治疗的风险。
根据临床医生的判断,ctDNA指导组中的大多数ctDNA阳性患者接受了基于奥沙利铂的治疗,而不是单独接受氟嘧啶治疗。这一方法很可能是由ctDNA阳性的预后较差和先前的研究结果开发的,这些数据表明基于奥沙利铂的治疗对高危II期结肠癌患者有益。本项研究中大多数患者计划治疗24周,ctDNA指导组中84%的患者和标准管理组中78%的患者完成了治疗计划。作者观察到接受奥沙利铂类药物治疗的ctDNA阳性患者的无复发生存率在数值上好于单剂氟嘧啶治疗的患者。但这一发现还需要进行更大样本量的进一步研究,以确定与以奥沙利铂为基础的联合方案相比,单独使用氟嘧啶的相对效果,并确定这一亚组患者的适当治疗时间。
除了确定受益于辅助治疗的II期结肠癌患者的亚组外,确定一个亚组可以避免治疗并将复发风险降至最低也是一个重要的目标。本实验的结果表明,ctDNA阴性的未经治疗的患者总体上复发风险很低,3年无复发生存率为92.5%。鉴于目前的焦点是利用临床病理风险来选择II期结肠癌患者进行辅助治疗。作者同时探讨了高危或低危疾病患者的结果。最值得注意的是在低风险疾病患者中3年无复发生存率为96.7%,这表明对于ctDNA阴性的临床病理低风险患者可以不考虑辅助治疗。这是一个重要的结论,因为在常规的临床实践中,辅助化疗仍然适用于一些低风险的患者,特别是年轻患者。
结论
ctDNA指导的II期结肠癌治疗方法不仅能够减少辅助化疗且不会影响无复发生存期。本实验的优势在于随机分配患者接受ctDNA指导治疗或标准治疗方案。这项试验有足够的样本来明确主要终点问题,更大规模的试验可能会为特定的患者亚群提供更明确的结论。除了最初的辅助化疗手段外,实验者没有检查ctDNA指导的方法的效果,因为这会影响试验终点。作者没有随机分配ctDNA阳性和ctDNA阴性的患者接受治疗或不接受治疗,这一试验设计将为每个亚组的疗效判断提供更明确的证据。其他研究小组正在探索ctDNA分析为非转移性结肠癌辅助治疗提供指导的其他方法,包括在完成标准辅助治疗后ctDNA仍呈阳性的患者的治疗方法。





