为什么说人类工业化的未来是合成生物学?
- boke
- 2023-12-12
- 4:01 下午
合成生物学,是一种将工程学原理应用于生物学系统的跨学科领域。它结合了生物学、计算机科学、工程学等多个学科的知识,以设计和构建新的生物元件、线路和系统为目标。合成生物学研究如何修改和优化生物体的遗传信息,甚至从头设计生命,以达到满足人类对于生物制造和改善生物性能或增加其功能的需求。
在合成生物学中,科学家们不仅研究生物体的自然状态,而且还通过创建新的基因和生物部件来改变它们,甚至创造生命。这就像把生物学家和工程师结合起来,让他们设计和制造可在自然界中不存在的生物部件和系统。例如,科学家可以使用合成生物学技术来创建能够生产特定药物或材料的微生物,或者设计和构建具有特殊功能的基因线路。合成生物学区别于其他生物学的主要特点是“工程化”,被认为是生物学中的“工科”合成生物学在许多领域都有广泛的应用,包括医药、农业、能源、环保等。在医药领域,合成生物学可用于设计和制造新的药物和治疗方法,例如利用基因工程改造的微生物来生产疫苗或抗生素。在农业领域,合成生物学可以用于设计和创建抗病、抗虫的作物,以提高粮食生产的效率。在能源和环保领域,合成生物学可以用于设计和构建能够利用太阳能或其他能源来源的微生物,或者能够清理和回收生物废弃物的微生物。
然而,合成生物学也带来了一些新的挑战和问题。例如,设计和构建人工生物部件和系统需要对生物学有深入的理解,并且需要先进的计算机和技术来进行模拟和优化。此外,由于合成生物学的应用可能对环境和人类健康产生影响,因此需要建立相应的法规和伦理标准来规范其应用。
在美国,合成生物学技术已经写入国家战略。在我国“十四五”发展规划对生物经济、现代能源、智能制造等作出了详尽描绘。其中,推动合成生物学技术创新被写入“十四五” 生物经济发展规划。以“战略性产业”、“颠覆性技术”的定位,合成生物学近年来获得来自科技部、国自然基金委重大专项的多项科研经费,为不断探索科学边界提供底层支撑。
合成生物学的兴起与21世纪以来崛起的基因组、蛋白质组、测序技术、高通量生物实验技术等息息相关,也使得“读-改-写”的工程型思维得以真正在生物学中落地。从「解构」到「建构」,合成生物学这一正成为基础设施和工具的交叉技术学科,将影响哪些行业?哪些产业需要为合成生物世纪的到来做好准备?合成生物学将以何种方式胜出,又面临哪些关键瓶颈?
一、生命科学的“读-改-写”,人类扮演造物主的时代到来
生命科学前数百年的发展,主要是解读生命密码的过程,我们用“解构”生命,或者“读懂生命”可能更准确一些,在读懂生命密码之后,摆在我们面前的,就是用这些密码,甚至创造一些密码,来从头设计生命,为人类所用。这就是以“读-改-写”并反复循环改进,以达到优化的研究方式。这是真正的人类扮演造物主的时代真正的到来。
溯源来看,基因相关的技术进步是推动合成生物学的基础。20世纪50年代,随着DNA双螺旋结构的发现、遗传密码的破译、限制性内切酶的发现、PCR技术的发明等一系列重大分子生物学成就, 催生了基因工程技术。真正的突破是21世纪初以来DNA合成技术、基因编辑技术、高通量生物实验技术等突破带来的新的可能性。2010年至2020年间,生物数据已增长50倍以上,涵盖基因组、转录组、蛋白质组等各类组学数据的测序和临床数据等等,计算、AI和生物技术的整合将产生巨大的机会。DNA合成技术则是人类探索生命奥秘过程中的必要工具,大规模基因组DNA设计和合成赋予我们改造细胞功能甚至创造人工生命的能力。
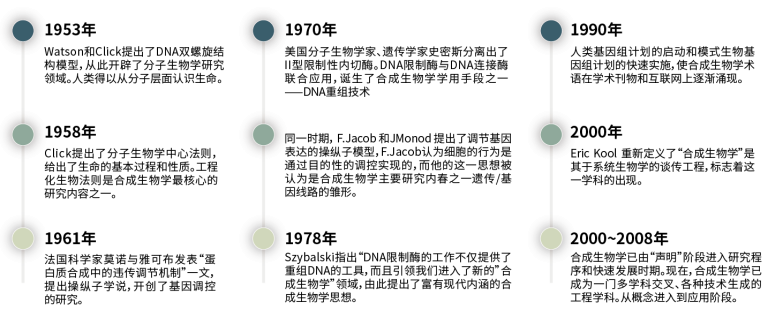
合成生物学的技术发展经历了四个阶段。
第一阶段(2005年以前):以基因线路在代谢工程领域的应用为代表,这一时期的典型成果是青蒿素前体在大肠杆菌中的合成。
第二阶段(2005-2011年):基础研究快速发展,年度的专利申请量较之前并未有显著增加,合成生物学研究开发总体上处于工程化理念日渐深入、使能技术平台得到重视、工程方法和工具不断积淀的阶段,体现出“工程生物学”的早期发展特点。
第三阶段 (2011-2015年):基因组编辑的效率大幅提升,合成生物学技术开发和应用不断拓展,其应用领域从生物基化学品、生物能源扩展至疾病诊断、 药物和疫苗开发、作物育种、环境监测等诸多领域。
第四阶段(2015年以后):合成生物学的“读-改-写”循环扩展至“读-改-写-学”,“半导体合成生物学”、“工程生物学”等理念或学科的提出,生物技术与信息技术融合发展的特点愈加明显。
二、将被合成生物学技术改变的行业
长期而言,合成生物学所引领的新范式,被寄予了解决医疗、能源、农业、环境、化工等挑战的厚望。按照波士顿咨询公司2022年2月的预测,预计到本世纪末,合成生物学手段将广泛应用在占全球产出1/3以上的制造业,创造30万亿美元的价值。在2020年以前,合成生物学技术的应用,主要应用于新药物合成、生物农药、生物肥料、标记辅助育种等。未来五年,大健康、生物治疗、医疗器械和电子等行业将面临合成生物领域竞争对手的挑战,正如制药和食品工作已经面临的挑战。中期而言,许多初创企业已经瞄准精细化工、纺织、时尚等其他行业,这些行业将面临来自合成生物替代品成本,生产方式,双碳等方面的竞争。长期来看,随着DNA编写和编辑成本的下降,合成工具的使用变得更加容易,合成生物学前沿将继续扩大,新的产品和工艺将逐渐走向成熟并成为主流。
合成生物学被认为是提供历史性机遇的先进制造技术,主要体现在以下三个方面:
1.基于合成生物学的生物制造具有极大的物质分子创新潜力和节能优势。
与传统石化行业相比较,生物制造可能是满足分子材料多样性需求的最优解决方案:天然生物中有超过300万种的新分子和新材料尚待发掘应用,其中包括小分子和聚合物、生物大分子和生物材料等,它们的多样性远超于石油化工。同时,在复杂的生物系统中存在着大量化工合成途径的替代方案,例如用生物合成小分子前体、用酶代替化工催化过程等。麦肯锡全球研究院在2020年发布的一份研究报告中指出,全球经济活动中60%的物质产品可通过生物技术进行生产,包括 1/3 天然生物来源的材料和 2/3 非生物来源的材料,涉及的市场规模高达4万亿美元。
我国明确提出了于 2060 年实现“碳中和”的发展目标 。石化行业作为传统碳排放大户,2020年总碳排放量约为14亿吨,占中国总碳排放量的14.7%。石化行业下游的化工原料和制品制造占据了石化行业总碳排放量的70.4%。相比之下,生物制造具有全方位的绿色优势:
在原料环节,以糖、油脂等可循环再生物质替代不可再生的化石资源,可使制成产品中的碳来源于环境中的二氧化碳,从而更好地维持自然的碳循环,减少对石化资源的依赖。
在生产环节,生物发酵的环境比化工生产中常见的高温高压环境更温和,在能耗上也更具优势。以重要化工原材料1,3-丙二醇的合成为例,通过化工方式制备涉及高温高压的环节(200℃上的高温以及100个大气压的压力),而使用生物发酵法,可在常温常压下制备,预计可以减少 40%的能耗。
在产物提取过程中,生物制造更多采用环境友好型的提取和纯化法,替代传统化学合成的高污染、高腐蚀性的有机溶剂。而在废水和废物方面,生物制造更加环境友好——传统化学合成产生的废水废物污染大,高危废物的处理成本高。此外废物中的菌体成分还可转化为蛋白肥料或饲料应用于农业中,实现碳、氮元素的循环利用。
总体而言,与化工合成路线相比,目前生物制造产品平均节能减排30%-50%,未来还有50%-70%减排潜力。预计到2030年,生物制造每年可减少二氧化碳排放10亿至25亿吨。
2. 合成生物学给食品和制药工业的巨大机遇
空气变馒头、肠道菌产药、植物肉、培养肉,这些新兴的词汇其实都是基于合成生物学技术在食品和药品领域的应用。以植物肉为例:植物肉就是利用合成生物学方法,改造植物蛋白,使得植物表达肉味的来源血红蛋白,从而产生肉味,甚至改变植物的营养构成,使之接近真正的肉。波士顿咨询集团关于碳排放和全球变暖的报告指出,畜牧业产生的一种温室气体甲烷占比高达 50%!与二氧化碳相比,甲烷具容易使全球变暖。照料动物时需耗费大量资源。根据报告,每生产1磅(约合0.45千克)的牛肉还需要消耗1800加仑(约合6814升)的水,同时,为了满足饲料需求,也需要大量的土地占用,畜牧业用地已经占到地球土地面积的30%。根据Euromonitor的预测,到2023年,中国植物肉的市场规模将达到130亿美元。根据杜邦营养与生物科学公司的数据显示,亚太地区目前共有43亿人口,占世界人口的60%,其中有36%的消费者选择低肉或无肉饮食,预计中国和泰国对植物性肉类的需求将在未来5年增加200%。也就是说,中国植物肉的消费市场在未来几年几乎占到全球市场的一半。高端的美国植物肉品牌Beyond Meat在淘宝上,1盒4根的植物肉香肠售价为130元,价格依然很高。未来,通过合成生物学方法,从固碳固氮效率提升,到植物生产动物蛋白,以及各种营养素的生产,都可以通过植物,甚至是微生物来进行,大大提高农业的效率,同时达到减少碳排放和降低温室气体排放的目标。
药品方面,传统的生物工程已经在制药工业中发挥重要作用。包括各种抗生素和抗体药,都是生物生产。医学合成生物学主要是利用人工合理设计的原理,合成大量治疗性基因回路,在载体的协助下最终植入人体,通过纠正机体缺陷的回路功能而最终实现疾病治疗目的。医学合成生物学的目的在于通过影响特定生物学过程而重建生命内稳态。为了在实现疾病治疗的同时尽可能减轻副作用,合成生物学需要达到高效、特异和可控等设计目标。
医疗合成生物学主要包括几个方面:
1、基于合成生物学策略的智能活细胞开发:智能细胞可以感知各种环境生物标志物,从化学物质到蛋白质。外部信号被转导到细胞中以触发下游响应。这些产品还以化学品到蛋白质的形式出现,以满足定制需求。传感响应系统赋予细胞新的或增强的能力。
2、组织工程中的合成生物学:在组织工程中使用合成生物学可以控制细胞行为人工遗传结构可以通过重新连接细胞信号来调节细胞功能。由于工程细胞是组织中具有特殊性质以实现更智能功能的构建块,因此合成生物学允许复杂的组织工程用于新的医学研究。
3、细菌活体诊断和治疗技术,包括:治疗癌症、糖尿病、胃肠道疾病和代谢紊乱的工程细胞。
4、各种治疗性细胞的合成,包括:CAR-T、治疗性的胰腺细胞、医疗性诱导干细胞和多能干细胞。
5、药物的合成生物学合成:这部分类似合成生物学技术在化工方向的应用。
3. 底层技术的成熟为合成生物学从实验室走向商业应用的提供了基础支持。
合成生物产业按照所处的行业上下游,可被划分为三个层面:原料层、软件/硬件层以及应用层(具体情况见下图)。

合成生物学相关技术分层:以基因测序、合成、编辑为代表的原料层和以自动化、信息化为代表的软硬件层的技术是合成生物学应用层开发的关键。
在原料层,基因测序、基因合成和基因编辑技术的成本下降是推动合成生物行业发展的重要驱动力。基因测序技术已从第一代发展至第三代,其成本自21世纪初以来下降了6个数量级,下降速度快于摩尔定律。20世纪末启动的人类基因组计划耗资42亿美金,完成了历史上第一个人类基因组测序,而在2019年完成相同项目的成本不到1000美元,预计未来成本将持续下降到100美元以下。过去20年中,合成长片段基因的成本也下降了近1000倍。基因“读、写”成本的断崖式下降,使人类能够以前所未有的效率积累大量的生物数据。
早期基因测序技术的应用成本居高不下,在下一代基因测序技术(Next Generation Sequencing,NGS)引入后,大大降低了测序所需的成本,其下降速度打破了摩尔定律,使得获得基因信息的成本出现了断崖式的下降。
基因和基因组合成技术,从第一个人工设计和制造的生命体Synthia开始,到大肠杆菌的人工合成,目前对于第一个整合生物基因组酵母基因组已达到50%的人工合成,其中也不乏中国科学家的贡献。
此外,基因编辑技术的快速发展,让人类对生物的改造能力上了一个新台阶。基于CRISPR的基因编辑技术的出现,克服了原有基因编辑技术操作复杂、成功率低、成本高的缺点,使科学家能够更便捷、精确、高效地编辑生物基因。也正是因为CRISPR对于现代生命科学的里程碑意义,相关技术在2013首次应用,其后仅7年就于2020年获得诺贝尔化学奖。
在软件/硬件层,IT、AI、自动化设备、传感器技术、数据科学和生物技术研发相结合,可以提高研发效率,同时在研发过程中积累数据,进一步推动研发的发展。
合成生物产业的关键环节包括:高通量高精度的DNA合成技术、基因组和基因的组装技术、底盘细胞设计改造、生物工程工艺开发、工业化量产和终端产品的交付,涉及生物、化学、材料、计算机等多个学科的交叉。
三、从实验室迈向产业的关键挑战
长期而言,成本问题是合成生物学技术公司与传统行业抗衡的关键。而从目前技术的发展阶段而言,选品和规模化生产,是绝大部分合成生物学公司面临的关键挑战。
1.选品。合成生物学领域产业化的一大问题在于边界太广,因此很难挑选具体的落地产品,最初阶段的选品就尤为重要。较早的科学研究集中在高单价药物,比如:青蒿素、阿片类止疼剂、紫杉醇等药物的人工合成,由于合成效率问题无法大规模产业化。工业品方面如Zymergen 曾押注于Hyaline 光学薄膜,由于折叠屏手机市场预期较低,最终产品失败,股价下跌70%;Amyris 曾以生物燃料为重要产品方向,后由于油价预期调整而竞争力大幅下降。总体而言,平衡好单价、生产效率和工业化的难度等问题,依然是行业必须面对的问题。
2.规模。特别是对于生物技术类企业而言,从小试到中试阶段的规模化放大是重要的里程碑事件,90%以上在实验室有效的技术可能难以在产业端得到放大。仅以发酵这一个环节而言,一个完整的发酵周期往往需要一个月,从小试、到中试再到大规模生产,需要设计团队与生产团队相互配合,从上游的菌株设计到下游的生产工艺全流程把关。
3.从产业链配套的角度来看,合成生物学的产业链条复杂而漫长,在发酵生产端,中国的优势在于是发酵大国(占全球60%-70%),劣势则在于甘蔗、玉米这类原材料的成本较高;以及在自动化实验室设备、关键设备零部件层面,例如高速搅拌棒、高灵敏度传感器等,还相对依赖进口。搭建高度协同的产学研交流生态,搭建能让人才、信息、资源与要素流动交互起来的平台和基础设施,最终决定了所有合成生物学企业的未来发展。国产相关技术型企业,近年来也在高速发展。从DNA合成、基因和基因组的合成、计算机辅助设计、底盘细胞的改造、自动化实验室设备等领域,已经取得了突破性的进展,具备了系统性组建合成生物学产业链的基础。
高品质的DNA/RNA合成技术与设备是基因测序,基因调控,基因合成方向的基础设施。伯科生物科技公司(以下简称:伯科生物)是一家合成生物学底层技术领军企业,致力于面向合成生物学与基因组学的新技术开发与转化。成立至今,伯科生物持续拓展核酸(DNA/RNA)合成上游技术与设备的开发制造。开发的不同型号的合成仪可以满足RNA、DNA、DNA/RNA修饰以及DNA/RNA嵌合Oligo合成,具有合成准确性高、经济、操作简单等优势;各类型合成仪通过深度优化的硬件和软件系统,可以提供pmol~mmol不同的合成规格,可以开展不同类别不同长度不同修饰的高品质 DNA 和 RNA Oligo合成。

在生物农业方面,2022年6月8日,Nature杂志在线发表了中国农业科学院深圳农业基因组研究所黄三文团队的两项关于作物基因组研究的重要成果,其中,番茄图泛基因组研究通过838个番茄基因组,包括32个全新的高质量基因组序列,构建了番茄图泛基因组集合。与传统参考基因组相比,图泛基因组遗传标记的遗传力大幅提升,这在很大程度上得益于图泛基因组包含了更多的结构变异(SVs)。新发现的SVs将通过标记辅助选择促进番茄的遗传改良基因组选择。本研究通过对番茄图泛基因组的全面解析,展示了图泛基因组在未来作物育种中的巨大能量。基于伯科生物自研自造的DNA合成技术平台,开发了TargetCap®液相基因芯片(Gene Panel)技术,也是国内唯一100%全流程国产化基因捕获平台。利用液相基因芯片(Gene Panel)设计和合成积累大量数据和经验,利用“侧链补偿效应”首次完成了液相基因芯片在图泛基因组中结构变异检测中的应用(SV panel of DNA capture array)。为未来分子农业,尤其是复杂性状育种提供了高效,经济可行的育种芯片方案;未来该技术平台适用于多物种、多组学以及不同测序平台(高通量NGS / 长读长测序LRS)的基因靶向测序研究与产品转化。
在生物药物方面,2022年11月,伯科生物自主研发的首款多功能Oligo合成仪SynStar21成功交付北京合生基因科技有限公司(以下简称“合生基因”),双方将在基于RNA合成的技术方向积极合作,拓展应用管线。在细胞治疗和小核酸药物等的药物研发领域,很大程度上都需要利用合成生物技术进行研发。合生基因研发的首款基因治疗产品——用于治疗晚期实体瘤的溶瘤病毒产品SynOV1.1腺病毒注射液获得国家药品监督管理局(NMPA)临床试验默示许可,这也是国内首个“合成基因线路精准调控”的基因治疗产品获得国家药监局批准开展临床试验。合生基因期望利用合成生物技术开发针对癌症、遗传病、传染性疾病的创新药物和治疗方法,构建基于合成生物技术的生物医药新生态。
在医疗领域方面,基于伯科生物的DNA/RNA合成技术与设备,已完整构建了精准诊疗和临床转化体系的工具平台。公司的产品线涵盖NGS测序、长读长测序、PCR平台检测、CRISPR基因编辑、以及RNA干扰等领域。随着科学技术的发展以及临床疾病的研究进展,以先进的分子检测技术、分子病理等为代表的检测方法在临床检测与诊断方面取得了长足的发展,满足临床诊疗日趋增长的个体化与精准化的需求。从基因源头调控基因表达、翻译是一种标本兼治的理想治疗手段、随着化学修饰和递送系统的改进,寡核苷酸药物(ASO、siRNA、mRNA等)有望成为继小分子药物和抗体药物后的第三大类药物,并在遗传疾病、肿瘤、病毒感染等疾病的治疗上广泛应用。2020年9月伯科生物完成了首款全流程国产人全外显子液相基因芯片的研发与测试,正式推向市场,质量与品质均达到了国际领先水平,打破了海外巨头对该产品的垄断。该产品在实现优质性能的同时实现了模块化扩展,扩大全外显子液相基因芯片在科研、临床、大健康等领域的应用。伯科生物已经为国内外100多家的医学检验机构、30多家知名医院与临床学术团队开发了500多款液相基因芯片(Gene Panel),在基因组、转录组、甲基化组及病原体液相基因芯片均有成熟的产品。尤其是在心脑血管病方向,基于过去二十年顾东风院士、国家心血管病中心研究团队的中国人群大队列遗传学研究,构建了首个中国人群的冠心病和脑卒中多基因风险评估模型。伯科生物的技术平台承载了该国家重点科研成果,基于新一代基因测序技术,转化开发了心脑血管健康评估芯片与评估模型的产品解决方案。研究团队协调组织了中国、新加坡、马来西亚、日本、菲律宾等东亚人群以及欧美人群,涉及到全球近100余个队列,开展了50万人群心脑血管疾病基因组学研究,系统地解码了影响中国人群冠心病、脑卒中以及血脂异常、高血压等主要危险因素的遗传信息。伯科生物的产品技术在国家心血管病中心研究团队的研究与应用转化中,相关成果发表在European Heart Journal、 JAMA Cardiology等世界顶尖的学术期刊上。现阶段,伯科生物团队与顾东风院士与鲁向锋教授带领的研发团队正在加速心血管病的基因组学研究,为未来市场刚需的寡核苷酸药物开发打下坚实的基础。随着基因测序、基因调控以及基因合成技术(“读-改-写”)的迭代升级,基因组学正在改变疾病筛诊治和健康管理理念,将进一步促进遗传信息与临床实践的整合,应用于疾病的诊断与风险评估、药物反应预测和治疗方案选择等方面,将持续的推动以遗传信息为蓝本的“精准医疗”进程。
参考资料:
1.《2023中国合成生物学发展研究报告》
2.《为什么说“以生物造万物”的合成生物学是确定性的未来?| 高瓴 Insight》





