多物种,跨组学丨伯科高品质DNA合成技术实现多平台靶向测序应用的领先水平
Target Capture-Seq(TargetCap)靶向捕获测序是一种平台型技术,最初是被作为一种更经济的目标基因的研究方法,经过10余年的发展,TargetCap逐步走向实践,广泛应用于辅助生殖、遗传病筛查诊断、肿瘤防治、病原检测、农业分子育种等领域。TargetCap基于核酸杂交原理,实验体系稳定,适用范围广,可以用于病毒、植物和动物基因组目标区域捕获;同时,其覆盖区域大小灵活,小至24Kb,用于ctDNA负荷监控[1],大到Mb级别,比如涵盖近两万个基因的全外显子区域。现在,TargetCap已经成为高通量测序应用转化中使用最为广泛的技术之一(图1)。那么,如何才能充分实现TargetCap技术的优势呢?
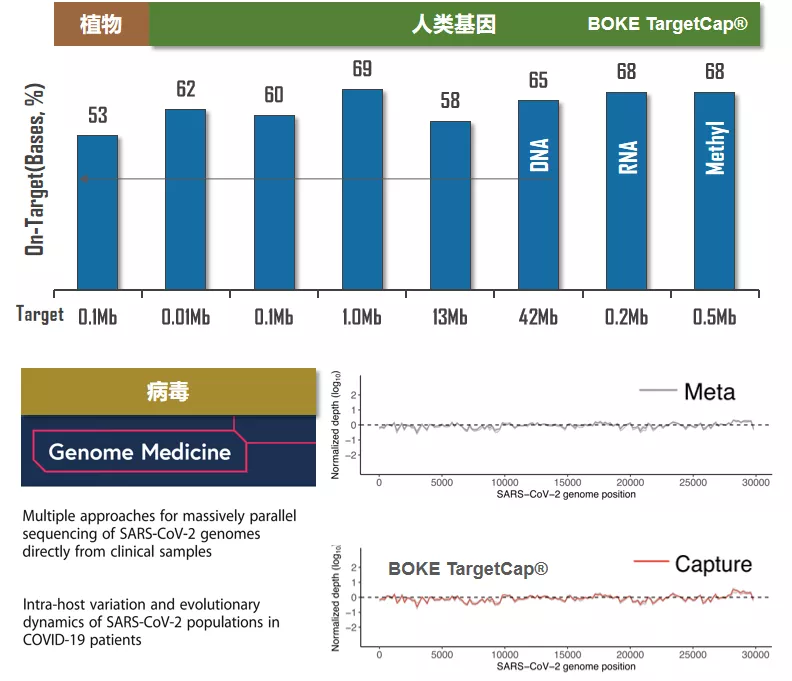
图1. 伯科TargetCap®液相基因芯片广泛应用
TargetCap的技术核心是液相基因芯片,它由序列不同的生物素修饰探针组成,探针拷贝数的均一性是其性能关键。按照生产工艺不同,可以分为直接合成与间接制备两类(图2),直接合成以长链ssDNA探针为代表,其优势是无后续处理过程,探针拷贝数均匀,批间稳定性好、特异性强、均一性优异。在低密度芯片中,两种路线的表现差异不大,而高密度芯片(如WES Panel)对间接制备探针的拷贝数均一性具有一定挑战。
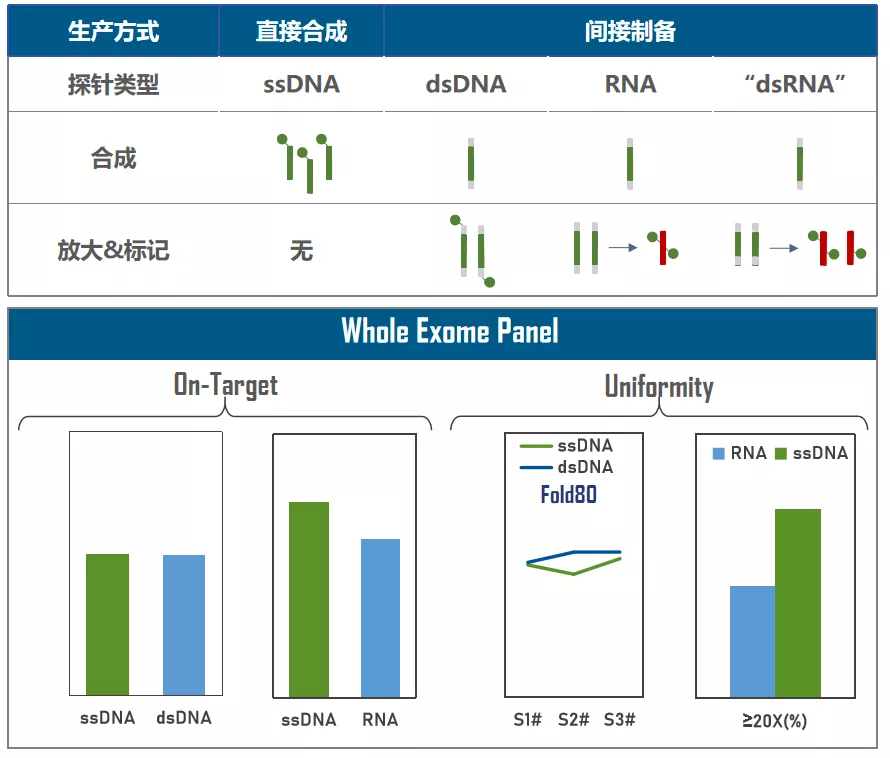
图2. 液相基因芯片合成路线示意图
单单只有基因芯片还不够,想要充分发挥TargetCap的功能,还需要好的“生态”,优秀的杂交缓冲液体系对捕获至关重要(图3)。现在,以磷酸缓冲液为基础的杂交体系已逐渐被放弃,Na离子浓度和辅助试剂尤为重要,它们能够提高Low-GC区域的亲和力,打开High-GC二级结构,使整个杂交反应更加均匀。伯科TargetCap® Hybridization and Wash Kit拥有自主知识产权,性能卓越,提供定制化服务,比如自动化流程需要个别组分增量。此外,接头阻断剂(Universal Blockers)必不可少,Universal Blockers主要用于防止接头序列串联,提高中靶率(On-Target),增加数据有效性。
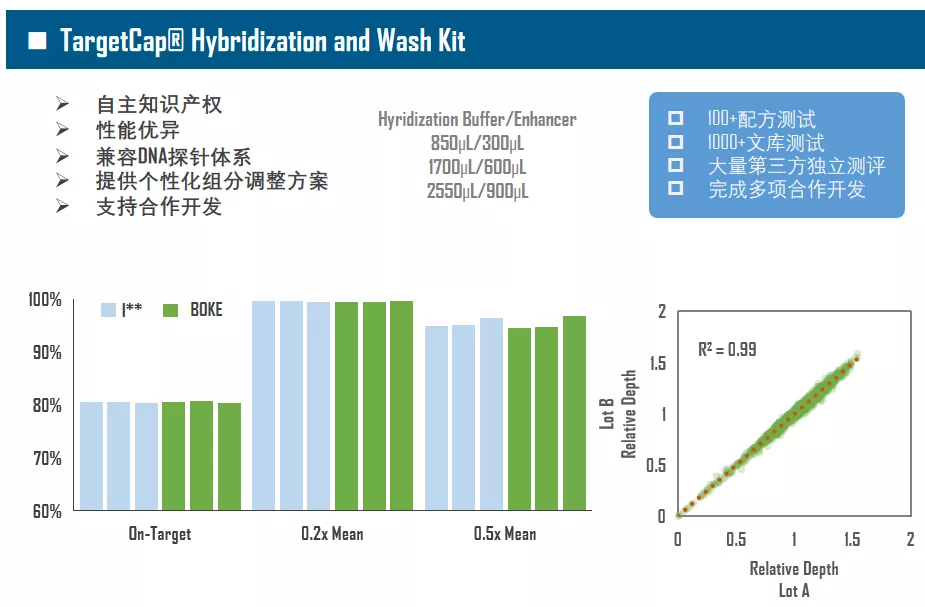

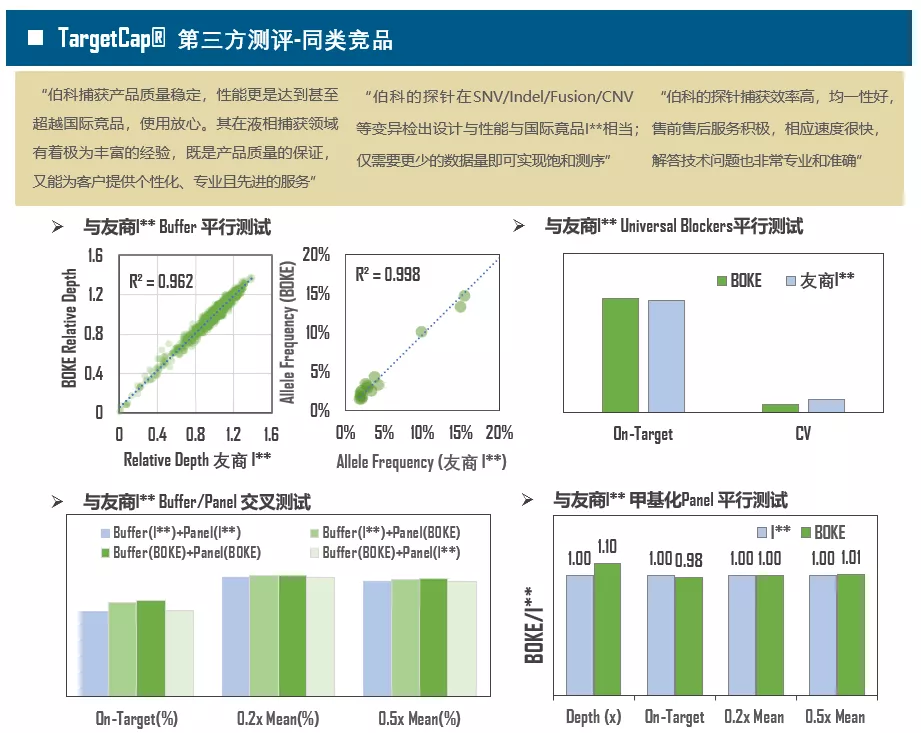
图3. 伯科TargetCap®捕获试剂体系
由于技术原理的限制,NGS技术或多或少的存在着一些偏好,例如PCR导致AT-rich区域覆盖不佳,研究人员就通过针对性的PCR-free技术来降低这些偏好,更真实的还原基因组。同样,TargetCap技术也有偏好,例如,由于结合长度降低导致亲和力不足所造成的目标区域上下游覆盖降低的“边缘效应”,这个现象在短Insert文库中将会被放大,比如cfDNA;此外,还有InDel变异导致探针对突变片段的捕获能力降低等现象。MSI由于多态性的存在,其覆盖往往具有类似InDel变异的现象,如图4所示,通过增加侧翼探针设计,可以明显改善MSI位点覆盖和InDel变异检测。因此,除了芯片、Buffer和Blockers三个关键因素,还需要优秀的探针设计助力,真正让TargetCap捕获基因组“最初的模样”。
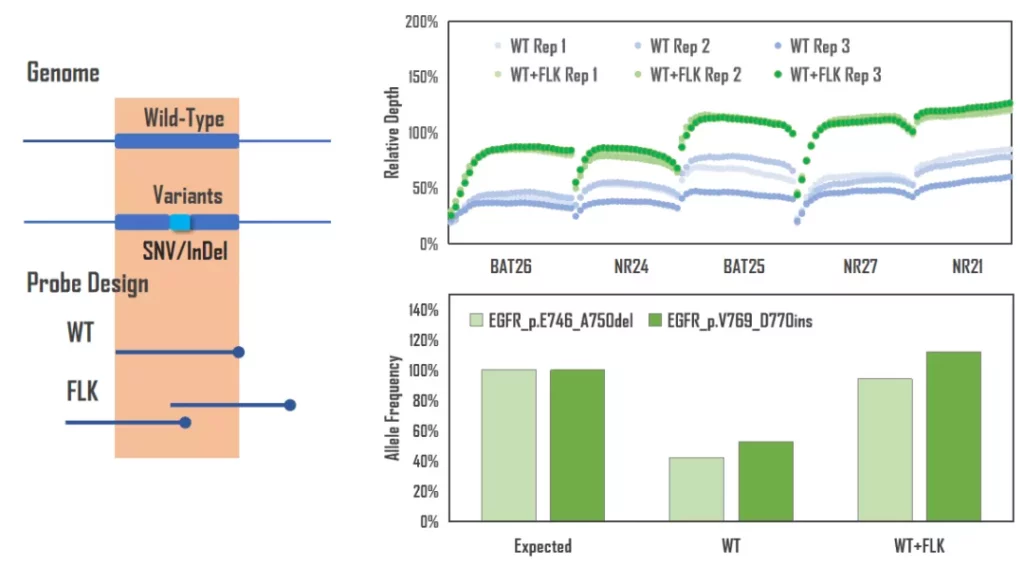
图4. 探针设计对覆盖及变异检测的影响
伯科TargetCap® 靶向捕获平台的液相基因芯片采用直接合成,拥有自主研发的合成平台,建立了以100+万真实合成探针为基础的智能化探针设计平台,配备高性能杂交缓冲液、Universal Blockers,拥有200+ Panel设计合成项目经验,适合多物种、多组学、多平台靶向测序研究,性能卓越,批次稳定。值得一提的是,TargetCap®提供的NGS功能验证检测,为用户的产品开发节省了宝贵时间,受到广泛好评(图5)。

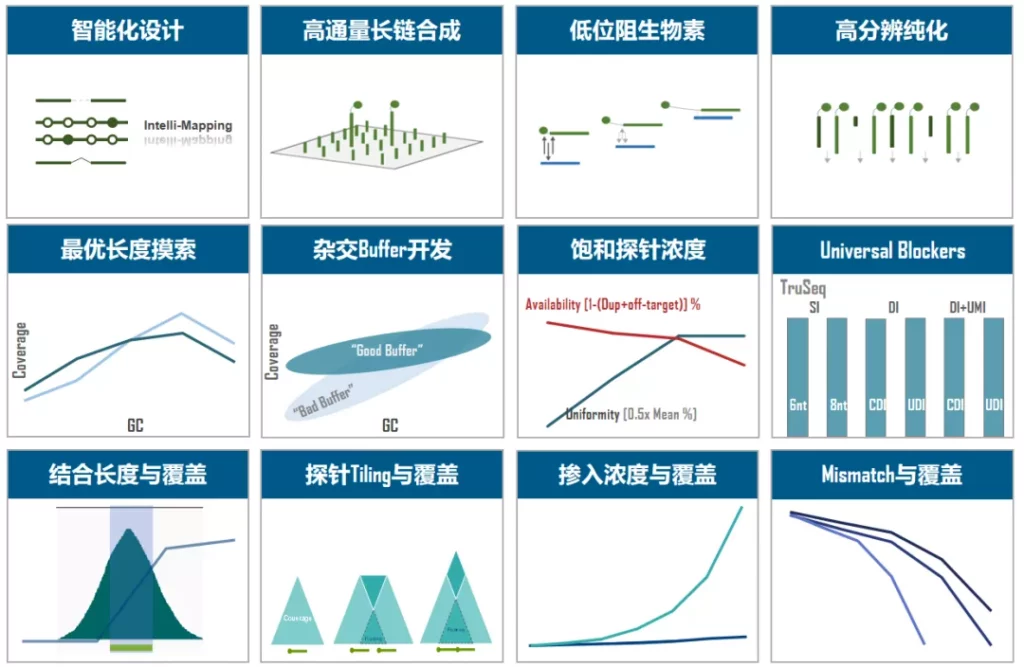

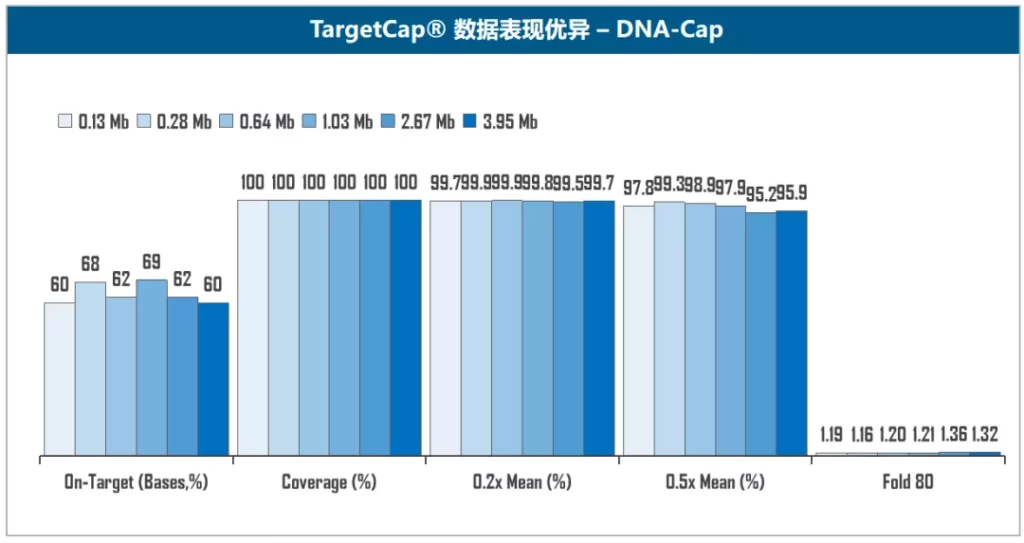


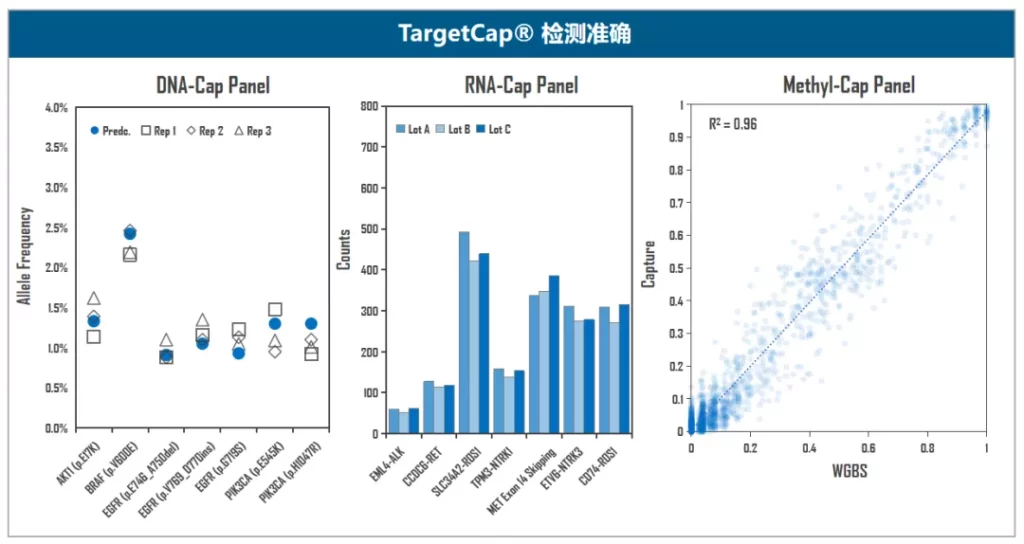
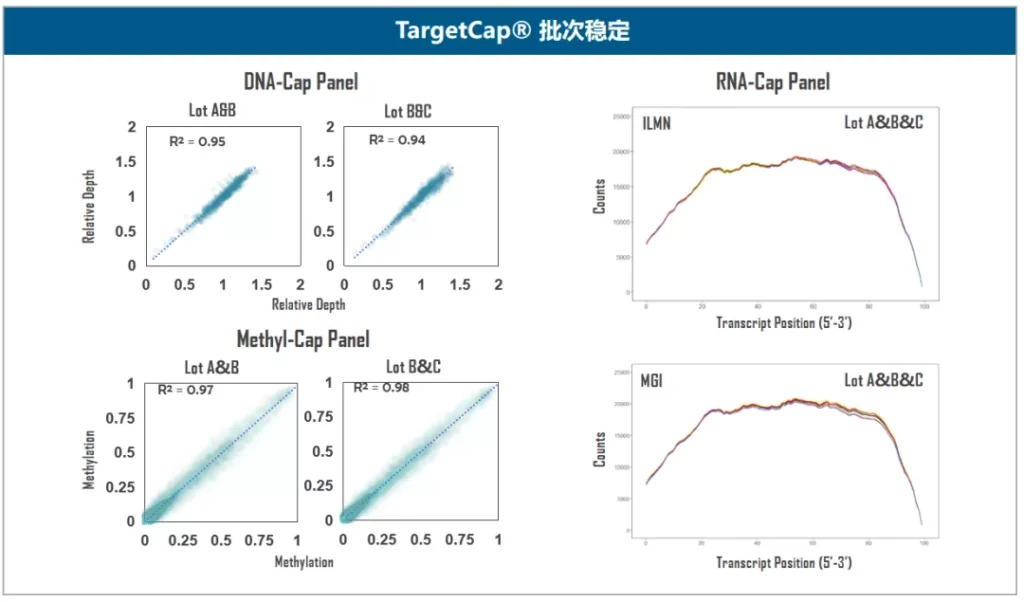
 图5. 伯科TargetCap®靶向捕获技术平台
图5. 伯科TargetCap®靶向捕获技术平台此外,伯科还为NGS应用开发了相应的高品质核酸产品-UltraPu Oligos,交叉污染可控制在0.05%以内,提供个性化规格,例如不等比混样等,适合多重PCR引物池,Index引物,UMI接头合成开发(图6)。
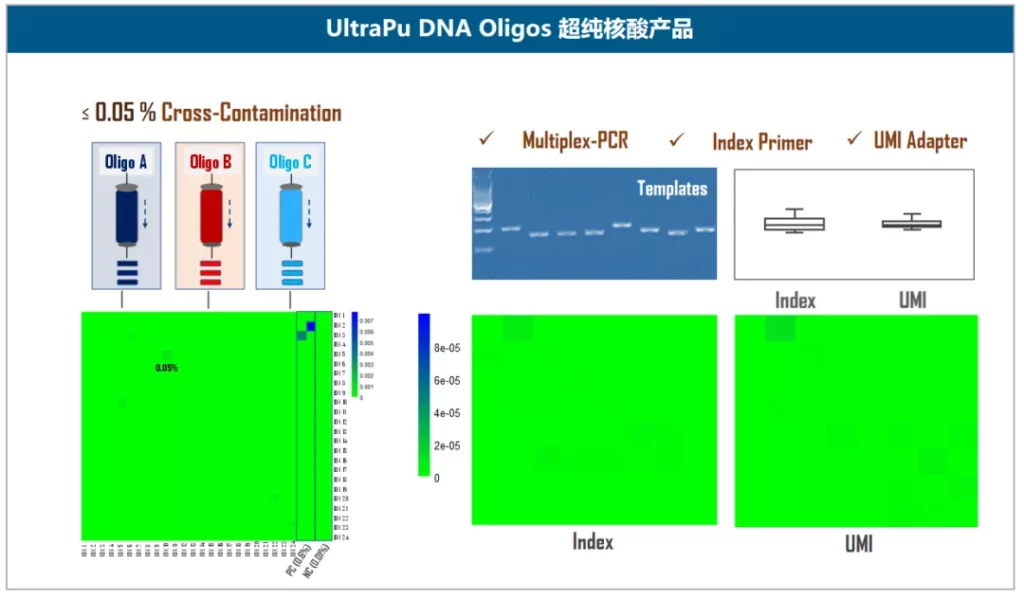
图6. 伯科UltraPu DNA Oligos合成技术
全外显子Panel的性能是检验捕获体系的“试金石”,伯科人类全外显子液相基因芯片TargetCap® Core Exome Panel v3.0(BOKE v3.0)全流程国产化设计生产,包含约40万条120nt ssDNA探针。自2020年9月推出以来,经过一年多的用户测评与使用,其性能表现获得高度认可。第三方独立分析显示,在中靶率相当的前提下,BOKE v3.0覆盖均一性参数Fold80可达到<1.4的顶尖表现,从众多同类产品中脱颖而出,在TMB、MRD检测中具有明显优势。除性能优异之外,BOKE v3.0 WES可灵活添加其他探针模块,配备高通量流程,耐受短时间杂交,同时测序平台兼容性好,更详细的数据表现请参考图7。
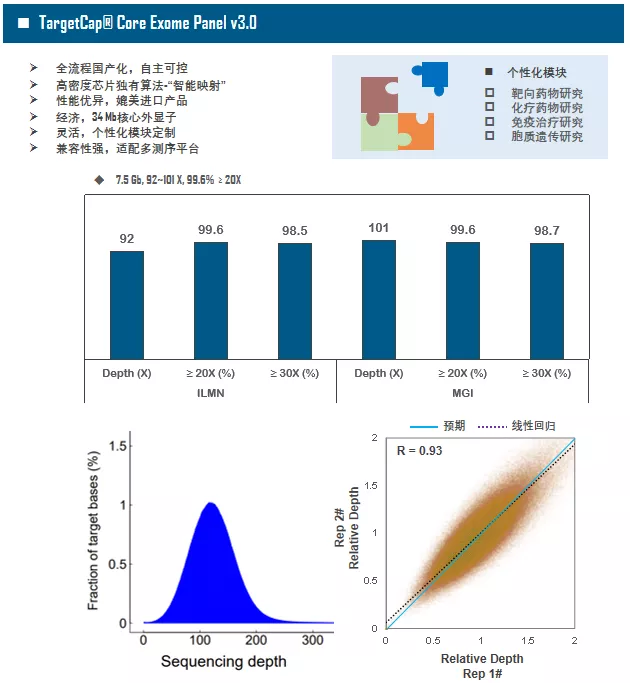

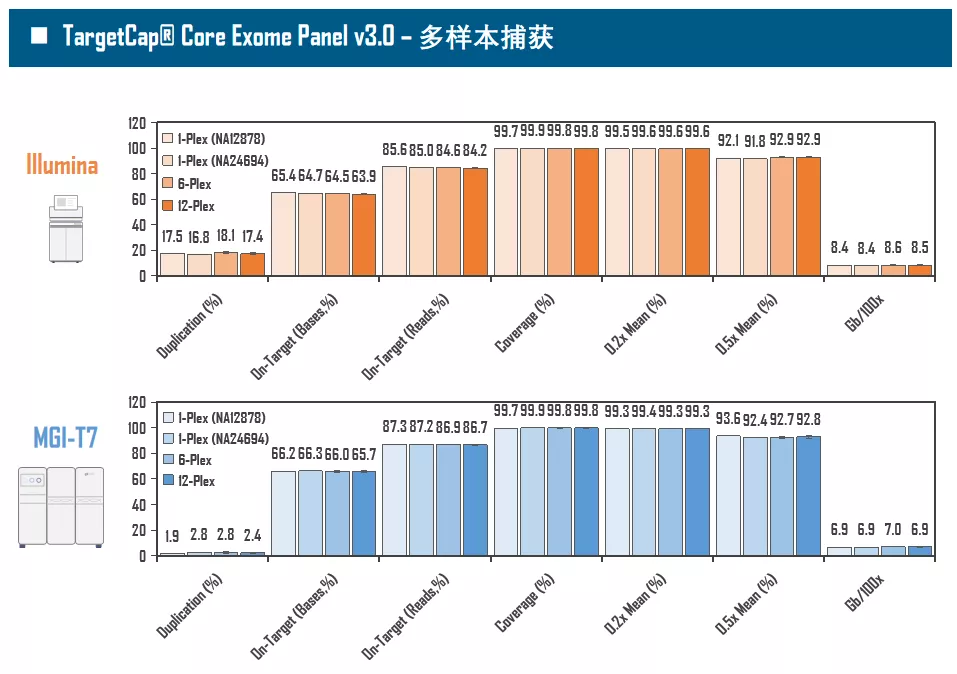
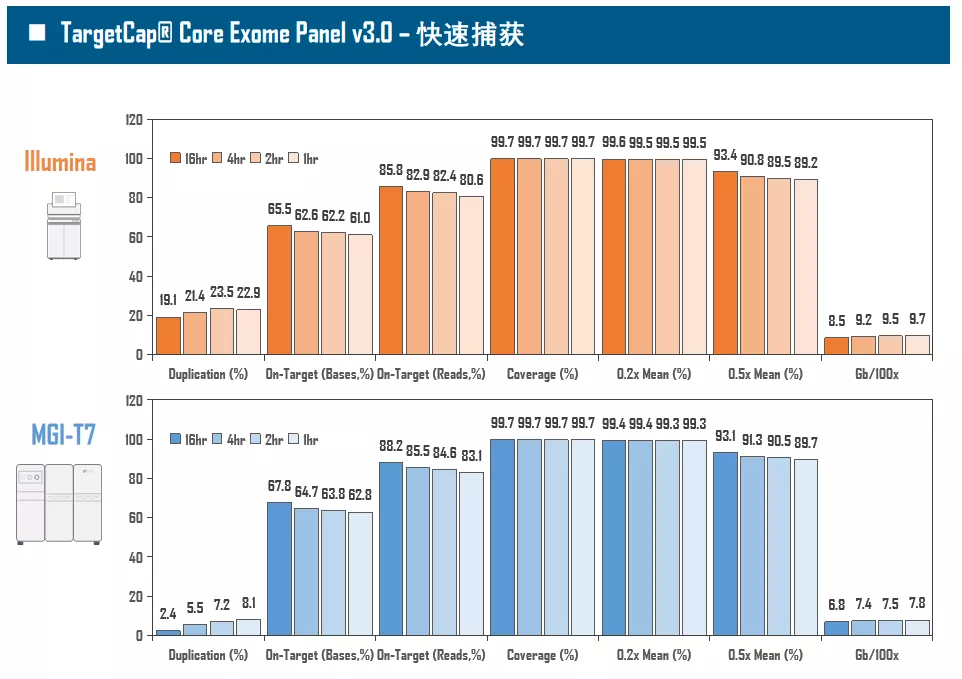




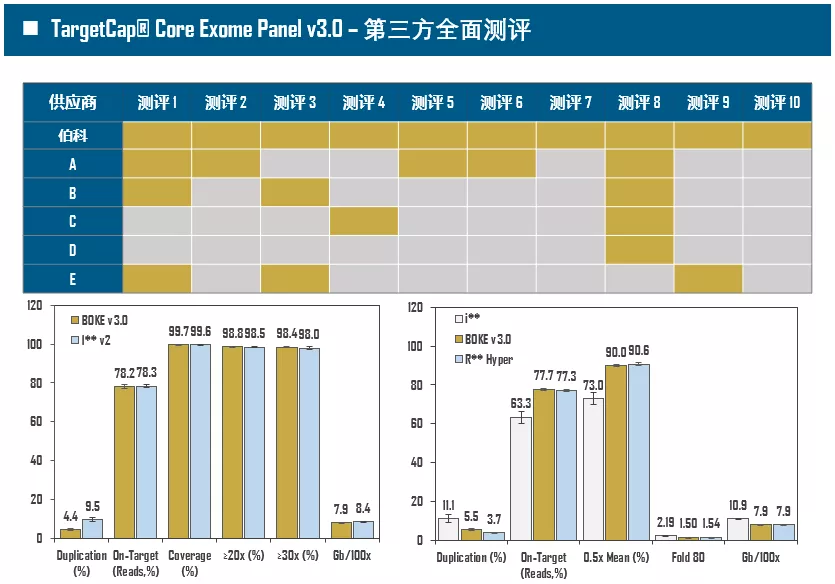
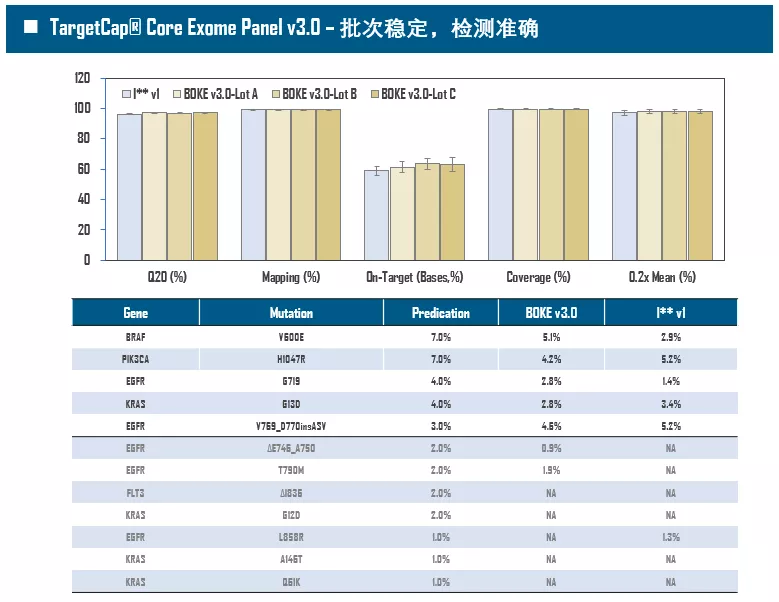
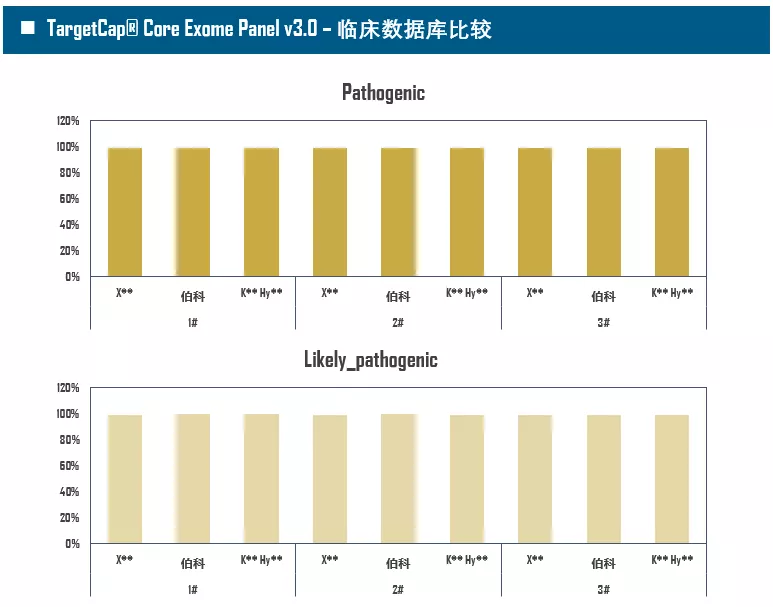

图7. 全流程国产化开发的人类全外显子液相基因芯片TargetCap® Core Eoxme Panel v3.0
全外显子芯片(WES Panel)开发的初衷是从整个基因组中富集可能直接导致蛋白变异的编码区进行测序检测,有效节约测序成本。随着MRD研究深入,WES Panel被赋予了另一种用途-间接保证ctDNA检测灵敏度。MRD在实体瘤治疗管理中的价值越来越受到重视,由于cfDNA拷贝数有限,追踪少量SNV无法匹配MRD的检测要求,即实现≥0.02% ctDNA检出;多项研究表明,通过增加追踪SNV数量可有效提高ctDNA检出率(图8),不过,肿瘤携带的变异位点有限,还要经过筛选过滤,WES测序提供了更加充足的候选突变位点选择。
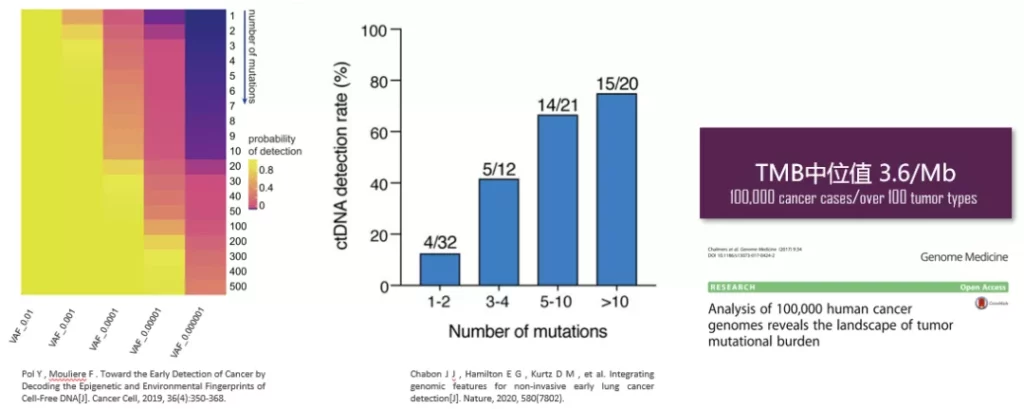
图8. 充足的突变位点候选是MRD检出的潜在保障
正因如此,基于WES Panel的“Tumor-Informed”思路顺理成章的受到研究人员的青睐。与此同时,特殊的应用场景也使得MRD对检测技术的要求更加严苛。基于个体突变图谱的ctDNA检测具有前所未有的个性化特征,固定Panel很难完美覆盖每一位患者的待追踪位点,理论上针对性的个体定制是最好的解决方案,但同时要满足MRD时效性要求,快速合成个性化位点Panel;监测超低频突变必须开展超深度测序,Panel过大,患者负担增加,个体特有的克隆性造血背景突变还需要配对白细胞进行“生物学降噪”,检测成本进一步增加,需要精简MRD Panel控制检测成本。总体来看,MRD的研究与开发需要完善的捕获体系和极速探针合成平台等底层技术支撑。
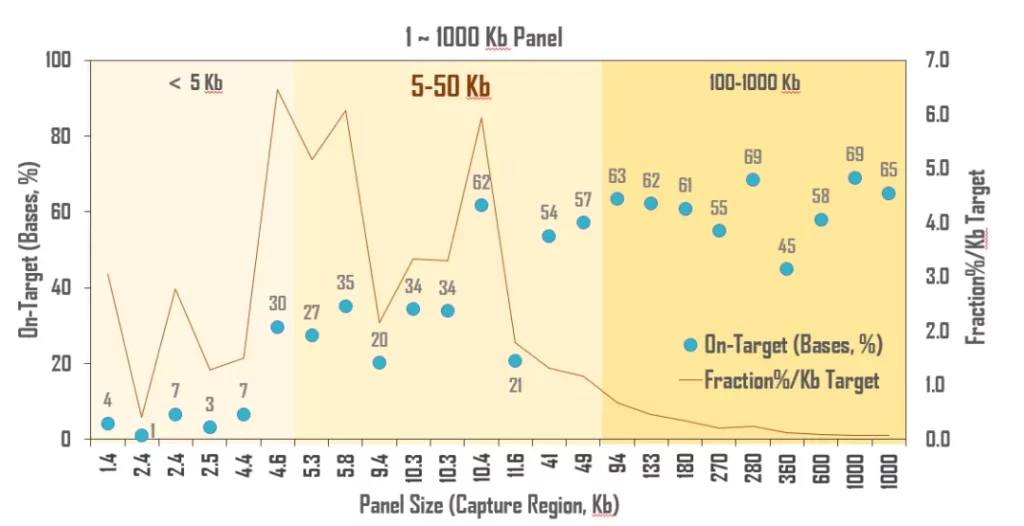
 图9. 伯科对“袖珍”Panel的开发可行性测试
图9. 伯科对“袖珍”Panel的开发可行性测试依托完备的靶向捕获产品线与自主合成平台,伯科将为MRD研究转化提供高品质上游助力而持续努力,包括,1)高性能WES Panel,可根据用户需要快速定制模块探针,筛选充足的肿瘤监测位点;2)“袖珍”Panel合成,具有样本Tracking功能、涵盖I/II变异位点,作为个性化位点的“Carrier”;3)个性化位点Panel合成,≥3个工作日极速周期,加速研发;4)个性化多重PCR引物池合成;此外,5)高性能UMI接头,长度、数量适中,效率均匀,编辑距离大,错位构成,测序准确;6)超纯Index Primer,低于0.05%的引物间交叉污染率保证样本拆分准确性;7)高性能杂交缓冲液,突变和片段长度耐受度高,背景突变低,适合cfDNA低频突变检测。通过碱基修饰和反应体系等技术细节的调整,我们相信液相基因芯片的突变检测性能还能进一步提升。
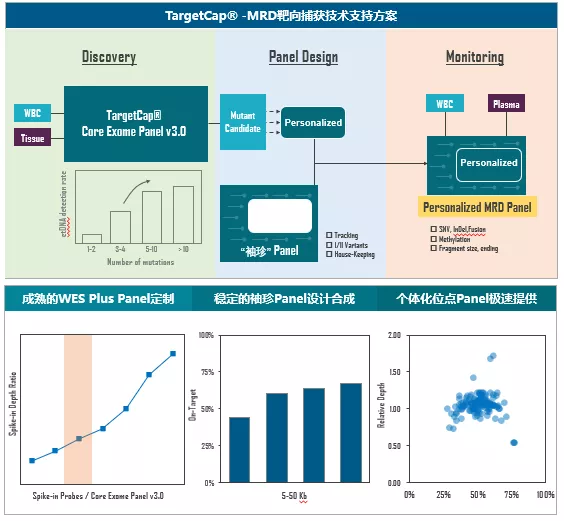
图10. 伯科为MRD研究转化提供底层技术支撑
MRD的应用需求包括准确性、个性化、时效性、经济性等,对上游原料供应,Assay研发,以及临床转化都提出了前所未有的挑战,同时,这也凸显了核心技术和完备产线的国产化意义。从合成路线摸索,到合成工艺概念验证,再到工业化生产和完备的质量体系建立,伯科生物稳步前行,现在,伯科已经建立了完整的国产化液相基因芯片合成产品线。在无锡市政府部门的帮助和支持下,伯科已经在锡东建成了国内最大的液相基因芯片生产基地和应用示范中心并投入使用。在这里,由衷的感谢企业和政府对伯科发展的帮助。
随着生物学和临床研究的深入,靶向测序作为平台型技术,必将迎来更多的应用场景,发挥更大的作用。伯科立足于国内,缩短供货周期和成本,为研究人员提供高品质核酸产品的同时也提供高品质服务,积极满足下游应用端的需求,伯科人将继续努力,真正践行“精益求精创新,为人类美好生活”的企业使命。
参考文献
[1] Zhu G, Guo Y A, Ho D, et al. Tissue-specific cell-free DNA degradation quantifies circulating tumor DNA burden[J]. Nature communications, 2021, 12(1): 1-11.