潜能不明克隆性造血(CHIP)近期进展:肾脏疾病
- boke
- 2025-05-20
- 11:25 上午
潜能不明克隆性造血(CHIP)
2022年,世界卫生组织(WHO)和国际共识分类指南将CHIP定义为:在未被诊断为血液疾病或不明原因血细胞减少症的个体中,存在已知驱动血液恶性肿瘤基因的获得性体细胞突变,其变异等位基因频率(VAF)在血液或骨髓中至少为2% [1,2]。
先进的分子生物学技术,特别是高通量测序,显著提升了我们对CHIP的理解。曾经被认为是罕见现象,如今已认识到它是一种常见的生物学现象,并与各种疾病的发生、发展和预后密切相关。
CHIP是一种常见的与年龄相关的生物学状态,且克隆性造血的发生率随着年龄增长而上升。然而,越来越多的研究将CHIP的应用范围扩大到心血管、肾脏、肝脏和肺部等非血液疾病。此外,随着基因检测技术和预防医学的快速进步,CHIP在各种疾病中的作用有望成为预防疾病发生和发展的重要靶点。

图1. CHIP的作用不仅限于血液领域,流行病学研究支持CHIP与心血管疾病和非心血管疾病相关,包括阿尔茨海默病、骨质疏松症、血管炎、关节炎、牙周病、肾病、2型糖尿病、慢性肝病、慢性阻塞性肺病和肺癌[3]。
慢性肾脏病(CKD)是由于其高患病率以及相关的预期寿命和生活质量下降而带来的重大公共卫生挑战。全球范围内,约6.98亿成年人患有CKD,占男性人口的10.4%,女性人口的11.8%。与许多慢性疾病一样,CKD的患病率随着年龄增长而增加。最近的估计表明,美国65岁及以上成年人中,有38%患有CKD。作为终末期肾病(ESKD)和心血管疾病(CVD)的重要促成因素,CKD在2016年导致全球约120万例死亡,CKD相关的死亡率在老年人中最高。由于全球人口老龄化,CKD的发病率、患病率和相关死亡率预计将在未来几十年内增加,这使得预防和治疗该疾病成为一项紧迫的公共卫生优先事项。
尽管CKD的负担巨大且不断增加,但治疗选择有限,通常仅能延缓肾功能衰退。识别导致CKD发生和进展的分子前体,可能为亟需的预防和治疗策略提供线索。
CHIP的影响遍及多个器官系统,而炎症通路在疾病进展中起关键作用。这一新发现引发了人们对CHIP与肾脏疾病关系的极大关注,鉴于炎症在加速肾脏疾病方面已确立的作用。新的数据正在加深我们对CHIP与肾病的理解(图 1)。
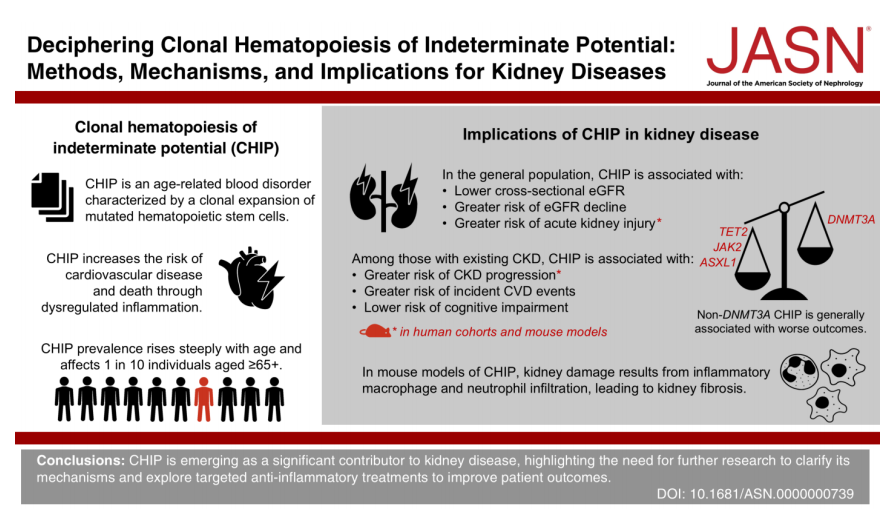
图2. CHlP 正在成为导致肾脏疾病的重要因素,这凸显了进一步研究其机制并探索靶向抗炎治疗以改善患者预后的必要性[4]。
流行病学研究考察了CHIP与一般人群和慢性肾脏病(CKD)患者肾功能损害之间的关联(表1)。
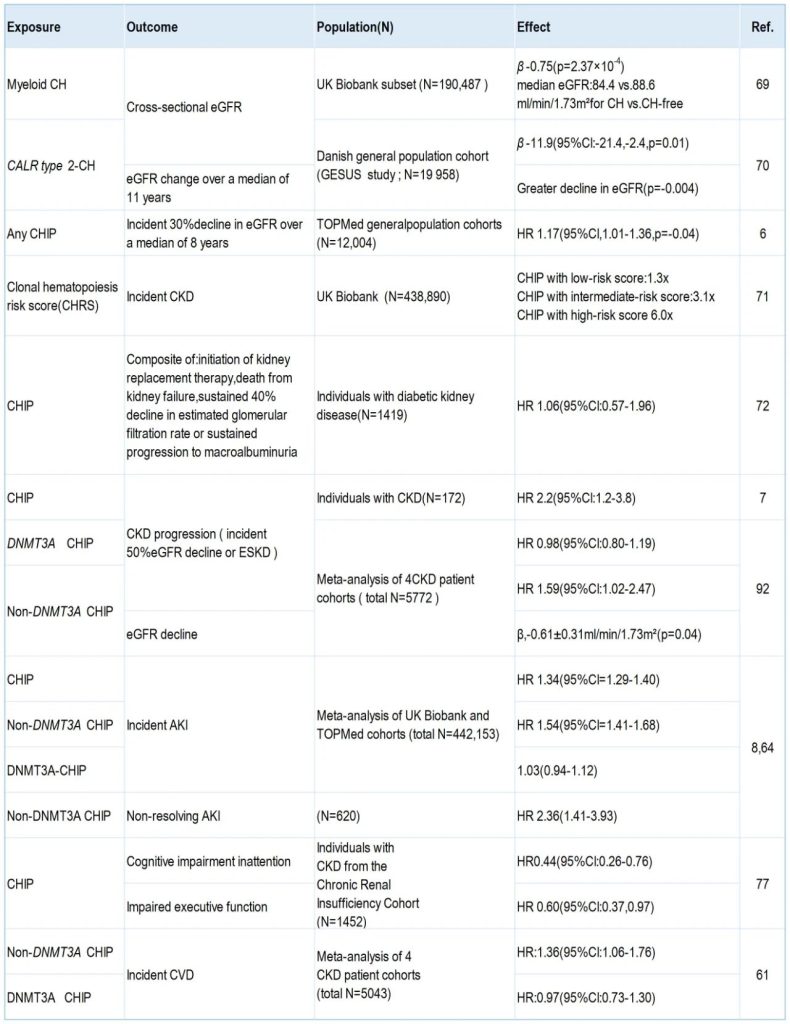
表1. 肾脏疾病中CHIP的流行病学研究[4]。此表格总结了关键流行病学研究的结果,这些研究调查了CHIP与各种肾脏疾病结果之间的关系,包括慢性肾脏病(CKD)发病率、CKD进展和急性肾损伤。
在一般人群中,一项针对英国生物库(约20万参与者)的初步研究,通过血液全外显子组测序,揭示了克隆性造血(CH)与CKD之间的关联。髓系CH与肾功能下降相关,特别是与来自胱抑素的较低eGFR估计值相关,而非肌酐。在这项研究中,孟德尔随机化提示克隆性造血(CH)和CKD之间存在因果联系。
随后,Kestenbaum等人在来自TOPMed队列的三个社区队列(共12,004人)中评估了CHIP与肾功能下降之间的联系。CHIP携带者在约8年内eGFR下降30%的风险增加了17%。
一项对丹麦一般人群队列(约2万人,随访11年)的研究发现,CALR驱动型CHIP患者的eGFR显著低于CHIP阴性个体。
最后,Weeks等通过计算CHIP的预后危险因素(如年龄、细胞减少症、突变数量和突变等位基因频率(VAF))的加权和,开发了克隆性造血风险评分(CHRS),将其用作预测髓系癌症进展的风险分层工具。CHRS评分与新发CKD风险相关,低风险、中风险和高风险CHIP克隆分别与CKD风险增加1.3倍、3.1倍和6.0倍相关。
在两组小而独立的晚期CKD患者队列(N=85和87)中,Vlasschaert等发现,CKD患者CHIP患病率较高(25%),且患有CHIP的患者在五年内发生肾衰竭的风险增加了2.2倍。
相比之下,一项针对294名糖尿病肾病患者的研究发现,CHIP与新发或进行性肾功能下降之间没有关联。
Vlasschaert等人的最新研究,考察了CHIP与CKD进展之间的关系,研究对象涵盖了四个CKD患者队列(N=5654)。结果显示,非DNMT3A CHIP携带者发生CKD进展的风险增加了64%。此外,与非携带者相比,非DNMT3A CHIP携带者eGFR的年下降速度更快,表明肾功能丧失的轨迹更陡峭。由于CKD是一个异质性疾病,CHIP可能会不同程度地影响导致CKD的不同病理机制;例如,在一项对113名抗中性粒细胞胞浆抗体(ANCA)相关血管炎患者的研究中,CHIP被证明可能对某些器官表现,例如肾脏和神经系统受累,具有潜在的保护作用。
动物研究也表明,克隆造血可能导致肾功能下降。最近的研究表明,Tet2-CHIP导致肾间质炎症、纤维化和eGFR下降,在饮食腺嘌呤诱导的慢性肾病小鼠模型中。Tet2-CHIP也被证明通过IL-6介导的肾脏钠通道激活和肾交感神经激活,促进盐敏感性高血压。
新研究显示,CHIP 也可能导致急性肾损伤(AKI)。在对三个大型人群队列进行的荟萃分析中,CHIP 携带者相较于未携带 CHIP 的个体,AKI风险增加了34%,其中非DNMT3A突变的 CHIP 携带者,其AKI风险显著高于DNMT3A突变的CHIP携带者。此外,非DNMT3A型CHIP与AKI后肾功能恢复较慢相关。
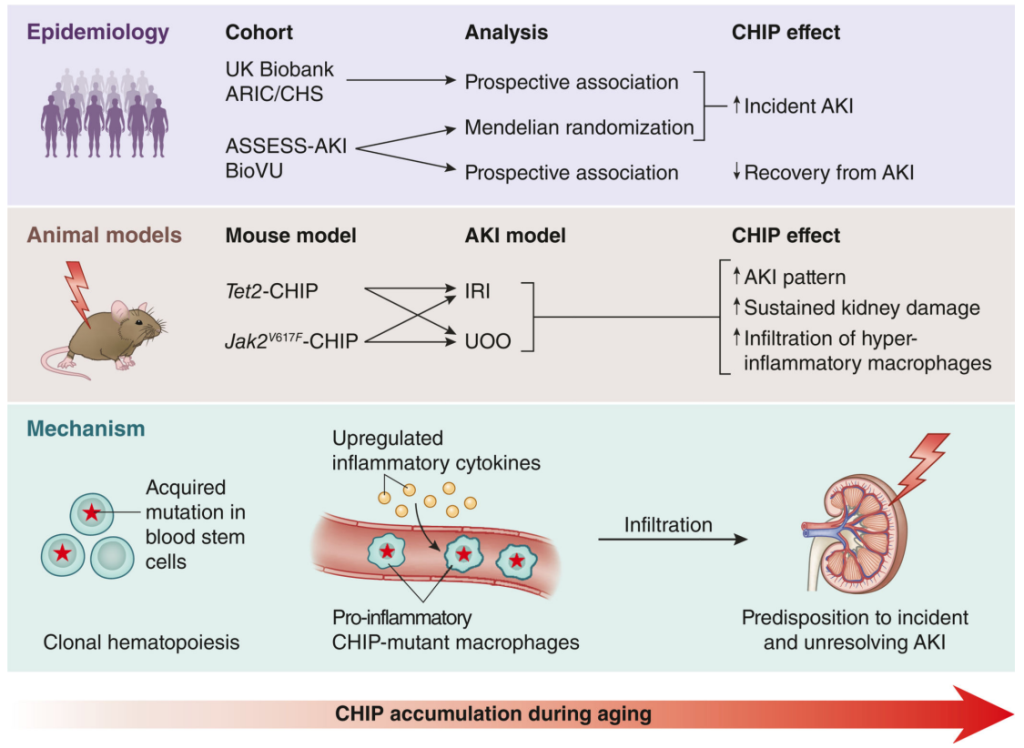
图3. CHIP在促进新发和非愈合性急性肾损伤(AKI)中的作用[5]。
此外,在已有慢性肾病(CKD)的患者中,CHIP会增加其他年龄相关疾病的风险。与一般人群研究结果一致,CHIP近期被证实会增加晚期CKD患者心血管疾病的风险。此外,Xiao等人通过慢性肾功能衰竭队列研究,调查了CHIP与认知障碍之间的关联。在 1452名老年CKD患者中,CHIP与注意力认知障碍风险降低了56%,执行功能障碍风险降低了40%,但与整体认知或言语记忆没有显著关联。这与先前关于阿尔茨海默病的研究结果相符,其中CHIP可能是一种保护因素。
了解CHIP与CKD之间的关系,需要在阐明其机制、制定精准的预防和治疗策略方面开展进一步研究。
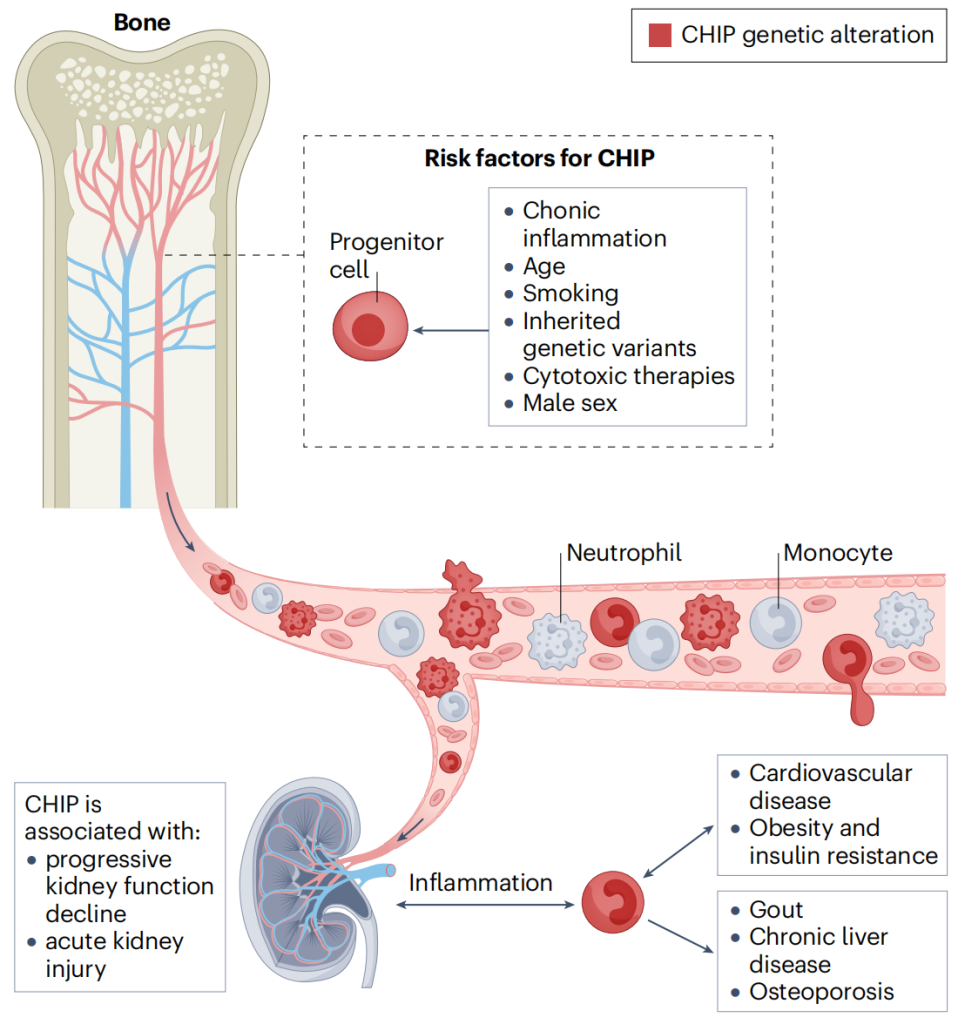
图4. CHIP在肾脏健康中的作用概念模型[6]。CHIP是一种获得性炎症性疾病,与急性肾损伤、肾功能逐渐下降以及影响肾脏健康的几种其他疾病有关,包括心血管疾病、痛风、慢性肝病、骨质疏松症、肥胖症和胰岛素抵抗。髓系癌症相关基因的突变是CHIP的起始事件,已确定几个风险因素导致随后的克隆扩增,包括年龄、吸烟、男性、慢性炎症、细胞毒性治疗和某些遗传变异。
首先,明确CHIP影响CKD及其并发症的关键途径至关重要。CKD常常与糖尿病、心血管疾病和高血压等疾病共存,这些疾病可能与CHIP以独特的方式相互作用。CHIP是否会加剧某些类型的肾病,目前尚待观察。CKD有多个阶段和亚型,每个都有独特的进展模式和对CHIP的反应。关于CHIP在CKD进展中的影响最大时期及最佳干预时机,仍有待研究。例如,CKD的某个阶段CHIP的影响可能很小,或者干预是否已错失改变疾病进程的时机?鉴于CHIP的流行程度和对合并症的影响,所有CKD患者是否都需要CHIP筛查,还是早期筛查和干预更有效?解决这些问题,需要对不同CKD阶段的CHIP进行纵向研究,并运用单细胞组学技术,识别CHIP引起的早期分子变化和受影响的特定细胞类型。了解这些差异,有助于制定更精准的CKD预防和管理策略,特别是针对CHIP患者。
新兴研究表明,与CHIP相关的某些炎症通路可以调节,从而改变其与相关疾病的联系。观察性研究和实验表明,如秋水仙碱等抗炎药物,可能改变心血管疾病风险。小鼠研究表明,靶向白介素-1β (IL-1β)等细胞因子的抗炎治疗,可减少CHIP驱动的炎症和动脉粥样硬化进展。此外,人类研究显示卡那单抗(抗IL-1β)、阻断IL-6信号通路以及类固醇在抑制CHIP相关炎症中的潜在益处,但CKD方面的可靠数据仍不足。应用类似方法研究CHIP对CKD的影响,或能揭示减轻CHIP携带者肾脏疾病风险的潜在治疗途径。然而,普遍的CHIP“治疗”可能不适用,特别是考虑到观察到的风险相对较低。识别高风险人群(例如,具有较大克隆或急性肾损伤的人群)可能更有临床意义。
总而言之,CHIP对急性肾病和慢性肾病都有新的影响。随着我们对这些关联的理解深入,更针对性的干预措施(例如,抗炎策略)可能有助于预防或减轻CHIP患者肾脏疾病。
伯科全外芯片 – Core Exome Panel v3.0
TargetCap@ Core Exome Panel v3.0基于伯科高品质DNA探针合成技术开发,全流程国产制造,由~40万条探针组成,以GRCh38/hg38人类参考基因组设计,参考Refseq、CCDS、ClinVar等数据库,覆盖19,524个基因,目标区域为33.9Mb。
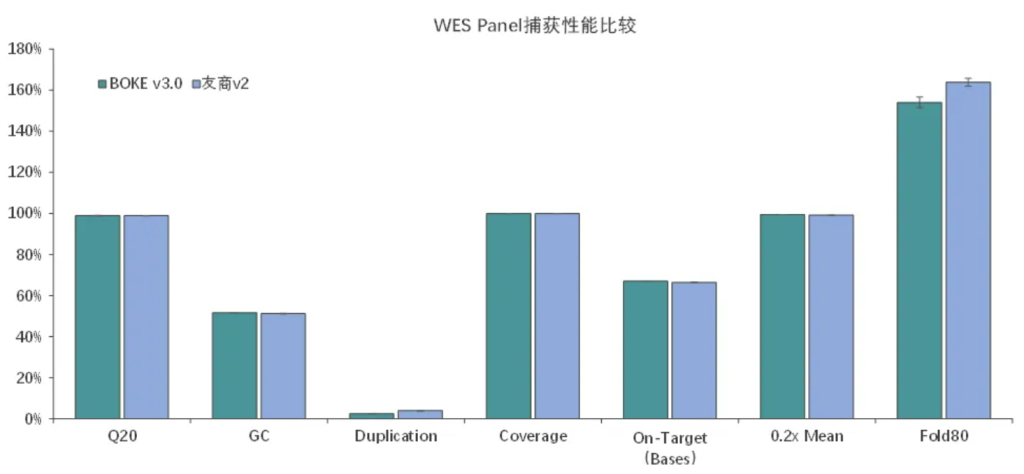
捕获性能比较
伯科全外芯片v3.0性能优异与国外友商同类型产品v2相当,中靶率、覆盖率、覆盖均一性等参数均达到国际领先水平。
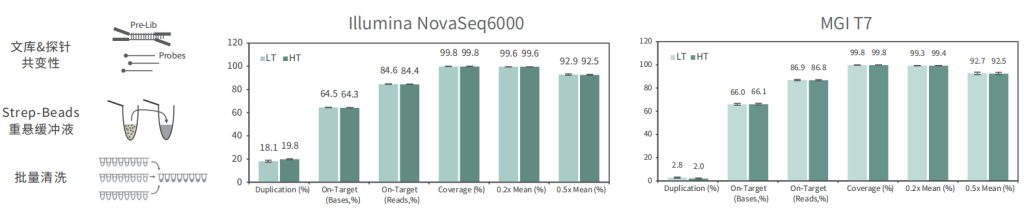
适配高通量流程平台
批次稳定
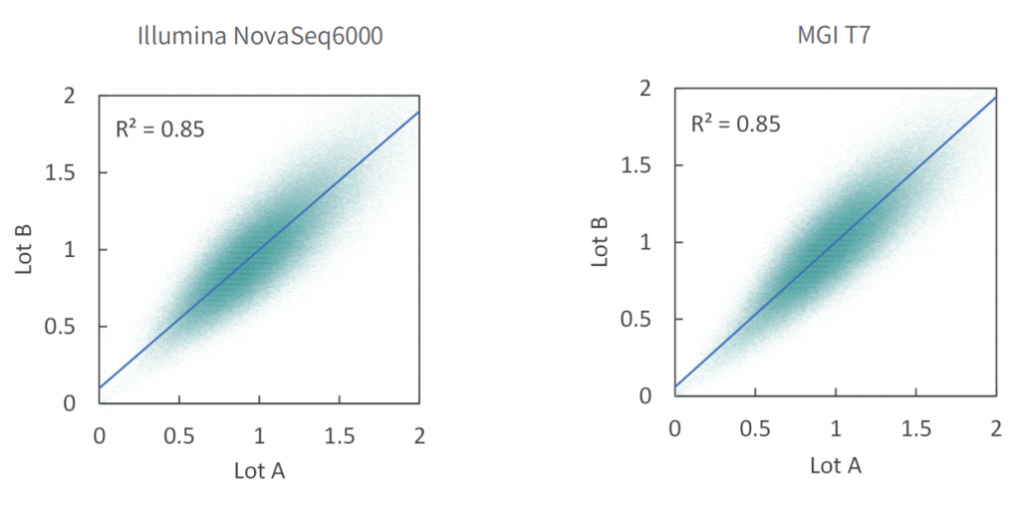
使用不同批次TargetCap® Core Exome Panel v3.0芯片对NA12878 gDNA进行捕获测序,结果显示,不同批次芯片在不同测序平台上均显示出优异的稳定性,不同位点的相对深度相关性高,批次稳定。
变异检测准确
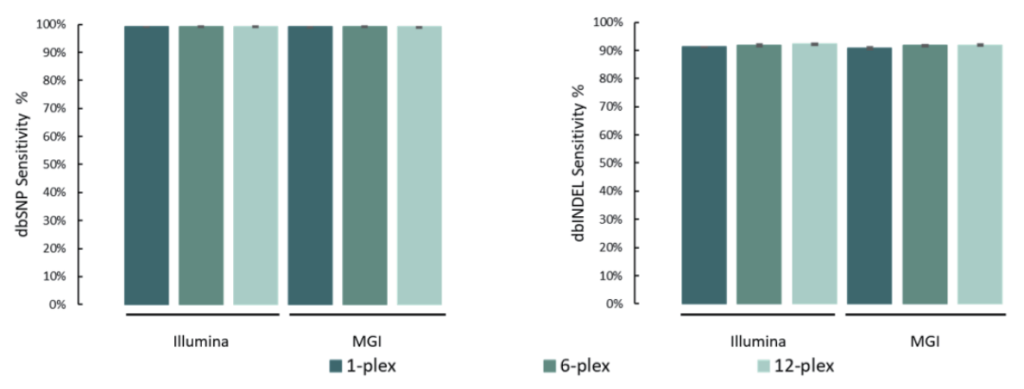
单核苷酸变异(SNV)和插入缺失 (INDEL)是基因组变异的常见形式,也是引起人类疾病的重要原因。
选取NA12878标准品,与预期SNV和INDEL变异进行比较。结果表明,在MGI与Illumina测序平台,SNP灵敏度为99.1%,INDEL灵敏度为91.6%。
添加线粒体模块临床样本表现
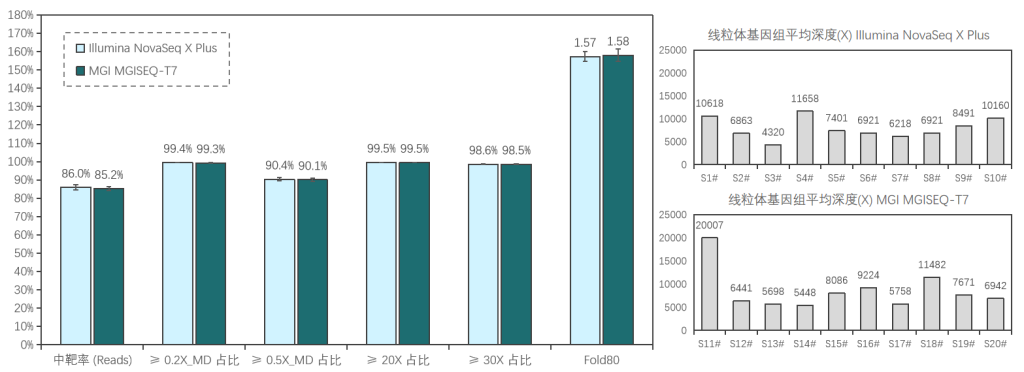
20例全血样本(S1#-S20#),采用1-4 Plex方式使用伯科Core Exome Panel v3.0添加线粒体模块进行过夜杂交捕获;其中,S1#-S10#在Illumina NovaSeq X Plus平台测序, S11#-S20#在MGI MGISEQ-T7平台测序,均采用150PE模式测序。得到测序数据后,抽取8Gb数据进行生信分析。
两种测序平台的数据表现相近,平均深度分别为111x/115x (Illumina/MGI),中靶率优异均> 85%,覆盖均一性极佳(0.2X_MD≥99.3%);仅使用8Gb数据,高达98.5%的捕获区域达到了30X以上,99.5%的捕获区域达到20X以上,为临床样本检测提供了可靠的捕获数据。