EHJ: 关于甘油三酯的激烈辩论 | 甘油三酯到底是“旁观者”还是“罪魁祸首”?
- boke
- 2025-04-25
- 2:07 下午
摘要图
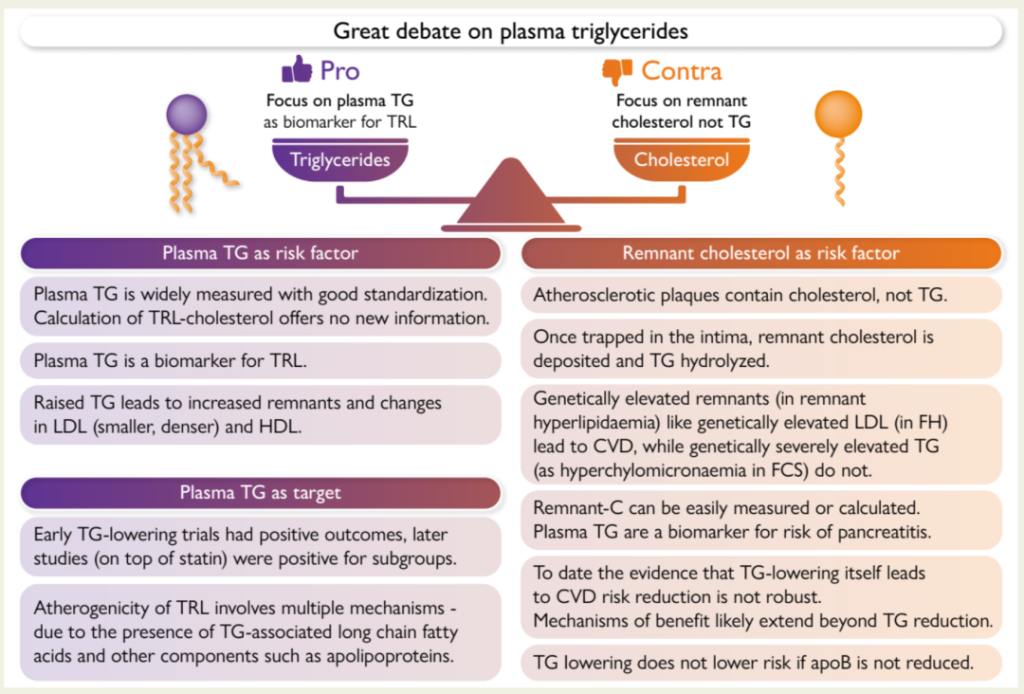
正方:关注血浆TG作为富含甘油三酯脂蛋白(TRL)的生物标志物
1.血浆TG既是风险因子
-
血浆TG是一种广泛使用的标准化检测
-
计算TRL胆固醇不能提供新信息
-
血浆TG是TRL的生物标志物
-
TG升高会导致残留物增多,以及LDL变小变密,HDL也发生变化。
2.血浆TG也是干预靶点
-
早期降低TG的试验结果积极,后来的研究(他汀基础上)也显示对部分人群有积极结果。
-
TRL的致动脉粥样硬化机制涉及多个方面,比如TG相关的长链脂肪酸和其他成分(比如载脂蛋白)的存在。
反方:关注残余胆固醇而不是TG
残余胆固醇才是风险因素
-
动脉粥样硬化斑块里是胆固醇,不是TG。
-
一旦卡在内膜里,残余胆固醇就沉积下来,甘油三酯则分解了。
-
遗传性的高残余胆固醇(比如残余物高脂血症)跟遗传性的高LDL(比如家族性高胆固醇血症)一样,都会引起心血管疾病,但遗传性的极高甘油三酯(比如家族性高乳糜微粒血症)则不会。
-
残余胆固醇(Remnant-C)很容易测量或计算。
-
血浆TG是胰腺炎的风险标志物。
-
单纯降低TG对降低心血管疾病风险的证据还不够充分。
-
如果载脂蛋白B没降下来,降低TG也没用。
引言

甘油三酯(TG)长期以来已被公认为动脉粥样硬化和心血管疾病的危险因素。然而,临床试验关于降低甘油三酯药物对心血管结局的影响,结果存在争议。
血液中的甘油三酯由于亲脂性不能自由循环,而是以脂蛋白核心形式运输,主要包括乳糜微粒、极低密度脂蛋白(VLDL)和残余脂蛋白,统称为富含甘油三酯的脂蛋白(TRLs)。虽然空腹状态下通常没有乳糜微粒存在于循环中,但VLDL及其残余物存在于循环中,并在脂酶(主要为脂蛋白脂肪酶(LPL))作用于甘油三酯并释放脂肪酸用于细胞β-氧化产生能量,或局部重新合成甘油三酯储存时,作为外周组织的能量来源。由于尺寸较大,乳糜微粒不能自由穿过内皮。乳糜微粒残余物、VLDL及其残余物尺寸较小,因此可以穿过内皮,并主要通过与细胞外基质的相互作用(由这些脂蛋白的载脂蛋白B [apoB] 介导)保留在内皮下空间。
这些脂蛋白被巨噬细胞和平滑肌细胞内化后,有助于斑块形成和发展,无需修饰(与低密度脂蛋白 [LDL] 不同),其机制包括胆固醇沉积和炎症。它们在内皮下空间的滞留依赖其高含量载脂蛋白E和C-III,使其流入量超过流出量。
重要的是,TRLs中每颗粒胆固醇含量是LDL的30-40倍。尽管胆固醇与动脉粥样硬化相关,并在动脉壁中积累,但甘油三酯在促进心血管疾病方面是否发挥直接作用仍不清楚。值得注意的是,LPL也可由血管壁中的巨噬细胞表达,在内皮表面或内皮下空间水解甘油三酯,会产生源自不同脂肪酸种类的前炎症介质,这些介质会改变内皮功能并导致斑块易损性,而与LDL胆固醇(LDL-C)水平无关。最近一项大型孟德尔随机化研究表明,残余胆固醇和甘油三酯水平升高与心脏代谢多病症风险显着相关,这表明TRLs可能是危险因素和潜在治疗靶点。
由此,一个重要的问题出现了:我们应该关注TRLs中的甘油三酯还是胆固醇?在本讨论中,我们将对比该领域三位公认专家的观点,并为读者提供目前关于TRLs中胆固醇和甘油三酯在动脉粥样硬化和心血管疾病中的作用的证据。
虽然两者可能都发挥作用似乎很明确,但难以理解其在心血管风险中的相对和绝对权重。在这里,我们将对比支持TRLs中甘油三酯含量与胆固醇含量的证据,并讨论脂蛋白的数量和质量是否也存在差异。此讨论还应作为目前超出LDL的残余风险概念的函数:降低血浆甘油三酯是否为正确的目标?我们是否应该寻找与TRLs相关的胆固醇?或者apoB(颗粒数量)是否是一个合理的靶点?
最近的数据表明,如果降低甘油三酯水平不伴随apoB水平的显着降低,那么任何降低甘油三酯水平的方法在临床上可能都没有相关性——这一指标概括了动脉粥样硬化性脂蛋白颗粒数量的减少。
临床实践中应该怎么做?目前,non-HDL-C和/或apoB是评估超越LDL-C水平的心血管风险的最佳方法,即使降低甘油三酯,似乎降低apoB才是有效降低心血管事件的关键。在出现新的、更好的、易于测量的生物标志物,能够概括甘油三酯降低的心血管益处之前,apoB降低是评估甘油三酯降低疗法潜在益处的良好指标。
正方陈述

血浆TG、TRL与动脉粥样硬化
最近欧洲动脉粥样硬化协会(EAS)的共识声明将血浆甘油三酯(TG)水平低于1.2 mmol/L(106 mg/dL)定义为‘最佳’,并将升高的水平分别归类为‘临界值’、‘中度’、‘重度’和‘极度’高甘油三酯血症。该声明还强调了两点重要内容。首先,血浆甘油三酯只是富含甘油三酯脂蛋白(TRLs,几乎所有循环中的甘油三酯都载于这些脂蛋白中)的一种易于测量且广泛使用的生物标志物;其次,当血浆甘油三酯升高时,脂蛋白谱会发生潜在的动脉粥样硬化改变。另一种易于测量的,但使用频率较低的生物标志物是TRL中的脂类(称为TRL-脂类、极低密度脂蛋白脂类或,我们认为更准确的,TRL/残余脂类)。这种脂类存在于所有TRL颗粒中,并且可以作为颗粒丰度的替代指标。鉴于在治疗患者时需越来越重视TRL相关风险,探讨如何最佳评估该风险因素非常必要。
简单地沿用脂蛋白种类脂类含量评估心血管疾病(CVD)风险的思路很诱人。低密度脂蛋白脂类(LDL-脂类),是血液中脂类的主要载体,也是将循环脂类输送到动脉壁的主要因素。多年来一直是评估个人和人群CVD风险的首选指标。它是在降脂干预试验中的主要疗效指标,因此被纳入专家指南中的主要治疗目标。
数十年的实验表明,LDL颗粒在病变部位穿透动脉壁,沉积脂类,促使动脉粥样硬化斑块生长。考虑到这种病理机制,使用直接测量或计算的LDL-脂类作为风险指标是合理的。然而,正如下面讨论的,对于TRL,我们有理由认为需要一种不同的评估方法,因为其结构和组成比LDL复杂,并可能通过多种机制作用于动脉壁。
我们的中心论点是,虽然TRLs和残余颗粒的甘油三酯或脂类含量可以反映其在循环中的丰度,但不能完全反映其动脉粥样硬化潜力。这一论点基于以下几点:
(i) TRLs和残余物的性质、结构异质性和组成变化;
(ii) 目前对TRLs和残余物促进动脉粥样硬化的机制的理解;
(iii) 关于TRL/残余颗粒动脉粥样硬化性的近期遗传学研究证据。
TRL颗粒的结构异质性
TRL包括多种脂蛋白:乳糜微粒和极低密度脂蛋白,以及它们的代谢产物,这些产物是通过脂解作用部分脱脂的颗粒(图1)。它们的直径从乳糜微粒的100纳米以上到极低密度脂蛋白的35纳米不等。这些TRL颗粒类型具有不同的特征:乳糜微粒和肠道产生的极低密度脂蛋白以apoB48短肽作为其主要结构蛋白,而肝脏来源的极低密度脂蛋白则具有全长apoB100。但也有相似之处:它们具有球形结构,甘油三酯在核心,表面是磷脂和少量蛋白质(apoC-II、apoC-III、apoE)(图1)。乳糜微粒和含有apoB48脂蛋白在摄入含脂肪膳食后从肠道组装并释放,而含有apoB100脂蛋白则在激素(如胰岛素)的调控下,肝脏持续产生。相比之下,LDL颗粒具有相对窄的尺寸范围(直径约25纳米)和更简单的结构。非高密度脂蛋白胆固醇(non-HDL-C)通常被用作循环中所有含apoB脂蛋白浓度的指标。它是通过从总血浆胆固醇中减去HDL-C计算出来的,等于TRL/代谢产物胆固醇和LDL胆固醇之和(图1)。
虽然LDL-C的血浆水平全天保持恒定,但随着进食和肠道释放乳糜微粒以及apoB48脂蛋白,以波的形式将甘油三酯输送到利用它作为能量(肌肉)或储存(脂肪组织)的组织,血液中TRL颗粒的浓度会发生很大波动。如图1B所示,随着颗粒的出现和代谢,TRL的组成会发生变化。在单一时间点测量甘油三酯或TRL/代谢产物胆固醇,可以反映循环中颗粒数量的概况,但无法确定具体颗粒类型,也不能完全捕捉这些脂蛋白对动脉壁的累积影响。
显然,采血时间是评估循环中TRL的类型和浓度的重要因素。通常,受试者在禁食12小时后采样,这为甘油三酯测量提供了一种标准化的方法,但最大限度地减少了检测肠道来源的脂蛋白的可能性。有人认为,非禁食状态通常被认为是更好的风险指标,但迄今为止,尚无关于最佳采样时间的一致意见(图1B)。采用标准化、最佳的非禁食采样时间点(例如2小时葡萄糖耐量试验)可能是一个有益的进步,对于具有过度餐后脂血症的受试者尤其相关。例如,2型糖尿病患者会过度产生乳糜微粒和apoB48脂蛋白,以及肝脏产生的apoB100脂蛋白,并且两种脂蛋白的脂解速度减慢(图1B)。结果是TRL/代谢产物在一天内积累,这可能对其高心血管疾病风险有显著贡献,即使在服用他汀类药物治疗下也如此。
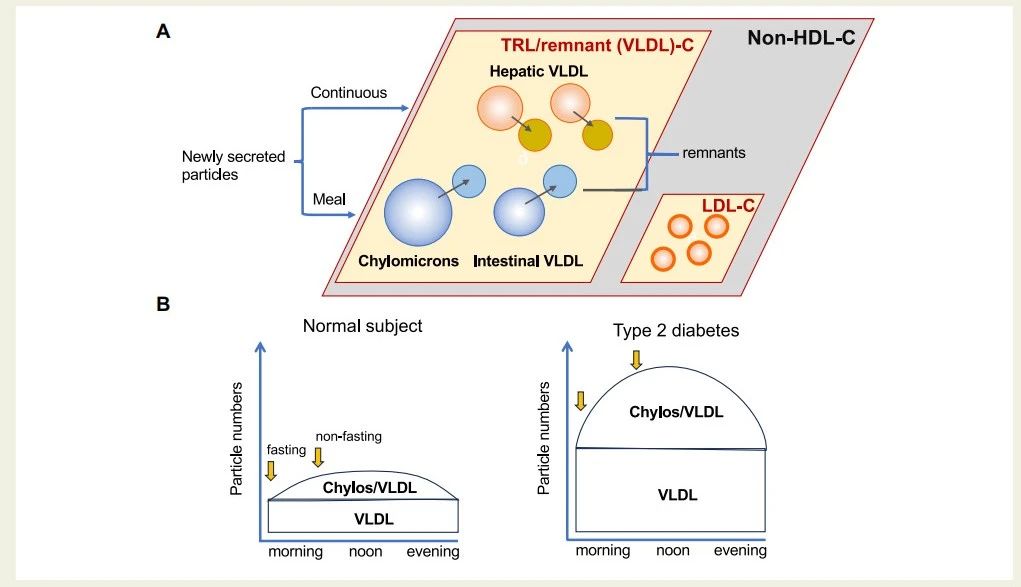
图 1 富含甘油三酯的脂蛋白的异质性和昼夜变化。面板 (A):富含甘油三酯的脂蛋白 (TRL)/残余物包含各种大小和成分的脂蛋白。乳糜微粒和极低密度脂蛋白 (VLDL) 在肠道中产生,以响应富含脂肪的膳食。残余颗粒源于新分泌的乳糜微粒和 VLDL 的脂解。测量的 TRL/残余物胆固醇 (VLDL) 包括所有 TRL 类型 (大菱形) 中的胆固醇。LDL 颗粒更小,更均匀 (小菱形)。非高密度脂蛋白 (HDL) 胆固醇包括 TRL/残余物胆固醇加低密度脂蛋白 (LDL) 胆固醇。面板 (B):每天早餐、午餐和晚餐,富含甘油三酯的脂蛋白颗粒谱系持续变化。乳糜微粒在每次进餐后从肠道释放,并在进食期间积累。通常需要大约 6-8 小时才能将这些颗粒从血液中清除掉。肝脏持续产生 VLDL,其浓度变化不大。2 型糖尿病患者肝脏和肠道产生的富含甘油三酯的脂蛋白过多,且清除效率低下。这导致全天所有富含甘油三酯的脂蛋白类型的显著升高。空腹外评估富含甘油三酯的脂蛋白可以更好地反映颗粒的种类范围,但目前还没有标准化的采血时间。
TRLs和残余物中的胆固醇
所有TRL都含有两种形式的胆固醇:游离胆固醇 (FC),主要位于颗粒表面;以及胆固醇酯 (CE),与甘油三酯 (TG) 一起位于内部“核心”(图2)。当新分泌的乳糜微粒或极低密度脂蛋白 (VLDL) 经脂解后,核心中的甘油三酯 (TG) 被去除,胆固醇酯 (CE) 通过胆固醇酯转运蛋白转移到 TRL 中,随着颗粒变小,核心中的胆固醇酯 (CE) 与甘油三酯 (TG) 的比例增加(图2)。因此,随着 TRL 的代谢,其脂质组成不断变化,影响脂蛋白的理化性质,并可能影响其与动脉壁的相互作用。由于这些扰动,TRL/残余物中 CE 含量或 CE/TG 比可能比总TRL胆固醇更能反映风险程度。
TRL 脂解时还会发生其他成分变化。当从甘油三酯 (TG) 分子中去除脂肪酸时,会形成甘油二酯和甘油单酯,部分保留在 TRL 颗粒中。此外,脂质组学分析表明,TRL 中含有各种脂质,包括神经酰胺和少量磷脂。同样,随着脱脂过程的进行,载脂蛋白的组成也会发生变化。载脂蛋白 B (乳糜微粒和肠道 VLDL 中的 apoB48,肝脏 VLDL 中的 apoB100) 保持不变,但 apoC-II、apoC-III、apoE(以及其他一些较少见的载脂蛋白)数量发生变化。这些载脂蛋白在动脉粥样硬化中扮演重要角色,颗粒中这些载脂蛋白的丰度值得关注。
因此,正方论点首先指出,TRL/残余物组成比LDL更复杂。TRL/残余物成分会随着一天时间和个人代谢状态而变化。如图 2 所示,许多成分可能导致动脉粥样硬化斑块的形成和发展。TRL/残余物总胆固醇(TRL/残余物-C)可能粗略反映这些颗粒的丰度(详见反方论点),但不太可能准确反映其全部动脉粥样硬化影响。
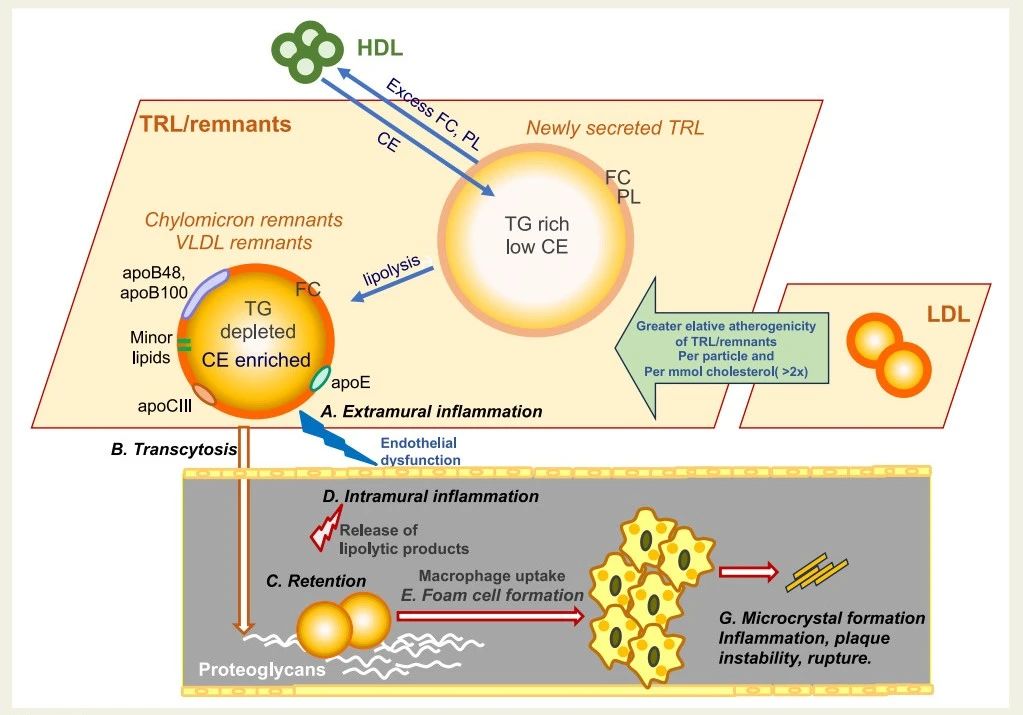
图 2 富含甘油三酯的脂蛋白/残余物与动脉粥样硬化。在甘油三酯丰富的脂蛋白 (TRL) 脂解过程中,游离胆固醇 (FC) 和磷脂 (PL) 从颗粒表面丢失到高密度脂蛋白 (HDL),胆固醇酯则从 HDL 转移到 TRL。研究表明,与低密度脂蛋白 (LDL) 相比,每颗粒和每单位胆固醇含量,TRL/残余物更易引起动脉粥样硬化。TRL/残余物是异质的,其成分复杂,包含可变数量的 FC 和胆固醇酯 (CE)、其他类型的脂质和载脂蛋白。TRL/残余物可能以多种方式与动脉壁在病变形成部位相互作用,例如,直接作用于内皮 (外膜),或经转胞吞、滞留于蛋白聚糖以及壁内脂解 TRL 生物活性脂质。TRL/残余物胆固醇可被局部巨噬细胞摄取,促进泡沫细胞的形成,导致坏死,进而促进病变进展和胆固醇晶体形成。
TRLs和动脉粥样硬化
动脉粥样硬化是由含有apoB的脂蛋白在动脉内膜沉积引起的。脂蛋白必须通过转运穿过内皮才能进入动脉壁(图2)。这种转运途径只能处理直径小于70纳米的颗粒,包括LDL、中间密度脂蛋白和较小的TRL残余物。较大的脂蛋白,如乳糜微粒和大VLDL,不能穿过内皮,导致人们认为这些颗粒不会导致动脉粥样硬化(请参阅关于这一点的反方讨论)。但是,最近的研究表明,内皮细胞可以通过特异性细胞表面受体摄取大的TRL颗粒,并在细胞内降解后释放刺激炎症细胞(例如巨噬细胞)的生物活性脂质。最近两篇论文揭示了TRL与血管疾病之间通过内皮脂滴(LDs)诱导的新机制联系。研究者巧妙地展示了内皮脂滴(LDs)的积累促进了动脉粥样硬化和高血压。这些脂滴抑制一氧化氮的产生,从而抑制内皮舒张,促进血管收缩,导致高血压。此外,内皮脂滴激活NF-κB,导致血管细胞粘附分子-1(VCAM-1)表达增加,进而促进白细胞黏附于内皮细胞,促进动脉粥样硬化和斑块炎症。
然而,内皮细胞间的转运效率很高,但并非动脉壁中致动脉粥样硬化脂蛋白浓度的关键决定因素。相反,脂蛋白在细胞外基质的选择性滞留(图 2)决定了其在潜在病变形成部位的含量。这种滞留是由脂蛋白颗粒上的带正电荷的载脂蛋白B和载脂蛋白E残基与动脉壁细胞释放的带负电荷的细胞外蛋白聚糖之间的离子相互作用介导的。与LDL类似,TRL每个颗粒含有一个载脂蛋白B分子,此外还携带几个载脂蛋白E分子,这提高了TRL残留物与蛋白聚糖的结合力(未发表数据)。
滞留的脂蛋白会诱导多种细胞反应(包括炎症通路),这些反应驱动动脉粥样硬化进展(图 2)。脂蛋白颗粒的组成-包括脂质组和蛋白质组会影响这些反应。因此,不仅动脉壁中含载脂蛋白B脂蛋白的数量,而且它们的特性也会影响动脉粥样硬化风险。
新数据显示,TRL及其残留物的滞留与导致斑块形成和进展的不良反应有关。例如,尽管TG没有直接导致动脉粥样硬化的证据,但其脂解过程中释放的游离脂肪酸会对内皮细胞和单核细胞来源的巨噬细胞产生促炎作用(图 2)。如果TG中饱和脂肪酸多于多不饱和脂肪酸,这种现象就会更严重。动脉壁中的泡沫细胞和平滑肌细胞富含脂酶,其局部分泌可能促进内皮激活和通透性,从而可能促进动脉粥样硬化。
此外,餐后阶段(图 1)TRL 及其残留物的急剧升高会导致血管舒张能力下降、促炎细胞因子增加、内皮炎症加剧以及 VCAM-1 和单核细胞活性增加。这些效应涉及直接和间接的途径。
最后,与LDL相反,TRL含有丰富的apoC-III,它会激活人类单核细胞中的 NLRP3 炎性小体。此外,乳糜微粒和极低密度脂蛋白结合并运输凝血因子VII和X。因此,TRL及其残留物可能还在斑块破裂和血栓形成中发挥作用。
因此,从专业角度来看,第二个观点是,TRL/残留物已被证明对动脉壁有各种潜在的危害,导致动脉粥样硬化斑块的形成和进展。只关注TRL中的胆固醇,暗示我们已经理解了主要致病机理,而实际上,TRL/残留物可能对动脉壁造成多种影响,尤其是在炎症和内皮功能障碍方面。
遗传和流行病学研究的发现
进行了广泛的个体基因和表型研究的大规模人群数据使得我们能够解决原本难以解决的关键问题。就目前的研究而言,一些将脂蛋白胆固醇与心血管疾病风险联系起来的发现值得注意。首先是持续的观察结果,即基因预测的TRL/残余胆固醇变化 (per 1 mmol/L)与心血管疾病的风险高于LDL-C。例如,在最近的研究中,我们在一项多变量孟德尔随机化分析中报告称,TRL/残余胆固醇每增加1mmol/L,其odds ratio为2.59,而LDL-C的odds ratio为1.37。此外,在包含apoB的模型中,TRL/残余胆固醇的基因变异与心血管疾病具有因果关系,而当包含apoB时,LDL-C不再是重要的因果因素。这些结果表明,TRL/残余颗粒的胆固醇含量与LDL相比,风险更高,并且该风险并非仅仅由颗粒数量(即apoB水平)决定,因为每个颗粒都含有一个apoB分子。
我们还报告称,当影响脂质的基因变异按其对TRL/残余物和LDL的影响大小分类时,导致TRL/残余物与LDL比率更高的变异与apoB每单位增加(即每颗粒数量)的心血管疾病风险增加两倍有关(图2)。
扩展这种方法,我们最近证实,正如预期的那样,每mmol/L的非HDL-C携带的风险会因TRL/残余C的比例而异(图1)。TRL/残余物导致动脉粥样硬化的风险大约是LDL的4倍。因此,随着TRL/残余物相对于LDL的丰度增加,apoB每单位变化或每mmol/L non-HDL-C的风险也会增加。
第三点支持正方观点的是,基因研究表明,TRL/残余物的动脉粥样硬化性不仅仅在于这些颗粒的胆固醇含量。TRL/残余物中相同量的胆固醇与LDL中相同量的胆固醇相比,其心血管疾病风险更高,并且TRL变异与炎症生物标志物具有因果关系,而LDL则没有,这与TRL/残余物除了胆固醇含量外,还有其他因素导致其与心血管疾病风险更强相关这一概念相符。
总结
TRL极易导致动脉粥样硬化,并对接受降LDL药物治疗的个体产生剩余风险。因此,为了决定合适的后续降脂方案,准确、精确地评估这一心血管疾病风险因素至关重要。
从正方角度来看,测定血浆TG(空腹或非空腹)可以作为TRL丰度的替代指标,但已知TG本身不被认为是动脉粥样硬化的促成因素。TG不会在动脉壁中沉积。TRL/残余胆固醇可能是一个更相关的生物标志物,正如反方观点所述,因为胆固醇是动脉粥样硬化斑块中的主要脂质。许多临床实验室会报告TRL胆固醇,因为它是由血浆TG计算得出的,不能提供心血管疾病风险的额外预测信息。应该直接测定TRL和残余物的胆固醇含量,这可能比TG更能反映风险的生物标志物。
然而,代谢、病理和遗传证据都支持以下观点:TRL/残余胆固醇并不能完全反映TRL的动脉粥样硬化潜力,需要进一步研究,开发更能反映人群和个体风险的指标。正如此处及其他文献所述,其他可能的生物标志物包括TRL/残余CE/TG比率,apoC-III含量,或微量脂质或蛋白质的浓度。
对反方观点的回应
文章的反方部分论述了将乳糜微粒/极低密度脂蛋白残粒中的胆固醇作为生物标志物和治疗目标的观点。我们认为,目前过早地采用这一范式。因为我们对乳糜微粒/极低密度脂蛋白残粒与动脉粥样硬化性心血管疾病之间关系的理解仍然不够深入。

残余胆固醇是动脉粥样硬化的致病因素,而甘油三酯不是
胆固醇,是动脉粥样硬化发展的致病因素,而不是血浆甘油三酯(TG)本身。事实上,化学分析表明,胆固醇分子沉积在动脉内膜的动脉粥样硬化斑块中,而甘油三酯(TG)分子则几乎不存在(图1)。(正方部分也有提到)动脉粥样硬化斑块呈黄色,这是大量融合的胆固醇沉积物造成的,包括酯化胆固醇晶体。当富含胆固醇和甘油三酯的脂蛋白(残余物)从动脉管腔穿过内皮细胞层进入内膜时,残余甘油三酯和残余胆固醇都会进入内膜。
然而,动脉内膜中的甘油三酯(TG)会降解为游离脂肪酸和单酰甘油,这可能是脂蛋白脂肪酶(LPL)介导的水解,也可能是残余物被巨噬细胞摄取和降解后发生的。
相反,大多数人体细胞缺乏降解胆固醇的酶,因此胆固醇会在动脉内膜中积累,导致富含胆固醇的动脉粥样硬化斑块形成(图1)。大多数人内膜胆固醇沉积主要由升高的低密度脂蛋白胆固醇(LDL-C)引起,但在一些人中,升高的残余胆固醇(remnant-C)也有显著贡献。
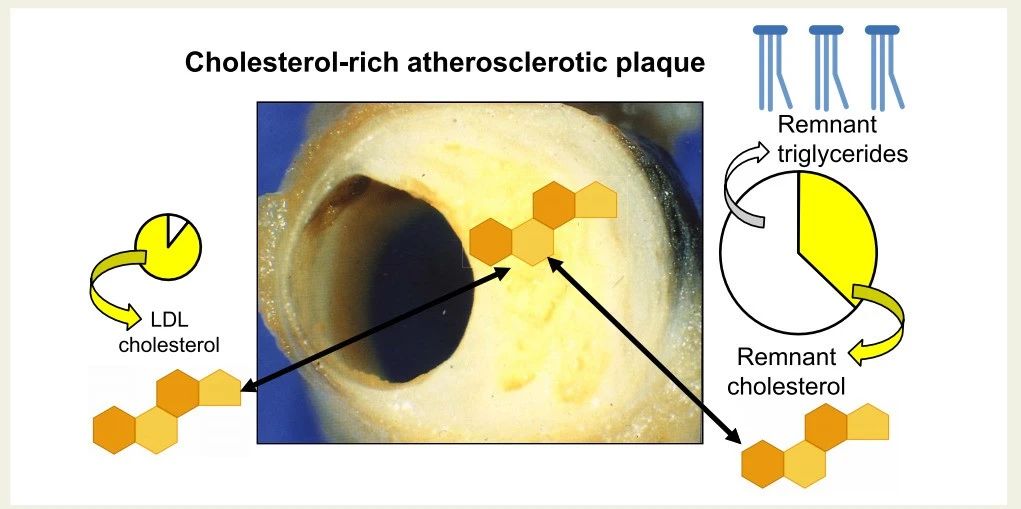
图1. 人类动脉中的动脉粥样硬化斑块含有大量的胆固醇,但甘油三酯含量极少。低密度脂蛋白及其残余物进入动脉内膜后,无法被内膜中的巨噬细胞和其他细胞降解,因此最终积累并导致动脉粥样硬化斑块的形成。相比之下,甘油三酯可被内膜细胞降解,因此不会增加动脉粥样硬化斑块的体积。LDL,低密度脂蛋白。
但是,如何将这一病理发现与来自人类非常大规模的流行病学和遗传研究的强有力证据联系起来?解释很简单,但临床医生和研究人员并不十分了解。一种说明方法是比较人类肺癌和心肌梗死风险研究的平行结果(图2)。
肺癌是由长期吸入香烟烟雾中充满有毒颗粒的空气引起的(图2)。当肺组织暴露于吸入的有毒颗粒时,肺部的一些细胞可能会发生突变并发展为肺癌。人类流行病学研究表明,吸烟暴露程度越高,肺癌风险越高。然而,吸烟支数与香烟盒数正相关,因此香烟盒数与肺癌风险也存在明确的相关性。当然,并非香烟盒数本身会增加肺癌风险,而是吸烟的支数。(图2)
类似地,动脉粥样硬化(导致心肌梗死和动脉粥样硬化性心血管疾病(ASCVD))是由non-HDL-C水平升高引起的,即LDL-C和残余胆固醇(remnant-C)的总和(图2)。进入动脉内膜后,LDL和残余物被巨噬细胞摄取并部分降解。由于大多数人体细胞缺乏降解胆固醇的酶,胆固醇会在内膜的巨噬细胞中积累,并将它们转化为富含胆固醇的泡沫细胞——这是动脉粥样硬化斑块的标志。
然而,残余物也含有甘油三酯(极低密度脂蛋白[VLDL]甘油三酯或残余甘油三酯),这与残余胆固醇(VLDL-C)的数量密切相关。因此,较高的残余甘油三酯(约等于血浆甘油三酯)也与心肌梗死风险增加相关,但关联性不如较高的残余胆固醇(remnant-C)强。人类介导分析表明,高残余胆固醇解释了与升高的含apoB脂蛋白相关的半数心肌梗死风险,而高残余甘油三酯则无法解释任何风险。总而言之,残余胆固醇很可能是动脉粥样硬化和ASCVD的主要原因,而非残余甘油三酯。
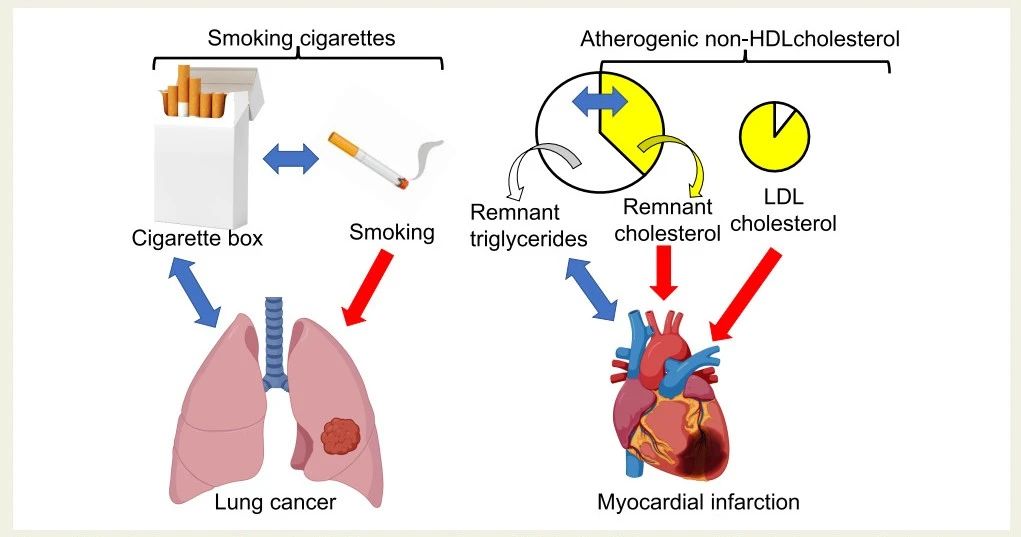
图2. 肺癌和心肌梗死风险的因果及非因果因素。对于肺癌(左部分),吸烟是肺癌的直接原因,而个人购买的香烟盒数量则是一个无辜的旁观者。同样地,升高的残余胆固醇(与低密度脂蛋白胆固醇共同作用)是心肌梗死和动脉粥样硬化性心血管疾病的直接原因(右部分),而升高的残余甘油三酯(≈血浆甘油三酯)则是一个无辜的旁观者。LDL,低密度脂蛋白;HDL,高密度脂蛋白。
人类遗传脂质表型
这些表型有助于理解血浆甘油三酯严重升高的高乳糜微粒、血浆胆固醇严重升高的低密度脂蛋白,以及血浆胆固醇和甘油三酯均严重升高的高残余物,是否为动脉粥样硬化、心肌梗塞和心血管疾病的直接原因(图3)。由于这些表型主要由遗传驱动,且根据孟德尔随机化原理,没有混杂因素和逆向因果关系,因此可以推测不同脂蛋白在每种疾病中的因果关系。
家族性乳糜微粒血症(图3,中间部分),发生率约为百万分之一左右,其特征是血浆甘油三酯水平严重升高,这是由于血浆中存在许多大型乳糜微粒所致。乳糜微粒也运输胆固醇,血浆甘油三酯达到100 mmol/L(88 000 mg/dL),血浆胆固醇可能高达10 mmol/L(386 mg/dL);然而,该疾病的临床原因是血浆甘油三酯的严重升高。因为乳糜微粒直径超过75纳米,所以它们太大,进不了动脉内膜,因此,乳糜微粒不会引起动脉粥样硬化和心血管疾病(ASCVD)。相反,家族性乳糜微粒血症会显著增加急性胰腺炎的风险,这可能是因为乳糜微粒进入胰腺组织,在那里局部产生的脂肪酶把甘油三酯分解成对组织有害的游离脂肪酸和单酰甘油,从而导致局部炎症和急性胰腺炎。
总之,对于具有家族性乳糜微粒血症临床表型的人,血浆甘油三酯的严重升高不会导致动脉粥样硬化和心血管疾病(ASCVD),因为甘油三酯携带在太大而无法进入动脉内膜的大型乳糜微粒中。
相反,家族性高胆固醇血症(图3,左侧部分)的特征是血浆胆固醇升高,这是由于低密度脂蛋白胆固醇(LDL-C)升高所致,这导致动脉粥样硬化、心肌梗塞和心血管疾病加速发展。杂合子家族性高胆固醇血症在全球每300人左右就有一个患病。人们一直明白,血浆LDL-C升高会导致动脉粥样硬化。这些临床发现代表了理解血浆LDL-C升高是动脉粥样硬化、心肌梗塞和心血管疾病直接原因的支柱之一。
家族性残余物高脂血症(混合性脂蛋白血症)(图3,右侧部分)代表着类似的清晰临床观察,表明残余物升高是动脉粥样硬化、心肌梗塞和心血管疾病(ASCVD)的直接原因。临床医生和研究人员可能不太了解这一点,这可能是因为这种情况相对罕见,并且许多临床医生没有识别出来。在家族性残余物高脂血症患者中,血浆胆固醇和甘油三酯均升高,而血浆LDL-C和乳糜微粒水平则较低。残余物就像低密度脂蛋白一样,进入动脉内膜,并导致动脉粥样硬化和心肌梗塞以及心血管疾病加速发展,其程度与家族性高胆固醇血症相似(图3中右侧和左侧部分)。
因此,如果LDL-C或残余物胆固醇遗传性升高,就会导致动脉粥样硬化、心肌梗塞和心血管疾病。但只有乳糜微粒和严重高甘油三酯遗传性升高时,动脉粥样硬化、心肌梗塞和心血管疾病几乎不会发生或发生得非常轻微。
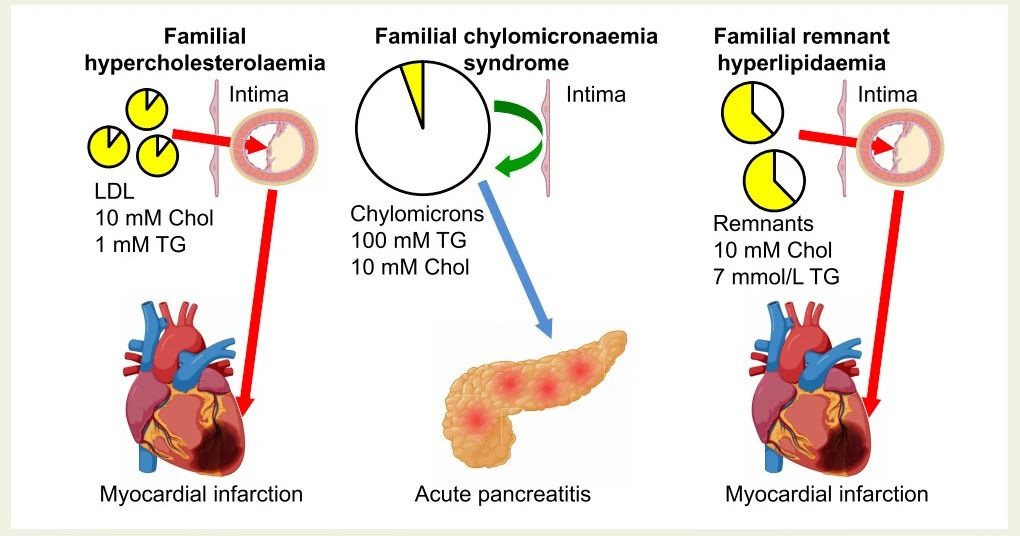
图3. 人类遗传脂质表型与动脉粥样硬化和心肌梗死发展的关系。由于这些人类遗传脂质表型由不受混淆因素和逆向因果关系影响的遗传变异驱动,因此这些条件说明了低密度脂蛋白、乳糜微粒和残余物水平升高分别导致心肌梗死和动脉粥样硬化性心血管疾病的风险。LDL,低密度脂蛋白;mM,mmol/L;Chol,血浆胆固醇;TG,血浆甘油三酯。要将胆固醇值转换为mg/dL,需将mmol/L中的数值乘以38.6。要将甘油三酯值转换为mg/dL,需将mmol/L中的数值乘以88。
流行病学
流行病学研究表明,在基于人群的研究中,血浆甘油三酯水平和甘油三酯残留物水平升高均与冠心病风险增加密切相关,这仅仅是因为这两个指标高度相关。所以,这对于服用他汀类药物和未服用药物的个体都适用。因此,流行病学证据无法清晰地确定是甘油三酯水平本身还是甘油三酯残留物水平本身导致动脉粥样硬化和冠心病。在来自68项前瞻性长期研究的302,430名初始未患血管疾病的个体中,一项荟萃分析显示,血浆甘油三酯水平升高与冠心病和缺血性中风风险显著相关,但在校正脂蛋白胆固醇含量后(包括甘油三酯残留物),这种关联性完全消失。
性别特异性差异
性别差异方面,从20岁到80岁,女性的甘油三酯(以及甘油三酯残留物)水平始终低于男性,这部分原因是男性通常饮酒更多。然而,对于相同水平的甘油三酯和甘油三酯残留物,女性和男性冠心病和死亡风险增加程度相似。
其他遗传学证据:孟德尔随机化研究
在基于人群和患者的队列中,孟德尔随机化研究表明,升高的残余物(富含胆固醇和甘油三酯的脂蛋白)与冠心病风险增加具有因果关系,且与HDL-C和LDL-C水平无关。这些研究通常用血浆甘油三酯、残余物胆固醇或载脂蛋白B来标记残留物。因此,在孟德尔随机化研究中,与流行病学研究一样,难以明确是甘油三酯本身还是甘油三酯残留物是动脉粥样硬化、心肌梗塞和冠心病的原因。然而,这些研究清楚地表明,残留物水平升高会加剧动脉粥样硬化、心肌梗塞和冠心病。
机制
当残余物进入动脉内膜时,它们会被巨噬细胞摄取而无需任何修饰。随后,残余物中的甘油三酯、磷脂和蛋白质被降解,而胆固醇保持未降解并累积在泡沫细胞中形成的胆固醇液滴内。最终,大量的细胞内胆固醇积累导致泡沫细胞死亡,从而在斑块中形成大范围的富含胆固醇的物质(图 1 中内膜的黄色部分)。一些甘油三酯分子在内膜中被脂蛋白脂肪酶降解为有害游离脂肪酸和单酰甘油,这可能发生在残留物被巨噬细胞摄取之前,这有可能引发局部炎症,从而将稳定的动脉粥样硬化斑块转化为易发生破裂的斑块,导致心肌梗死或卒中。更多细节请参阅正方部分。
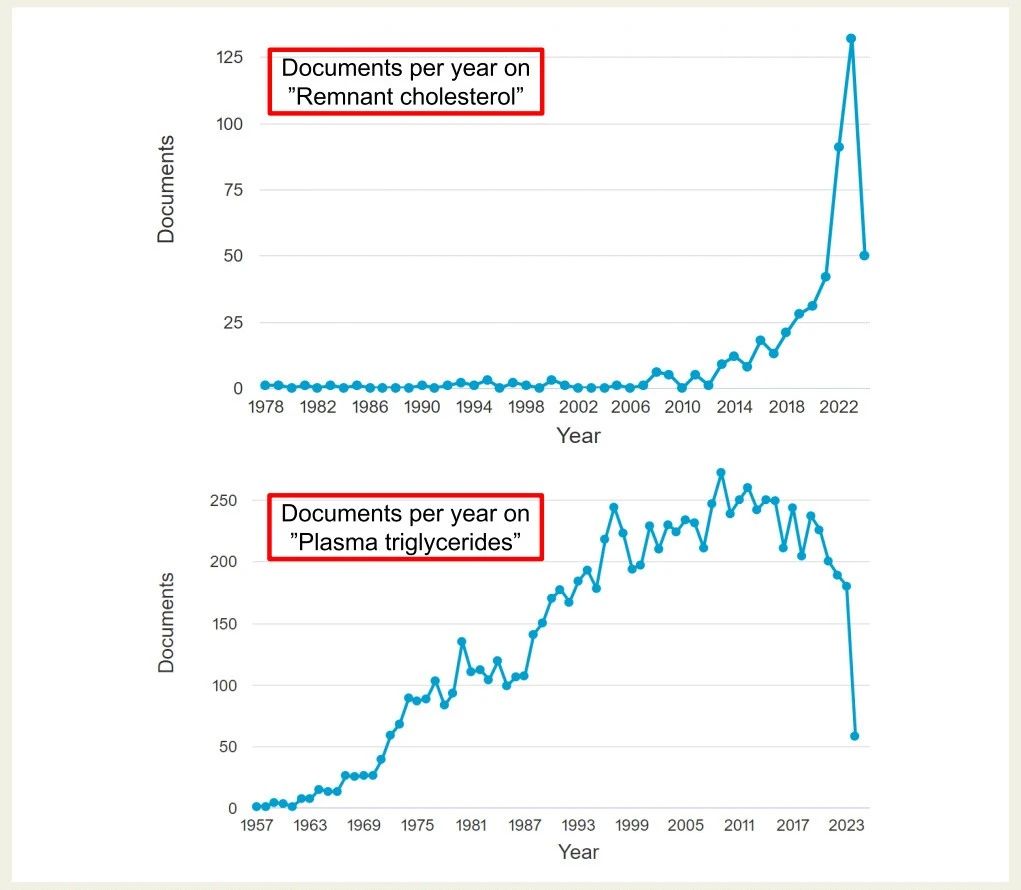
图4. 每年发表的关于残余胆固醇和血浆甘油三酯的文章数量。基于Scopus中的检索。注意两个面板的X轴和Y轴的刻度不同。
为什么临床重视血浆甘油三酯?
标准脂质谱一直包括血浆甘油三酯,这意味着关注心血管风险的医生和患者会将该值与血浆总胆固醇、LDL-C和HDL-C水平一起查看。为了将心血管风险评估的重点从血浆甘油三酯转移开,标准脂质谱还应报告脂蛋白残粒胆固醇和非HDL-C水平,两者都能从常规脂质谱计算出来,实验室一般不额外收费。脂蛋白残粒胆固醇是总胆固醇减去LDL-C减去HDL-C,而非HDL-C是总胆固醇减去HDL-C。
然而,血浆甘油三酯值对于评估患者急性胰腺炎发作风险很重要。有趣的是,近年来,提到“脂蛋白残粒胆固醇”的论文数量显著增加,而血浆甘油三酯的关注度则略有下降(图4)。
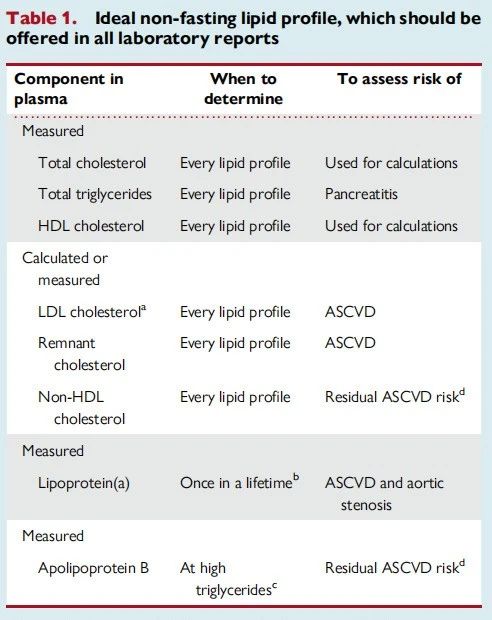
理想的脂质谱
因此,实验室报告中的理想的脂质谱应该包含这六项指标:血浆总胆固醇、甘油三酯、HDL-C、LDL-C、脂蛋白残粒胆固醇和non-HDL-C(表1)。目前,哥本哈根的所有医院都已全面实施,丹麦其他地区也很快将实施,这是2016年以来欧洲动脉粥样硬化协会和欧洲临床化学及实验室医学联合会建议的标准。此外,值得注意的是,脂质谱应在非空腹状态下获得,更能反映患者24小时内动脉暴露的平均脂蛋白残粒胆固醇水平;重要的是,血浆甘油三酯和脂蛋白残粒胆固醇值在非空腹状态下分别比空腹状态高0.3 mmol/L(26 mg/dL)和0.2 mmol/L(8 mg/dL)。
此外,应在每个人的一生中至少测量一次血浆脂蛋白(a)(表1),最好在首次心血管风险评估的脂质谱检查中一并进行。或者,对于有此类风险的患者,下次脂质谱检查中可以包含脂蛋白(a)测量。
最后,对于正在接受充分的LDL-C降解治疗的患者,除了六成分脂质谱外,还应进行血浆载脂蛋白B的测量,以评估剩余心血管疾病风险(表1)。这在甘油三酯升高、脂蛋白残粒胆固醇升高和/或non-HDL-C升高的患者中尤其重要。
表1. 理想的非空腹血脂报告
“富含甘油三酯的脂蛋白”的误称
由于残余物含有大量胆固醇和甘油三酯,所以,应该把这些颗粒叫做‘富含胆固醇和甘油三酯的脂蛋白’。而“富含甘油三酯的脂蛋白”一词显得甘油三酯含量过高。如果重点是残余物作为动脉粥样硬化和心血管疾病病因的重要性,最好使用“残余胆固醇”一词,类似于“LDL-C”,两者都说明最终导致动脉内膜胆固醇积累、动脉粥样硬化斑块形成和心血管疾病的是这两种颗粒的胆固醇含量。
对正方部分的回应
正方部分的所有论点都是成立的;然而,它们共同描绘了一幅复杂的图景,让阅读PRO部分的读者觉得我们对残余物是否以及如何导致动脉粥样硬化和心血管疾病的机制了解不多。而事实并非如此,正如正方部分所解释的那样。相反,大量证据表明,高残余胆固醇独立于LDL-C水平,会增加心血管疾病的残余风险。着重于复杂性会使大多数临床医生感到困惑,而侧重于降低残余胆固醇来降低残余心血管疾病风险(类似于降低LDL-C)的简单性则易于理解和在临床实践中实施。
参考资料
Borén J, Packard C, Nordestgaard BG, Catapano AL. Great debate: Plasma triglycerides are an important causal factor and therapeutic target for atherosclerotic cardiovascular disease. Eur Heart J. Published online April 11, 2025. doi:10.1093/eurheartj/ehaf214


