miRNA与心脏发育和心脑血管系统疾病(一)历史回顾
- boke
- 2024-10-30
- 4:02 下午
一
lin-4在1993:第一个miRNA的发现
lin-4是人类发现的第一个miRNA。它是在1993年被“正式”发现的(那时候它还没有被命名为miRNA)。但故事还得从1984年讲起。那时候,作为lin-4两个发现者之一,当Ambros还在美国麻省理工学院Horvitz教授的实验室工作时,他们在研究秀丽隐杆线虫(Caenorhabditiselegans)的异时性发育(heterochronic;组织器官时序性发生发展)的调控过程时就发现若干基因的突变会导致线虫异时性发育异常或缺陷,而其中一个基因叫做lin-14(一个蛋白编码基因)。
有趣的是,lin-14的表达与之后发现的lin-4miRNA在幼虫发育过程中表现出完全相反的时序性趋势,这一发现被发表在Science杂志上。三年后,也就是1987年,Ambros和Horvitz再次联名发表了一篇关于lin-14在确定线虫胚后发育时序性中所发挥的关键性作用。从此,lin-14在线虫发育中的功能就算是被确认了。
这对于发现lin-4这个在日后声名鹊起的miRNA是至关重要的一步。这就好比抛砖引玉,“抛出”lin-14这块“砖”、引来lin-4这块“玉”。有意思的是,在同一年,Horvitz与另外一名研究者Ferguson又在Nature杂志发文,揭示了lin-14基因无效突变能够造成线虫发育表型变异,而发生在lin-4基因上的一个抑制因子的突变却能够纠正这种发育变态。也就是说,lin-4能够对lin-14基因施加负性调节作用。这时候,Ruvkun(作为lin-4两个发现者中的另外一位)加盟了Horvitz的研究团队,与Ambros共同承担了克隆lin-14的科研课题。
然而,lin-4对lin-14调节功能的发现激起了Ambros对lin-4的强烈兴趣,这也促使他没多久之后就与Ruvkun“分道扬镳”,各自独立地从事对lin-4和lin-14的研究工作:Ambros的目光聚集于lin-4并附带研究lin-14,而Ruvkun的精力则放在lin-14并附带研究lin-4。
于是乎,这边Ambros的研究团队开始克隆lin-4基因,分离出一段700bp的核苷酸,此序列确保了lin-4的完整功能,因此推断其包含了lin-4的编码基因。但问题是,此序列却没有包含公认的启动和终止密码子,亦即没有明显的蛋白编码区。这些结果令他们困惑。为了弄清楚这段核苷酸中假定的lin-4基因到底是个什么基因,他们决定在假定的开放阅读框(ORF)内引入移码突变。
如果lin-4基因是个蛋白编码基因,此突变应该会使lin-4功能丧失。但结果是:这样的突变并没有改变lin-4的功能。更深的困惑袭上心头!
或许是天意如此,Ambros在百思不得其解的时候,读到了一篇颇具启发性的论文,这篇文章是天然反义核苷酸(atRNA)的研究结果。该论文阐述了atRNA能够与mRNA特异性的互补结合可抑制蛋白翻译的现象。
据此,Ambros大胆地提出:lin-4是一个不编码蛋白质的基因,lin-4是以RNA的形式存在并发挥其基因调节的功能作用。的确,他的团队在1992年运用核糖核酸酶保护技术发现了两个非常小的lin-4RNA片段:一个长度为61nt(相当于pre-lin-4),另一个才22nt(成熟lin-4)。他们的科研成果于1993年发表在全球顶级科学杂志Cell上。
另一边,Ruvkun领导的研究团队发现lin-14的蛋白水平在线虫发育过程中出现了时间梯度变化,这种随发育的进程其表达水平逐渐下调的现象是发生在转录后水平调节的结果,而且是由于lin-4作用于lin-14 mRNA 3′ UTR中多个序列位点所造成的,因为lin-14的两个功能获得性突变(gain-of-functionmutation)正是发生在其3′ UTR。他们进一步揭示:lin-14 3′ UTR是保证这种调节机制的必要条件(或者说,lin-4对lin-14蛋白的负调控要求后者具有一个完整的3′UTR,只有具有完整3′UTR的lin-14mRNA才能被lin-4所调节,从而抑制lin-14蛋白质的表达。lin-14 3′ UTR的这个功能在秀丽隐杆线虫(C.elegans)和秀丽广杆线虫(C.briggsae)之间是保守的;在lin-14 3′ UTR的保守序列中有7个位点与lin-4序列呈反义互补。这些成果也于1993年发表在Cell杂志上,与Ambros发表在Cell上的文章在同一期出现。
私下里,Ambros和Ruvkun这两位科学家一直保持着科研信息的“互相切磋、互通有无”。这样的交流使得他们能够在1992年6月不谋而合地得出了一个同样的结论:非编码RNAlin-4与蛋白编码基因lin-14的RNA 3′ UTR序列反义互补,lin-4通过与lin-14 3′ UTR的相互作用而调节后者的表达水平。
于是乎,一个崭新的思想诞生了!一个生物体内隐藏几十亿年的奥秘被揭示了!一个新型的基因表达调控机制被阐明了:非编码基因调控蛋白编码基因,ncRNA调控mRNA。这个思想在他们各自于1993年发表在Cell杂志上的里程碑式的论文中展现出来。
令人不无叹息的是:这一重大的科研发现和科学思想在之后的7年中竟遭到了科学界的“冷落”。直到第二个miRNA let-7的发现,“星星之火”才又重新燎原起来。值得提醒的是:lin-4其实早在20世纪70年代就被著名的科学巨匠Sydney Brenner(siRNA研究领域大咖,2002年诺贝尔生理学或医学奖获得者)所领导的实验室首先发现。80年代人们就已经阐明了其在幼虫发育方面的调节作用。时隔近20年,科学家们才弄清楚lin-4原来只是个长度不过22nt的ncRNA。
二
let-7在2000:第二个miRNA的发现
或许是因为lin-4只在线虫体内表达,而没有在更高等的动物体内找到其“芳踪”,lin-4的发现在当时显然并没有抓住人们的眼球。在之后的7年中也没有获得应有的重视:没有其他科学家跟进研究这类小小的基因调控RNA。这种现状一直到2000年人类发现的第二个miRNA ——let-7(lethal-7)走入人们的视线之后才得到改变。
有趣的是,将let-7带入“人世”的科研团队还是Ruvkun所领导的实验室。他们的研究发现:let-7与lin-4类似,也是一个时序性基因(heterochronicgene;表达水平随个体发育而逐渐变化)。
其序列长度为21nt,控制着线虫由晚期幼虫(L4期)向成虫转化的发育过程。let-7功能缺失导致成虫再现幼虫的细胞性状;相反,let-7功能增强造成幼虫出现早熟表型。更重要的是,这些研究者发现let-7可以对lin-41基因施加负性调节作用,抑制let-7能够部分缓解由于lin-41功能缺失突变所造成的表型。而且,lin-41 3′ UTR存在两个let-7反义互补序列位点,将此位点切除,或者给let-7序列引入突变,都可以消除let-7对lin-41的抑制性调节作用。与lin-4最大的不同点是:let-7在序列上从果蝇到人类都是保守的(包括脊椎动物、海鞘、半索动物、软体动物、环节动物、节肢动物等),但植物和单细胞生物体不含有let-7基因序列。现在我们知道,let-7是miRNA亚家族中的一个家庭,至少包括12个成员,它们的5′末端具有同样的核苷酸序列(这个区域被称为“种子位点”,是决定miRNA靶基因特异性及转录后基因表达调节的关键区域),而只在3′末端有微小的差异。
三
miRNA在2001:miRNA时代的开启
如果说lin-4的发现是miRNA研究领域的一个开创性的发现,那么,let-7的发现就是一个转折性的、变革性的发现,它激发了人们对这类小分子调节性RNA的研究兴趣。
在短短一年之后的2001年,三篇划时代的关于miRNA的科学论文同时发表在同一期的Science杂志上。Tuschl的研究团队发现:类似于lin-4和let-7这样的ncRNA也存在于无脊椎动物和脊椎动物细胞,而且高度保守,预示着序列特异性的转录后基因调节机制的普遍存在。Bartel的研究团队报道了在秀丽线虫中发现的55个新miRNAs,证实了其中几个线虫miRNAs在果蝇和人体组织中的表达,并首次揭示了若干个let-7亚型共处一个基因簇(cluster)的表达机制。类似地,Ambros的研究团队也报道了在秀丽线虫中发现的15个新miRNAs,并在人体和昆虫中发现了同样的miRNA序列。
这三篇论文的发表标志着miRNAs研究领域的真正兴起。一时间,miRNA登上生命科学研究的前台,成为科学新星”。从那一刻起,miRNAs才被科学界当作是一类独特的基因表达调节分子、一个与众不同的ncRNA亚家族。miRNAs的研究热潮也从此迅速席卷了全球各大学和科研机构,覆盖了生命科学的各个领域。
2024年10月7日诺贝尔生理学或医学奖授予两位美国科学家维克托·安布罗斯(Victor Ambros)和加里·鲁夫昆(Gary Ruvkun)。

四
miRNA与心脏发育和心脑血管系统疾病
第一篇关于miRNA与心血管系统关系的科学论文由Srivastava的研究团队于2005年发表在Nature杂志上。与lin-4和let-7巧合的是,这篇文章也是关于miRNA在器官发育中的作用。
作者发现肌肉特异性表达的miR-1在小鼠心脏发生中维持心肌细胞分化和增殖平衡方面起着重要作用。同年,同一研究室又在PNAS上发表了一篇结论相同的关于果蝇心脏发育的文章。紧接着在2006年,王大之的研究团队在Nature Genetics报道miR-1促进心脏肌肉分化,而另一个肌肉特异性miRNA miR-133则刺激成肌细胞增殖。
如果以上工作首次揭示了miRNA在心脏发育中的意义,那么之后发表的文章就建立了miRNA在心血管疾病发生发展中的作用。
这个领域的“大咖”Olson终于在2006年出场了。他的研究团队发表了第一篇关于miRNA(特别是miR-195)在心肌肥厚和心力衰竭病理过程中的调节作用。Olson团队的开创性工作引领了miRNA与心血管疾病研究新潮流。
之后的四年中(2007—2010年),这个研究领域就如同一个巨浪拍着另一个巨浪地精彩迭出。可以说,最具有创新性的里程碑式的发现大多是在这个时期涌现出来的。
2007年,Nature Medicine先后发表了两篇颇具轰动性的论文,一篇来自于哈尔滨医科大学杨宝峰的研究团队,另一篇发自意大利Condorelli的实验室。
前者的工作首次揭示了miRNA在心肌电生理及心律失常方面的作用。杨宝峰的团队发现miR-1在心肌梗死组织过表达,这样的过表达显著抑制Kir2.1钾离子通道基因KCNJ2以及connexin-43缝隙连接通道基因GJA1的表达,并因此而造成心肌细胞膜异常去极化、心脏兴奋传导受阻,最后导致室性心律失常的发生。这项发现被科学界一致认为是具有创新性和影响力的工作,是医学研究领域的一大突破,开辟了miRNA调控心肌兴奋性和电生理活动的一个新分支。miR-1对心脏传导的调节被Srivastava实验室在同年发表于Cell杂志的文章所证实。

一些miRNA还可以与非Argonaute(非Ago)蛋白相互作用,即所谓的miRNA结合蛋白(miRBPs),它们可以与Ago蛋白合作或竞争,从而增强或沉默其靶分子上的miRNA功能。实例分别包括miR-1和TNRC6B miRBP,以及miR-21和PDCD4 miRBP[1]。
Condorelli实验室在2007年Nature Medicine上发表的文章揭示了miR-133的抗心肌肥厚作用及其调节与心肌肥厚相关基因的功能。
张春祥和王大之两个独立的研究团队也在这一年证实了miRNAs在心肌肥厚病理过程中的调节作用,并且特别强调了后来名声大震的miR-21的作用。
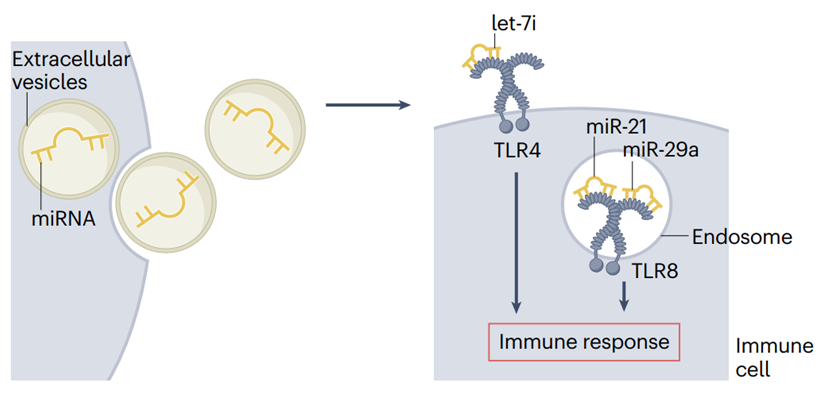
miRNA可以通过细胞外囊泡分泌并充当激素,从而充当细胞内通讯的介质。在免疫细胞上,miRNA可以直接靶向Toll样受体(TLR),作为其配体,进而激活TLR信号通路并诱导免疫反应。例如,let-7i可以靶向TLR4,而miR-21和miR-29a可以靶向TLR8[1]。
除了电生理活动以外,心脏的另一个最重要的特性就是机械收缩活动,而两者的联结就是所谓兴奋-收缩耦联(excitation-contractioncoupling),它决定着心脏的泵血功能。
2007年,Olson的团队从一个α-肌球蛋白重链基因亚型(α-MHC)的内含子(intron)中分离出一个心肌特异性的miRNA miR-208,并发现其在应激反应中对心脏重构、心肌肥厚及纤维化起着不可或缺的作用。特别是,miR-208被证明是控制心肌收缩力及兴奋-收缩耦联的关键性的调节分子。
两年后,Olson团队又在另一个α-MHC基因的内含子分离出另一个心肌特异性的miRNA:miR-499。之后,李培峰团队揭示miR-499在调控心肌线粒体功能及其相关的细胞凋亡方面起着关键性的作用。
miRNA调节血管生物学特性和生理病理过程的研究分支是从张春祥团队的工作开始的。
2007年,张春祥实验室报道了受损血管壁平滑肌组织的miRNA表达谱,同时揭示了miR-1在新生血管内膜病变形成中的作用。之后,他们又继续报道了其他miRNAs在调节血管功能和病理过程中的作用。
一年后(2008年),Srivastava和Olson两个团队也分别报道了miR-126对血管完整性和血管再生(angiogenesis)的调节功能。
2009年,Srivastava又进一步发现miR-145和miR-143在调控平滑肌细胞命运(生存和死亡)和可塑性方面的作用。他们的科研结果表明miRNA参与了动脉粥样硬化发生和发展过程的调节。
2008年,Srivastava的研究团队发现miR-1和miR-133两者都能够促进小鼠中胚层的形成,但在调节心肌祖细胞(cardiacprogenitorcell)形成方面却表现了相反的作用,而它们的作用都是通过调节胚胎干细胞分化来实现的。这是第一篇关于miRNA调节干细胞与心脏形成关系的文章。
miRNA在细胞生物学方面的功能不仅仅体现在它们对干细胞分化和增殖的调节,也不仅仅局限于它们对心肌生长(肥厚)的调控,它们同样对心肌细胞死亡和心肌纤维化起着极其重要的作用。
余细勇的研究团队在2008年发现miRNA参与了心肌细胞凋亡的调控,他们报道miR-1过表达能够通过作用于靶基因IGF-1而促进心肌凋亡。miRNA的这个功能很快就被张春祥的团队所证实。所不同的是,他们发现miR-21具有抗凋亡作用。
在一年以后的2009年,这个团队和另一个实验室分别报道了抗凋亡miRNA在心脏缺血再灌损伤中对心肌生存的保护作用和对心脏功能的改善效应。
也是在2008年,Olson的研究团队首次报道了miR-29在心肌梗死组织中调节心室肌纤维化的发现。
紧接着在2009年,Roy等也发表了关于miR-21在缺血心肌调节心室肌纤维化的文章。同年,哈尔滨杨宝峰的团队报道了miR-133和miR-590对心房肌纤维化的调节及其在心房重构中的作用,以及miR-101对缺血心室肌纤维化的抑制作用。
在杨宝峰团队的这篇论文中,研究人员还发现miR-133和miR-590的表达下调促进了心房肌纤维化,从而介导尼古丁诱发的心房颤动。在此之后,哈尔滨团队又相继揭示了miR-328(2010年)和miR-26(2013年)在心房颤动方面的调控作用,进一步将miRNA与心肌电生理研究推向了一个新的阶段。
最后不得不提到的是关于临床用药对miRNAs表达的调节,或者说是miRNA介导药物药理作用的机制。杨宝峰研究团队在2009年就首次报道了尼古丁抑制miR-133和miR-590表达的药理作用,并以此为分子机制而诱发房颤。同一年,他们又发现:丹参滴丸的主要成分TanshinoneⅡA能够通过抑制miR-1表达而保护心脏免受猝死的威胁。之后在2010年,这个团队又进一步发现:β-受体阻断剂普萘洛尔(β-blockerpropranolol)也能够通过下调miR-1来显现其在心肌梗死中对心脏的保护作用。此外,miR-133也具有介导临床用药药理作用的特性。同样,临床上用于治疗稳定型心绞痛的伊伐布雷定(ivabradine)也被发现具备上调miR-1和miR-133来实现心肌保护作用的药效。
如上文所述,杨宝峰的研究团队率先报道了关于血浆miR-1作为急性心肌梗死生物标志物的发现,以及几乎在同时三个实验室对此发现的证实。这些工作标志着miRNA作为心脏病诊断手段的可能性。以上的科研成果将miRNA与心脏疾病发生发展的研究带入了一个崭新的纪元。
如今,ncRNAs已成为心脑血管疾病的关键调节因子,是一个非常值得进一步探索的有前景的研究领域。未来的研究将继续阐明包括miRNA在内的ncRNAs的分子机制和潜在的治疗应用,而大规模、多中心的研究将在验证其从实验室到临床的转化可行性方面发挥至关重要的作用。
参考资料:
1.Nemeth K, et al. Nat Rev Genet. 2024.
2.杨宝锋,王志国.非编码 微小分子RNA 与心脏疾病[M].北京:人民卫生出版社
推荐阅读
这是示例文本,单击 “编辑” 按钮更改此文本。


