高多基因风险评分(PRS)患者的非钙化斑块体积长期进展增加了6倍以上!PRS与冠状动脉斑块进展以及高危斑块相关
- boke
- 2024-10-28
- 10:18 上午
大约40-60%的冠心病(CAD)风险归因于遗传,并由基因组中的许多变异驱动。尽管传统的预防心血管疾病的方法主要集中在临床风险因素上,如高胆固醇血症或高血压,但多项研究表明,纳入CAD PRS可以提高临床风险计算的性能,并提高风险分层的精确度。
由于DNA信息从出生时就存在,并代表了一生的风险,CAD PRS可以在临床风险因素出现之前量化风险,甚至在晚中年个体或既往有心血管事件的患者中也是如此。重要的是,临床试验数据的回顾性分析还显示, CAD PRS高风险个体从降脂治疗中获得了更大益处。
因此,通过多基因风险评分(PRS)衡量的冠状动脉疾病(CAD)遗传风险,正在成为一种早期识别CAD高风险个体的临床工具。
冠状动脉计算机断层扫描血管造影(CTA)能够进行高分辨率的斑块量化和特征化。斑块体积百分比(PAV)、高风险斑块(HRP)特征的存在以及斑块随时间的进展都与心血管结局相关。因此,冠状动脉CTA正在成为评估亚临床冠状动脉粥样硬化和测试CAD新干预措施的有力工具,提供早期疗效证据和机制见解。
传统上,CAD PRS是在临床终点(如心肌梗死和冠状动脉血运重建)上开发和训练的,这些终点类似于冠状动脉粥样硬化潜在病理生理过程的终末期疾病表现。
然而,个体遗传背景如何影响冠状动脉斑块负担和/或表型尚未完全理解。几项横断面研究显示,CAD PRS高风险患者冠状动脉斑块负担更高。然而,CAD PRS与长期斑块进展和高风险斑块特征之间的纵向关系至今尚未解开。
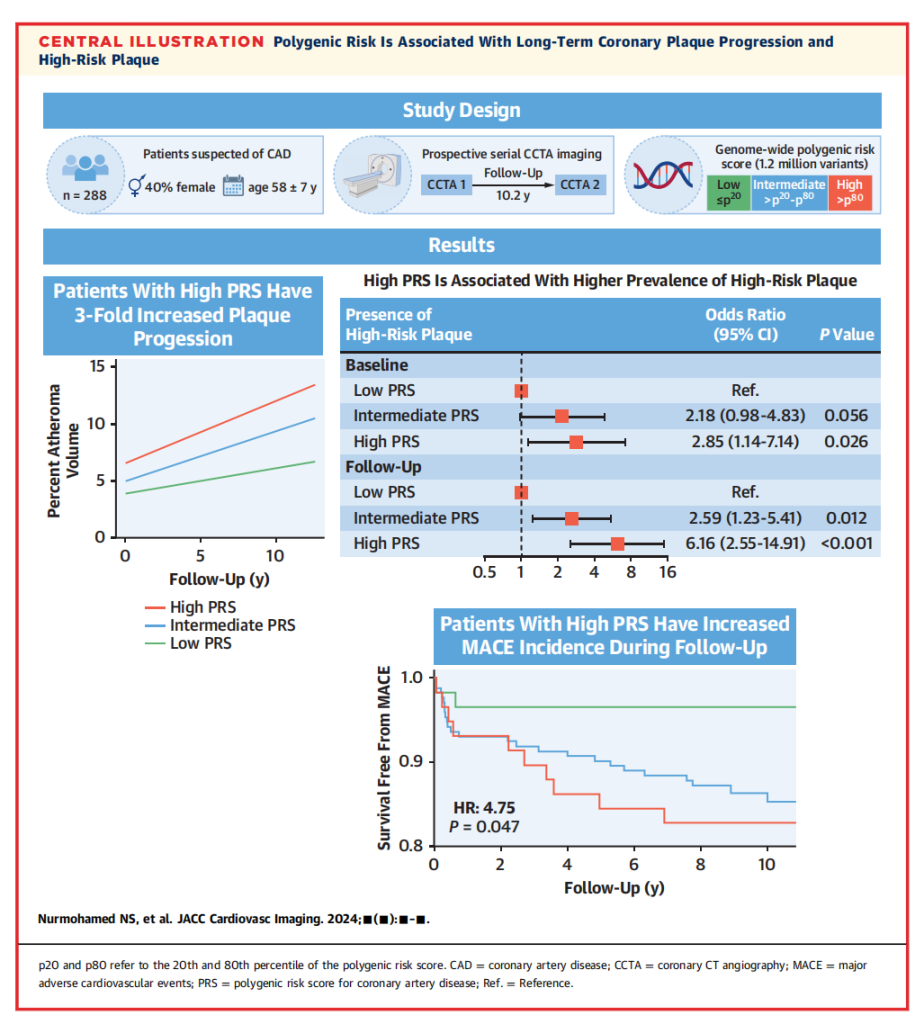
在一项发表在JACC Cardiovasc Imaging期刊的研究中[1],通过包含288名患者队列,研究了CAD PRS对长期冠状动脉斑块进展和高风险斑块的影响,这些患者进行了CAD PRS风险分层和间隔10年的连续冠状动脉CTA成像。
背景
冠心病(CAD)的多基因遗传风险(多基因风险评分,PRS)与长期斑块进展和高危斑块(HRP)特征之间的纵向关系尚不清楚。
目的
本研究旨在探讨冠心病多基因遗传风险(CAD PRS)对长期冠状动脉斑块进展和高危斑块(HRP)的影响。
方法
患者接受CAD PRS检测和前瞻性系列冠状动脉计算机断层扫描血管造影(CTA)成像。冠状动脉CTA扫描使用先前验证的基于人工智能的算法(动脉粥样硬化成像-定量计算机断层扫描成像)进行分析。在基线斑块体积变化和传统风险因素的线性混合效应模型中进行研究,探讨冠心病多基因遗传风险(CAD PRS)与斑块体积百分比(PAV)变化、非钙化斑块进展百分比和HRP患病率之间的关系。
结果
共纳入288名受试者(平均年龄58岁,60%为男性),中位扫描间隔为10.2年。
基线时,高冠心病多基因遗传风险患者(CAD PRS)的斑块体积百分比(PAV)比低冠心病多基因遗传风险患者高出5倍以上(10.4% vs 1.9%)。
每10年随访期间,CAD PRS每增加1个标准差,多变量校正模型中PAV进展增加了 0.69%。
在加入传统风险因素后,CAD PRS综合模型为随访期间中位数以上的非钙化斑块进展提供了额外的区分提高。
与低冠心病多基因遗传风险患者相比,高冠心病多基因遗传风险患者在基线和随访时出现高危斑块(HRP)分别为2.85倍和6.16倍。
结论
冠心病多基因遗传风险(CAD PRS)与疑似CAD患者的未来长期斑块进展和高危斑块(HRP)密切相关。
患者特征
这288名受试者的基线平均年龄为58 ± 7岁,其中174人(60%)为男性。患者的种族主要为白人欧洲人(252人 [87.5%]);17人(5.9%)为亚洲人,8人(2.8%)为非洲裔,8人(2.8%)为中东或北非裔,3人(1.0%)的种族为其他或混合种族。
受试者出现了多种症状,包括典型心绞痛(91人 [32%])、非典型心绞痛(105人 [37%])和非特异性胸痛(88人 [31%]),作为进行基线冠状动脉CTA影像学检查的原因。基线特征在低、中、高PRS组之间相似(表1)。
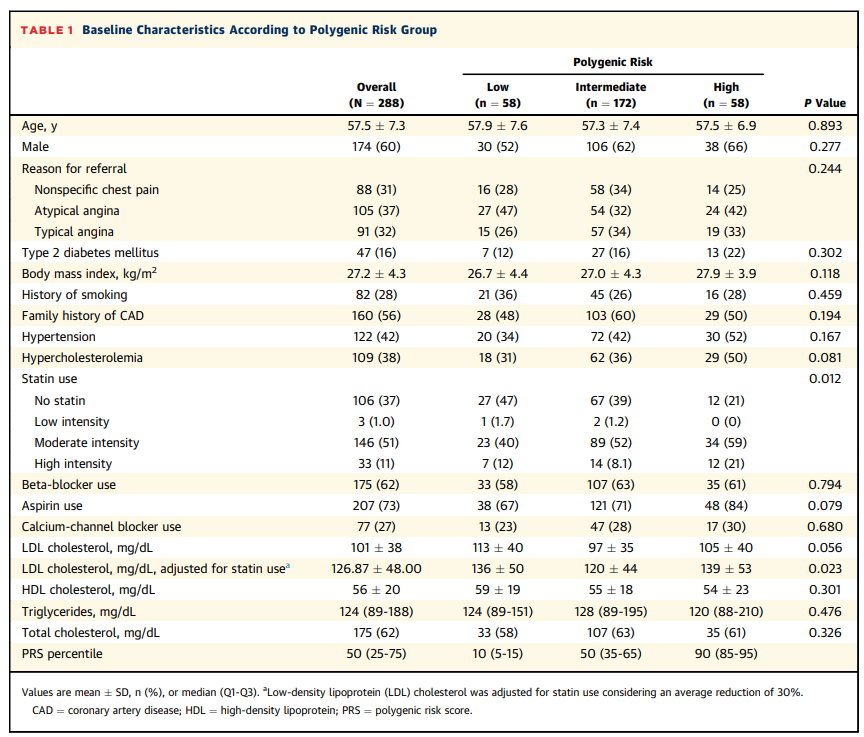
表1. 根据多基因风险组得出的基线特征
CAD PRS与基线冠状动脉斑块负担相关。在基线时,PRS与冠状动脉斑块体积相关。高PRS患者相比低PRS患者,PAV高出>5倍(10.4 vs 1.9)(表2)。高PRS患者的非钙化斑块体积也较高(6.4)而低PRS患者为(1.7)。
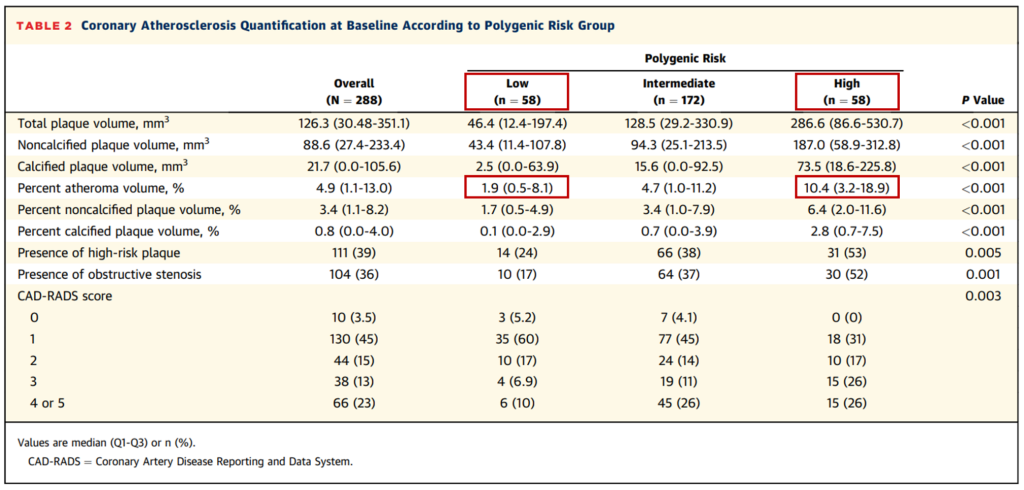
表2.多基因风险组的基线冠状动脉粥样硬化量化
此外,高PRS患者的基线钙化斑块体积也较高(2.8),而低PRS患者的钙化斑块体积几乎可以忽略(0.1)。在校正年龄、性别、遗传祖先和传统风险因素后,PRS每增加1个标准差,PAV增加0.97%,非钙化斑块体积增加0.43%,钙化斑块体积增加0.55%。高PRS患者的PAV比低PRS患者高3.31%,非钙化斑块体积高1.58%,钙化斑块体积高1.79%。。
在校正年龄、性别、遗传祖先、传统风险因素和基线斑块体积后(图1),CAD PRS在10年随访期间与斑块进展率保持强相关,PRS每增加1个标准差,PAV增加0.69%。与低PRS患者相比,高PRS患者的PAV进展高出2.75%。随着遗传风险的增加,钙化和非钙化斑块的加速进展均有观察到。
最后,评估了PRS和基线斑块在预测高于中位PAV进展(>2.83%)和非钙化斑块进展(>0.66%)方面超越传统风险因素的额外区分价值。
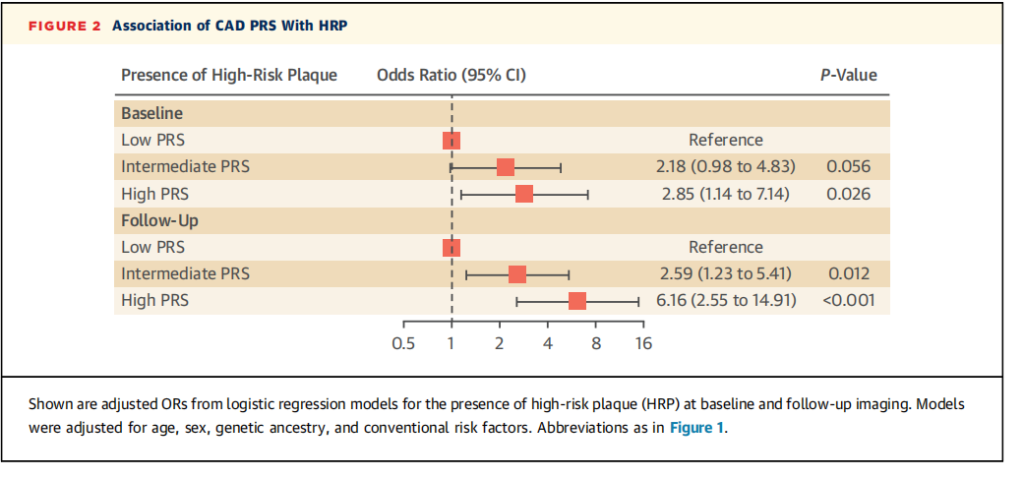
图2. CAD PRS与高风险斑块(HRP)的关联
图3展示了两例(高和低CAD PRS)斑块进展和HRP的案例。多基因风险评分(PRS)与10年随访期间的心血管事件相关。
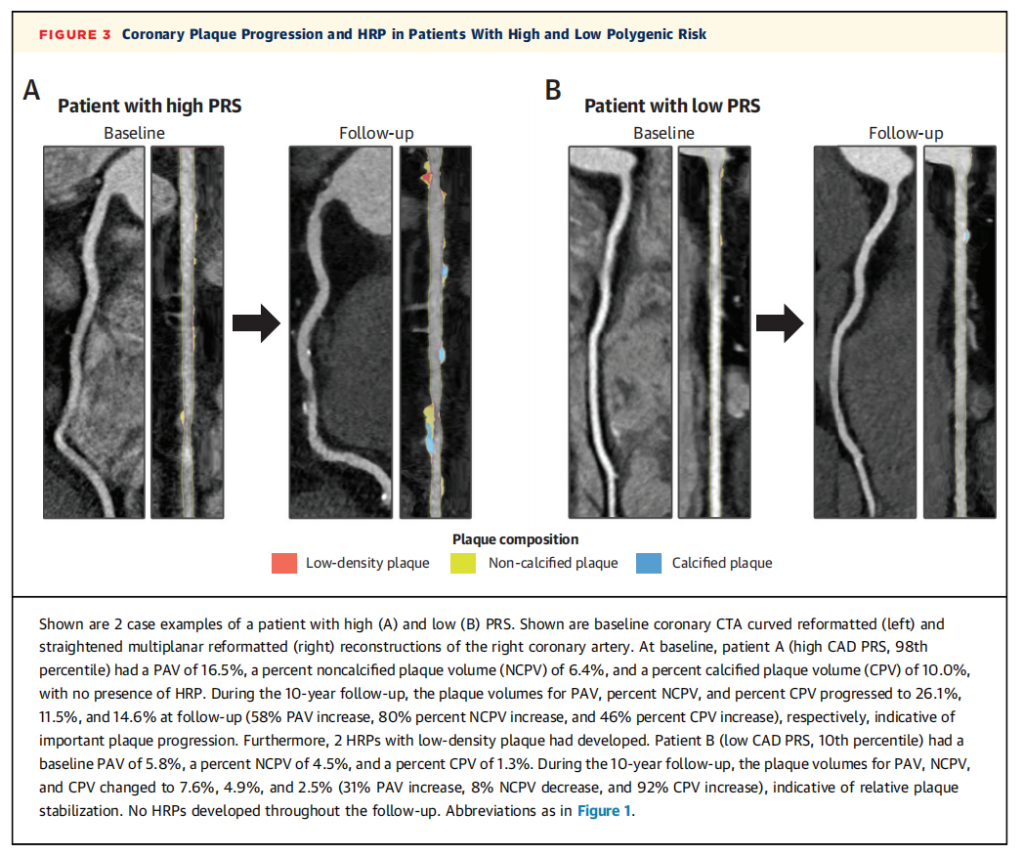
图3. 两例患者的案例,一个高PRS(A)和一个低PRS(B)
在中位随访10.2年期间,高CAD PRS的患者MACE无事件生存率降低(图4A)。在多变量校正的生存分析中,高PRS和中等PRS患者的复合MACE结果的HR分别为4.75和4.58。
当将PRS和基线PAV合并到一个模型中时,只有PAV保持独立与MACE相关(图4B)。
在多变量校正后,PRS高于中位数的患者与低于中位数的患者相比,其MACE的HR为1.98,而PAV高于中位数则与HR为6.63相关。同样,当PRS与HRP的存在结合时,只有HRP保持独立与MACE相关(图4C)。在多变量校正后,PRS高于中位数的患者与低于中位数的患者相比,其MACE的HR为1.95。

图4. 根据遗传风险组和基线斑块进行长期随访的MACE
讨论
本研究利用288名患者的PRS和10年间隔的冠状动脉CTA影像数据,展示了CAD PRS在冠状动脉斑块长期进展中的重要作用。在接受冠状动脉CTA怀疑CAD的患者中,CAD PRS与基线时的非钙化斑块体积增加密切相关。在超过10年的随访中,高PRS患者的冠状动脉斑块整体增加几乎是低PRS患者的三倍。此外,无论在基线还是随访影像中,高CAD PRS患者的高风险冠状动脉斑块风险增加了多达7倍。高PRS患者,尤其是基线时斑块体积负担或HRP高于平均水平的患者,在长期随访期间经历MACE的风险显著增加。这些数据集中说明了个体遗传背景对冠状动脉斑块负担发展和进展的影响。
长期来看,高PRS患者的非钙化斑块体积进展增加了6倍以上,而低PRS患者的进展较少。这种显著加速的斑块进展即使在校正了传统风险因素和基线斑块体积后仍然持续。本研究中观察到的PRS对斑块进展以及MACE的预测价值,可能是因为PRS捕捉了终生的遗传风险暴露,而传统风险因素通常在生命后期才发展。此外,PRS可能涵盖了多种致动脉粥样硬化途径的复杂相互作用,而这些途径无法通过测量少数传统风险因素来捕捉。
先前的研究已经探讨了PRS与冠状动脉钙评分(CACS)之间的关联,并对冠状动脉CTA进行了定性评估。在PROMISE(前瞻性多中心影像研究评估胸痛)试验的605名参与者的回顾性分析中,结果显示PRS最高五分位数的参与者患阻塞性CAD的风险是其他人的5倍。Christiansen等人报告说,PRS每增加一个标准差,CACS就会增加78%,并且存在阻塞性斑块(OR: 1.78。最近另一项研究涉及954例病例,发现PRS最高五分位数的受试者与最低五分位数相比,具有更多的阻塞性狭窄、严重的动脉粥样硬化(OR: 3.77)和斑块破裂(OR: 4.05)。
因此,在接受冠状动脉CTA风险分层的患者中评估PRS可能有助于识别MACE风险最高的患者。过去一年启动的研究正在前瞻性地评估,利用CAD PRS检测和/或冠状动脉CTA的亚临床方法预防CAD是否优于传统的基于风险的方法(NCT03920176、NCT06112418、NCT05819814、NCT05850091和NCT05800093)。
参考资料
1. Nurmohamed et al., Polygenic Risk Is Associated With Long-Term Coronary Plaque Progression and High-Risk Plaque. JACC Cardiovasc Imaging. 2024
推荐阅读
这是测试文本,单击 “编辑” 按钮更改此文本。


