Nature Cell Biology | 衰老和年龄相关疾病中的端粒功能障碍
- boke
- 2022-06-21
- 7:21 上午
上个世纪,公共卫生和医学的进步推动了全球寿命的大幅提高。按照目前的发展,到2050年60岁以上的人口将达到21亿(联合国,2017)。伴随人口大幅增加与年龄有关的疾病,如阿尔茨海默氏病、心血管疾病和癌症发病率基本上每5年翻一番。如果没有新的医疗和健康规范,全球将遭受难以承受的慢性病负担,造成巨大的社会和经济损失。
衰老伴随着组织干细胞耗竭、组织炎症、基质改变、细胞衰老和代谢功能障碍,是一种逐渐发生的退行性过程。这些细胞和组织的变化反映了线粒体、蛋白质内稳态、细胞通讯、营养感知、表观遗传和DNA修复等潜在的分子异常,这些异常会导致包括端粒功能障碍的基因组不稳定性和损伤。随着对衰老的各种分子机制越来越深入地了解,端粒被认为是驱动衰老过程及其相关疾病的分子通路的诱因或放大器。衰老的细胞积累导致身体功能障碍,而端粒缩短和损伤是引起细胞衰老和衰老的主要原因。一些与正常衰老相关的疾病是由端粒功能障碍加速引起的。
端粒和端粒酶的历史
端粒的概念诞生于20世纪30年代,当时McClintock和Muller推测玉米和果蝇的染色体末端存在一种独特的结构,并假设该结构对防止染色体末端融合至关重要。Muller根据希腊语“telos”(意为:结束“end”)和“meros”(意为:部分“part”)的意思,创造了“端粒”一词(“end part”)。1961年,研究表明人类胎儿细胞具有有限的复制潜能(50-60倍),被称为“Hayflick limit”或复制衰老。20世纪70年代初,Olovnikov和Watson通过观察线性DNA复制中的不对称性引入了末端复制问题并且预测了由于去除末端RNA引物,每次细胞分裂都会引起滞后链末端染色体DNA的丢失,从而导致染色体不断缩短[1]。
端粒的概念诞生于20世纪30年代,当时McClintock和Muller推测玉米和果蝇的染色体末端存在一种独特的结构,并假设该结构对防止染色体末端融合至关重要。Muller根据希腊语“telos”(意为:结束“end”)和“meros”(意为:部分“part”)的意思,创造了“端粒”一词(“end part”)。1961年,研究表明人类胎儿细胞具有有限的复制潜能(50-60倍),被称为“Hayflick limit”或复制衰老。20世纪70年代初,Olovnikov和Watson通过观察线性DNA复制中的不对称性引入了末端复制问题并且预测了由于去除末端RNA引物,每次细胞分裂都会引起滞后链末端染色体DNA的丢失,从而导致染色体不断缩短[1]。
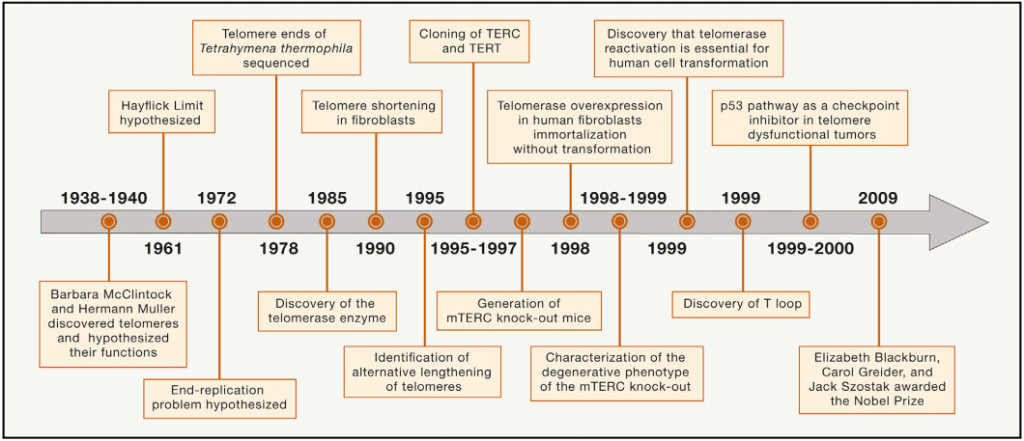
图1 端粒领域研究发展时间表
端粒位于线性染色体末端,脊椎动物的端粒DNA由TTAGGG重复序列与一组调节其生物学功能的蛋白质结合而成。这些蛋白质可以防止它们被识别为DNA损伤,从而引发DNA损伤反应(DDR)。标准的DNA聚合酶在缺少端粒酶(一种独立于DNA模板的DNA聚合酶)的情况下无法完全复制线性的DNA模板,由于核溶解过程,DNA复制导致染色体端粒逐渐缩短。当端粒达到一个临界长度时,无法结合足够多的telomere-capping蛋白,暴露DNA末端,从而激活DDR通路,并通过诱导细胞周期抑制剂p21和p16来阻止增殖。激活端粒上的DDR(以下称为tDDR)导致端粒相关的DDR病灶(TAFs)或端粒诱导的DNA损伤病灶(TIFs)的形成,它们是人工培养的细胞和组织中细胞衰老的标志。衰老细胞分泌一组复杂的促炎细胞因子(衰老相关分泌表型,SASP)可以改变细胞外基质的组成,损害干细胞功能,促进细胞转分化,并将衰老表型扩散到周围细胞,引起慢性炎症[2]。
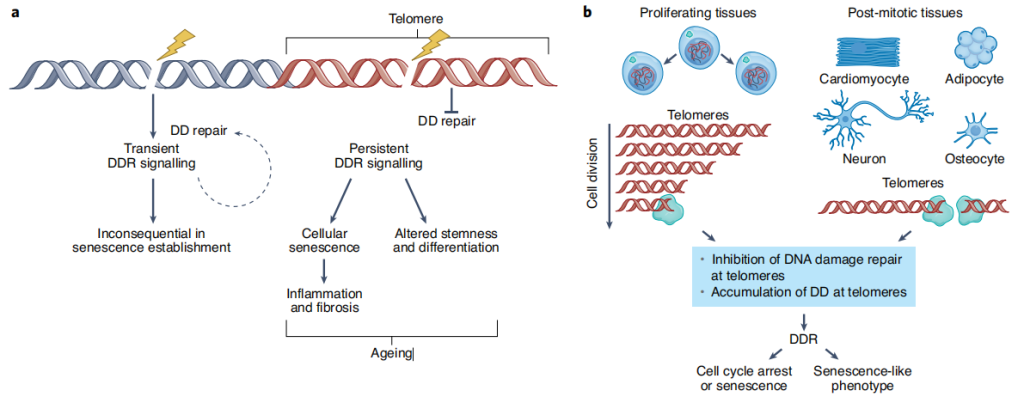
图2 端粒缩短、损伤及其后果
慢性阻塞性肺病
一些肺部疾病与年龄以及端粒功能障碍和衰老细胞积累有关。
特发性肺纤维化:特发性肺纤维化(IPF)是一种以肺间质纤维基质重建为特征的肺退行性疾病,影响全球约300万人。人类老化的肺的纤维化与端粒缩短、DDR和细胞衰老有关。IPF患者随着疾病严重程度的增加在肺部积累TAFs和衰老标志物,并激活SASP。短端粒是IPF的一个确定的危险因素,对循环白细胞和肺泡上皮细胞进行评估显示,37%的家族性病例和25%的散发病例的端粒长度低于其年龄的十分之一。较短的端粒长度被证明是疾病进展、治疗反应和死亡反应的可靠独立预测因子。
慢性阻塞性肺疾病:慢性阻塞性肺疾病(COPD)与老年患者的高发病率和死亡率相关,影响全球约3亿人。COPD表现为肺部老化加速,软组织和气道炎症、外周支气管慢性重塑和肺泡间隔破裂并向肺气肿发展。与未受影响的个体相比,COPD患者的小气道上皮细胞显示出更高水平的TAFs和衰老标志物。
其他肺部疾病:非囊性纤维化支气管扩张是一种常见的以支气管不可逆扩张为特征的炎症性肺病。这些患者的肺组织显示端粒变短,TAFs和衰老标志物水平升高。严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)引起的2019冠状病毒病(COVID-19)已被预测会引起长期肺纤维化,疾病的严重程度与患者的年龄和白细胞端粒长度相关。
获得性骨髓衰竭综合征
有核血细胞的端粒是人体组织中最短的。因此,端粒持续受损对造血功能的严重损害也就不足为奇了。
再生障碍性贫血:再生障碍性贫血是一种诊断年龄不一的罕见疾病,其特征是外周血全血细胞减少和骨髓细胞明显减少。约三分之一的再生障碍性贫血患者外周血端粒较短,说明了再生障碍性贫血病理与端粒功能障碍之间存在因果关系。诊断时端粒较短的患者表现出更严重的疾病、对治疗的反应较差、复发的风险增加、骨髓增生异常综合征(MDS)以及较低的生存率。
MDS:MDS是一组异质性的造血干细胞克隆性疾病,其特征是无效造血和造血干细胞及祖细胞DNA损伤积累。每10万人中有13.2人患有MDS,通常是老年人。MDS也可能继发于化疗或放疗,或与DNA修复和端粒维持基因有关。MDS患者的骨髓细胞端粒短于健康供者。
新陈代谢疾病
当机体不能有效地将食物转化为能量时,就会发生代谢性疾病。
代谢综合征:代谢综合征是一组与代谢相关的疾病同时发生在个人身上,包括慢性炎症、肥胖、血脂异常、高血压和胰岛素抵抗,这些都会增加严重的心血管疾病的风险。和其他导致肥胖的情况类似,与各种器官和组织的TAFs增加有关。脂肪组织中的短端粒与代谢性疾病进程有关,其诱发性已被证实,通过小鼠脂肪细胞前体中的端粒酶失活,导致了肥大和炎症反应。
肝脏疾病:端粒缩短与肝细胞衰老和肝硬化患者的疾病进程有关。与正常人相比,肝硬化患者端粒酶突变率更高,端粒更短。非酒精性脂肪性肝病(NAFLD)的特点是肝脏脂肪堆积过多(脂肪变性),在后期出现炎症(非酒精性脂肪性肝炎)和纤维化。原发性胆汁性肝硬化是一种慢性进行性胆汁淤积和肝功能衰竭的自身免疫性疾病,与短端粒、DDR激活和胆汁上皮细胞衰老标志物积累有关。在人类肝脏活检中,酒精性肝病和慢性病毒性肝炎也与端粒功能障碍有关。
2型糖尿病:2型糖尿病(T2D)是一种年龄相关性疾病,其特征是胰腺β细胞数量和功能下降,多个组织中的胰岛素拮抗导致高血糖症。几项代表性对白细胞的研究表明T2D和短端粒之间存在关联,端粒短的小鼠表现出与衰老标记物积累相关的胰岛素分泌受损和葡萄糖耐受不良。衰老细胞的清除改善了肥胖和老年小鼠的葡萄糖稳态和提高了胰岛素敏感性。
心血管疾病
心血管疾病是西方国家发病率和死亡率的主要原因,老龄化是这些国家发展的主要风险因素。端粒缩短和端粒损伤已被报道为心脏病的潜在驱动因素以及治疗结果的指标。
心脏疾病:随着年龄的增长,心脏出现心肌细胞肥大和纤维化,导致心室僵硬和心功能受损。在人类和小鼠的衰老过程中,TAFs的发生独立于有丝分裂后期心肌细胞端粒长度。清除衰老细胞可以改善老年小鼠的心脏功能,减少心肌细胞TAF阳性的比例,但对平均端粒长度没有显著影响。长度无关的端粒损伤可能由氧化损伤引起,小鼠模型显示氧化应激增加和线粒体功能障碍引起年龄依赖性端粒功能障碍的早期发作。遗传性肥厚型或扩张型心肌病的患者,其心肌细胞的端粒比同龄个体更短。在一个大型独立队列中也观察到,肥厚性心肌病的严重程度与白细胞端粒长度相关。
动脉粥样硬化:动脉粥样硬化是一种血管疾病,其特征是形成含有血管平滑肌细胞(VSMCs)的动脉斑块,可能导致血栓形成和心肌梗死,是全球死亡的主要原因。在有限的队列研究中,动脉粥样硬化患者的循环白细胞端粒比同龄健康人群短。
遗传性骨病
骨质疏松和骨关节炎的骨骼和关节组织的变化与衰老细胞的积累有关。
骨关节炎:骨关节炎影响超过3000万美国成年人(https://oaaction.unc.edu/oa-module/oa-prevalence-and-burden/),其特点是关节软骨和软骨下骨的变性。构成关节软骨的软骨细胞在骨关节炎患者中显示出几种衰老标志物,包括DDR激活。证据表明,在小鼠模型中,去除衰老细胞可以减少创伤后和自然发生的骨关节炎的发展。骨关节炎患者的白细胞的端粒比同龄的人短,端粒长度与慢性严重疼痛成反比。
骨质疏松症:骨质疏松症是一种慢性骨骼疾病,影响全球2亿多人。其特点是骨密度低和骨组织微结构恶化,导致骨折风险增加。越来越多的证据指向端粒功能障碍和衰老在骨质疏松症中的作用。骨质疏松症与患者白细胞中的短端粒相关,女性队列中的长端粒与高骨密度和骨质疏松风险降低相关。通过晚期端粒酶缺陷小鼠总结了骨质疏松症的几个特征,如骨体积减小,成骨细胞数量和功能减少,孔隙度增加,TAFs与骨损伤相关母细胞分化,支持了端粒功能障碍在骨质疏松症中的作用。
肾病
在衰老过程中,肾脏会经历有害的结构和功能变化。一些肾脏病理,如急性肾损伤、肾小球肾炎、糖尿病肾病、多囊肾病和慢性肾病(CKD)与细胞衰老和端粒功能障碍有关。
CKD:CKD表现出加速衰老的几个特征,包括肾重量的下降、萎缩、硬化、纤维化和产生与CKD相关的分泌表型。在CKD患者中可以观察到在肾小管上皮细胞、足细胞、间质细胞和系膜细胞中存在衰老标志物,它们的积累与疾病进展有关。DNA损伤可在多种形式的肾损伤中累积。DDR激活和衰老与感染、脂多糖、尿毒症毒素和透析治疗等损害结合均可导致CKD。
尿毒症:尿毒症是肾损伤的标志。在尿毒症患者中,淋巴细胞端粒长度明显短于未受影响的个体。一项对CKD患者的大队列研究显示,外周血中测量的端粒长度是全因死亡率的一个强大的独立预测因子。此外,在经常吸烟的人和糖尿病患者中端粒缩短与慢性肾病风险增加有关。
神经退行性疾病
脑老化的特点是记忆力和认知能力的逐渐衰退,是神经退行性疾病的最大危险因素。衰老细胞在小鼠大脑中随着年龄的增长而积累,并在端粒酶缺乏的晚期小鼠中加剧。清除衰老细胞可以显著改善衰老小鼠的认知功能,表明衰老在与年龄相关的认知障碍中起着重要作用。
阿尔茨海默氏症:阿尔茨海默氏病是导致痴呆的最常见原因,65岁以上的人群中,大约10%受其影响(https://www.alz.org/alzheimers-dementia/facts-figures)。DNA损伤和DDR标记已在阿尔茨海默病模型和患者死后大脑神经元中被观察到。神经细胞死亡是阿尔茨海默病的一个特征,被认为是小神经胶质细胞衰老的结果,据报道,阿尔茨海默病患者小胶质细胞的端粒比健康个体短。在小鼠模型中,对衰老细胞进行基因清除或衰老溶解治疗,可缓解认知能力下降和神经退行性变。
帕金森氏症:帕金森氏症是一种运动功能受损的进行性疾病。该疾病影响全球1000多万人(https://www.parkinson.org/
Understanding-Parkinsons/Statistics),年龄是散发型和家族型疾病的主要风险因素。虽然没有明确的证据表明端粒长度在帕金森病患者中发生了变化,但端粒极短的小鼠在神经肌肉协调试验中的表现指出端粒功能障碍在帕金森病中的作用,端粒激活剂导致病理α-synuclein蛋白水平下降,并改善帕金森病小鼠模型的运动症状。
老年性黄斑变性
老年性黄斑变性(AMD)是一种影响视网膜黄斑区域的眼病,是全球老年人不可逆转失明的最常见原因。在AMD动物模型和AMD患者视网膜组织中检测到多种衰老标志物,一项针对少数早期AMD患者的双盲研究表明,端粒酶激活剂治疗可显著改善黄斑功能。
生育能力降低

图3 细胞衰老和端粒功能障碍在年龄相关疾病中的作用
结论与治疗机会
为了抵消端粒缩短,研究者提出通过TERT(端粒酶成分)表达的活化或外源性传递来诱导端粒酶活性。由于TERT启动子对性激素应答,达那唑(一种合成睾丸素)在临床使用多年,已成为再生障碍性贫血治疗临床实践的一部分,并取得了一定的疗效。小分子抑制剂PAPD5(一种破坏TERC(端粒酶成分)RNA稳定的非典型poly(A)聚合酶)已被证明可以挽救先天性角化障碍患者诱发的多能干细胞中的TERC水平。但是这些方法的临床价值尚不清楚,未必能有效地治疗端粒酶相关功能基因突变患者。
腺相关病毒(AAVs)介导的TERT已在再生障碍性贫血、IPF和阿尔茨海默病的动物模型中观察到治疗效果。尽管TERT端粒外功能的潜在影响仍有待研究,但这已是目前为止最先进的临床前治疗方案。虽然已经在心肌细胞中观察到疗效,但诱导端粒酶活性是否对非增殖细胞有效仍不清楚。在临床中,使用免疫原性病毒载体(如AAV)可能会减少重复治疗的可能性。
由于导致细胞衰老或凋亡的不是端粒功能障碍本身,而是它所涉及的tDDR激活的途径,另一种方法是减弱DNA损伤信号。尽管抑制整个基因组的DNA损伤信号和修复可能是危险的,但是通过选择性地抑制功能失调的端粒上DDR可能是一个机会。DDR的激活依赖于非编码RNA的发现,如损伤诱导长非编码RNA(dilncRNA)和DNA损伤反应RNA(DDRNA)产生于暴露的DNA末端,这些RNA成为潜在治疗干预的靶点。反义寡核苷酸(ASOs)是一种以RNA为靶点的新兴药物,目前有8种产品上市,还有更多的产品正在进行临床试验[3]。端粒ASOs(tASOs)在小鼠体内特异性减弱端粒DDR激活的能力,以及在早衰症动物模型中改善健康寿命,为其临床应用提供了基础。该方法的优点是其广泛的活性,不依赖于端粒功能障碍下的遗传缺陷,既能作用于极短和受损的端粒,也能作用于非增殖细胞。其应用的局限性可能在于其组织分布、安全性评估的必要性以及相对较少的作用机制的研究。
该文总结了与年龄相关的疾病,这些疾病往往是端粒功能障碍的潜在原因,端粒缩短或端粒DNA损伤。病因的确定以明确和扩展端粒功能障碍对更多疾病的影响,也可以为病人提供更多的治疗选择。


