结直肠癌发病机制研究与靶向治疗进展
- boke
- 2026-02-02
- 2:20 下午
结直肠癌(Colorectal cancer,CRC)仍是全球癌症相关死亡的主要原因之一,约占全球每年新发癌症和癌症相关死亡的10%,是全球第四大致命癌症,每年约有90万人死于该疾病。CRC按发病因素可以分为遗传性和散发性,按发病年龄又可以分为早发性(患者年龄<50岁)和迟发性(患者年龄>50岁)。在流行病学研究中,女性发病率与死亡率比男性低约25%,男性性别和年龄增长始终与疾病发病率呈现强关联。
结直肠癌发病风险因素包括:
(1)遗传:约10%至20%的结直肠癌患者有阳性家族史;约5%至7%的结直肠癌患者受特定遗传结直肠癌综合征影响(林奇综合征、家族性腺瘤性息肉病等)。
(2)生活方式:吸烟、过量饮酒、体重增加、缺乏锻炼以及饮食因素(如高脂肪、高蛋白饮食等)。
(3)疾病:肠道长期处于慢性炎症状态,炎症因子持续刺激肠黏膜,导致细胞增殖失控;Ⅱ型糖尿病患者的结直肠癌风险较高。
(4)其他因素:感染特定细菌(如具核梭杆菌和脆弱拟杆菌)可能会增加结直肠癌的发病风险[1]。
一、结直肠癌发病机制
CRC的病因学轨迹是一个多阶段过程,分为四个关键阶段:启动期、促进期、进展期和转移期,绝大多数结直肠癌遵循“正常上皮→腺瘤(早期→中期→晚期)→癌→转移”的连续过程。1990年Vogelstein团队提出了结直肠癌发生遗传模型,核心为多阶段、多基因突变[2]。
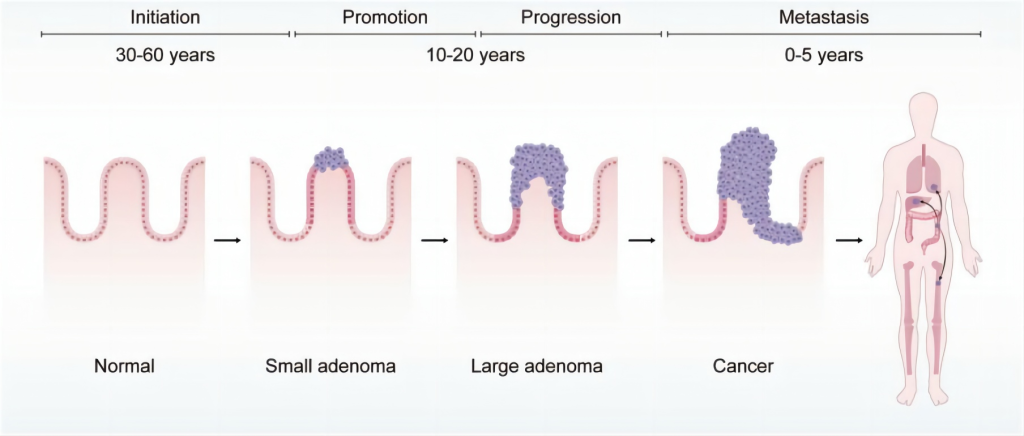
图 1 CRC的病因学轨迹[3]
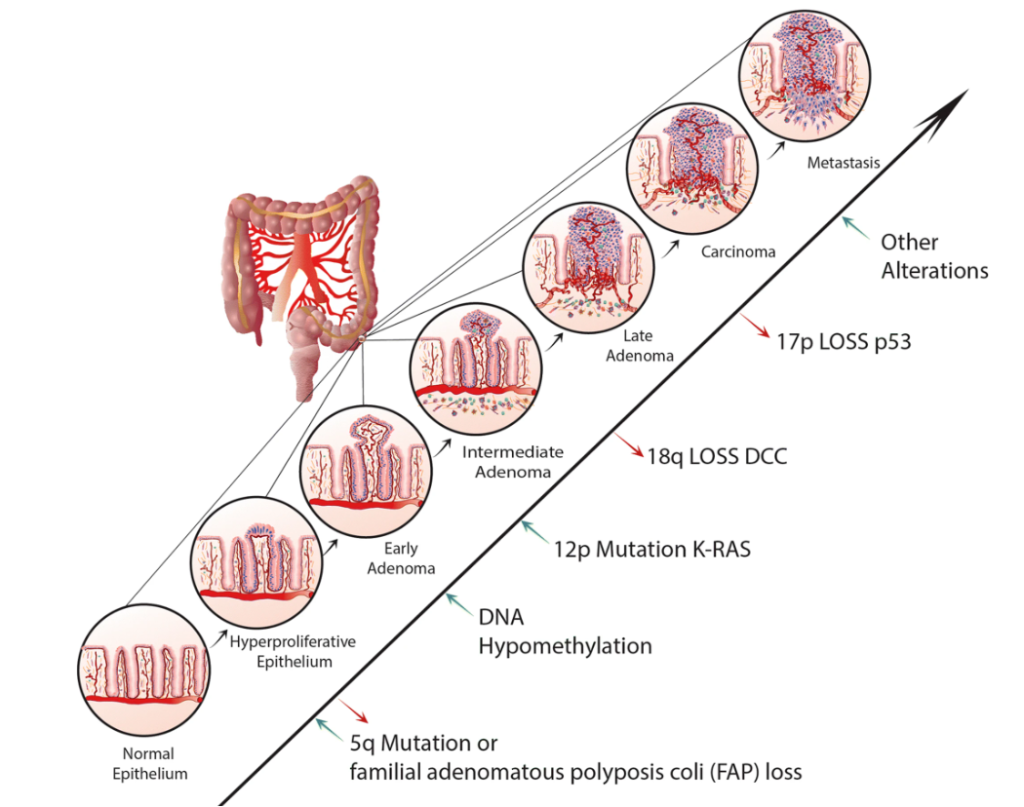
图 2 Vogelstein结直肠癌遗传模型
1
信号通路失调
Wnt/β-catenin信号通路在CRC的发病中起着核心作用,APC基因突变导致该通路的异常激活,使得β-catenin蛋白在细胞核内积累,进而促进癌细胞的增殖。
PI3K/AKT/mTOR信号通路通过增强癌细胞的生长和存活能力,助推了癌细胞的恶性生长,是多个靶向治疗的关键目标。
GF-β信号通路在疾病早期抑制肿瘤发展,但随着疾病进展,它通过上皮-间质转化(EMT)过程,促进癌细胞的侵袭和转移。
另外ErbB家族、Notch、Hedgehog、Hippo、SMAD、AMPK等通路失调,也能驱动肿瘤增殖、存活、侵袭和转移,这些通路并非孤立运作,而是构成复杂且相互交织的信号网络共同调控肿瘤发生。
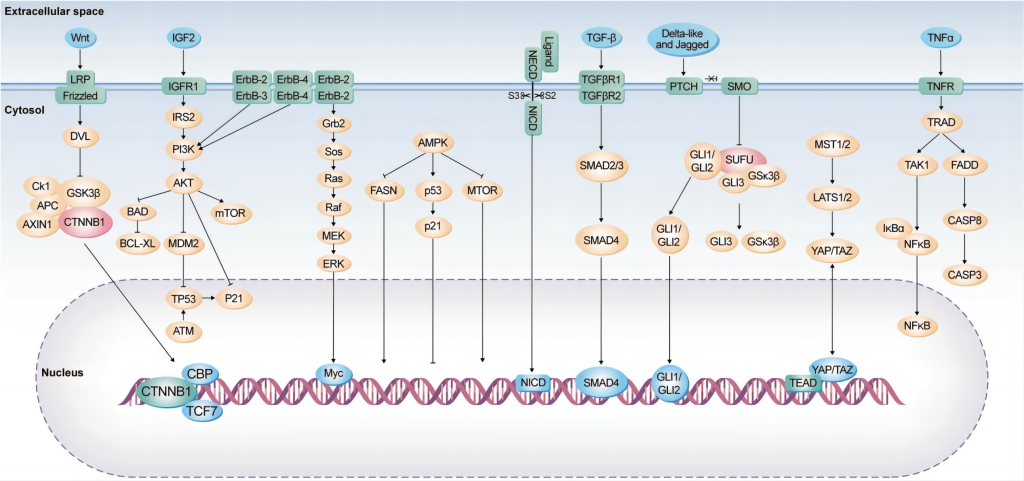
2
基因变异
结直肠癌可分为两大类:散发性和家族性。家族性结直肠癌的基因变异多为胚系突变,具有明确的遗传模式和高外显率;散发性结直肠癌的基因变异则更为复杂,涉及多个基因的体细胞突变。家族性病例变异包括APC、MSH6/MLH6 和SMAD2 等基因,而散发性病例涉及ATF1、SMAD7 和TPD52L3 等基因。
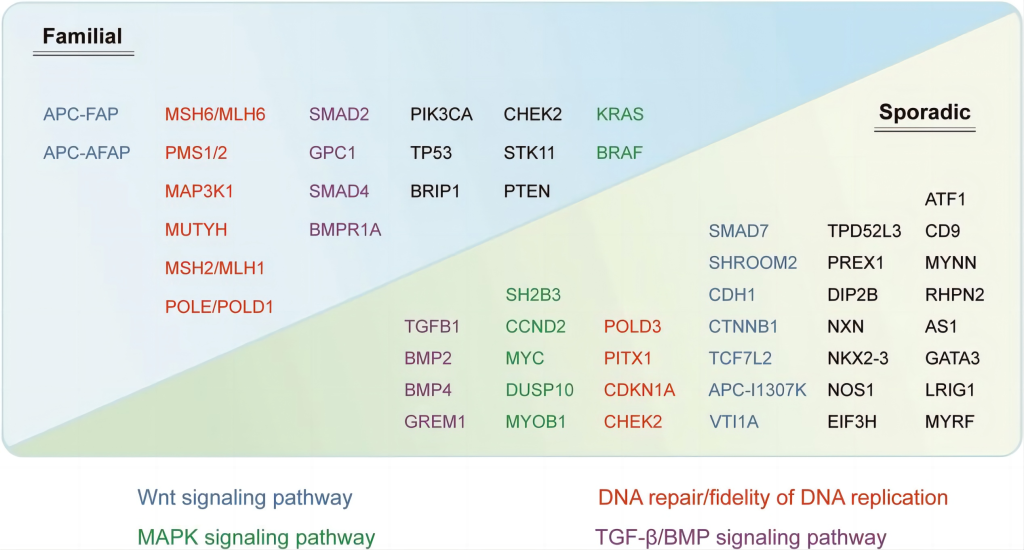
3
表观遗传改变
活组织结直肠癌是一种多因素疾病,遗传和表观遗传异常均导致其异质性。表观遗传学指一系列影响基因表达而不改变基础DNA序列的分子修饰。在CRC中,表观遗传调控在疾病的启动、进展和转移中起着基础性作用。它包括DNA甲基化、组蛋白修饰和非编码RNA(ncRNAs)的活性等机制,这些机制共同构成复杂的调控网络,既可促进也可抑制肿瘤发生。
①DNA甲基化
异常高甲基化可导致基因沉默(肿瘤抑制基因MLH1);CRC中的全基因组低甲基化导致CIN(染色体不稳定性)和突变率增加。特定基因(如SEPT9、MLH1和CDKN2A)的高甲基化已被探索作为诊断和预后指标。
②组蛋白修饰(包括乙酰化、甲基化、磷酸化和泛素化)
CRC中,组蛋白修饰的失调模式可通过改变参与关键细胞功能的基因表达来促进致癌作用。
③非编码RNA(ncRNAs)
微小RNA(miRNAs)、长链非编码RNA(lncRNAs)、环状RNA(circRNAs)。
miRNAs:miRNAs是约22个核苷酸的短ncRNAs,在转录后水平调控基因表达。miR-135和miR-155可靶向APC;let-7和miR-143等miRNAs可靶向癌基因KRAS;肿瘤抑制基因TP53也受多种miRNAs调控,包括miR-125b。
lncRNAs:lncRNAs是长度超过200个核苷酸的转录本,通过多种机制发挥功能,包括染色质修饰、转录干扰和作为分子支架。
circRNAs:circRNAs是一类新型ncRNA,具有闭环结构,可作为miRNA sponges,影响mRNA的稳定性和翻译。
注:miRNA sponges(miRNA海绵):主要是通过竞争性结合miRNA,阻止miRNA与其天然靶mRNA的相互作用,从而调节基因表达。
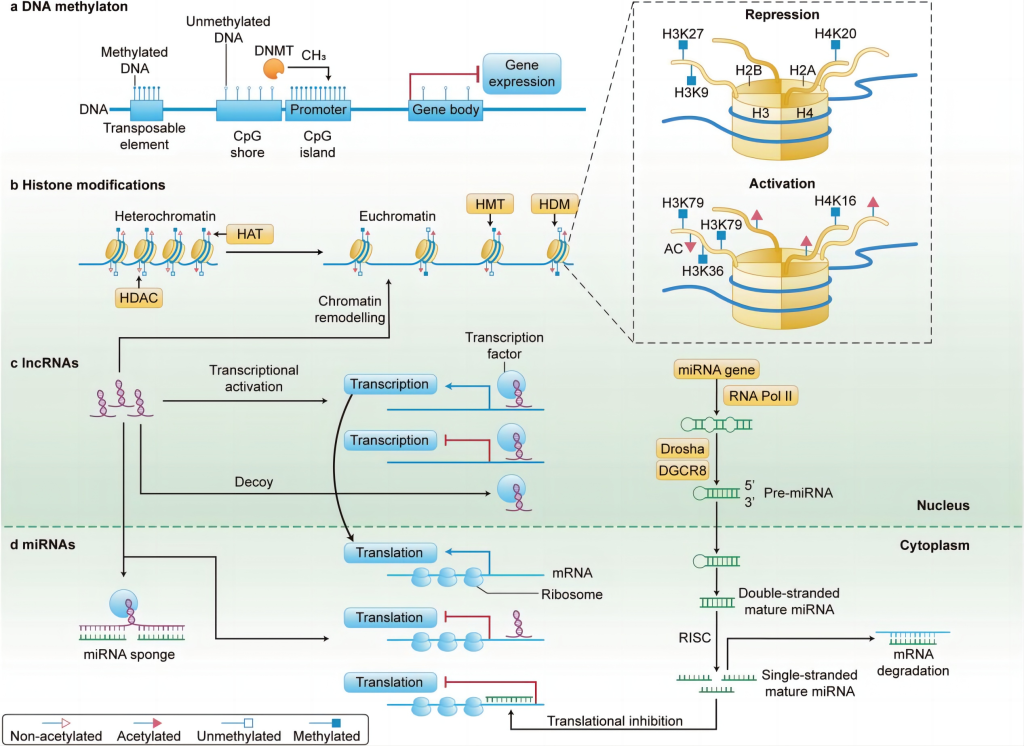
图 5 调节结直肠癌基因表达的表观遗传机制示意图[3]
④肠道微生物与CRC
CRC患者与健康个体的肠道微生物群组成存在显著区别:CRC患者的微生物多样性增加,特定类群的相对丰度发生改变——具有保护作用的类群(如罗斯氏菌属(Roseburia)丰度降低,而具有促癌潜力的类群(如拟杆菌属(Bacteroides)、埃希氏菌属(Escherichia)、梭杆菌属(Fusobacterium)和卟啉单胞菌属(Porphyromonas)丰度升高。另外CRC组织中鉴定出多种病毒包括巨细胞病毒、JC病毒和人乳头瘤病毒。
微生物导致结直肠癌机制主要包括:
(1)微生物在生长代谢过程中产生的某些物质能够引起生物体遗传物质(如DNA)发生突变、损伤或改变的特性。
(2)宿主免疫系统的微生物调节,即诱导促肿瘤性炎症程序和抑制有益的抗肿瘤免疫,可间接促进转化和CRC进展。
(3)微生物产生毒力因子,与上皮细胞膜蛋白相互作用以激活信号传导途径,刺激增殖、促进转移和抑制凋亡。
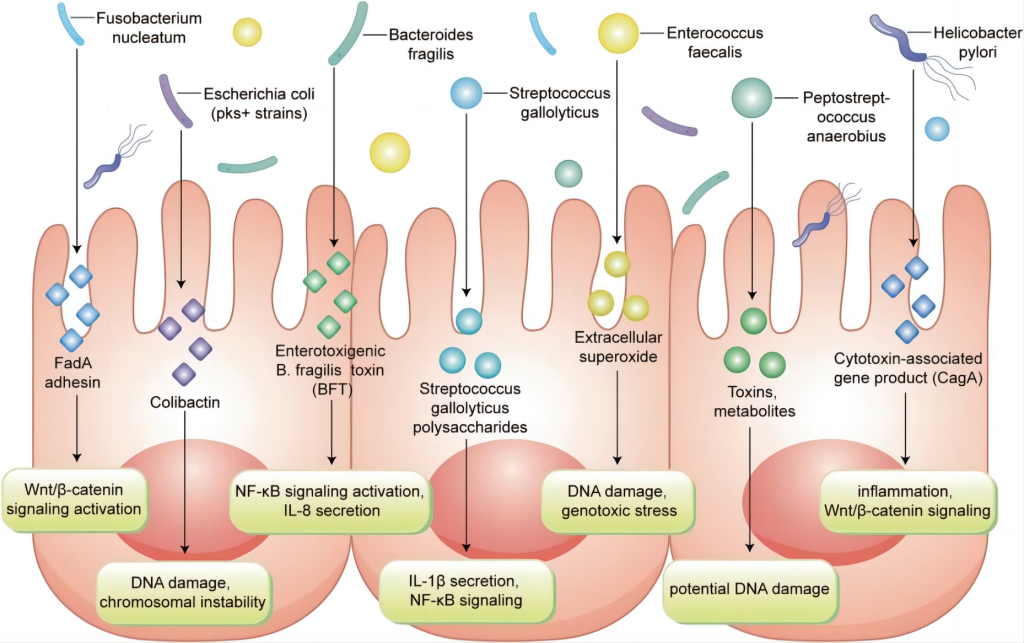
二、结直肠癌筛查
结直肠癌已成为一种高发恶性肿瘤,发病率和死亡率均处于高位。随发病率上升而来的还有结直肠癌的“年轻化”特征。早发现、早预防、早治疗是防止癌症发生、减缓癌症发展的重要手段,通过早期筛查,并及时有效干预可以极大提升生存率,降低结直肠癌发生。
结肠镜检查是结直肠癌诊断“金标准”,但由于肠镜的侵入性,人群依从性差;粪便潜血试验(FOBT/FIT)等检测手段假阳性率高,敏感性有限,仅能发现部分进展期肿瘤。患者迫切需要更加精准、便捷、有效的方式来早期发现结直肠癌。而甲基化检测作为一种新兴的早筛技术,凭借无创便捷、精准度高为结直肠癌的早期发现、诊断和治疗提供了新的途径。中国研究团队基于基因甲基化异常与癌症发生的相关性,探讨了血液样本ctDNA甲基化对结直肠癌及腺瘤的筛查诊断,提出整合6个结直肠癌甲基化标志物基于qPCR的血液检测方法,用于结直肠癌的早期检测和术后监测[4]。
结直肠癌的发生与环境因素(如生活方式)、遗传因素及其相互作用相关。虽然环境风险因素的影响最大,但在欧洲(EUR)和东亚(EAS)人群中,基因变异可以分别解释大约7%-16%的结直肠癌遗传率,表明遗传变异在结直肠癌发展中起到重要作用。先前全基因组关联研究(GWASs)已经确定了100多个与结直肠癌风险相关的单核苷酸多态性(SNP),尽管这些SNP对结直肠癌患病风险的影响较小,但多基因风险评分(PRS)能够整合这些SNP的微弱效应,有效识别结直肠癌高风险个体。
2023年,中国研究者通过GWAS-meta分析鉴定出东亚和欧洲人群中与结直肠癌风险相关的常见遗传变异并构建跨族群的EAS-EUR PRS模型评估不同人群的遗传风险,同时提出健康生活方式能显著减轻遗传因素对结直肠癌发病的影响[5]。
PRS是结直肠癌风险评估的辅助工具,有助于优化早筛策略,帮助识别高遗传风险人群,为早筛提供参考依据(例如指导高风险个体更早或更频繁地进行筛查)。
三、结直肠癌分子分型
CRC分子分型的目的在于对患者实行个体化精准治疗和预测治疗反应和预后评估。
1
CRC分型联盟的共识分子亚型(CMS)[6]
(1)CMS 1(MSI免疫型,14%):以微卫星不稳定(MSI)为标志,伴有CpG岛甲基化表型(CIMP)高、BRAF基因突变,免疫细胞浸润显著。
(2)CMS 2(经典型,37%):以染色体不稳定(CIN)为主,Wnt/β-catenin和MYC信号通路激活。
(3)CMS 3(代谢型,13%):肿瘤细胞呈上皮样,具有KRAS基因突变,代谢通路异常(如糖代谢、脂质代谢)。
(4)CMS 4(间充质型,23%):以间质浸润、上皮-间质转化(EMT)为特征,TGF-信号通路激活,血管生成相关基因高表达,基质细胞(如癌相关成纤维细胞CAF)浸润明显。

2
癌症基因组图谱(TCGA)分型
(1)高突变型:以微卫星不稳定高(MSI-H)为主,多伴有MLH1基因启动子甲基化和CpG岛甲基化表型(CIMP-H),常出现BRAF V600E 基因突变,部分病例与DNA错配修复基因(如POLE/POLD1)突变相关。
(2)非高突变型:主要表现为染色体不稳定(CIN)通路激活,常见APC、KRAS、TP53等基因突变,体细胞拷贝数变异(SCNA)较为常见,微卫星稳定(MSS)或错配修复正常(pMMR)。
3
DNA甲基化分型
(1)Cluster 1(CIMP-H,CpG岛甲基化表型高):CpG岛高度甲基化,与MLH1 基因启动子超甲基化密切相关,常伴随BRAF V600E 突变。
(2)Cluster 2(CIMP-L,CpG岛甲基化表型低):CpG岛甲基化水平较低,KRAS 突变比例较高。
(3)Cluster 3:CpG岛甲基化阴性,TP53 突变频率较高。
(4)Cluster 4:低甲基化且突变频率低,染色体不稳定性(CIN)特征不明显。
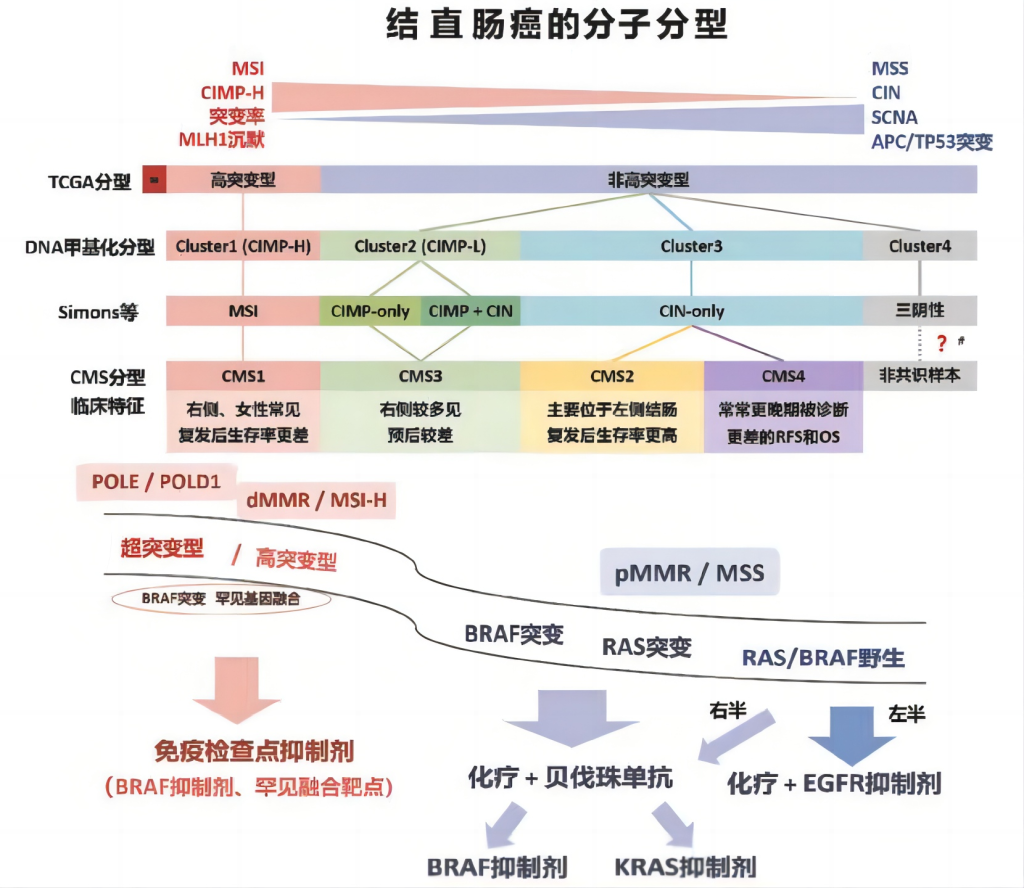
四、分子标志物检测与靶向药物
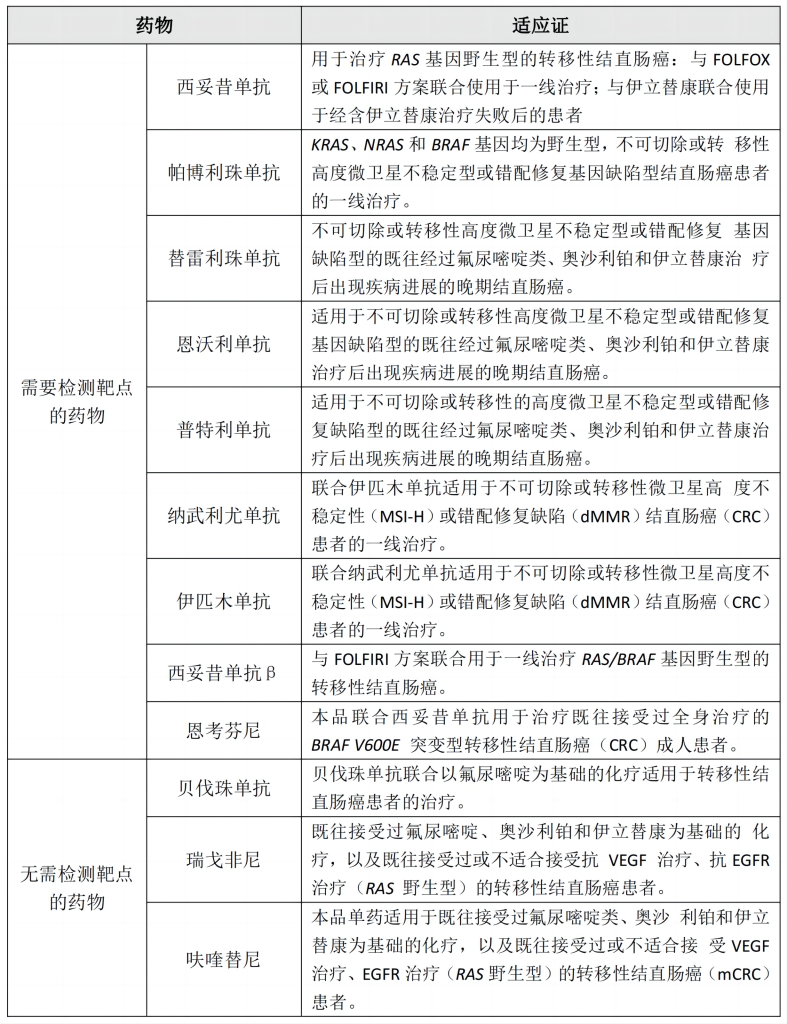
1
分子标志物检测
结直肠癌治疗已迈入精准化、个体化时代,分子标志物检测作为精准治疗的基石,在结直肠癌临床诊疗中发挥着日益重要的作用[7]。

2
结直肠癌治疗常用药物及适应证[8]
伯科生物在国内已经建设了全流程国产化的高通量核酸合成与应用技术转化中心,建立了GMP厂房和ISO9001、ISO13485质量体系。已经为国内外数百家知名医院、科学研究机构、临床检验所开发了上千款Gene Panel(液相基因芯片),并配套完整的检测试剂,各项性能参数均与国际竞品相当或优于(详见附表1),在基因组、转录组、甲基化组及病原体的检测应用方向均有成熟的产品管线。
附表1: 产品简介
肿瘤液相基因芯片
伯科设计的TargetCap® OncoGene Plus Research Panel基于美国食品药品监督管理局(FDA)批准的用于肿瘤基因检测的FoundationOne CDxTM与MSK-IMPACTTM,其覆盖702个肿瘤相关基因编码区和34个基因的非编码区(融合基因),含有6个MSI和53个化药相关位点,探针覆盖2.32Mb区间。这些区域涵盖更多基因,检测范围更泛,涉及肿瘤高频突变、肿瘤易感、药物靶向、药物耐受等多种类型基因。
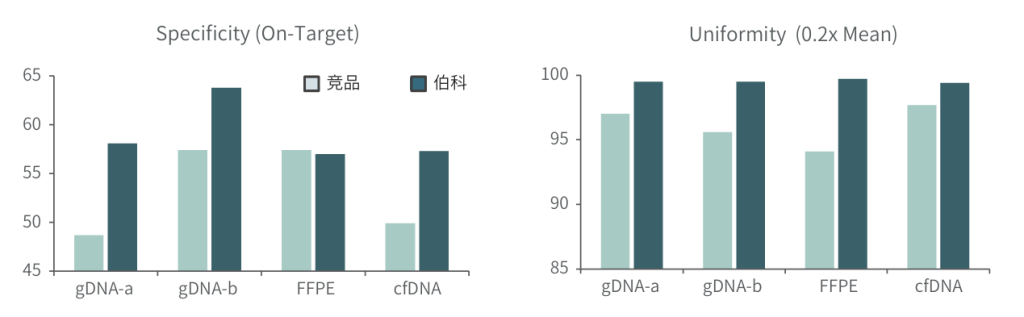
性能表现
竞品评测
采用gDNA/cfDNA/FFPE/泛肿瘤800gDNA标准品文库,分别使用伯科商品化肿瘤大Panel-OncoGene Plus Research Panel与竞品肿瘤大Panel进行性能比较(二者大小相近),在捕获特异性上(On-Target)和覆盖均一性(0.2XMean)上,伯科均优于竞品。
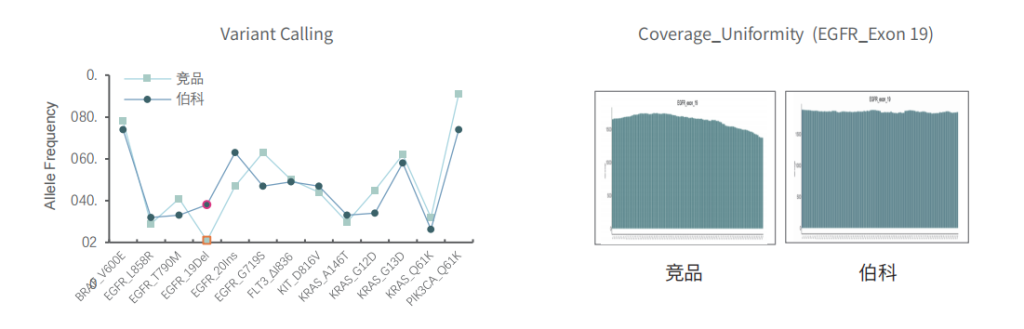
对于gDNA标准品,竞品测序35.9Gb,伯科测序19.6Gb,虽然伯科测序数据少,深度低,但二者的突变频率检出无明显差异,伯科对EGFR的19号外显子缺失变异的检出优于竞品。
不同样本类型表现
对不同质量的gDNA样本 (WBC/FFPE, >150例),TargetCap® OncoGene Plus Research Panel表现稳定。
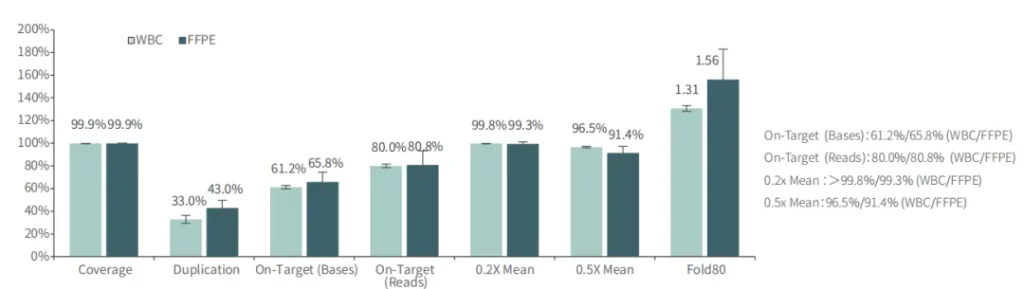
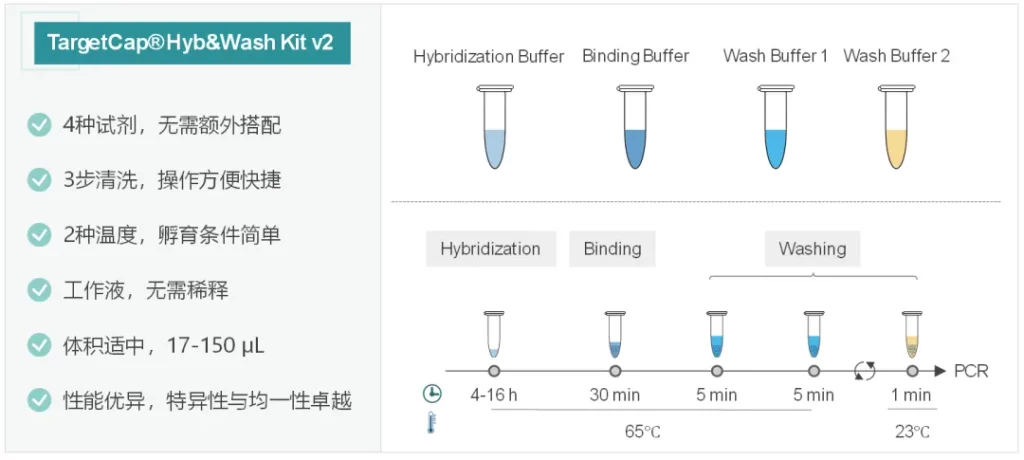
杂交与清洗试剂盒v2 简介
试剂盒概述
伯科杂交与清洗试剂盒v2 (TargetCap® Hybridization and Wash Kit v2,下文简称Hyb&Wash Kit v2)简化了试剂组分和操作流程,同时仍保持优异的捕获性能。Hyb&Wash Kit v2包含4种缓冲液组分,仅需3步清洗,操作流程更加便捷。
性能表现介绍
Ⅰ. 基本QC表现
使用NA12878和NA24694 gDNA标准品,采用三款不同大小的Gene Panel (650Kb、2.3Mb和42Mb) 对Hyb&Wash Kit v2 和 v1 进行比较测试。
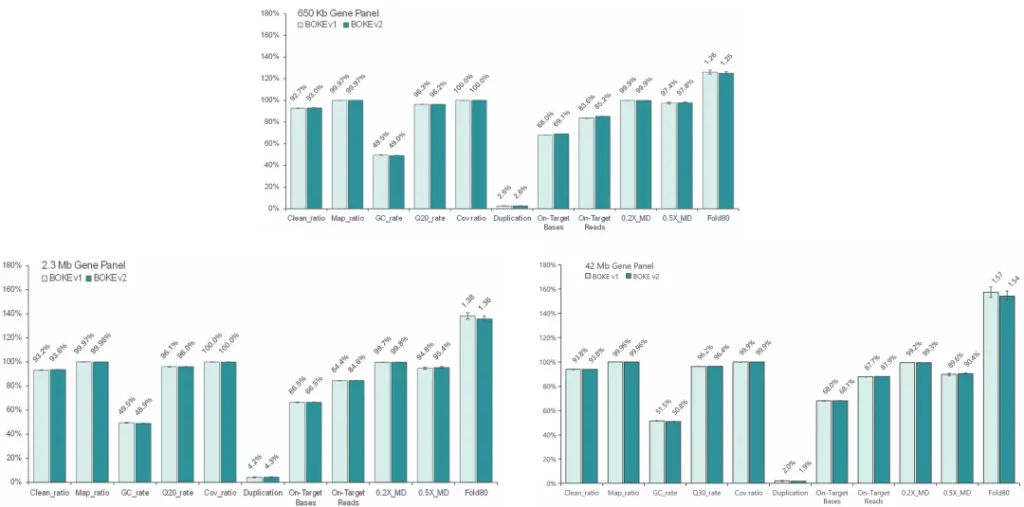
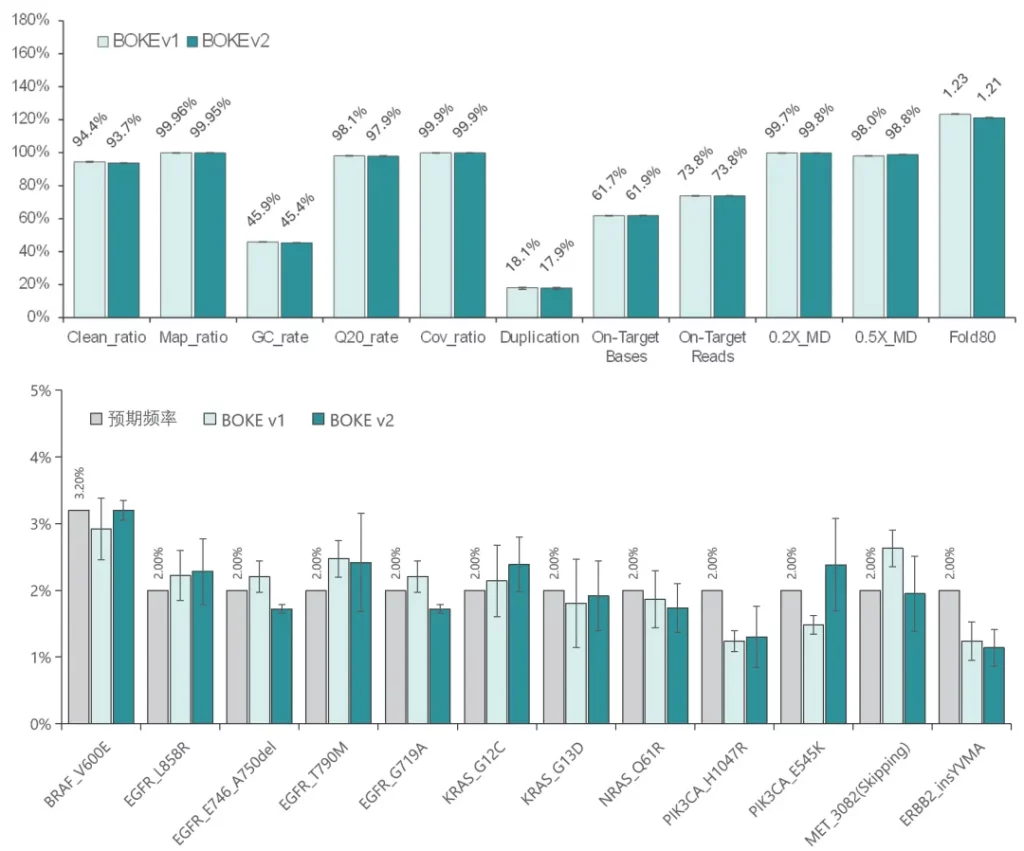
结果显示,在不同大小的Gene Panel中,对于杂交与清洗试剂盒的关键参数-中靶率和均一性,v2与v1试剂盒表现相当,v2试剂盒表现更好的均一性(0.2X_MD、0.5X_MD和Fold80)。
Clean_ratio、Map_ratio等基本参数两款试剂盒表现一致,由于v2试剂盒对低GC目标区域覆盖更佳,其GC_rate率略低于v1。
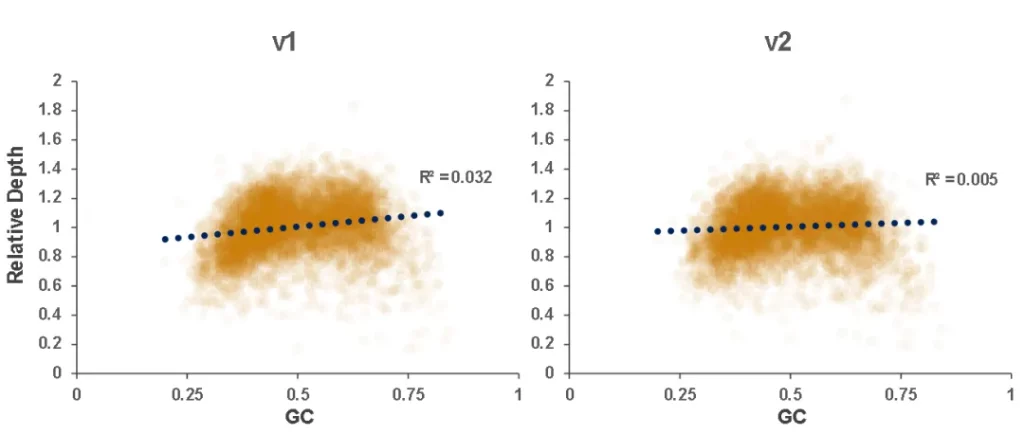
Ⅱ. 低频变异检测
使用肿瘤 SNV gDNA 标准品Ⅱ (GW-OGTM006) 对Hyb&Wash Kit v2的低频变异检测性能进行验证。GW-OGTM006 DNA标准品包含 EGFR、KRAS、NRAS、BRAF、PIK3CA、FGFR3、Her2、MET 等多个常见伴随诊断基因及位点,包含点突变、插入和缺失等多种变异类型。
采用300 Kb Gene Panel对该标准品进行捕获,捕获数据显示,v1与v2试剂盒的基本捕获性能表现相当,v2的中靶率与均一性略优于v1。同时,v1与v2试剂盒均能对12个已知变异准确检出。
参考文献:
1.Dekker E, Tanis PJ, et al. Colorectal cancer. Lancet. 2019 Oct 19;394(10207):1467-1480.
2.Fearon ER, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell. 1990 Jun 1;61(5):759-67.
3.Li Q, Geng S, et al. Signaling pathways involved in colorectal cancer: pathogenesis and targeted therapy. Signal Transduct Target Ther. 2024 Oct 7;9(1):266.
4.Cai G, Cai M,et al. A Multilocus Blood-Based Assay Targeting Circulating Tumor DNA Methylation Enables Early Detection and Early Relapse Prediction of Colorectal Cancer. Gastroenterology. 2021 Dec;161(6):2053-2056.e2.
5.Xin J, Du M,et al. Risk assessment for colorectal cancer via polygenic risk score and lifestyle exposure: a large-scale association study of East Asian and European populations. Genome Med. 2023 Jan 24;15(1):4.
6.Guinney J, Dienstmann R,et al. The consensus molecular subtypes of colorectal cancer. Nat Med. 2015 Nov;21(11):1350-6.
7.结直肠癌分子病理检测临床实践指南(2025版),中华病理学杂志,2025.
8.新型抗肿瘤药物临床应用指导原则(2025年版),国家卫生健康委


