2026.V1.0 NCCN指南|非小细胞肺癌诊疗方案、靶向治疗及作用机制
- boke
- 2026-01-23
- 1:36 下午
一、疾病概述
肺癌作为全球癌症相关死亡的首要原因,每年约导致220万新发癌症病例以及超过180万例死亡。非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)是肺癌中最常见的类型,约占所有肺癌病例的85%。根据病理类型,非小细胞肺癌主要分为:腺癌、鳞状细胞癌、腺鳞癌、大细胞癌等亚型。NSCLC患病风险因素包括吸烟、环境因素、遗传因素、肺部慢性疾病等。
二、NSCLC临床分期
非小细胞肺癌的临床分期主要采用国际肺癌研究协会(IASLC)发布的第9版TNM分期系统,该系统基于肿瘤的大小和范围(T)、淋巴结受累情况(N)以及远处转移(M)进行综合评估。



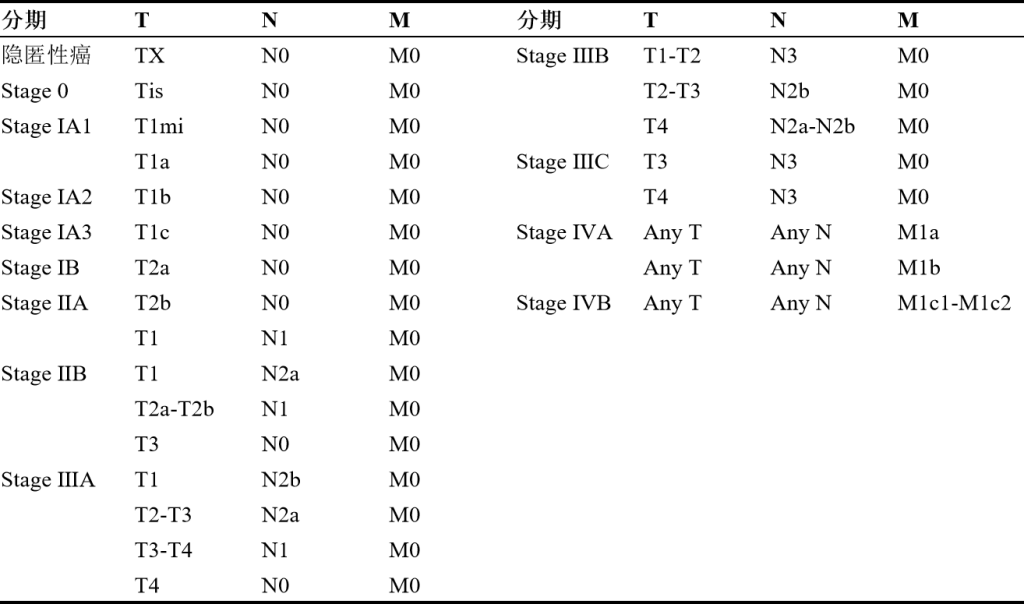
图 1 肺癌TNM分期系统
三、NSCLC临床评估与治疗方案
病理确诊为NSCLC后,需完成多方面初始评估,然后进行临床分期,根据分期结果进行分层诊疗。
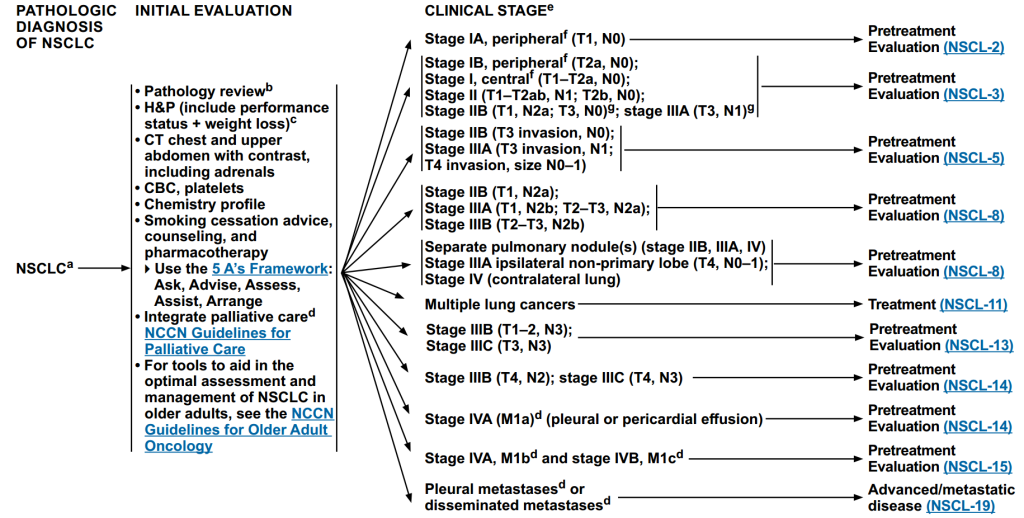
图 2 NSCLC临床分期诊疗路径
1
不同分期治疗方案
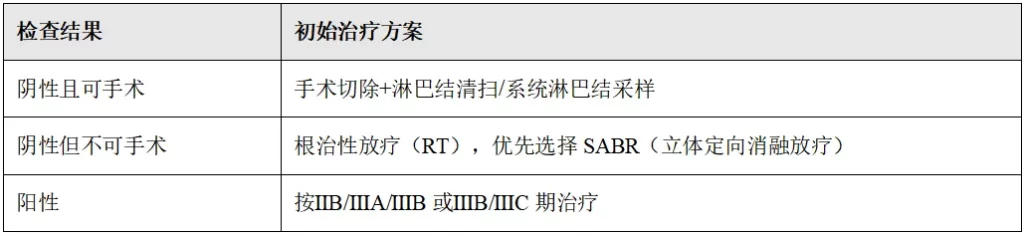
(1)IA期(外周T1,N0)
治疗前需完成以下检查项目:
评估肺功能检查(PFT)(如果之前未进行)、支气管镜检查(术中首选)、考虑病理淋巴结评估、FDG-PET/CT扫描(如果之前未进行)。
根据纵隔淋巴结的病理结果(阴性/阳性),进行不同的治疗方案:
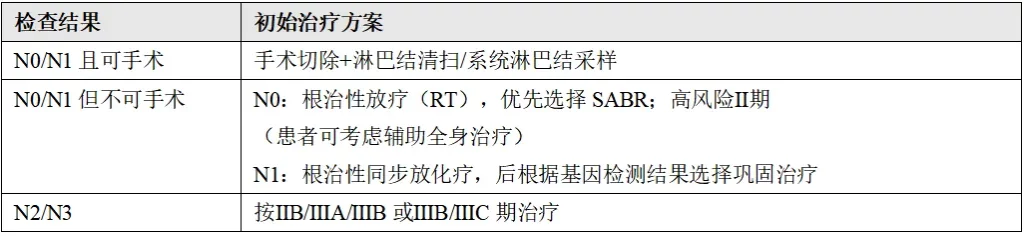
(2)IB期(外周T2a,N0);I期(中央T1-T2a,N0)Ⅱ期(T1-T2ab,N1;T2b,N0)ⅡB期(T1,N2a;T3,N0)ⅢA期(T3,N1)
治疗前需完成以下检查项目:
围手术期治疗评估、生物标志物检测(包括EGFR、ALK和PD-L1)、PFT(如果之前未进行)、支气管镜检查、病理淋巴结评估、FDG-PET/CT扫描(如果之前未进行)、脑部MRI(Ⅱ期、ⅢA期、IB期可选)。
根据纵隔淋巴结转移情况(N0/N1、N2/N3),进行不同的治疗方案。
根据IA~ⅢB期的手术切缘状态,进行对应的辅助治疗。
注:R0=完全切除,切缘阴性;R1=显微镜下切缘阳性;R2=剩余大体未切除肿瘤。
(3)ⅡB期(T3浸润,N0);ⅢA期(T3浸润,N1;T4浸润,N0-1)
治疗前需完成检查项目:同(2)。
根据评估结果(肿瘤侵犯部位、淋巴结转移状态及是否存在远处转移),进行不同的治疗方案。
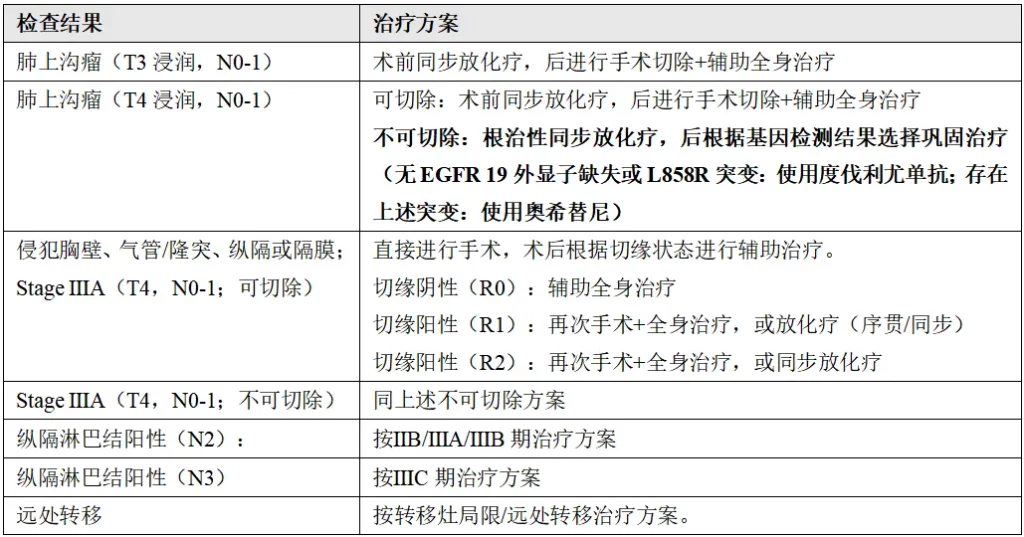
(4)ⅡB期(T1,N2a);ⅢA期(T1,N2b;T2-T3,N2a);ⅢB期(T2-T3,N2b)
治疗前需完成检查项目:同(2)。
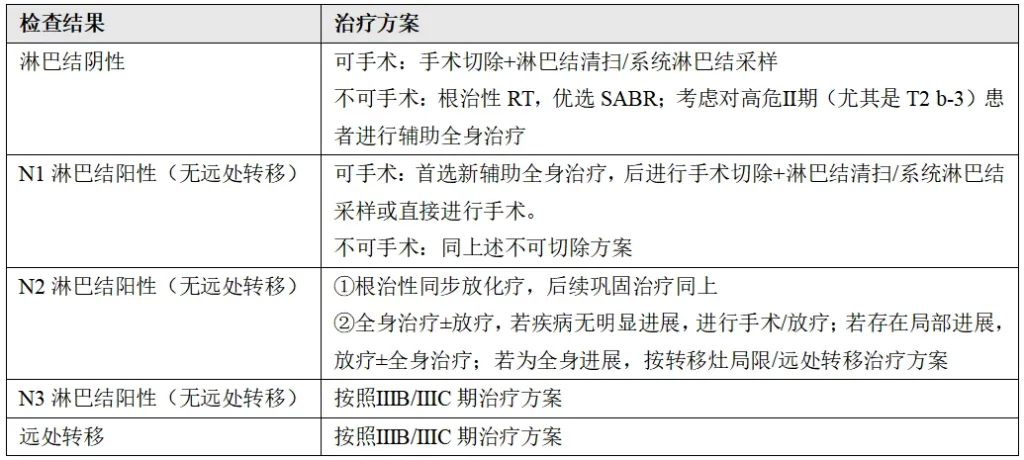
(5)单独的肺结节(ⅡB、ⅢA、Ⅳ期);ⅢA期同侧非主叶(T4,N0-1);Ⅳ期(对侧肺)
治疗前需完成检查项目:同(2)。
根据结节位置和是否存在胸外转移,进行不同的治疗方案。

(6)多发性肺癌
治疗前需完成以下检查:增强胸部CT、FDG-PET/CT(若未完成)、脑增强MRI,明确是否存在胸外转移。
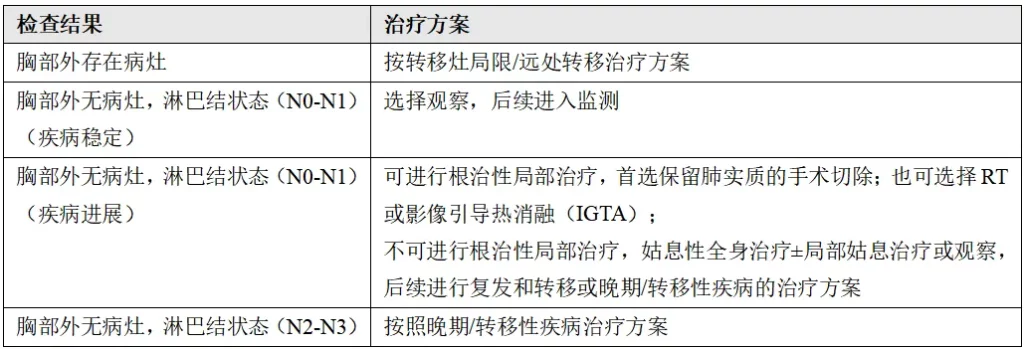
(7)ⅢB期(T1-2,N3);ⅢC期(T3,N3)
治疗前需完成以下检查项目:同(2)
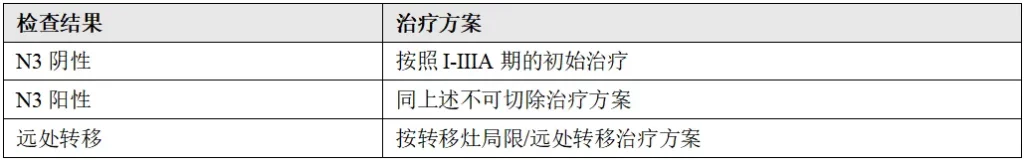
(8)ⅢB期(T4,N2);ⅢC期(T4,N3)
治疗前需完成以下检查项目:同(2)
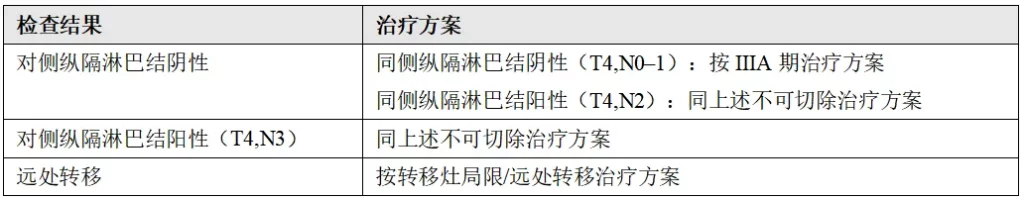
(9)ⅣA期(M1a)(胸膜或心包积液)
治疗前需完成以下检查项目:FDG-PET/CT扫描(如果之前未进行)、脑部MRI、生物标志物检测、胸腔穿刺术或心包穿刺术±胸腔镜检查。
胸腔积液阴性:按原发灶的TNM分期进行治疗
胸腔积液阳性:局部处理(必要时):胸膜固定术、留置引流管、心包开窗等
全身治疗:按IV期疾病(孤立灶或广泛转移)治疗方案
(10)ⅣA期,M1b和ⅣB期,M1c
治疗前需完成以下检查项目:生物标志物检测、脑部MRI、FDG-PET/CT扫描、转移性病变的病理学确认。
基于体能状态与转移灶特征的分层治疗:
PS 3–4:患者体能状态差,按照晚期/转移性疾病治疗方案进行。
PS 0-1:患者体能良好,进一步按转移灶数量/位置进行不同的治疗。
注:PS(Performance Status)是指患者体能状态评分,用于评估患者日常活动能力和对治疗的耐受能力。
① 多发转移病灶:按照晚期/转移性疾病治疗方案进行。
② 孤立/局限转移病灶:按转移部位进一步处理。
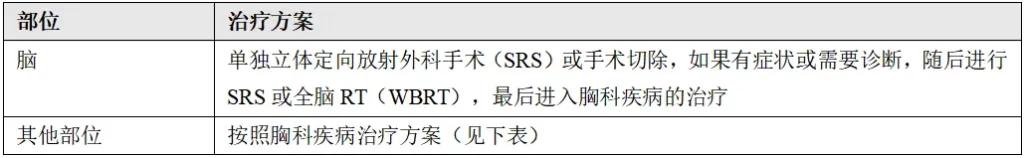
胸科疾病治疗方案:
根据晚期/转移性疾病方案考虑全身治疗,并重新分期以确认未进展或继续进行根治性治疗,按T/N分期进行不同的初始治疗。初始治疗后,按照晚期/转移性疾病方案治疗。
(11)胸膜转移或播散性转移
按照晚期/转移性疾病方案进行治疗。
四、监测方案与复发、晚期/转移性疾病治疗方案
(1)根据初始治疗方式和分期,制定监测方案
I-Ⅱ期(初始治疗含手术±全身治疗)
前2–3年:每6个月进行体格检查(H&P)+增强胸部CT;之后每年H&P+低剂量非增强胸部CT。
I-Ⅱ期(初始治疗含放疗)、Ⅲ期或寡转移Ⅳ期(根治性治疗)
前3年:每3–6个月H&P+增强胸部CT;接下来2年:每6个月H&P+增强胸部CT;之后每年H&P+低剂量非增强胸部CT
通用辅助措施:
全程提供戒烟建议、咨询及药物治疗;脑MRI(仅在风险评估提示临床需要时进行);癌症生存者护理。
(2)复发后评估与处理
若出现复发,进行FDG-PET/CT(全身评估)和脑MRI(平扫+增强,排查脑转移)。局部区域复发:根据不同的局部并发症类型,采取针对性治疗。
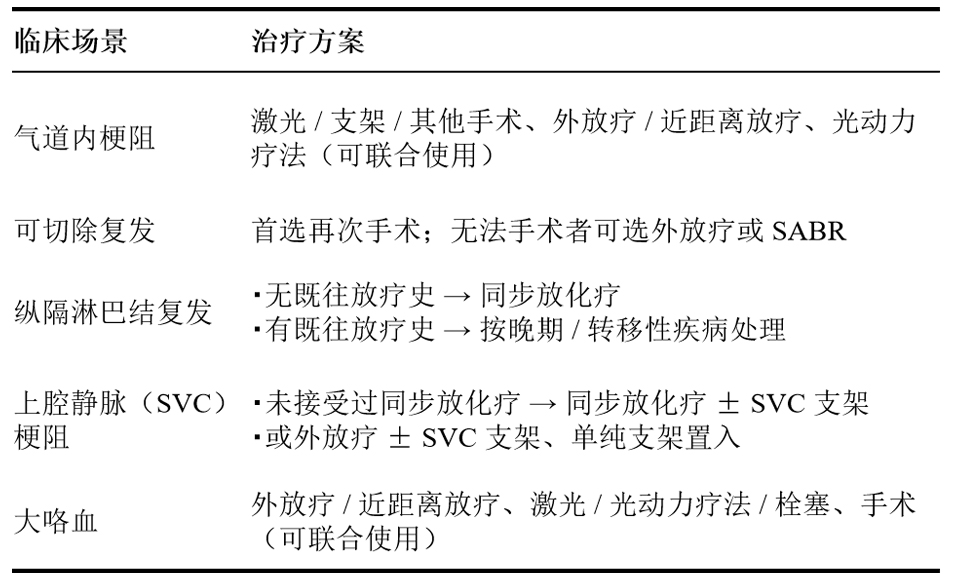
完成治疗之后,需进行增强胸部CT、脑 RI(平扫 + 增强)、FDG-PET/CT。
无播散性疾病证据→观察,或按晚期/转移性疾病处理。
有播散性疾病证据→进入晚期/转移性疾病处理。
远处转移:根据转移部位和范围,选择治疗方案。

治疗完成之后,进入晚期/转移性疾病处理。
(3)晚期/转移性疾病治疗方案
明确组织学亚型,进行生物标志物检测,通过精准分子分型指导后续靶向/免疫治疗。
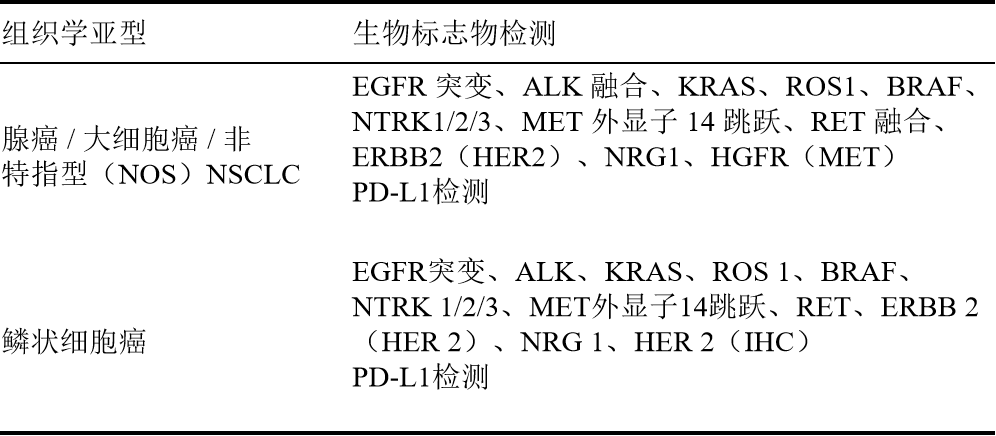
五、生物标志物检测方法及治疗方案
(1)EGFR 19del或L858R突变
检测方法:实时PCR、NGS是EGFR突变检测常用方法。
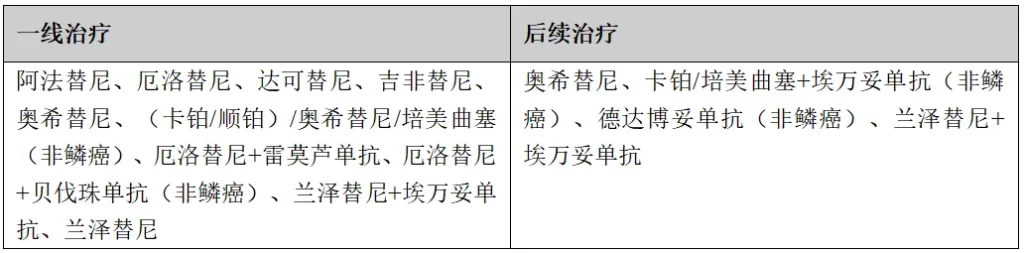
(2)S768I、L861Q、和/或G719X突变
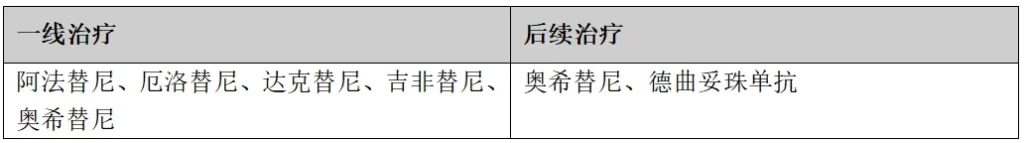
(3)EGFR 外显子20插入突变
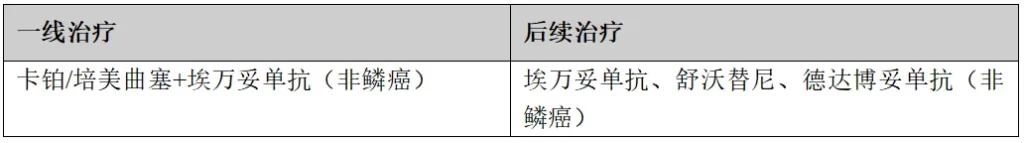
(4)KRAS G12C突变
检测方法:NGS、实时PCR、Sanger测序
后续治疗:索托拉西布、阿达格拉西布。
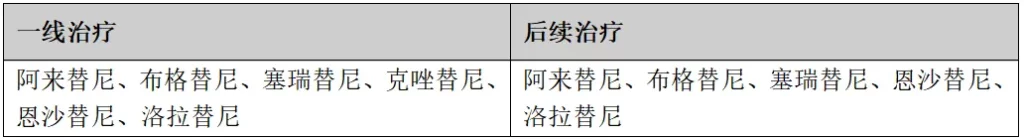
(5)ALK基因融合
检测方法:IHC、FISH、NGS
(6)ROS1基因融合
检测方法:初筛:IHC;确认:FISH、RNA-NGS、DNA-NGS(易漏检)
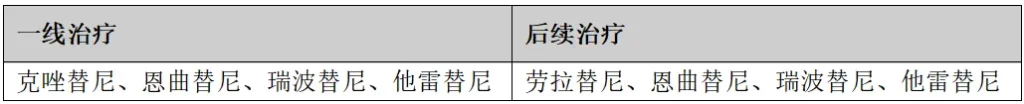
(7)BRAF V600E突变
检测方法:NGS、实时PCR
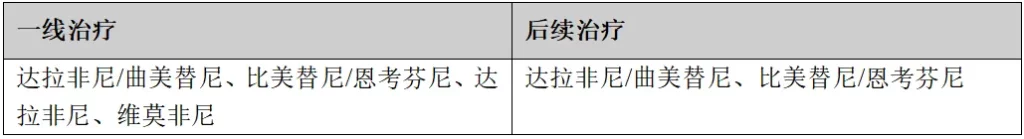
(8)NTRK1/2/3基因融合
检测方法:FISH、IHC、PCR、NGS
一线/后续治疗:拉罗替尼、恩曲替尼、瑞普替尼。
(9)MET Exon 14跳跃突变
检测方法:NGS
一线/后续治疗:卡马替尼、克唑替尼、特泊替尼。
(10)RET基因融合
检测方法:RNA-NGS、DNA-NGS、FISH

(11)ERBB2(HER2)突变
检测方法:NGS
后续治疗:可选德曲妥珠单抗、恩美曲妥珠单抗、宗格替尼。
检测方法:DNA-NGS,RNA-NGS、FISH(需NGS确认)
后续治疗:泽妥珠单抗。
后续治疗:德曲妥珠单抗
(14)MET(HGFR)(≥50% IHC3+且EGFR野生型)
检测方法:IHC
后续治疗:特立妥珠单抗(非鳞癌)。
(15)PD-L1
检测方法:IHC
六、NSCLC治疗药物具体机制
1
EGFR-TKI(表皮生长因子受体—酪氨酸激酶抑制剂)
作用靶点:EGFR
作用机制:
(1)一代TKI:通过与ATP竞争位于EGFR激酶区的ATP结合位点可逆性结合,抑制EGFR的酪氨酸激酶活性,并且其选择性较低,还会抑制正常细胞的EGFR蛋白功能,导致一些不良反应的发生。
药物:厄洛替尼、吉非替尼
(2)二代TKI:以共价键结合的方式与EGFR激酶区的ATP结合位点不可逆地结合,形成更稳定的药物-靶点复合物,从而更彻底地阻断EGFR信号通路。这种不可逆结合使得药物对EGFR的抑制作用更强、更持久,能更有效地抑制肿瘤细胞的生长和增殖。除了抑制EGFR,还能抑制EGFR家族的其他成员(如HER2、HER4),具有更广泛的靶点覆盖范围。
药物:阿法替尼、达克替尼
(3)三代TKI:专门针对EGFR敏感突变和T790M耐药突变设计,以不可逆性共价结合的方式特异性地与T790M突变型EGFR结合,同时对野生型EGFR的抑制作用较弱。这种选择性结合使得药物在有效抑制肿瘤细胞生长的同时,减少了对正常细胞的毒性作用,降低了不良反应的发生风险。
药物:奥希替尼
2
ALK抑制剂
作用靶点:ALK(间变性淋巴瘤激酶)
(1)一代:ALK融合蛋白激酶域的ATP结合位点结合,阻止ATP与ALK蛋白结合,从而抑制ALK激酶活性,阻断下游信号通路(如MAPK、PI3K/AKT等)的激活,抑制肿瘤细胞的生长、增殖和存活。
药物:克唑替尼
(2)二代:在第一代基础上进行了结构优化,增强了对ALK激酶域的结合亲和力和选择性,同时提高了血脑屏障透过率。
药物:塞瑞替尼、布格替尼、阿来替尼、恩沙替尼
(3)三代:采用大环酰胺结构,与ALK激酶域的ATP结合口袋结合更紧密、更深入,能更有效地阻断ALK信号通路。同时,其结构设计减少了P-糖蛋白介导的药物外排,提高了血脑屏障透过率,对ALK耐药突变(如G1202R等)有更强的抑制作用,可克服第一代和第二代ALK抑制剂的耐药问题。
药物:洛拉替尼
3
达拉非尼
作用靶点:BRAF,尤其是BRAF V600E、V600K和V600D突变型激酶
作用机制:BRAF是RAS/RAF/MEK/ERK信号通路中的关键蛋白,该通路在细胞生长、分化和存活中起重要作用。BRAF V600E等突变会导致该蛋白持续激活,促使癌细胞增殖和存活。达拉非尼通过抑制突变型BRAF蛋白的活性,阻断信号通路的异常激活,从而抑制癌细胞的生长和扩散。
达拉非尼常与MEK抑制剂(如曲美替尼)联合使用。曲美替尼作用于BRAF下游的MEK蛋白,两者联合可从上下游全面阻断RAS/RAF/MEK/ERK信号通路,更有效地抑制肿瘤细胞生长,延缓耐药性的出现,提高治疗效果。
4
维莫非尼
作用靶点:BRAF V600E
作用机制:维莫非尼能特异性地结合并抑制BRAF V600E突变蛋白的活性,阻止其异常激活,从而阻断细胞内信号传导通路,抑制肿瘤细胞的生长和增殖。
5
德曲妥珠单抗
作用靶点:HER2
作用机制:德曲妥珠单抗的抗体部分(曲妥珠单抗)能特异性地识别并结合肿瘤细胞表面过度表达或突变的HER2蛋白。抗体与HER2结合后,整个复合物通过胞吞作用进入肿瘤细胞内部。在细胞内,溶酶体酶会裂解连接子,释放出携带的细胞毒性药物——拓扑异构酶I抑制剂(DXd)。释放的DXd进入细胞核,与DNA拓扑异构酶I结合,抑制该酶的活性,导致DNA链断裂且无法修复,从而阻断DNA复制和转录过程,最终诱导肿瘤细胞凋亡。
6
阿达格拉西布
作用靶点:KRAS G12C
作用机制:阿达格拉西布是一种共价不可逆抑制剂,能够特异性地与KRAS G12C突变蛋白中的半胱氨酸残基形成共价键。这种结合将KRAS G12C蛋白锁定在非活性状态(GDP结合态),阻止其与GTP(鸟嘌呤三磷酸)结合,从而抑制KRAS蛋白的激活,阻断下游信号传导,使肿瘤细胞的生长和分裂受到抑制,诱导细胞周期停滞和凋亡。
7
索托拉西布
作用靶点:KRAS G12C
作用机制:索托拉西布同样与KRAS G12C蛋白的突变半胱氨酸残基共价结合,但其更侧重于抑制KRAS G12C的GTP酶活性,通过这种方式将KRAS G12C锁定在非活性状态,进而阻断下游信号通路,抑制肿瘤细胞生长和存活。
8
卡马替尼、特泊替尼、克唑替尼
作用靶点:MET
作用机制:
(1)卡马替尼是一种高选择性MET抑制剂,属于Ib型ATP竞争性抑制剂。它通过精准结合MET激酶的ATP结合口袋,与ATP竞争性结合来抑制酪氨酸激酶磷酸化,从而阻断MET信号通路的激活,抑制肿瘤细胞的增殖、存活、迁移和血管生成等过程,发挥抗肿瘤作用。
(2)特泊替尼与卡马替尼作用机制类似。
(3)克唑替尼是一种多靶点酪氨酸激酶抑制剂,属于Ia型ATP竞争性抑制剂。它主要作用于ALK、ROS1、MET和RON等受体的酪氨酸激酶结构域,通过抑制这些受体的酪氨酸激酶活性,阻断肿瘤细胞的信号传导通路,从而抑制肿瘤细胞的增殖、存活和扩散。
9
拉罗替尼
作用靶点:NTRK基因融合
作用机制:拉罗替尼是一种高选择性的TRK抑制剂,能够特异性地结合NTRK基因融合产生的异常TRK融合蛋白,阻断其激酶活性,进而抑制下游信号通路的激活和传递,如PI3K-AKT、RAS-RAF-MEK-ERK等信号通路,从而抑制癌细胞的生长、增殖和存活,诱导癌细胞凋亡,达到治疗肿瘤的目的。
10
恩曲替尼
作用靶点:恩曲替尼是一种多靶点酪氨酸激酶抑制剂,主要作用靶点包括:NTRK基因融合、ROS1、ALK基因重排
作用机制:
(1)恩曲替尼能特异性结合TRK激酶结构域,抑制其磷酸化活性,阻断下游信号通路(如PI3K-AKT、MAPK等),使肿瘤细胞周期停滞并诱导凋亡,从而抑制肿瘤生长。
(2)ROS1基因融合在部分非小细胞肺癌等肿瘤中常见。融合后的ROS1蛋白持续激活下游信号,促进肿瘤细胞生长。恩曲替尼可有效抑制ROS1激酶活性,阻断其信号传导,抑制肿瘤细胞增殖和存活,对ROS1阳性的局部晚期或转移性非小细胞肺癌患者具有显著治疗作用。
(3)ALK基因融合是多种肿瘤(如肺癌、神经母细胞瘤等)的致癌驱动因素。恩曲替尼能抑制ALK激酶活性,阻断ALK介导的信号通路,抑制肿瘤细胞的生长和存活,对ALK阳性的肿瘤细胞具有抑制作用。
11
塞普替尼
作用靶点:RET重排和突变
作用机制:RET基因可能发生突变或与其他基因融合,导致RET蛋白持续激活,驱动癌细胞异常增殖、存活和转移。塞普替尼能够特异性地与RET蛋白结合,阻断其激酶活性,从而抑制异常的信号传导通路,阻止癌细胞的生长、增殖和扩散。
12
普拉替尼
作用靶点:RET重排和突变
作用机制:与塞普替尼类似
13
卡博替尼
作用靶点:包括MET、VEGFR1/2/3、RET、KIT、FLT3、AXL、NTRK、ROS1等。
作用机制:卡博替尼能够直接结合RET蛋白的激酶域,阻断其磷酸化激活过程,从而抑制RET信号通路的传导。这有助于阻止肿瘤细胞因RET异常激活而产生的增殖、存活和迁移信号。
14
西米普利单抗
作用靶点:PD-1
作用机制:PD-1是T细胞表面的一种受体,其配体PD-L1和PD-L2在肿瘤细胞表面常高表达。当PD-1与PD-L1/L2结合时,会向T细胞传递抑制信号,使T细胞活性降低,无法有效识别和攻击肿瘤细胞,这是肿瘤细胞逃避机体免疫监视的重要机制。西米普利单抗能够特异性地结合T细胞表面的PD-1受体,阻断PD-1与PD-L1/L2的相互作用,从而解除这种免疫抑制状态。
15
塔拉妥单抗
作用靶点:DLL3、CD3
作用机制:塔拉妥单抗是一种双特异性T细胞接合剂(BiTE),能同时结合肿瘤细胞上的“靶点”——DLL3和免疫细胞上的“开关”——CD3。
通过同时结合DLL3和CD3,塔拉妥单抗形成一个桥梁结构,将T细胞引导至肿瘤细胞附近,并激活T细胞的杀伤功能。激活后的T细胞会释放细胞毒性物质(如穿孔素、颗粒酶等),直接诱导肿瘤细胞凋亡,从而实现对小细胞肺癌细胞的特异性杀伤。
16
依沃西单抗
作用靶点:PD-1/VEGF
作用机制:沃西单抗是一种PD-1/VEGF双特异性抗体,其作用机制主要通过同时靶向PD-1和VEGF两个关键靶点实现,具体机制为:
(1)依沃西单抗的抗PD-1片段可特异性结合T细胞表面的PD-1受体,阻断PD-1与PD-L1/L2的相互作用,解除肿瘤对T细胞的抑制,恢复T细胞对肿瘤细胞的识别和杀伤功能,增强免疫系统对肿瘤的攻击能力。
(2)依沃西单抗的抗VEGF片段可结合VEGF-A,阻止其与血管内皮细胞受体(VEGFR)结合,抑制肿瘤血管生成,切断肿瘤的营养供应,从而抑制肿瘤生长和转移。
17
泽妥珠单抗
作用机制:
(1)NRG1基因融合会导致神经调节蛋白1(NRG1)的异常表达,其结构域与HER3受体结合,激活下游致癌信号通路。泽妥珠单抗通过特异性结合HER3,阻止NRG1或NRG1融合蛋白与HER3的相互作用,从而抑制HER3的激活,阻断肿瘤细胞的增殖和生存信号。
(2)HER2和HER3形成异源二聚体是肿瘤细胞增殖和存活的关键步骤。泽妥珠单抗同时结合HER2和HER3,干扰二者之间的相互作用,阻止异源二聚体的形成,进而抑制下游PI3K/AKT、MAPK等致癌信号通路的激活,抑制肿瘤细胞的生长和分裂。
伯科生物在国内已经建设了全流程国产化的高通量核酸合成与应用技术转化中心,建立了GMP厂房和ISO9001、ISO13485质量体系。已经为国内外数百家知名医院、科学研究机构、临床检验所开发了上千款Gene Panel(液相基因芯片),并配套完整的检测试剂,各项性能参数均与国际竞品相当或优于(详见附表1),在基因组、转录组、甲基化组及病原体的检测应用方向均有成熟的产品管线。
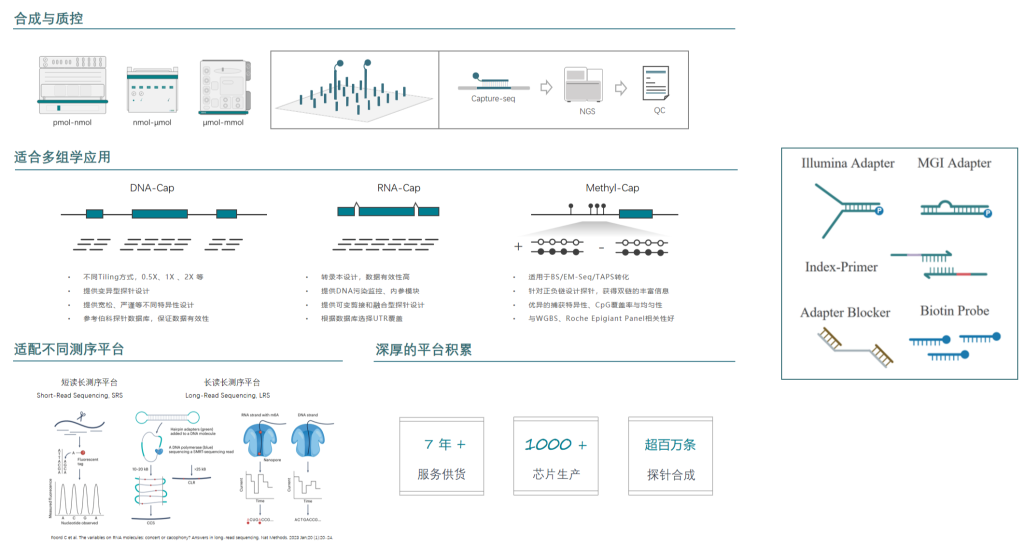
附表1: 产品简介
肿瘤液相基因芯片
伯科设计的TargetCap® OncoGene Plus Research Panel基于美国食品药品监督管理局(FDA)批准的用于肿瘤基因检测的FoundationOne CDxTM与MSK-IMPACTTM,其覆盖702个肿瘤相关基因编码区和34个基因的非编码区(融合基因),含有6个MSI和53个化药相关位点,探针覆盖2.32Mb区间。这些区域涵盖更多基因,检测范围更泛,涉及肿瘤高频突变、肿瘤易感、药物靶向、药物耐受等多种类型基因。
性能表现
竞品评测
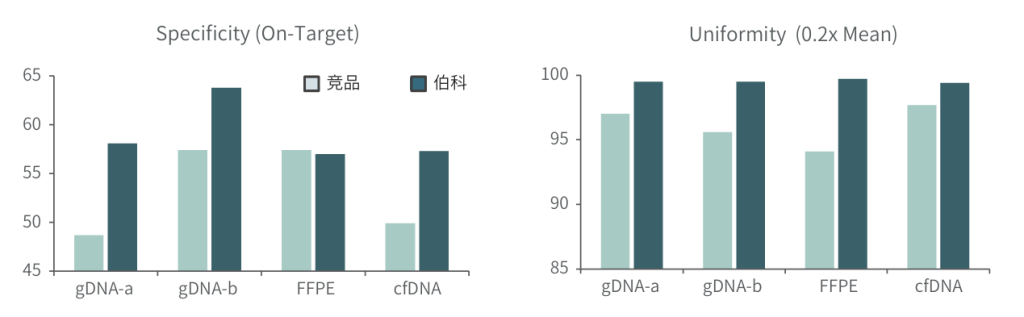
采用gDNA/cfDNA/FFPE/泛肿瘤800gDNA标准品文库,分别使用伯科商品化肿瘤大Panel-OncoGene Plus Research Panel与竞品肿瘤大Panel进行性能比较(二者大小相近),在捕获特异性上(On-Target)和覆盖均一性(0.2XMean)上,伯科均优于竞品。
对于gDNA标准品,竞品测序35.9Gb,伯科测序19.6Gb,虽然伯科测序数据少,深度低,但二者的突变频率检出无明显差异,伯科对EGFR的19号外显子缺失变异的检出优于竞品。
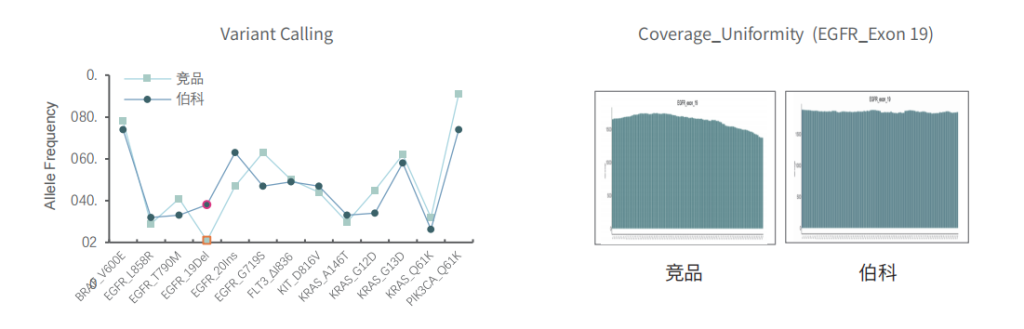
不同样本类型表现
对不同质量的gDNA样本 (WBC/FFPE, >150例),TargetCap® OncoGene Plus Research Panel表现稳定。
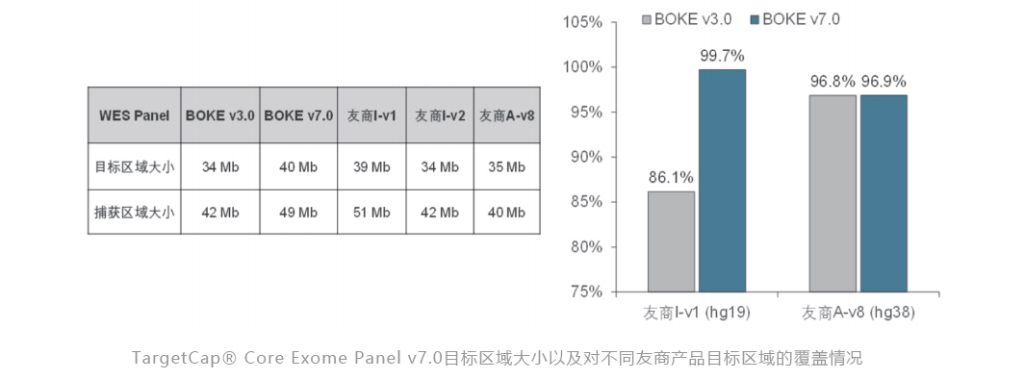
人全外显子液相基因芯片 v7.0
为更好保证的临床科研与转化的延续性和全面性,伯科公司已推出人全外显子液相基因芯片的升级产品-TargetCap® Core Exome Panel v7.0 ( 下文简称 BOKE v7.0 ),该 Panel 加强了基因组 hg19 传统研究区域的覆盖,兼顾 hg19 & hg38 双版本基因组,同时添加了部分明确了表型的基因,覆盖基因数量超20000个。
BOKE v7.0 也可灵活的与扩展模块组合使用,满足不同场景的临床研究的需求及转化应用,包括了线粒体、遗传病非编码区变异位点、 单基因全覆盖、 病毒基因组、 肿瘤全景变异检测、 重大疾病多基因风险评估模块等。 此外,伯科公司自研自造的寡核苷酸合成平台可以快速响应个性化定制需求,为人类基因组分子遗传学的研究与转化,提供更加全面高效的解决方案。

数据表现
在捕获性能方面,BOKE v7.0依然表现优异,与TargetCap® Core Exome Panel v3.0表现相近。在测序9Gb条件下,平均深度达到110x左右,20x和30x以上区域占比分别为99.5%和98.5%,Fold 80为1.5-1.6之间,与国际领先产品数据表现相当。
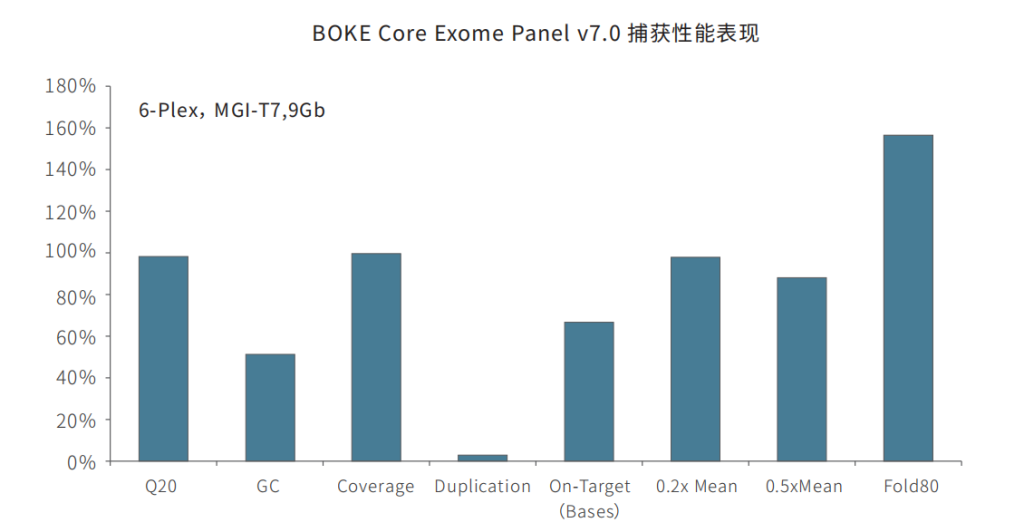
BOKE v3.0&BOKE v7.0对比
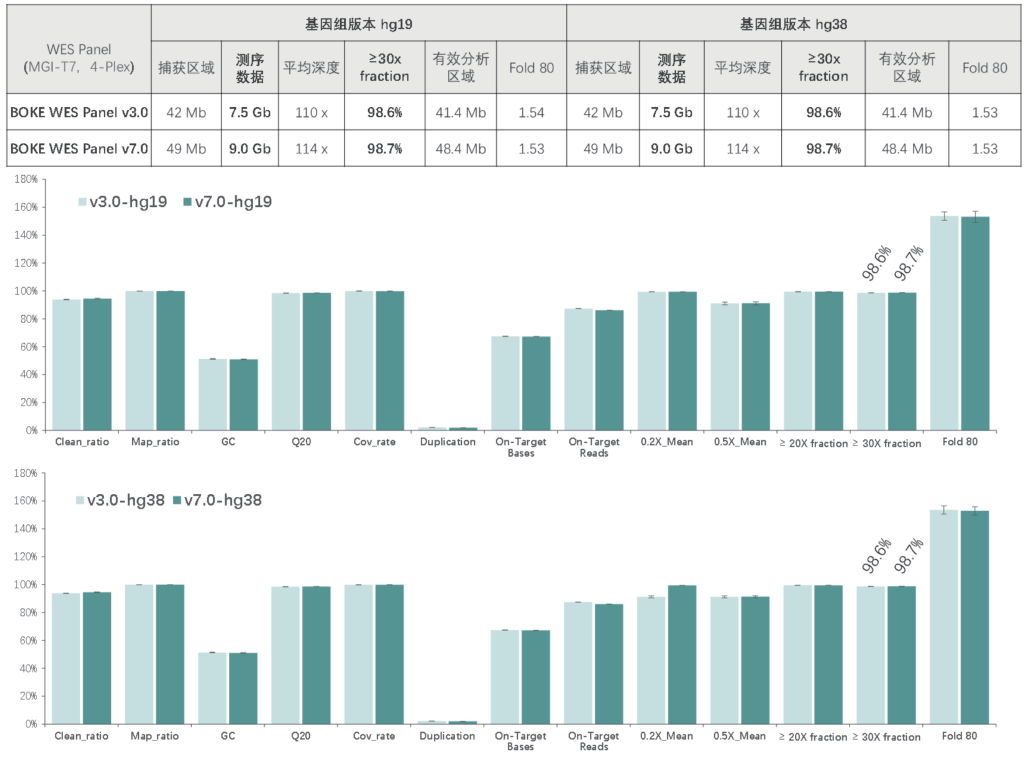
竞品对比
该WES Panel增强了基因组 hg19 传统研究区域的覆盖,兼顾 hg19 & hg38 双版本基因组,可以更好的保证临床科研与转化的延续性。目标区域和捕获区域大小分别为 40 Mb 和 49 Mb ,对 hg19 传统研究区域覆盖提升至99.7% (友商I-v1),hg38 传统研究区域覆盖相近(友商A-v8)。同时,新添加数百个具有一定功能与表型的基因,总基因数量达到20000+。
杂交与清洗试剂盒v2 简介
产品概述
伯科杂交与清洗试剂盒v2 (TargetCap® Hybridization and Wash Kit v2)简化了试剂组分和操作流程,同时仍保持优异的捕获性能。该试剂盒由4种缓冲液组成,分别为Hyb Buffer、Bingding Buffer、Wash Buffer 1和Wash Buffer 2,所有试剂均为1x缓冲液,可以直接使用,同时清洗步骤仅需3步,整个操作流程更加便捷。

基本捕获性能
使用NA12878和NA24694 DNA标准品,分别采用不同大小的Gene Panel对TargetCap® Hybridization and Wash Kit v1和v2进行比较。结果显示,在不同大小的 Gene Panel 中, v2试剂盒的中靶率和均一性与v1试剂盒表现基本一致,v2试剂盒表现略好。
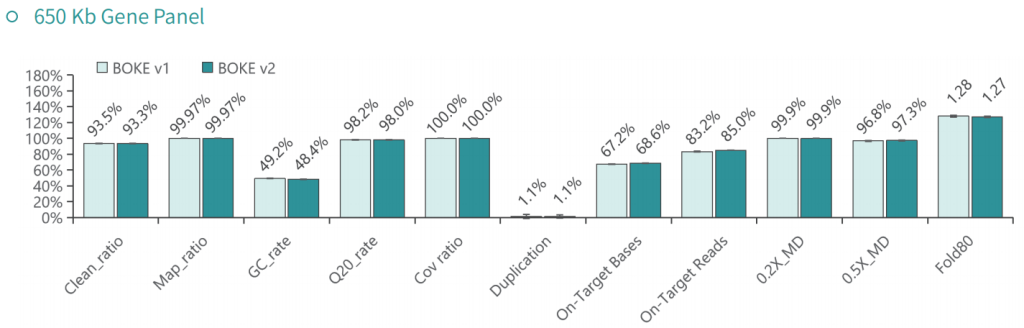
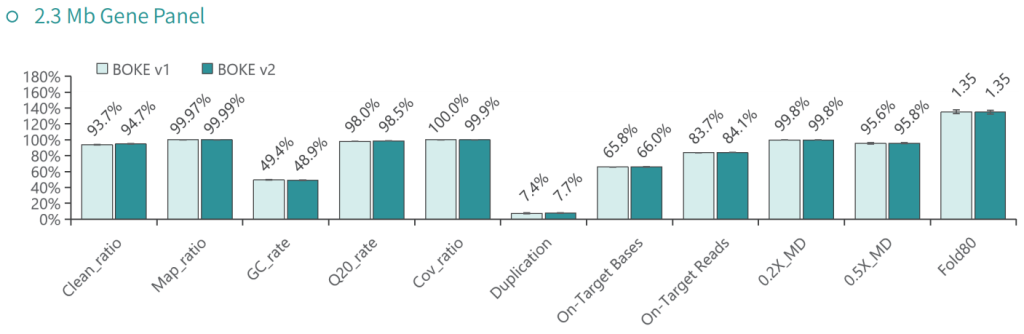
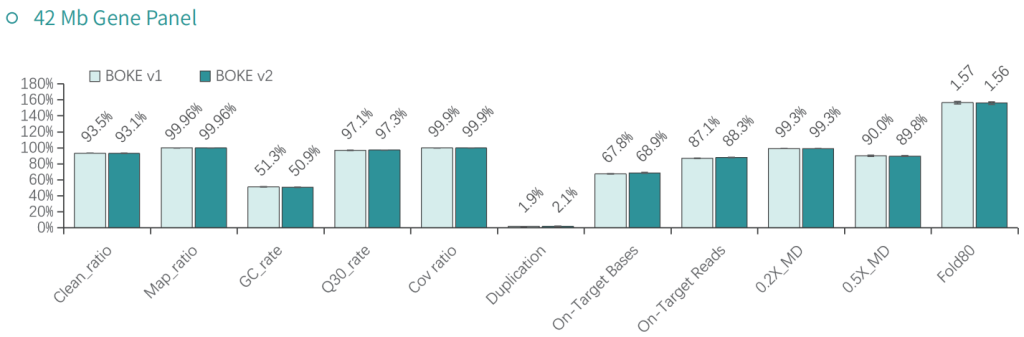
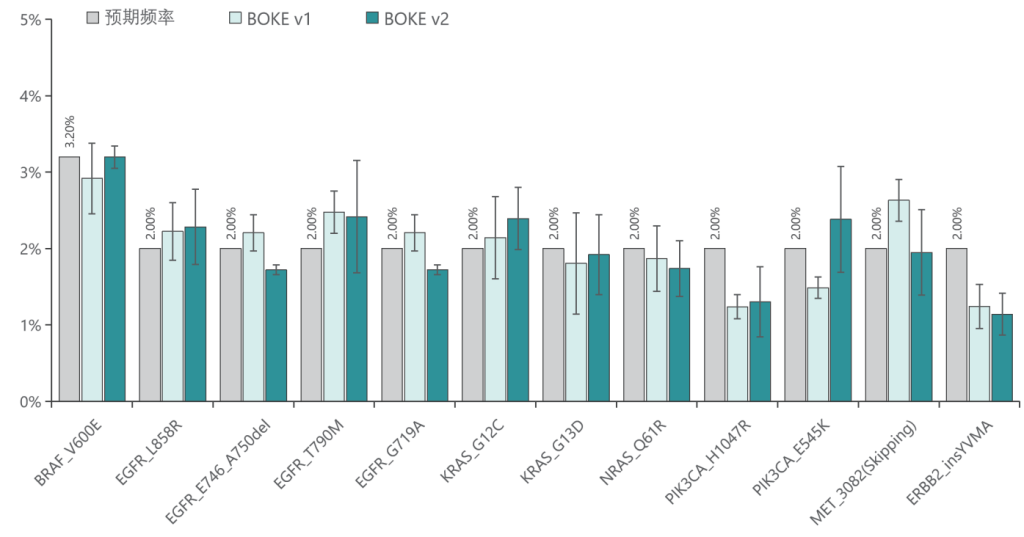
低频变异检测
使用肿瘤 SNV gDNA 标准品Ⅱ (GW-OGTM006) 对TargetCap® Hybridization and Wash Kit v1和 v2 进行验证。GW-OGTM006 DNA标准品包含 EGFR、KRAS、NRAS、BRAF、PIK3CA、FGFR3、Her2、MET 等多个常见伴随诊断基因及位点,包含点突变、插入和缺失等多种变异类型。
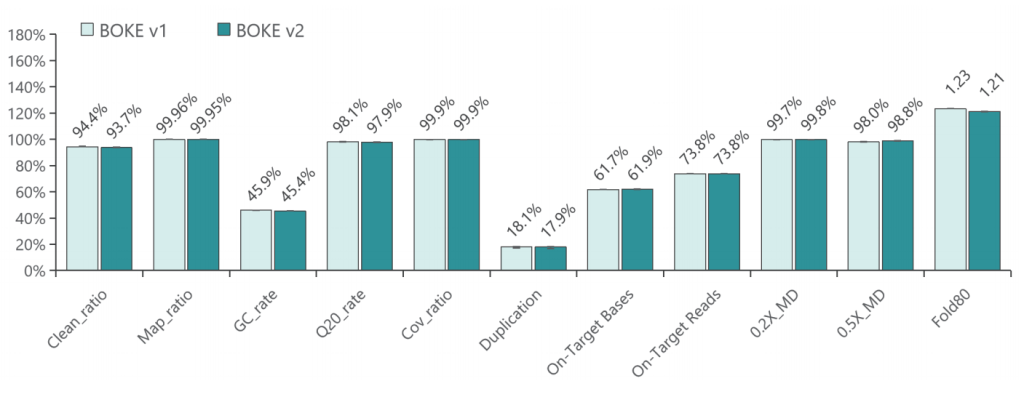
a. 基本QC
采用300Kb Gene Panel对该标准品进行捕获,捕获数据显示,v1与v2试剂盒的基本捕获性能表现相当,v2略优于v1。
b. 变异检测
v1与v2试剂盒均能对12个已知变异准确检出。
参考文献
NCCN Clinical Practice Guidelines in Non-Small Cell Lung Cancer (2026 Version 1).


