肝细胞癌的诊疗方案与治疗药物及作用机制
- boke
- 2026-01-21
- 5:14 下午
一、疾病概述
肝细胞癌(Hepatocellular Carcinoma,HCC),是全球最常见的原发性肝癌类型(占原发性肝癌的70%-90%),也是导致癌症相关死亡的主要原因之一。肝细胞癌(HCC)的发病率正在上升,尤其是在年轻人群中。HCC最常发生在慢性肝病的环境中,长期炎症状态使患者易患恶性肿瘤。尽管病毒性肝炎和酒精仍是全球慢性肝病的主要病因,但代谢功能障碍相关脂肪肝炎(MASH)因肥胖和代谢综合征的流行率上升,已成为HCC致病的新兴原因[1]。
二、肝细胞癌诊疗方案
1
肝细胞癌(HCC)筛查
检查人群
肝硬化患者:CTP A/B级(病因包括乙肝/丙肝、酒精性肝病、代谢相关脂肪性肝炎等);CTP C级(肝移植候选者);无肝硬化的慢性乙肝患者。
检查方式
超声(US)+甲胎蛋白(AFP)
根据检查结果,进行下一步额外检查。
(1)AFP阳性或超声发现≥10mm结节,进一步进行额外检查。
(2)超声结节<10mm,在3-6个月内重复US+AFP。
(3)超声阴性,6个月内重复US+AFP。
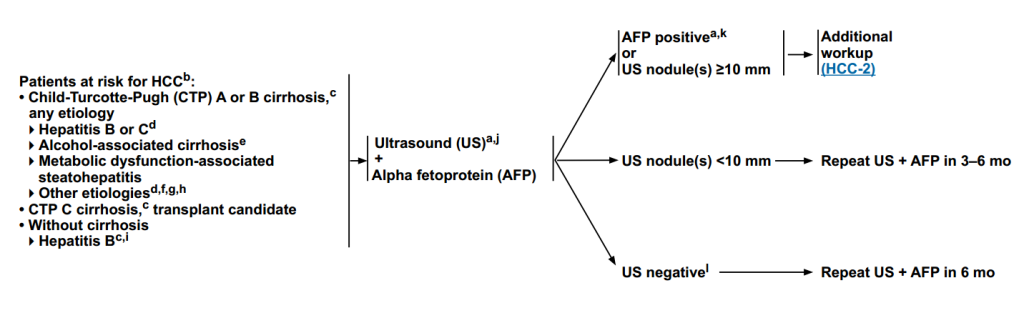
图1 肝细胞癌(HCC)筛查
2
额外检查
对影像学结果阳性或发现异常、AFP阳性患者进行腹部多相CT(首选)或MRI(首选)或增强超声检查,根据影像学结果,进行下一步治疗。
有检查结果:
(1)明确HCC:进入确诊后评估路径。
(2)性质不确定:个体化检查,可能包括额外的成像或活检(由多学科讨论决)。
(3)明确良性:6个月后重新筛选。
无检查结果:6个月后重新筛查。
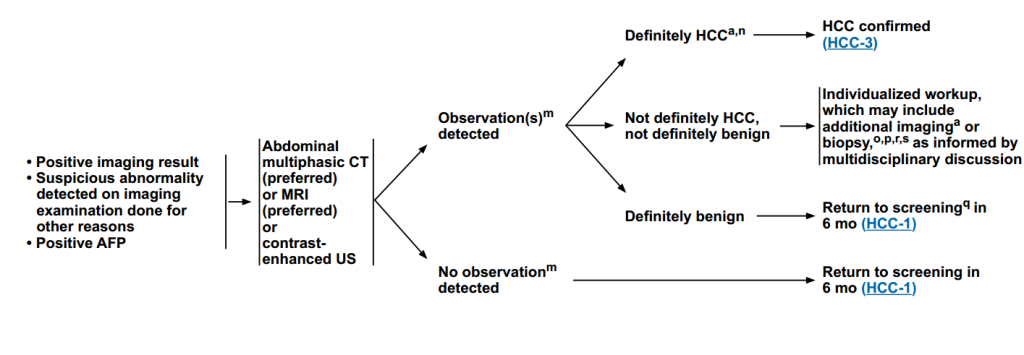
图2 影像学结果阳性或发现异常、AFP阳性患者额外检查路径
3
HCC确诊患者治疗分流
对HCC确诊患者,进行多学科评估:病史和体格检查;肝炎检查;胆红素、转氨酶、碱性磷酸酶;凝血酶原时间或国际标准化比值(INR)、白蛋白、血尿素氮、肌酐;全血细胞计数、血小板;AFP、胸部CT、骨扫描(如有临床指征);腹部/骨盆CT或MRI造影(如之前未进行或需要更新);考虑转诊至肝病专家。
根据评估结果,进行不同的治疗方案。

图3 HCC确诊患者治疗路径分流
4
治疗方案
(1)根据肿瘤负荷有可能切除或移植;根据体能状态或合并症可手术
评估标准
切除标准:CTP A级,B;无门静脉高压症;肿瘤位置合适;肝脏储备充足;肝脏残留合适。
移植标准:UNOS标准(AFP≤1000ng/mL;肿瘤:1个2–5cm或2–3个1–3cm,无大血管受累;无肝外疾病)、扩展标准。
治疗方案:切除(首选)、移植(符合标准时首选,需转诊至移植中心,必要时桥接治疗)、局部区域治疗(消融、动脉导向治疗、放疗)。
监测方案:影像(每3–6个月,持续2年,之后每6个月检查一次;AFP(每3–6个月,持续2年,之后每6个月检查一次);出现复发重新评估治疗。
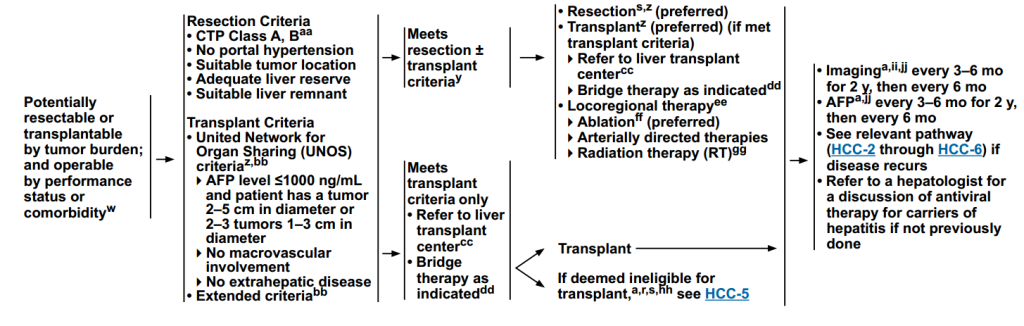
图4 评估为可进行手术患者治疗路径
(2)肝脏受限,不可切除,不适合移植
治疗方案:局部区域治疗(消融、动脉化疗栓塞、放疗);临床试验;系统治疗;最佳支持治疗。
疗效评估:定期评估缓解情况,重新考虑切除、移植、局部治疗;如果在全身治疗期间或之后发生进展,则接受后续全身治疗。
监测方案与(1)相同。
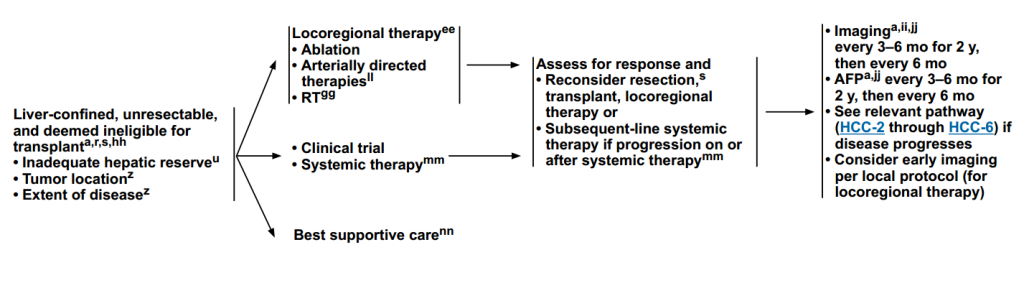
图5 评估为不可进行手术患者治疗路径
(3)肝外/转移性疾病;被认为不适合切除、移植或局部治疗
治疗前检查:活检(首选,如果之前未进行活检);组织学确认。
治疗方案:临床试验、全身治疗、最佳支持治疗。
疗效评估:定期评估缓解情况,重新考虑局部治疗和多学科审查;如果在全身治疗期间或之后进展,则进行后续全身治疗。
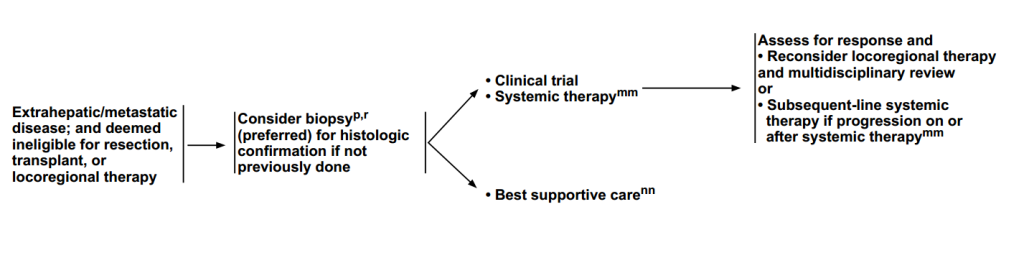
图6 转移性疾病或不适合切除、移植或局部治疗患者治疗路径
三、全身治疗具体方案
1
一线全身治疗:

2
后续全身治疗:

四、治疗药物、靶点及作用机制
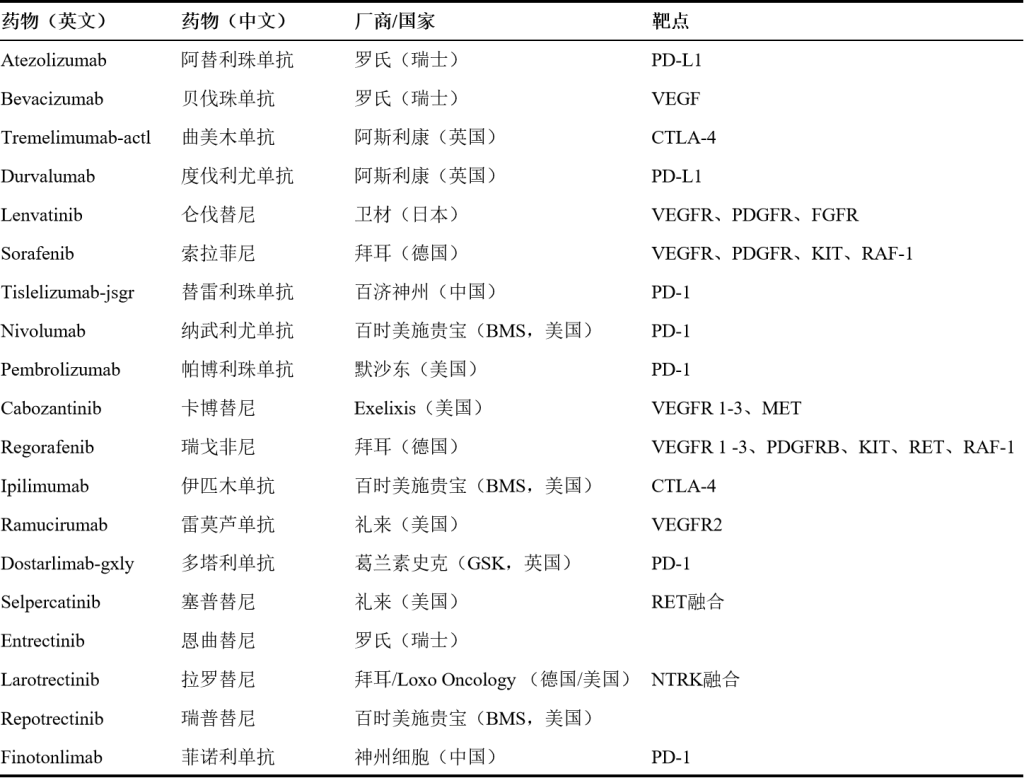
1.阿替利珠单抗(Atezolizumab)
作用靶点:PD-L1(细胞程序性死亡-配体1)
作用机制:阿替利珠单抗是一种人源化免疫球蛋白G1(IgG1)单克隆抗体,其作用机制主要基于对PD-L1的靶向抑制,具体 机制为:肿瘤细胞常通过高表达PD-L1蛋白,与T细胞表面的程序性死亡受体1(PD-1)结合,传递抑制性信号,使T细胞活性受到抑制,无法有效识别和攻击肿瘤细胞。阿替利珠单抗能特异性地与PD-L1结合,阻断PD-L1与PD-1的相互作用,解除这种免疫抑制状态,恢复T细胞的抗肿瘤活性。
2.贝伐珠单抗(Bevacizumab)
作用靶点:VEGF(表皮生长因子)
作用机制:贝伐珠单抗的作用机制主要通过抑制VEGF来实现,具体如下:VEGF是促进肿瘤血管生成的关键因子,贝伐珠单抗作为重组人源化单克隆抗体,特异性结合VEGF,阻断其与血管内皮细胞表面受体(VEGFR)的结合,抑制血管内皮细胞的增殖、迁移和管腔形成,从而减少肿瘤新生血管的生成,切断肿瘤的营养供应,抑制肿瘤生长和扩散。
3.曲美木单抗(Tremelimumab-actl)
作用靶点:CTLA-4(细胞毒性T淋巴细胞抗原4)
作用机制:曲美木单抗(Tremelimumab)是一种CTLA-4的全人源化单克隆抗体,其作用机制通过以下方式实现:在正常生理状态下,CTLA-4与抗原呈递细胞(APC)表面的CD80/CD86分子结合,会抑制T细胞的活化和增殖,从而维持免疫系统的平衡,防止过度免疫反应。在肿瘤微环境中,肿瘤细胞可能会利用CTLA-4这一免疫抑制机制,通过上调CTLA-4的表达或增强其信号传导,来抑制T细胞对肿瘤细胞的识别和杀伤,从而逃避机体的免疫监视。曲美木单抗能够特异性地与CTLA-4结合,阻断CTLA-4与CD80/CD86的相互作用,从而解除CTLA-4对T细胞的抑制作用,使T细胞能够重新被激活,增强其对肿瘤细胞的免疫攻击能力。
4.度伐利尤单抗(Durvalumab)
作用靶点:PD-L1
作用机制:与阿替利珠单抗作用机制一致
5.仑伐替尼(Lenvatinib)
作用靶点:VEGFR(血管内皮生长因子受体)、PDGFR(血小板衍生生长因子受体)、FGFR(成纤维细胞生长因子受体)
作用机制:仑伐替尼是一种多靶点酪氨酸激酶抑制剂,具体机制为:
(1)仑伐替尼能全面抑制VEGFR的活性,阻断VEGF与VEGFR的结合,抑制肿瘤血管生成。抑制血管内皮细胞的增殖、迁移和管腔形成,从而减少肿瘤新生血管的生成,切断肿瘤的营养供应,抑制肿瘤生长和扩散。同时,它还能抑制FGFR,阻断肿瘤细胞通过FGF通路代偿性激活血管生成的途径,增强抗血管生成效果。
(2)抑制PDGFR等与肿瘤细胞迁移和侵袭相关的激酶,阻断肿瘤细胞的上皮-间质转化(EMT)过程,降低肿瘤细胞的迁移能力和侵袭性,抑制肿瘤细胞的生长和扩散。
6.索拉菲尼(Sorafenib)
作用靶点:VEGFR、PDGFR、KIT、RAF-1
作用机制:
(1)通过抑制KIT和RAF激酶,阻断RAS-RAF-MEK-ERK信号通路,从而抑制肿瘤细胞的增殖、分化和存活。该信号通路的异常激活在多种肿瘤中常见,索拉非尼通过抑制该通路,可有效抑制肿瘤细胞的生长。
(2)通过抑制VEGFR和PDGFR等受体的激酶活性,阻断肿瘤血管生成的信号通路,抑制血管内皮细胞的增殖、迁移和血管形成,从而切断肿瘤细胞的营养供应,抑制肿瘤的生长和转移。
7.替雷利珠单抗(Tislelizumab-jsgr)
作用靶点:PD-1
作用机制:在正常生理情况下,PD-1是一种存在于免疫细胞表面(如T细胞、B细胞和自然杀伤细胞)的膜表面分子。当PD-1与其配体PD-L1或PD-L2结合时,会抑制免疫细胞对肿瘤细胞的攻击,使肿瘤细胞能够逃避免疫系统的检测和清除。替雷利珠单抗通过与PD-1分子结合,阻止PD-1与其配体PD-L1和PD-L2的结合,从而解除对免疫细胞的抑制作用。T细胞等免疫细胞就能更有效地识别和攻击肿瘤细胞,增强机体的抗肿瘤免疫反应。
8.纳武利尤单抗(Nivolumab)
作用靶点:PD-1
作用机制:属于PD-1抑制剂,其作用机制与替雷利珠单抗相似。
9.帕博利珠单抗(Pembrolizumab)
作用靶点:PD-1
作用机制:属于PD-1抑制剂,其作用机制与替雷利珠单抗相似。
10.卡博替尼(Cabozantinib)
作用靶点:VEGFR 1-3、MET(肝细胞生长因子受体)
作用机制:卡博替尼是一种多靶点的酪氨酸激酶抑制剂,主要靶点包括MET、VEGFR1/2/3、RET、AXL等。这些靶点与肿瘤的生长、转移和血管生成密切相关。
(1)卡博替尼可抑制血管VEGFR 1-3的活性,阻断VEGF信号通路。V减少肿瘤新生血管的形成,切断肿瘤的营养供应,从而抑制肿瘤生长和转移。
(2)卡博替尼通过抑制MET等受体酪氨酸激酶,阻断细胞增殖信号通路,抑制肿瘤细胞的生长和分裂。
(3)通过抑制AXL等受体,减少肿瘤细胞的侵袭和转移。
11.瑞戈非尼(Regorafenib)
作用靶点:VEGFR 1 -3、PDGFRB、KIT、RET、RAF-1
作用机制:瑞戈非尼是一种多靶点激酶抑制剂,它能够同时作用于多个信号通路,通过强效协同的方式抑制肿瘤生长和扩散。
(1)瑞戈非尼可靶向抑制VEGFR1-3,阻断血管内皮生长因子(VEGF)信号通路,抑制肿瘤组织内新生血管的形成,减少肿瘤的血液供应,从而限制肿瘤的生长和转移。
(2)抑制PDGFR等与肿瘤细胞迁移和侵袭相关的激酶,阻断肿瘤细胞的上皮-间质转化(EMT)过程,降低肿瘤细胞的迁移能力和侵袭性,抑制肿瘤细胞的生长和扩散。
(3)KIT、RET、RAF-1等靶点在肿瘤细胞的增殖、存活和分化等过程中发挥关键作用。瑞戈非尼抑制这些靶点的活性,可阻断相关信号通路,抑制肿瘤细胞的增殖和存活,诱导肿瘤细胞凋亡。
12.伊匹木单抗(Ipilimumab)
作用靶点:CTLA-4
作用机制:作用机制与曲美木单抗相似。
13.雷莫芦单抗(Ramucirumab)
作用靶点:VEGFR2
作用机制:雷莫芦单抗能够特异性地与VEGFR2结合,阻止VEGF家族成员与VEGFR2的配体结合,阻断VEGFR2的激活,从而阻止血管内皮细胞的增殖和迁移,抑制新生血管的形成,切断肿瘤的营养供应,从而抑制肿瘤细胞的生长和增殖。
14.多塔利单抗(Dostarlimab-gxly)
作用靶点:PD-1
作用机制:属于PD-1抑制剂,其作用机制与替雷利珠单抗相似。
15.塞普替尼(Selpercatinib)
作用靶点:RET融合
作用机制:RET基因编码的蛋白是一种细胞膜上的受体酪氨酸激酶,正常情况下参与细胞间信号传导,维持细胞正常功能。但当RET基因发生突变或与其他基因融合(如RET融合),会导致RET蛋白持续激活,驱动癌细胞不受控制地增殖、存活和转移。塞普替尼能够精准地与RET蛋白结合,抑制其激酶活性,阻断异常信号传递,从而抑制肿瘤细胞的生长和增殖。
16.恩曲替尼、拉罗替尼、瑞普替尼(Entrectinib、Larotrectinib、Repotrectinib)
作用靶点:NTRK基因融合产生的TRK融合蛋白
作用机制:NTRK基因融合会导致TRK蛋白(TRKA、TRKB、TRKC)持续激活,驱动肿瘤细胞增殖和存活,恩曲替尼、拉罗替尼、瑞普替尼通过属于ATP竞争性抑制剂,通过与TRK蛋白的ATP结合口袋结合,阻止ATP与TRK蛋白结合,从而抑制TRK蛋白的激酶活性,阻断肿瘤细胞的异常信号传导,进而抑制肿瘤细胞的生长和增殖。
17.菲诺利单抗(Finotonlimab)
作用靶点:PD-1
作用机制:属于PD-1抑制剂,其作用机制与替雷利珠单抗相似。
五、HBV整合与HCC发生
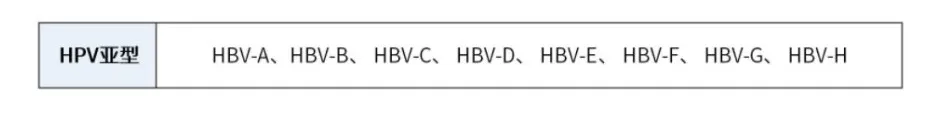
HCC是全球第二大致癌死亡原因,HBV是其最主要诱因,约80%的HCC中可检测HBV的存在。HBV型别众多,根据病毒DNA序列差异,HBV基因型可分为A、B、C、D等八种类型(详见附表1)。不同型别在流行特征、致病性,对药物治疗反映等方面都存在差异,目前我国以B型和C型最为常见。
HBV DNA整合与HCC的发生密切相关。HBV DNA可随机整合到宿主肝细胞基因组中,导致原癌基因激活或抑癌基因失活。常见整合靶点包括端粒酶基因(TERT)、周期蛋白基因(CCNE1)、组蛋白甲基转移酶基因(MLL4)等。另外HBV DNA整合后还可能导致染色体重排、基因拷贝数变异,引起基因组不稳定,增加癌变风险[3]。
有研究基于全基因组测序(WGS)、纳米孔三代长读长测序(ONT)、转录组测序和单细胞RNA测序结合体外实验验证,阐明HBV整合通过诱导基因组不稳定性(如CNV、染色体易位)和激活8q24区域的TONSL/TMEM65基因来驱动肝癌发生,为HBV相关肝癌的预防和治疗提供了新的理论依据[4]。
中国临床科学研究采用人外显子测序(WES)、RNA-seq、蛋白质组学(TMT标记)、磷酸化蛋白质组学等多组学进行研究,研究结果揭示我国HBV相关HCC人群具有与西方国家不同的基因突变频谱;根据蛋白质组数据将HBV相关HCC分为三个亚型,代谢驱动型(S-Mb)、微环境失调型(S-Me)和增殖驱动型(S-Pf),能够提供更好的预后价值;同时该研究还鉴定到两个与预后显著相关的蛋白质PYCR2(脯氨酸合成酶)和ADH1A(醇脱氢酶1A);该研究还发现了CTNNB1突变导致ALDOA(醛缩酶A)Ser36磷酸化升高,促进糖酵解和肿瘤细胞增殖,体内外实验验证该磷酸化是CTNNB1突变型HCC的关键驱动事件。总之,该研究利用多组学数据,较为完整地揭示了肝癌肿瘤细胞的分子特性,全面解析了肝癌的发生和发展机制,为肝癌的精准分型与个体化治疗、疗效监测和预后判断提供了新的思路和策略。
伯科生物在国内已经建设了全流程国产化的高通量核酸合成与应用技术转化中心,建立了GMP厂房和ISO9001、ISO13485质量体系。已经为国内外数百家知名医院、科学研究机构、临床检验所开发了上千款Gene Panel(液相基因芯片),并配套完整的检测试剂,各项性能参数均与国际竞品相当或优于(详见附表1),在基因组、转录组、甲基化组及病原体的检测应用方向均有成熟的产品管线。
附表1: 产品简介
肿瘤液相基因芯片
伯科设计的TargetCap® OncoGene Plus Research Panel基于美国食品药品监督管理局(FDA)批准的用于肿瘤基因检测的FoundationOne CDxTM与MSK-IMPACTTM,其覆盖702个肿瘤相关基因编码区和34个基因的非编码区(融合基因),含有6个MSI和53个化药相关位点,探针覆盖2.32Mb区间。这些区域涵盖更多基因,检测范围更泛,涉及肿瘤高频突变、肿瘤易感、药物靶向、药物耐受等多种类型基因。
性能表现
竞品评测
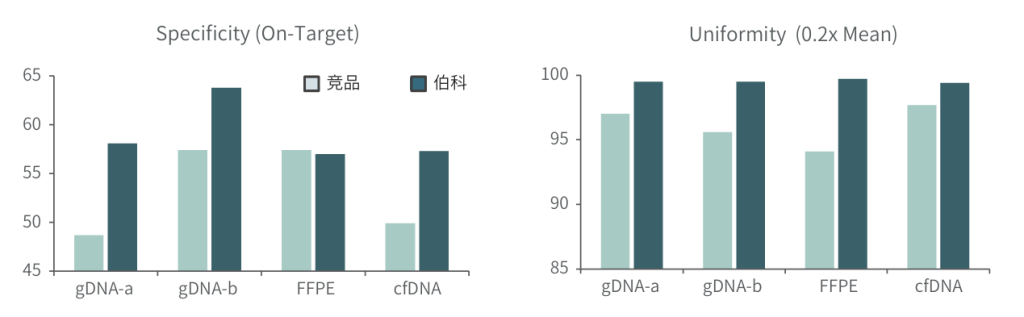
采用gDNA/cfDNA/FFPE/泛肿瘤800gDNA标准品文库,分别使用伯科商品化肿瘤大Panel-OncoGene Plus Research Panel与竞品肿瘤大Panel进行性能比较(二者大小相近),在捕获特异性上(On-Target)和覆盖均一性(0.2XMean)上,伯科均优于竞品。
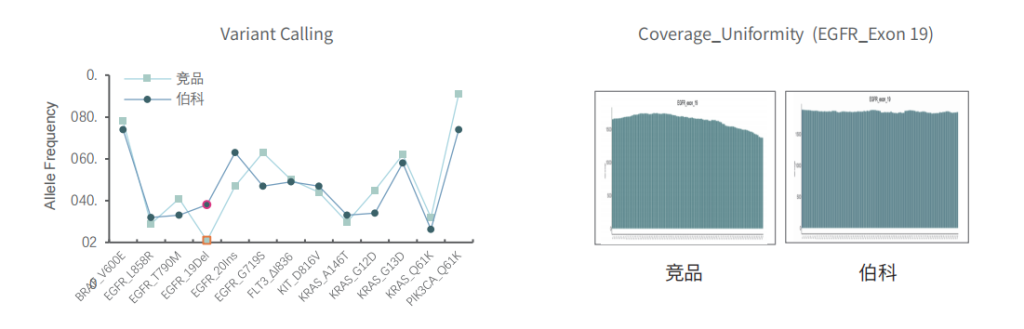
对于gDNA标准品,竞品测序35.9Gb,伯科测序19.6Gb,虽然伯科测序数据少,深度低,但二者的突变频率检出无明显差异,伯科对EGFR的19号外显子缺失变异的检出优于竞品。
不同样本类型表现
对不同质量的gDNA样本 (WBC/FFPE, >150例),TargetCap® OncoGene Plus Research Panel表现稳定。
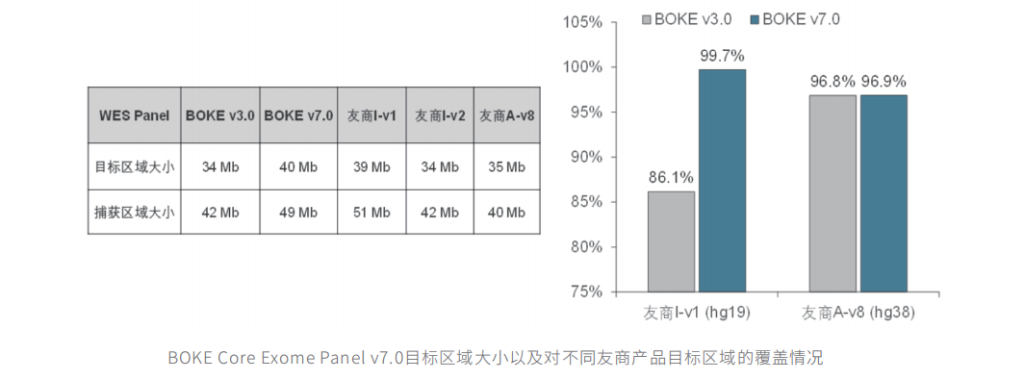
人全外显子液相基因芯片 v7.0
为更好保证的临床科研与转化的延续性和全面性,伯科公司已推出人全外显子液相基因芯片的升级产品-TargetCap® Core Exome Panel v7.0 ( 下文简称 BOKE v7.0 ),该 Panel 加强了基因组 hg19 传统研究区域的覆盖,兼顾 hg19 & hg38 双版本基因组,同时添加了部分明确了表型的基因,覆盖基因数量超20000个。
BOKE v7.0 也可灵活的与扩展模块组合使用,满足不同场景的临床研究的需求及转化应用,包括了线粒体、遗传病非编码区变异位点、 单基因全覆盖、 病毒基因组、 肿瘤全景变异检测、 重大疾病多基因风险评估模块等。 此外,伯科公司自研自造的寡核苷酸合成平台可以快速响应个性化定制需求,为人类基因组分子遗传学的研究与转化,提供更加全面高效的解决方案。

数据表现
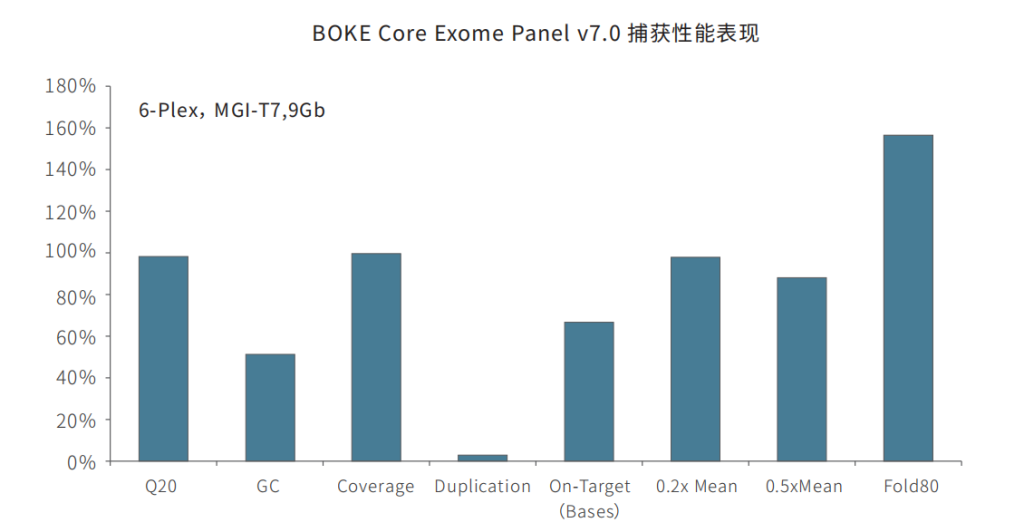
在捕获性能方面,BOKE v7.0依然表现优异,与TargetCap® Core Exome Panel v3.0表现相近。在测序9Gb条件下,平均深度达到110x左右,20x和30x以上区域占比分别为99.5%和98.5%,Fold 80为1.5-1.6之间,与国际领先产品数据表现相当。
BOKE v3.0&BOKE v7.0对比
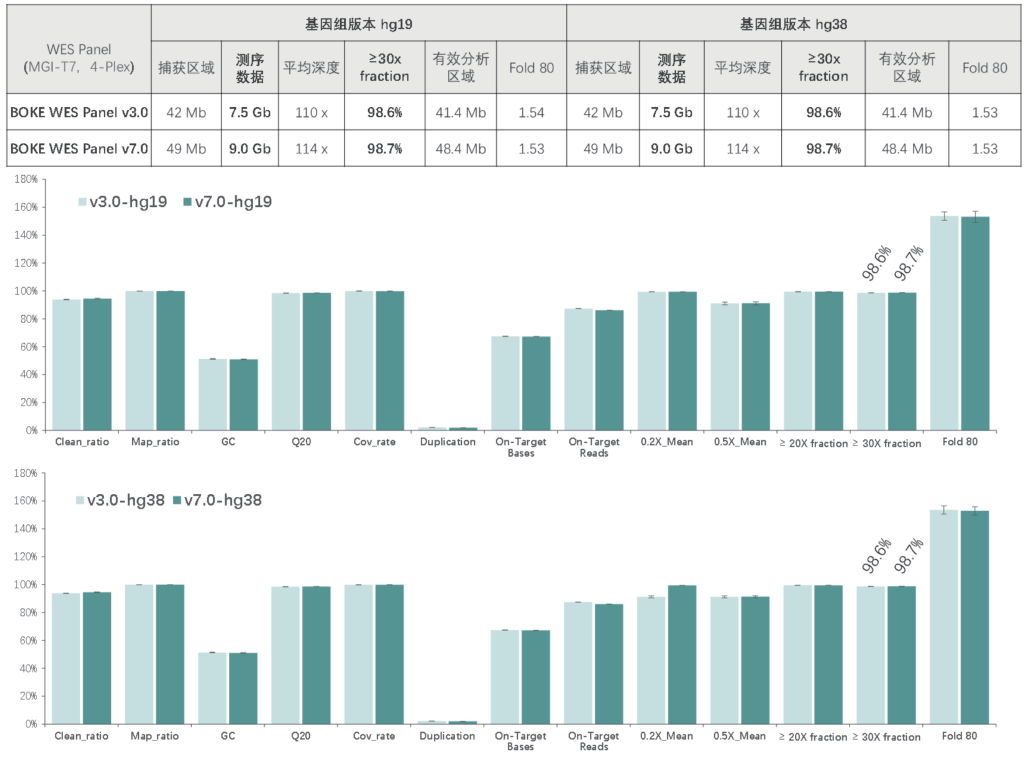
竞品对比
该WES Panel增强了基因组 hg19 传统研究区域的覆盖,兼顾 hg19 & hg38 双版本基因组,可以更好的保证临床科研与转化的延续性。目标区域和捕获区域大小分别为 40 Mb 和 49 Mb ,对 hg19 传统研究区域覆盖提升至99.7% (友商I-v1),hg38 传统研究区域覆盖相近(友商A-v8)。同时,新添加数百个具有一定功能与表型的基因,总基因数量达到20000+。
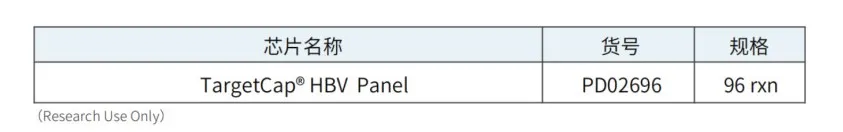
伯科HBV病毒液相基因芯片
依托伯科高通量核酸合成以及自主知识产权的生物素修饰技术,对8种人类乙型肝炎病毒(Hepatitis B Virus,HBV)进行检测,完成商业化Panel制备。该产品全面覆盖8种HBV的亚型基因组,探针覆盖区域大小为26 Kb。Panel既可以独立使用,又可作为模块加入个性化Panel,且不影响个性化Panel各项数据指标。Panel表现优异。覆盖均一性好,检测特异性高。
杂交与清洗试剂盒v2 简介
产品概述
伯科杂交与清洗试剂盒v2 (TargetCap® Hybridization and Wash Kit v2)简化了试剂组分和操作流程,同时仍保持优异的捕获性能。该试剂盒由4种缓冲液组成,分别为Hyb Buffer、Bingding Buffer、Wash Buffer 1和Wash Buffer 2,所有试剂均为1x缓冲液,可以直接使用,同时清洗步骤仅需3步,整个操作流程更加便捷。

基本捕获性能
使用NA12878和NA24694 DNA标准品,分别采用不同大小的Gene Panel对TargetCap® Hybridization and Wash Kit v1和v2进行比较。结果显示,在不同大小的 Gene Panel 中, v2试剂盒的中靶率和均一性与v1试剂盒表现基本一致,v2试剂盒表现略好。
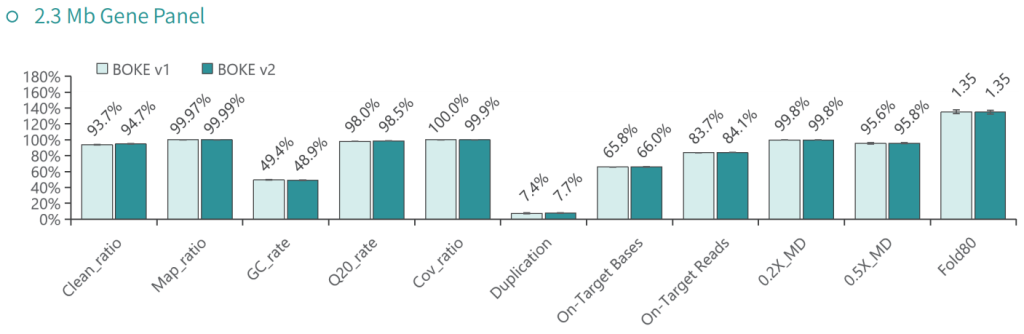
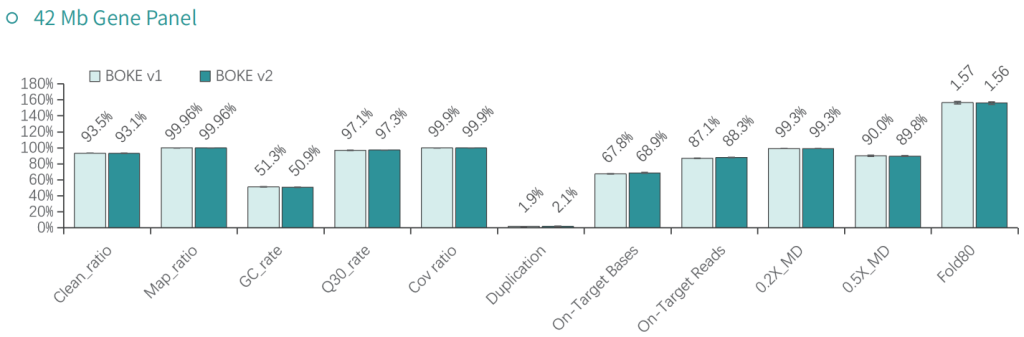
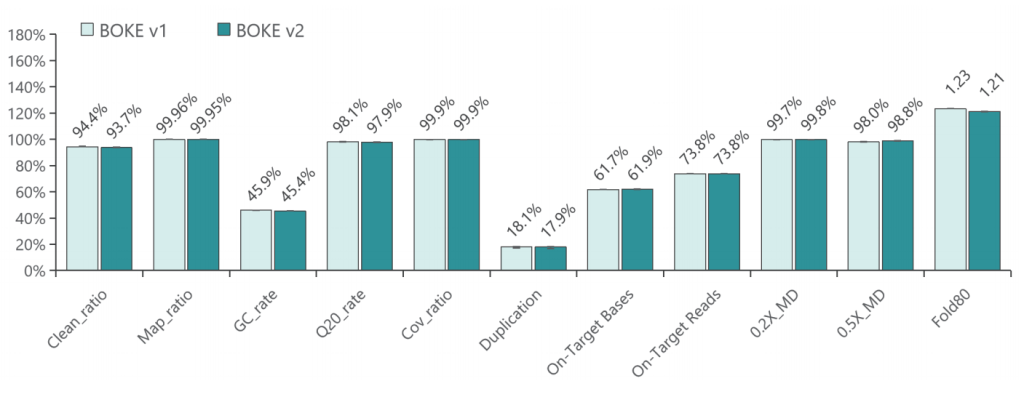
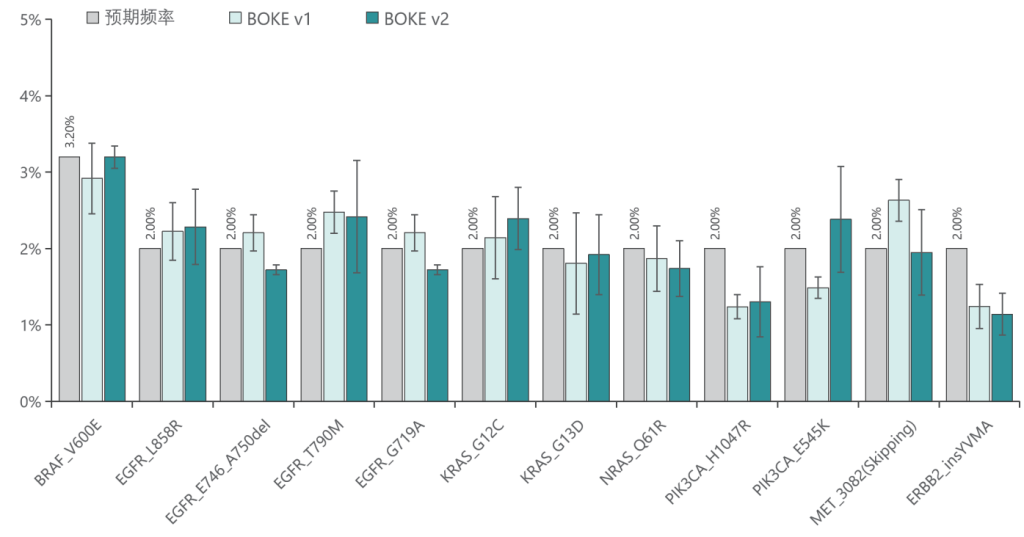
低频变异检测
使用肿瘤 SNV gDNA 标准品Ⅱ (GW-OGTM006) 对TargetCap® Hybridization and Wash Kit v1和 v2 进行验证。GW-OGTM006 DNA标准品包含 EGFR、KRAS、NRAS、BRAF、PIK3CA、FGFR3、Her2、MET 等多个常见伴随诊断基因及位点,包含点突变、插入和缺失等多种变异类型。
a. 基本QC
采用300Kb Gene Panel对该标准品进行捕获,捕获数据显示,v1与v2试剂盒的基本捕获性能表现相当,v2略优于v1。
b. 变异检测
v1与v2试剂盒均能对12个已知变异准确检出。
参考文献
Moris D, Martinino A,et al. Advances in the treatment of hepatocellular carcinoma: An overview of the current and evolving therapeutic landscape for clinicians. CA Cancer J Clin. 2025 Nov-Dec;75(6):498-527. doi: 10.3322/caac.70018.
NCCN Clinical Practice Guidelines in Hepatocellular Carcinoma (2025 Version 2).
Levrero M, Zucman-Rossi J. Mechanisms of HBV-induced hepatocellular carcinoma. J Hepatol. 2016 Apr;64(1 Suppl):S84-S101.
Qian Z, Liang J, et al. HBV integrations reshaping genomic structures promote hepatocellular carcinoma. Gut. 2024 Jun 6;73(7):1169-1182.
Gao Q, Zhu H, et al. Integrated Proteogenomic Characterization of HBV-Related Hepatocellular Carcinoma. Cell. 2019 Oct 3;179(2):561-577.e22.


