2025 V5.0 NCCN指南|结肠癌的诊断与精准治疗
- boke
- 2026-01-13
- 3:30 下午
一
疾病概述
结直肠癌(包括结肠癌和直肠癌)是全球范围内发病率较高的恶性肿瘤之一。发病率位居恶性肿瘤前列。结直肠癌发病率在不同地区和人群中存在差异,发达国家如发病率相对较高,而发展中国家发病率呈上升趋势。在中国,结肠癌发病率呈逐年上升趋势,男性发病率略高于女性。结直肠癌风险与遗传因素、肠道疾病、饮食因素以及生活方式等因素密切相关。
二
疾病分层
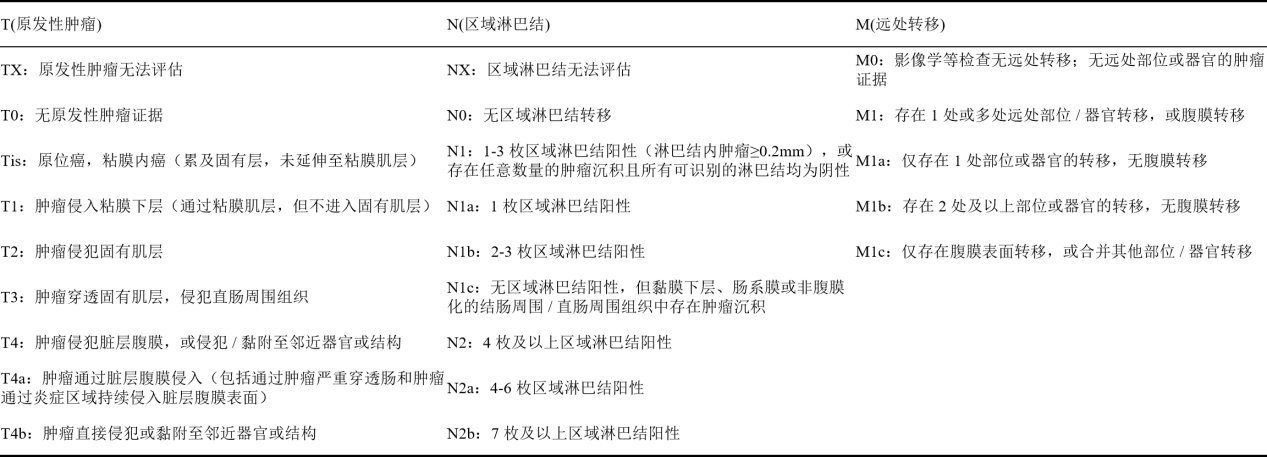
图1 AJCC结肠癌TNM定义
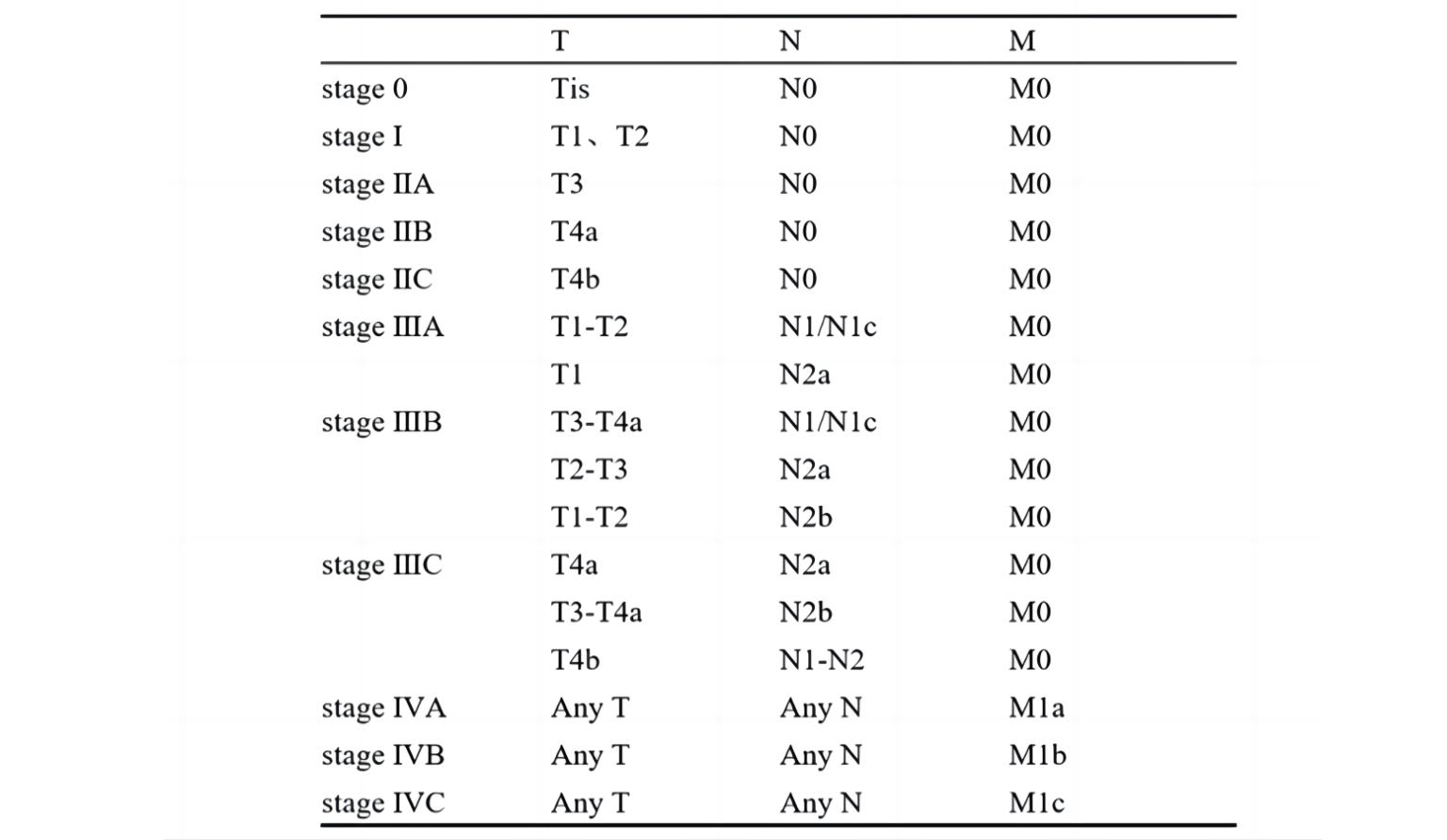
图2 基于TNM分期的预后分层
三
疾病治疗
1
带蒂或无蒂息肉(腺瘤)伴浸润性癌治疗方案
检查(Work up):病理复查、结肠镜检查、癌性息肉位点标记、MMR/MSI检测。根据检查结果,进行不同的治疗。
单个标本,完全切除,组织学特征良好,边缘清晰
有蒂息肉伴浸润癌→观察。
无蒂息肉伴浸润癌→观察或结肠切除术伴区域淋巴结整块切除术。
标本破碎,切缘无法评估,组织学特征差
完善检查(考虑骨盆MRI、CBC、化学特征、CEA、胸部/腹部/骨盆(C/A/P)CT、FDG-PET/CT不适用)→结肠切除术伴区域淋巴结整块切除术,后续根据MMR状态(pMMR/MSS或dMMR/MSI-H),转诊至对应分期的治疗。
2
可切除(非转移性)结肠癌治疗方案
活组织检查、MMR/MSI检测、PIK3CA检测(II-III期患者)、病理学检查、结肠镜检查、胸腹盆CT、考虑腹部/骨盆MRI、全血细胞计数(CBC)、化学特征、癌胚抗原(CEA)、生育风险咨询(在适当患者中进行),后续根据MMR状态(pMMR/MSS或dMMR/MSI-H/POLE/POLD1突变)进行不同的治疗。
(1)pMMR/MSS患者治疗方案
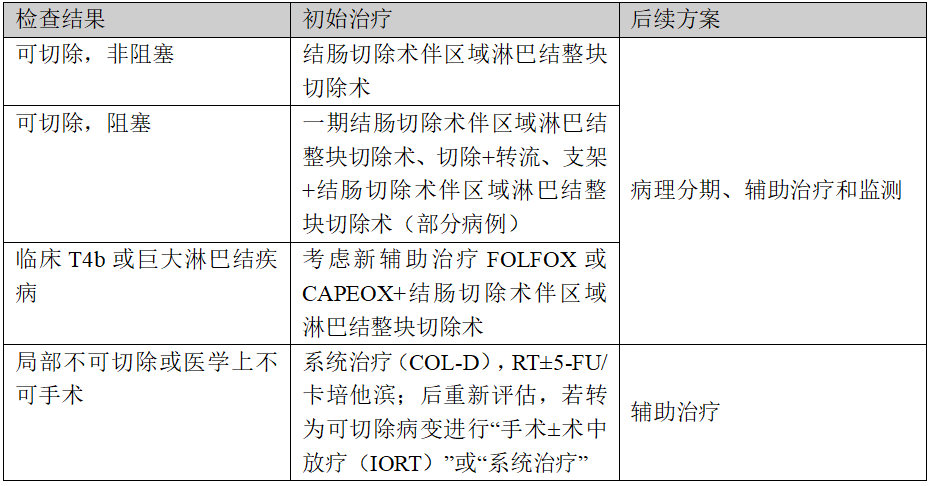
(2)pMMR/MSS临床分期及辅助治疗方案
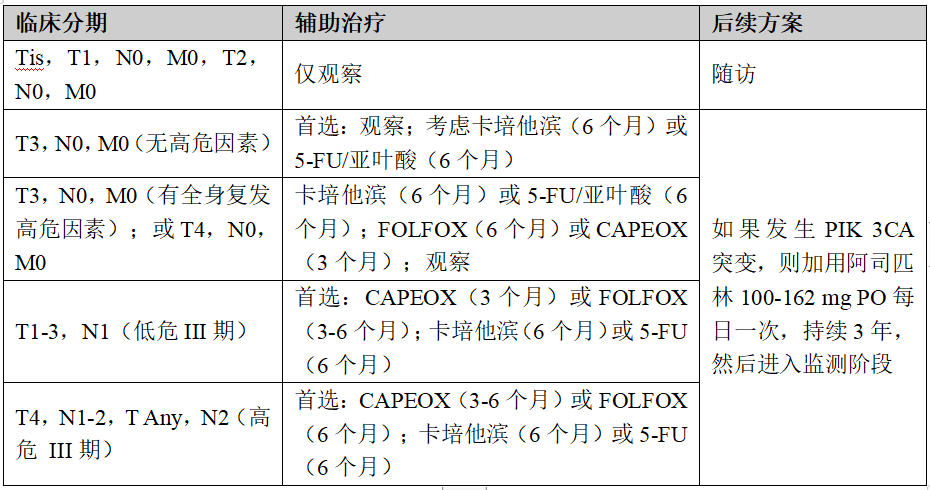
(3)dMMR/MSI-H或POLE/POLD1突变患者治疗方案
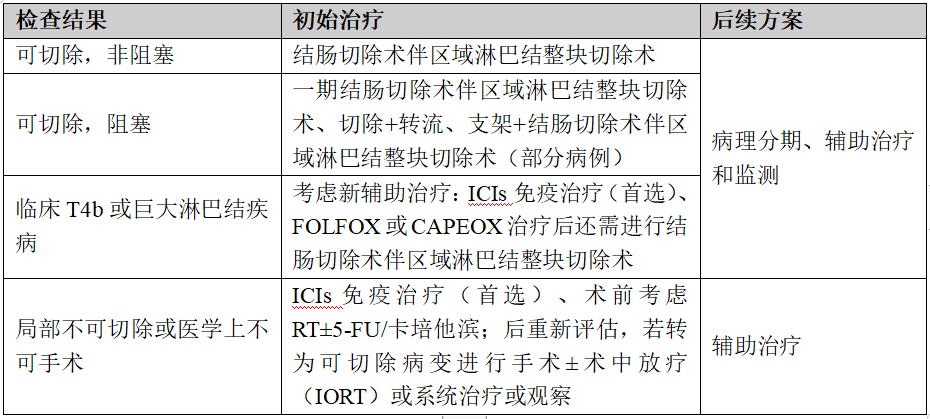
(4)dMMR/MSI-H/POLE/POLD1临床分期及辅助治疗方案
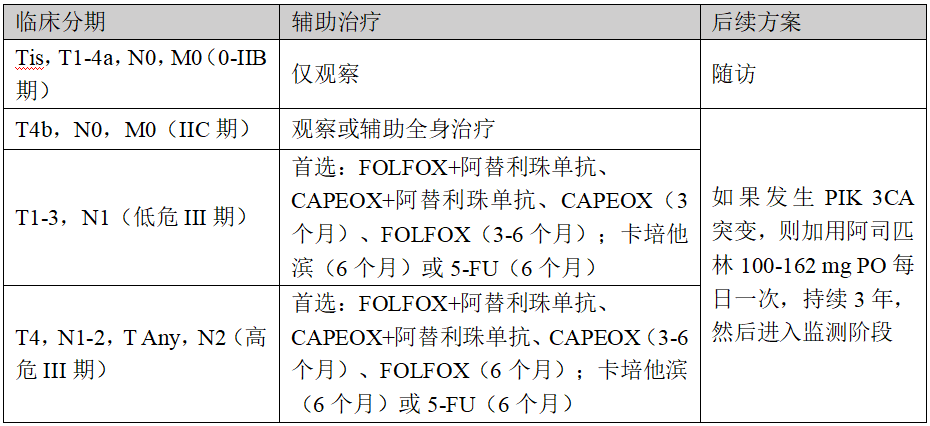
3
疑似或证实转移性腺癌治疗过程
结肠镜检查胸腹盆CT、CBC、化学特征、CEA、分子检测(RAS和BRAF突变,HER2扩增;MMR或MSI状态、罕见突变POLE/POLD1、RET、NTRK)如果有临床指征,则进行活检。如果在选定病例中可能通过手术治愈M1疾病,则考虑FDG-PET/CT(潜在可手术的M1患者)、肝转移可切除者考虑肝脏MRI检查。后续根据MMR状态(pMMR/MSS或dMMR/MSI-H或POLE/POLD1突变)进行不同的治疗。
(1)pMMR/MSS同步转移性腺癌的初始治疗
仅肝脏和/或仅肺同步转移
可切除:
同期或分期结肠切除术伴肝或肺切除±局部治疗。
新辅助治疗(2-3个月FOLFOX/CAPEOX等)后,同期/分期结肠切除+转移灶切除(±局部治疗)。
结肠切除术后,进行2-3个月化疗(FOLFOX等),再同期/分期转移灶切除±局部治疗。
术后进行辅助治疗:FOLFOX/CAPEOX/卡培他滨/5-FU,之后进入监测阶段。
不可切除:
系统治疗。
FOLFIRI或FOLFOX或CAPEOX或FOLFIRINOX±贝伐单抗。
FOLFIRI或FOLFOX±帕尼单抗或西妥昔单抗(仅KRAS/NRAS/BRAF WT和左侧肿瘤)结肠切除术(出现梗阻、大出血、穿孔或其他明显的肿瘤相关症状风险时进行)。
腹部/腹膜同步转移
非阻塞:全身治疗。
阻塞/即将阻塞:先进行结肠切除术、改道造口术、旁路术、支架置入术后,再进行全身治疗。
其他部位的同步不可切除转移:直接进行全身治疗。
全身治疗方案:
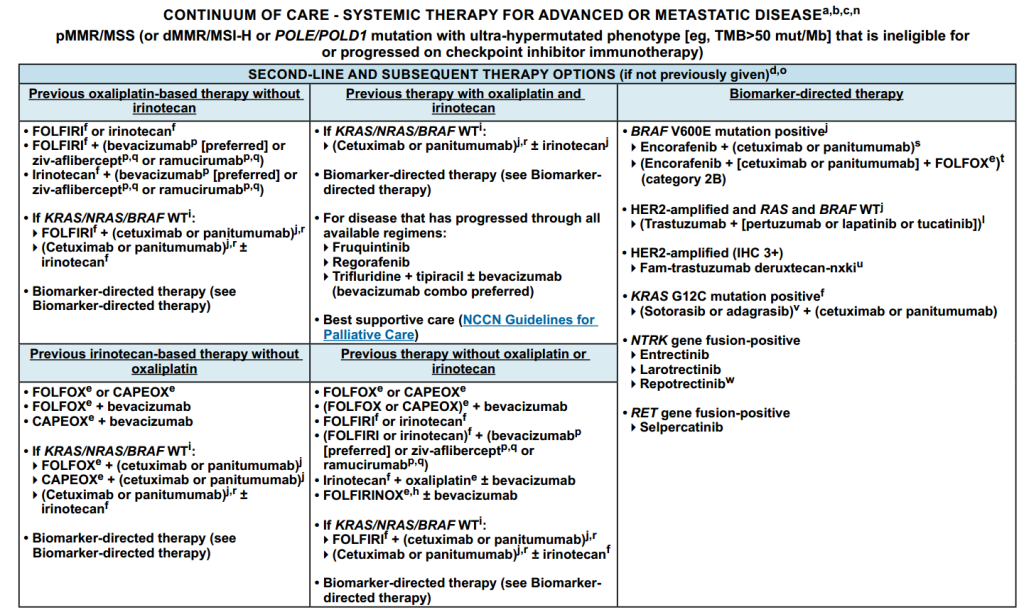
图3 全身治疗具体方案
(2)dMMR/MSI-H或POLE/POLD1突变
可切除的同步仅肝/肺转移灶:
同步/分期结肠切除术,联合肝/肺切除术(首选)和/或局部治疗;后进行辅助治疗:FOLFOX、CAPEOX或卡培他滨或5-FU/亚叶酸。
腹部/腹膜同步转移
非阻塞:全身治疗。
阻塞/即将阻塞:先进行结肠切除术、改道造口术、旁路术、支架置入术后,再进行全身治疗。
其他部位的同步不可切除转移:直接进行全身治疗。
4
监测方案
不同病理分期结肠癌术后的监测方案:
Ⅰ期
术后1年结肠镜检查;若发现进展性腺瘤,1年后复查;没有则3年后复查,之后每5年1次。
Ⅱ、Ⅲ期
病史/体格检查:前2年每3-6个月1次,之后每6个月1次,共5年;
CEA:前2年每3-6个月1次,之后每6个月1次,共5年;
胸腹盆CT:每6-12个月1次,共5年(<12个月频率为2B类推荐);
结肠镜:术后1年(术前未完成完整结肠镜则3-6个月后),后续同Ⅰ期监测方案。
Ⅳ期
病史/体格检查、CEA频率比II/III更密集(前2年每3-6个月1次);
胸腹盆CT:前2年每3-6个月1次,之后每6-12个月1次,共5年;
结肠镜:术后1年(术前未完成完整结肠镜则3-6个月后),后续同Ⅰ期监测方案。
若出现连续CEA升高或复发,则进入相应的诊断与治疗阶段。
5
连续CEA升高或复发治疗方案
(1)连续CEA升高
当出现连续CEA(癌胚抗原)升高时,进行检查:体格检查、结肠镜检查、胸腹盆CT(带造影剂)。
结果阴性:进行FDG-PET/CTb 检查、3个月后复查胸腹盆CT(带造影剂),复查后重新评估:若仍为结果阴性:重复上述检查;若结果为阳性:见下文“经CT、MRI和/或活检证实的异时转移治疗方案”。
(2)经CT、MRI和/或活检证实的异时转移治疗方案
可切除
考虑进行FDG-PET/CT检查,之后再进行评估:
若仍为可切除,进一步区分分子表型,分为pMMR/MSS和dMMR/MSI-H或POLE/POLD 1突变伴超超突变表型;若不可切除,直接区分分子表型,按照其对应治疗方案进行治疗。
不可切除
直接区分分子表型,按照其对应治疗方案进行治疗。
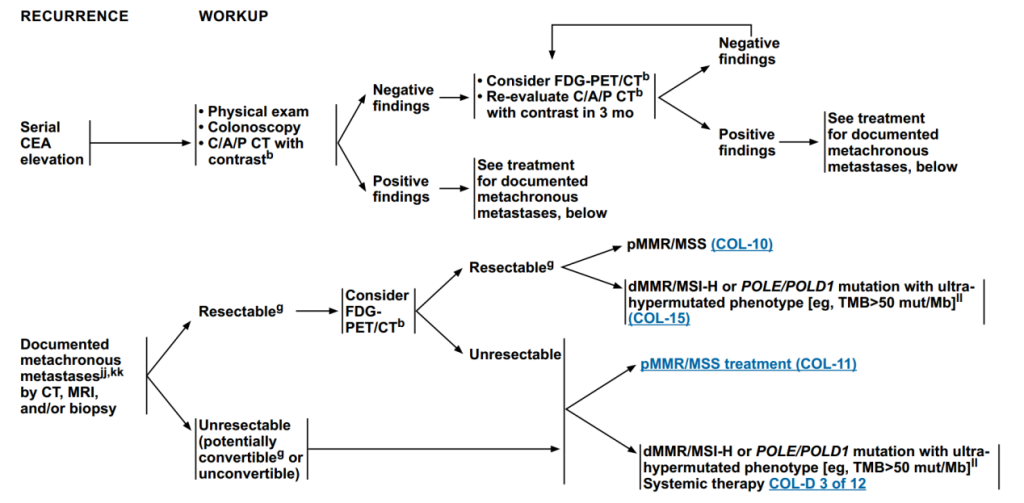
图4 连续CEA升高及证实异时转移
(3)pMMR/MSS可切除异时转移病灶治疗
无既往治疗史:
进行手术切除或局部治疗,后进行辅助治疗:FOLFOX或CAPEOX(首选)或卡培他滨或5-FU/亚叶酸。
进行新辅助治疗(2-3个月):FOLFOX、CAPEOX、卡培他滨或5-FU/亚叶酸,后续进行手术切除或局部治疗,然后进行辅助治疗:FOLFOX或CAPEOX、卡培他滨、5-FU/亚叶酸或观察。
有既往治疗史:
进行手术切除或局部治疗,后进行辅助治疗:观察、全身治疗±生物治疗。
进行新辅助化疗(2-3个月):FOLFOX、CAPEOX、卡培他滨或5-FU/亚叶酸,后进行辅助治疗:FOLFOX或CAPEOX、卡培他滨、5-FU/亚叶酸或观察。
所有辅助治疗方案结束后,均进入监测阶段。
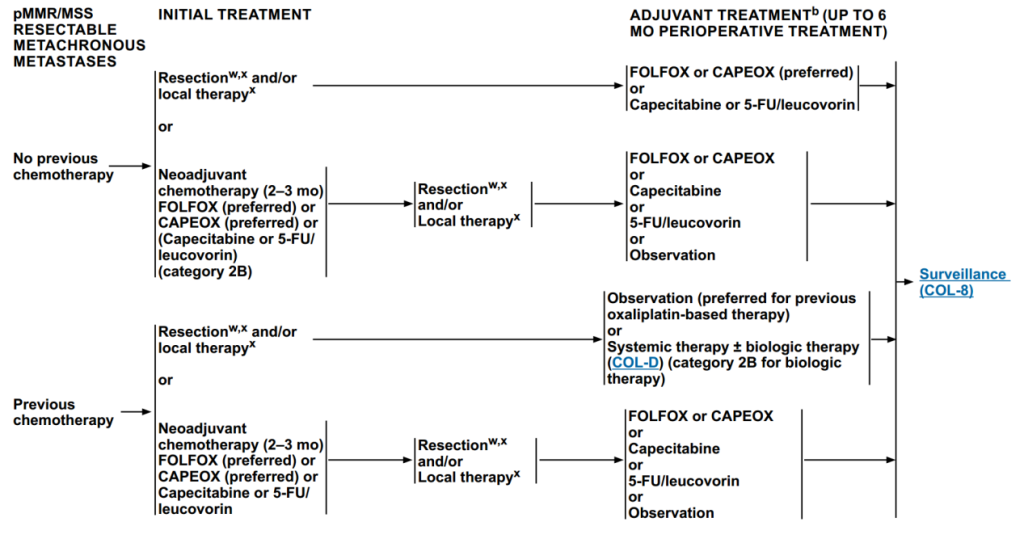
图 5 pMMR/MSS可切除异时转移病灶治疗
(4)pMMR/MSS不可切除异时转移病灶治疗
过去12个月内接受过FOLFOX/CAPEOX治疗:针对不同的突变,选择不同的化疗方案。
接受FOLFOX/CAPEOX治疗已超过12个月、接受过5-FU/亚叶酸卡培他滨治疗、无既往化疗:全身治疗。
初始治疗后,每2个月重新评估是否可转化为可切除。
若转化为可切除,首选手术切除,可联合局部治疗,术后进行辅助治疗:全身治疗±生物治疗或观察,最后进入监测阶段。
若仍不可切除,采用全身治疗,并考虑为特定患者进行局部治疗。
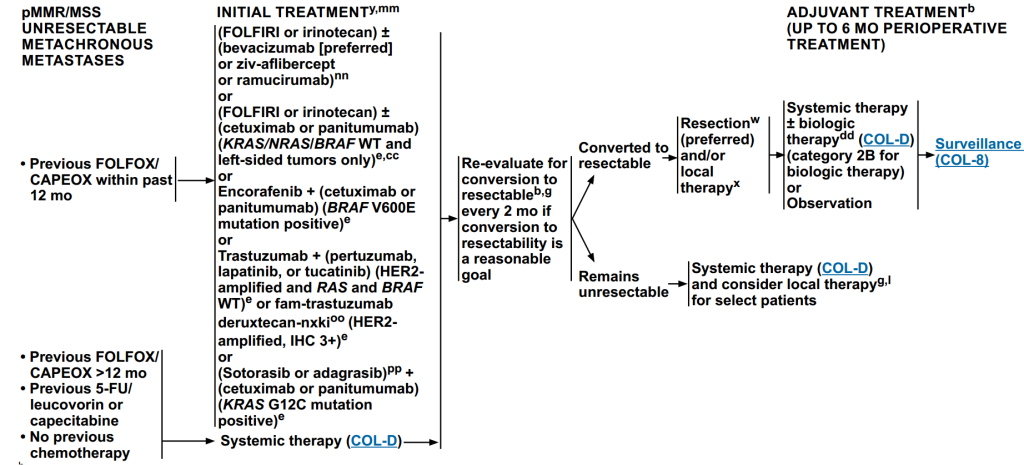
图6 pMMR/MSS不可切除异时转移病灶治疗
四
结直肠癌诊疗过程中分子标志物检测[2,4]
结直肠癌治疗已迈入精准化、个体化时代,分子标志物检测作为精准治疗的基石,在结直肠癌临床诊疗中发挥着日益重要的作用。
1
常规分子标志物检测
(1)KRAS、NRAS基因突变检测
KRAS、NRAS突变的检测,有助于帮助患者选择最佳的个体化治疗方案。
检测方法::Sanger测序法、PCR和NGS
(2)BRAF基因突变检测
BRAF V600E突变检测,可用于选择个体化治疗方案、帮助林奇综合征的诊断以及患者的预后判断。
检测方法:Sanger测序法、PCR和NGS
(3)微卫星不稳定性(MSI)/错配修复(MMR)检测
MSI/MMR状态对于遗传性结直肠癌的诊断也具有较大的意义,尤其是林奇综合征的诊断,MMR基因的胚系突变是确诊的金标准。遗传性结直肠癌的患者,应推荐进行MSI/MMR检测以帮助临床诊断。
检测方法:IHC、PCR、NGS
2
其他分子标志物检测
(1)HER2检测:
HER2基因扩增在CRC中的发生率仅为3%~5%,但与其预后密切相关,并已成为新的治疗靶点,同时HER2的检测在CRC的治疗决策中具有重要意义,
检测方法:IHC、FISH、NGS
(2)NTRK融合
NTRK基因融合在结直肠癌中比较罕见,NTRK抑制剂仅对携带NTRK融合的患者有效,而对突变患者无效。
检测方法:IHC、FISH、DNA-NGS、RNA-NGS
(3)POLE/POLD1突变检测
POLE/POLD1突变型结直肠癌往往表现出较高的肿瘤突变负荷(TMB),使其更倾向于从免疫治疗中获益;同时,POLE/POLD1 突变也与患者预后密切相关。
检测方法:NGS panel、单基因检测
(4)RET融合
RET基因融合在结直肠癌中属于罕见变异,研究发现RET融合阳性意味着更差的预后,转移性结直肠癌患者进行RET融合基因检测可以帮助判断预后以及指导靶向治疗。
检测方法:IHC、FISH、DNA-NGS、RNA-NGS
3
遗传性结直肠癌基因检测
5%~10%的结直肠癌病例是由明确界定的遗传性结直肠癌综合征引起的,因此在临床实践中,精准识别遗传性结直肠癌综合征对于风险评估和结直肠癌早期诊断至关重要。
检测方法:NGS

图7 结直肠癌相关遗传肿瘤综合征[2]
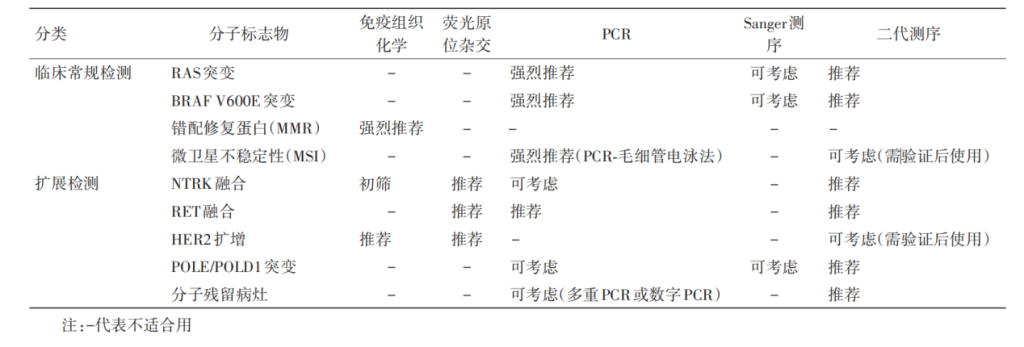
图8 结直肠癌分子标志物检测方法推荐[2]
基因组的变异检测在各种肿瘤类型中越来越多的用于诊断和治疗指导,基因靶向技术结合高通量测序可以检测遗传性结直肠癌相关基因(如MLH1、MSH2、APC等)胚系变异,帮助识别高危人群,指导家系筛查和预防措施;同时检测KRAS、NRAS、BRAF等基因突变,指导结直肠癌的靶向治疗;另外,能够检测POLE/POLD1突变,该基因突变患者表现出较高TMB,对免疫治疗有着更好的效果以及更好的预后;使用基于杂交捕获的二代测序对结直肠癌根治术后患者进行ctDNA MRD检测,以监测预后和提示复发风险[2,4]。
伯科生物在国内已经建设了全流程国产化的高通量核酸合成与应用技术转化中心,建立了GMP厂房和ISO9001、ISO13485质量体系。已经为国内外数百家知名医院、科学研究机构、临床检验所开发了上千款Gene Panel(液相基因芯片),并配套完整的检测试剂,各项性能参数均与国际竞品相当或优于(详见附表1),在基因组、转录组、甲基化组及病原体的检测应用方向均有成熟的产品管线。
附表1: 产品简介
肿瘤液相基因芯片
伯科设计的TargetCap® OncoGene Plus Research Panel基于美国食品药品监督管理局(FDA)批准的用于肿瘤基因检测的FoundationOne CDxTM与MSK-IMPACTTM,其覆盖702个肿瘤相关基因编码区和34个基因的非编码区(融合基因),含有6个MSI和53个化药相关位点,探针覆盖2.32Mb区间。这些区域涵盖更多基因,检测范围更泛,涉及肿瘤高频突变、肿瘤易感、药物靶向、药物耐受等多种类型基因。
性能表现
竞品评测
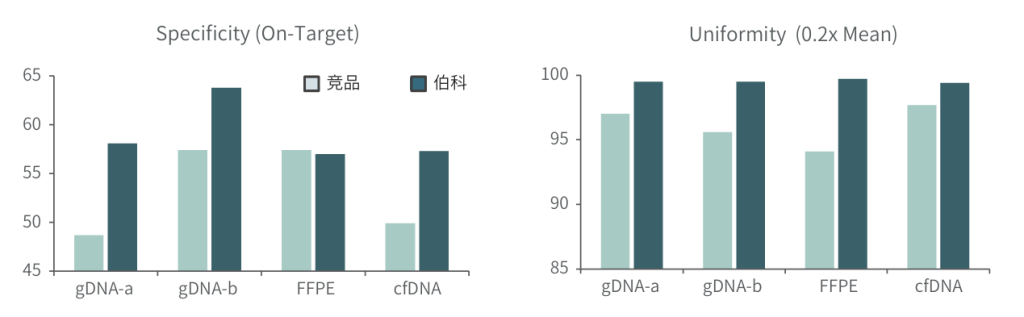
采用gDNA/cfDNA/FFPE/泛肿瘤800gDNA标准品文库,分别使用伯科商品化肿瘤大Panel-OncoGene Plus Research Panel与竞品肿瘤大Panel进行性能比较(二者大小相近),在捕获特异性上(On-Target)和覆盖均一性(0.2XMean)上,伯科均优于竞品。
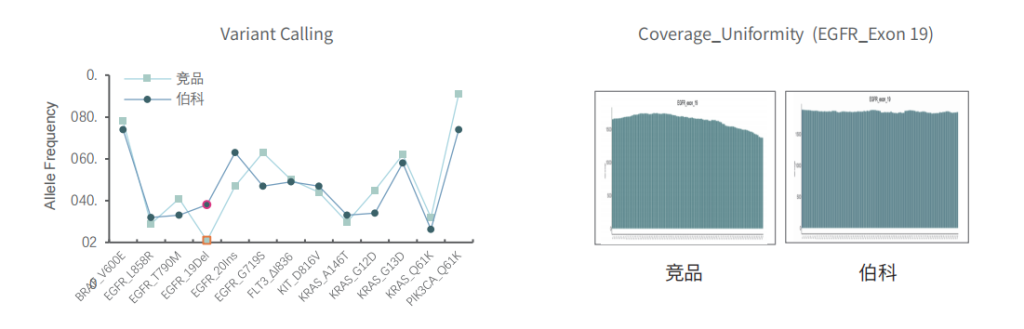
对于gDNA标准品,竞品测序35.9Gb,伯科测序19.6Gb,虽然伯科测序数据少,深度低,但二者的突变频率检出无明显差异,伯科对EGFR的19号外显子缺失变异的检出优于竞品。
不同样本类型表现
对不同质量的gDNA样本 (WBC/FFPE, >150例),TargetCap® OncoGene Plus Research Panel表现稳定。
杂交与清洗试剂盒v2 简介
产品概述
伯科杂交与清洗试剂盒v2 (TargetCap® Hybridization and Wash Kit v2)简化了试剂组分和操作流程,同时仍保持优异的捕获性能。该试剂盒由4种缓冲液组成,分别为Hyb Buffer、Bingding Buffer、Wash Buffer 1和Wash Buffer 2,所有试剂均为1x缓冲液,可以直接使用,同时清洗步骤仅需3步,整个操作流程更加便捷。

基本捕获性能
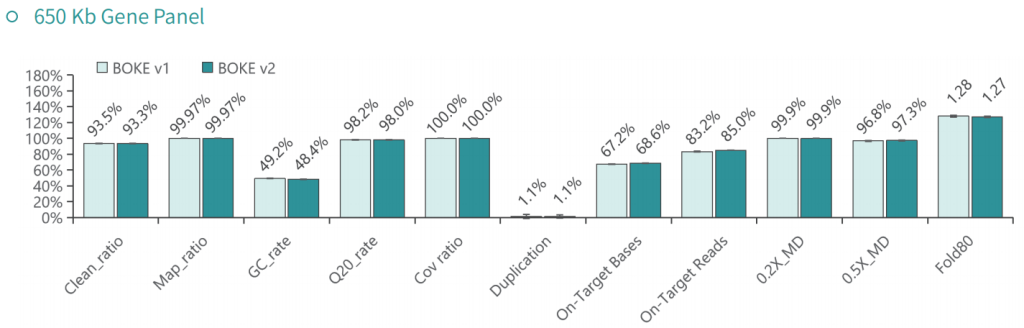
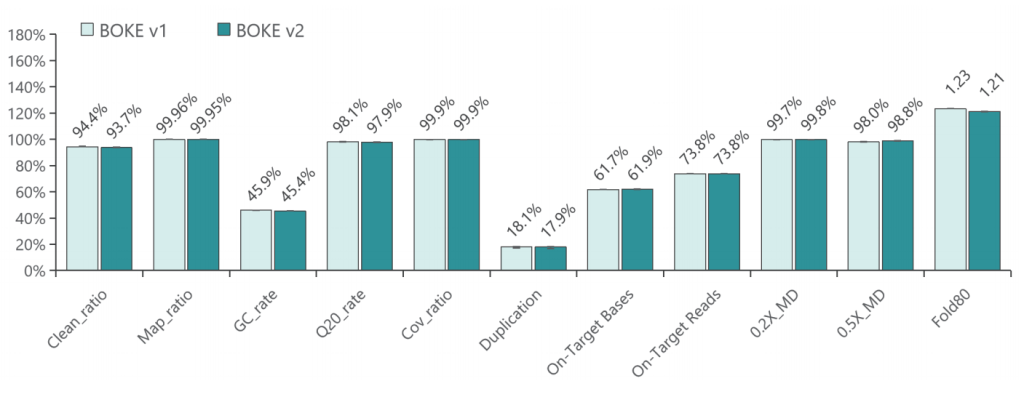
使用NA12878和NA24694 DNA标准品,分别采用不同大小的Gene Panel对TargetCap® Hybridization and Wash Kit v1和v2进行比较。结果显示,在不同大小的 Gene Panel 中, v2试剂盒的中靶率和均一性与v1试剂盒表现基本一致,v2试剂盒表现略好。
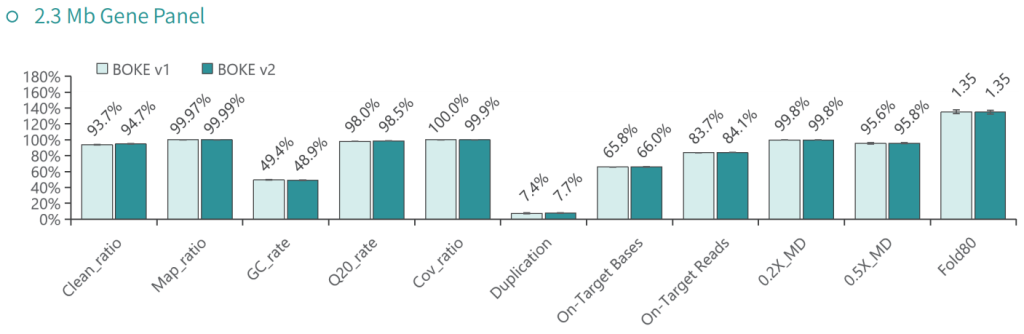
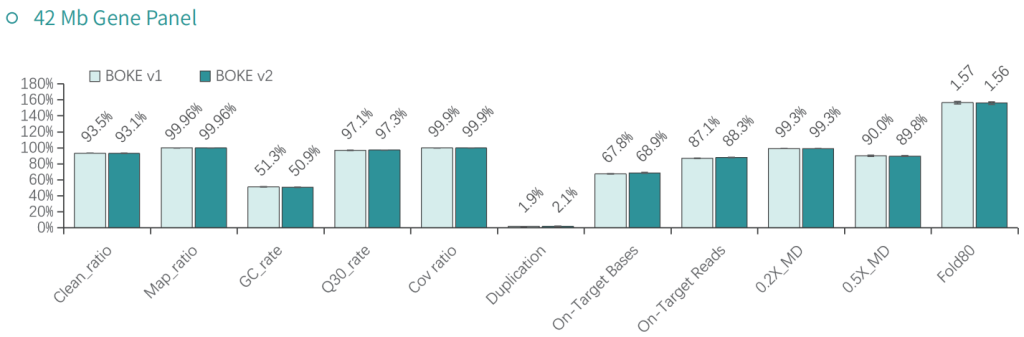
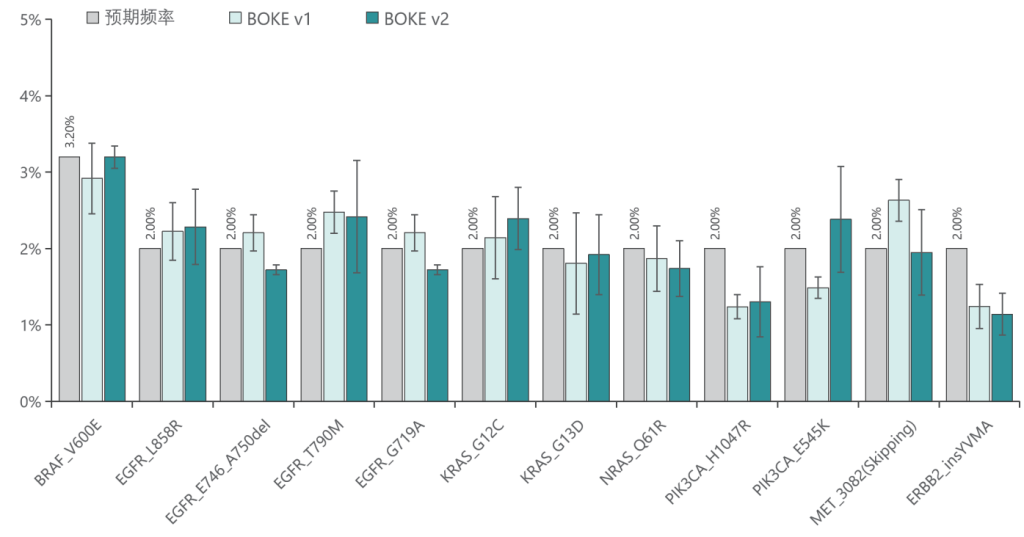
低频变异检测
使用肿瘤 SNV gDNA 标准品Ⅱ (GW-OGTM006) 对TargetCap® Hybridization and Wash Kit v1和 v2 进行验证。GW-OGTM006 DNA标准品包含 EGFR、KRAS、NRAS、BRAF、PIK3CA、FGFR3、Her2、MET 等多个常见伴随诊断基因及位点,包含点突变、插入和缺失等多种变异类型。
a. 基本QC
采用300Kb Gene Panel对该标准品进行捕获,捕获数据显示,v1与v2试剂盒的基本捕获性能表现相当,v2略优于v1。
b. 变异检测
v1与v2试剂盒均能对12个已知变异准确检出。
参考文献:
NCCN Clinical Practice Guidelines in Oncology-Colon Cancer(2025 Version 5).
结直肠癌分子病理检测临床实践指南(2025版).中华病理学杂志,2025. 中国临床肿瘤学会(CSCO)结直肠癌诊疗指南2025[M].人民卫生出版社,2025. 结直肠癌分子标志物临床检测中国专家共识.中华胃肠外科杂志, 2021.


