2026 V2.0 NCCN指南 | 宫颈癌的诊断与精准治疗
- boke
- 2026-01-12
- 2:19 下午
一
疾病概述
宫颈癌是指发生在子宫颈部位的恶性肿瘤,起源于子宫颈上皮细胞。正常宫颈上皮细胞在多种致癌因素(HPV感染是最重要因素)作用下,基因发生突变,细胞生长和分化失控,逐渐发展为癌细胞,并可侵犯周围组织和器官,甚至通过淋巴、血液转移至身体其他部位。宫颈癌发病率居妇科三大恶性肿瘤之首,是导致女性癌症死亡的第四大原因。根据组织类型,可将宫颈癌分为三类:鳞状细胞癌、腺癌、腺鳞癌,其中鳞状细胞癌最为常见,约占宫颈癌的70-80%。
二
疾病诊断分层

图1 宫颈癌诊断基本项目
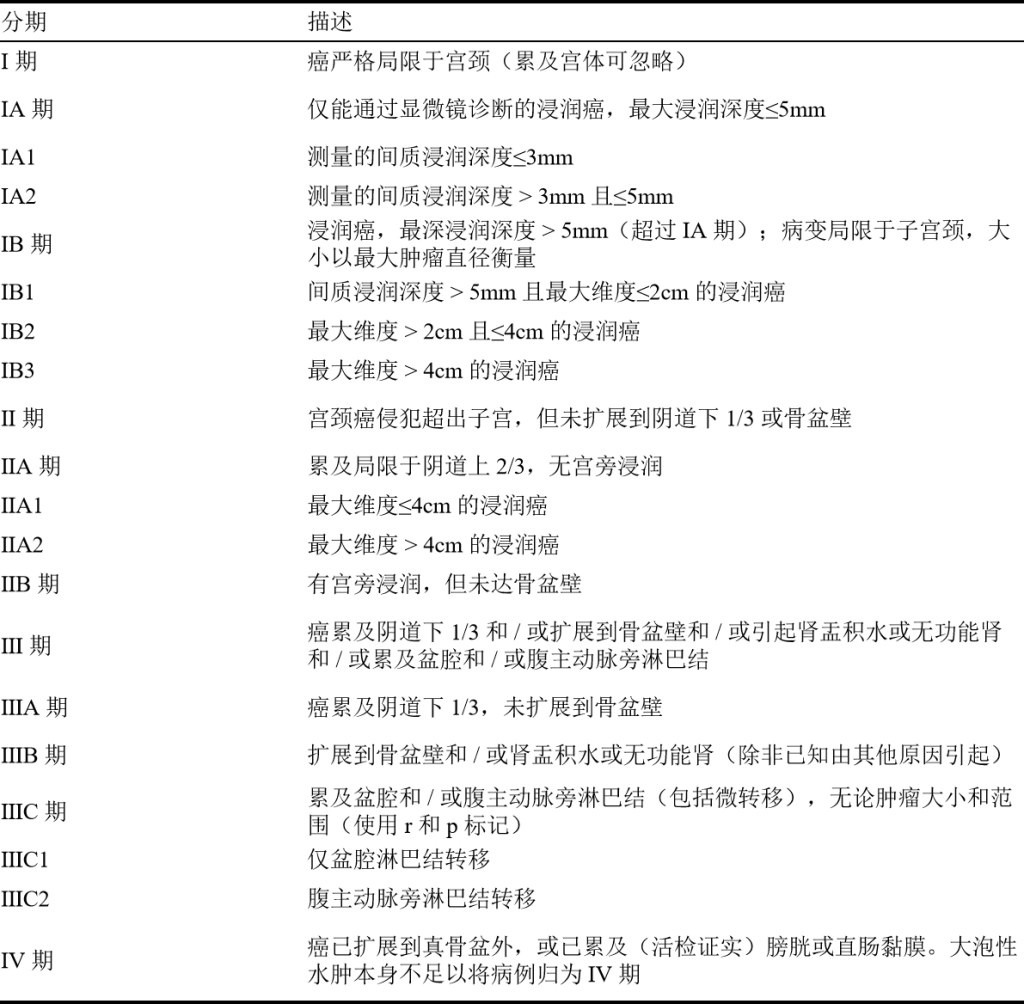
临床分期:按照国际妇产科联合会(FIGO)宫颈癌分期(2018)。
三
疾病治疗
宫颈癌的治疗手段包括手术、放疗、系统性治疗(包括化疗、免疫治疗和靶向治疗)。
1
鳞状细胞癌、腺癌或腺鳞状细胞癌初始治疗
根据上述的分期进行不同的治疗方案,分为保留生育功能和不保留生育功能。
(1)保留生育功能
IA1期无淋巴血管间隙侵犯(LVSI)
手术方案:锥形活组织检查(切缘阴性),术后进入随访阶段(切缘阳性则再次锥切或进行宫颈切除术)。
IA1期伴LVSI
手术方案:锥形活检(切缘阴性)+前哨淋巴结(SLN)定位或盆腔淋巴结清扫,术后进入随访阶段(切缘阳性则再次锥切或进行宫颈切除术)。
IA2-IB1期(基于锥切活检,符合保守手术条件)
注:保守条件:无LVSI、肿瘤锥切缘阴性、鳞状细胞(任何级别)/普通型腺癌(仅1级或2级)、肿瘤大小≤2 cm、LEEP/锥切上浸润深度≤10 mm、局部疾病成像阴性(推荐MRI)。
手术方案:锥切活检+前哨淋巴结定位/盆腔淋巴结清扫;若盆腔淋巴结阴性,进入随访;若为阳性,进入下一阶段治疗。
IB1 期(不符合保守条件)/IB2期
手术方案:根治性子宫颈切除术+SLN定位或盆腔淋巴结清扫±主动脉旁淋巴结切除术,后进入下一阶段治疗。
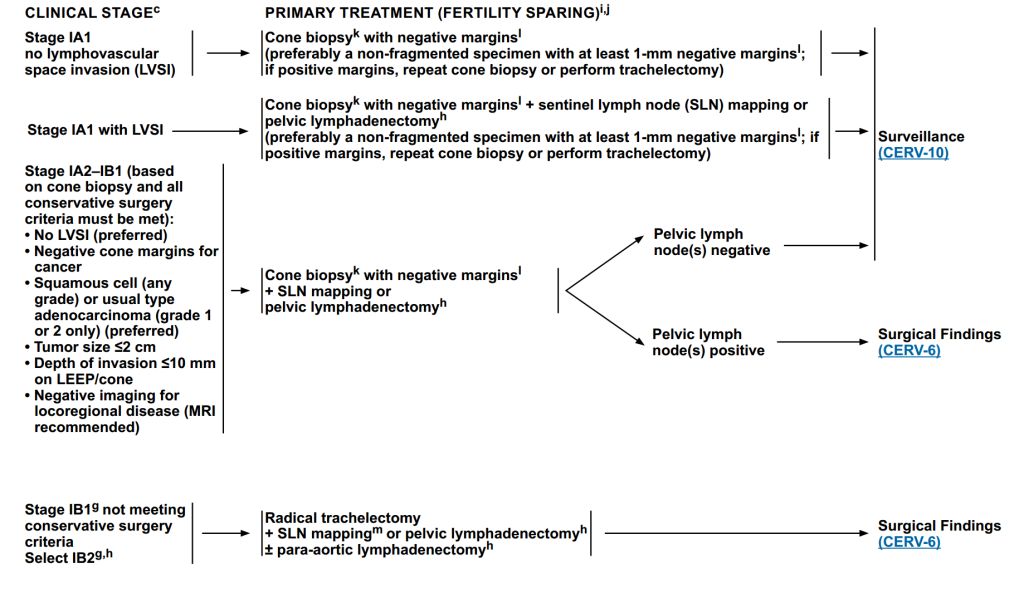
图3 初始治疗(保留生育功能)治疗方案
(2)不保留生育功能
IA1期无LVSI
首先进行锥切活检,根据结果进行进一步治疗。

IA1期伴LVSI
切缘阴性:A型子宫切除术+SLN定位或盆腔淋巴结清扫、EBRT+近距离放疗。
切缘阳性:重复锥切、A型子宫切除术(切缘异型增生阳性)+ SLN定位或盆腔淋巴结切除术、B型根治性子宫切除术(切缘癌阳性)+SLN定位或盆腔淋巴结切除术、盆腔EBRT+近距离放射治疗。
IA2-IB1期(符合保守条件)
A型子宫切除术+ SLN定位或盆腔淋巴结清扫,术后进行辅助治疗。
IB1期(不符合保守手术标准)、IB2期、IIA1期
C1型根治性子宫切除术+ SLN定位或盆腔淋巴结清扫±主动脉旁淋巴结切除术或盆腔EBRT+近距离放射治疗±同期含铂化疗。
IB3期、IIA2期
盆腔EBRT+同期含铂化疗+短程治疗或C1型根治性子宫切除术+盆腔淋巴结切除术±主动脉旁淋巴结切除术或盆腔EBRT+同期含铂化疗+短程治疗+选择性完全子宫切除术。
1
术后辅助治疗
根据不同的手术结果,进行不同的治疗方案,治疗后进入随访阶段。
阴性淋巴结、阴性切缘、阴性宫旁:
辅助治疗选择:直接观察;若复发风险较高风险,则进行盆腔EBRT。
盆腔淋巴结阳性/手术切缘阳性/子宫旁组织阳性:
首先进行转移性疾病的影像学检查:若无远处转移,进行盆腔EBRT+同步含铂化疗±近距离放疗,后续进入随访;若存在远处转移,需对可疑区域进行活检,活检结果阴性,按照无远处转移方案进行;活检结果阳性,全身治疗±个体化EBRT。
手术分期显示主动脉旁淋巴结阳性:
首先进行转移性疾病的影像学检查:若无远处转移,进行扩大放射治疗+同步含铂化疗±近距离放疗,后续进入随访;若存在远处转移,需对可疑区域进行活检,活检结果阴性,按照无远处转移方案进行;活检结果阳性,进行全身治疗±个体化EBRT。
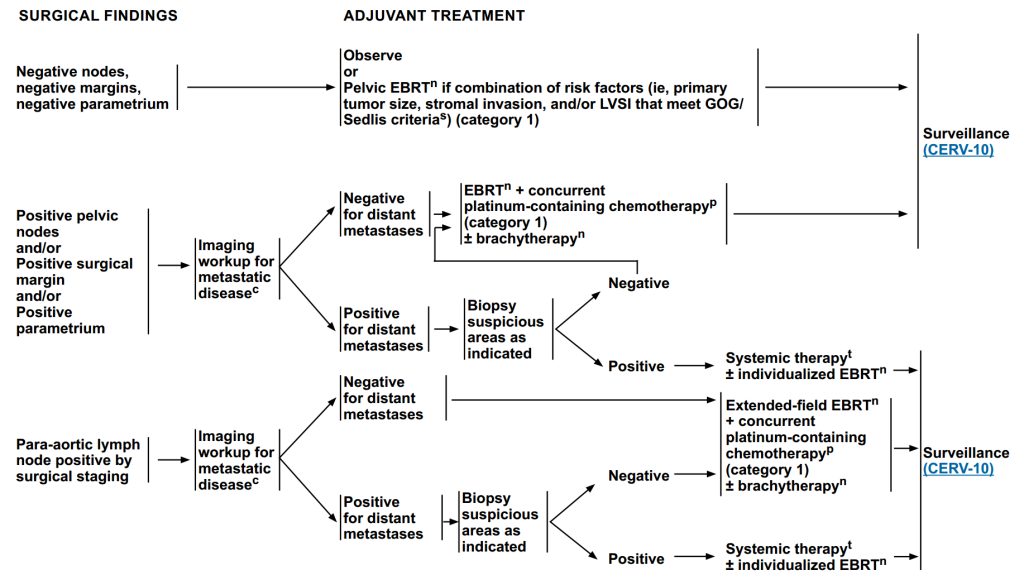
图4 术后辅助治疗方案
3
IIB-ⅣA期初始治疗
首先进行转移性疾病的影像学检查,若无远处转移,进行EBRT+同步含铂化疗+近距离放疗±帕博利珠单抗;若存在远处转移,需对可疑区域进行活检,活检结果阴性,按照无远处转移方案进行;活检结果阳性,全身治疗±个体化EBRT。
4
单纯全子宫切除术后并发浸润性鳞状或普通型腺癌
- ⅠA1期
先进行病理复查,若结果为“无淋巴血管间隙浸润(LVSI)+切缘阴性”,直接进入随访。
- IA1期伴LVSI和阴性切缘
首选:盆腔淋巴结清扫,后续淋巴结阴性进入随访;淋巴结阳性进行辅助治疗辅助治疗。
进行盆腔EBRT±近距离放疗±同步含铂化疗,完成治疗后进入随访。
- ⅠA2-ⅠB1 期宫颈癌(满足保守手术要求)
治疗方案与“IA1期伴LVSI和阴性切缘”方案一致。
- 切缘阳性
首先进行转移性疾病的影像学检查,若无远处转移,进行盆腔EBRT+同步含铂化疗+近距离放疗,后续进入随访;若有远处转移:直接进入辅助治疗。
- ⅠB1(不满足保守手术标准)-ⅠB2 期、切缘阴性、复发风险低:
首先进行转移性疾病的影像学检查。
若无远处转移,进行盆腔EBRT+同步含铂化疗+近距离放疗,后续进入随访;或者进行完整宫旁切除术/上阴道切除术+盆腔淋巴结清扫±腹主动脉旁淋巴结取样,若“淋巴结阴性+无残留病灶”则进入随访阶段;若“淋巴结阳性/手术切缘阳性/宫旁阳性”则进行盆腔 EBRT+ 同步含铂化疗±个体化近距离放疗(阴道切缘阳性时)。
若有远处转移,需进一步对可疑区域进行活检,活检阴性:进行EBRT+同步含铂化疗+近距离放疗,后续进入随访;活检阳性:进行全身治疗±个体化EBRT。
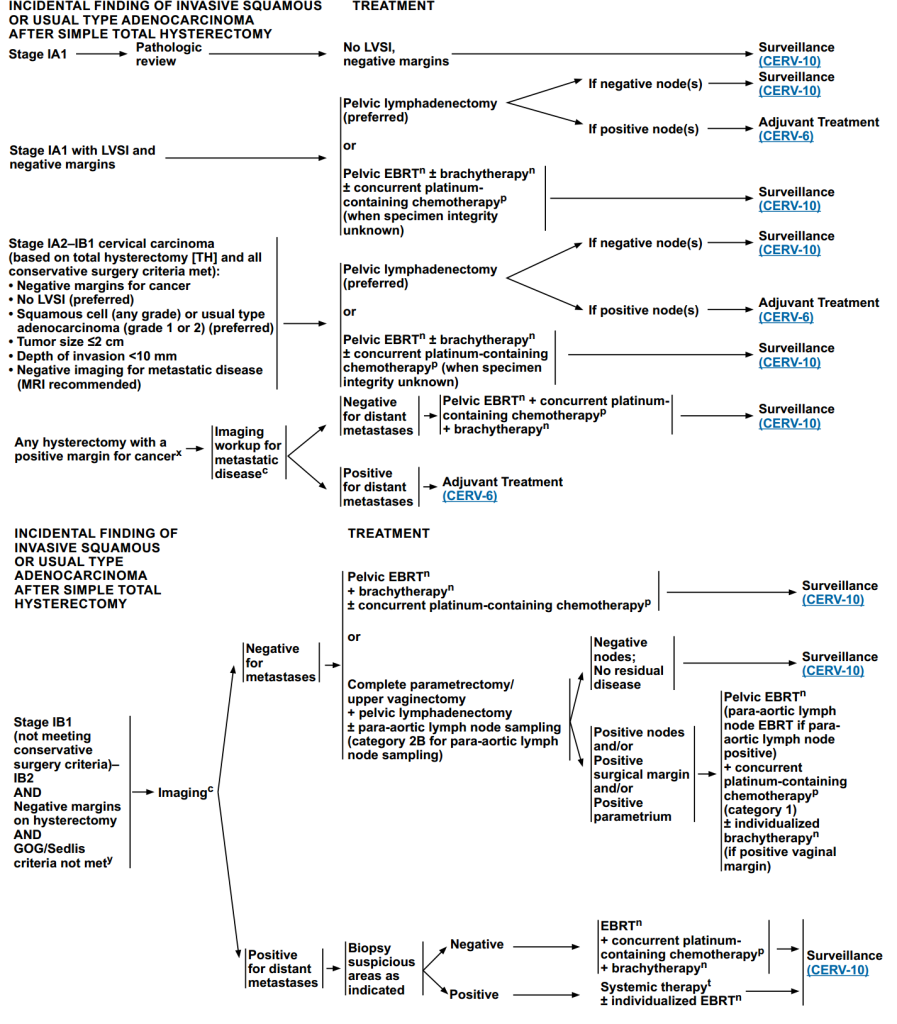
图5 子宫切除术后意外发现宫颈癌的治疗方案
5
随访
病史与体格检查(H&P):治疗后前2年,每3-6个月1次;第3-5年,每6-12个月1次;5年后根据患者复发风险每年1次。
宫颈/阴道细胞学筛查。
根据宫颈癌分期安排对应影像学检查。
实验室评估:根据症状或疑似复发的检查结果进行全血细胞计数(CBC)、血尿素氮(BUN)、肌酐。
治疗潜在长期和晚期效应的临床评价和管理。
若随访中发现持续或复发病变,需进行以下检查:
影像学检查:根据临床需求,补充额外的影像学评估。
活检±麻醉下妇科检查(EUA):据临床指征,对可疑病灶进行活检,必要时在麻醉下进行妇科检查(EUA)以充分评估。
手术探查:仅用于特定病例。
综合分子谱分析:需通过FDA批准检测或CLIA认证实验室的验证测试。
ctDNA检测:若转移部位活检不可行,通过血浆循环肿瘤DNA(ctDNA)做综合基因组分析(CGP)。
完成检查后,根据复发类型选择对应治疗路径。
6
局部区域复发的治疗
根据“是否有既往放疗史”和“复发类型”进行分层选择治疗方案,并明确复发后的后续方案。

7
ⅣB期或复发伴远处转移
适合局部治疗
手术切除±个体化EBRT、局部消融治疗±个体化EBRT、个体化EBRT±同步含铂化疗、考虑辅助全身治疗。
不适合局部治疗
全身治疗±最佳支持治疗。
8
宫颈小细胞神经内分泌癌(NECC)的治疗方案
所有患者需先进行影像学检查,基于结果分层进行治疗。
IA1-IB2(肿瘤≤4cm)
初始治疗:选择根治性子宫切除术+前哨淋巴结(SLN)定位/盆腔淋巴结清扫 ± 腹主动脉旁淋巴结取样或化疗+近距离放疗。
辅助治疗:化疗或放化疗,后进入随访阶段。
IB3期(肿瘤>4 cm)
初始治疗:放化疗+近距离放疗;新辅助化疗(顺铂/依托泊苷或卡铂/依托泊苷),之后考虑根治性子宫切除术。
辅助治疗:若进行根治性子宫切除,后续考虑辅助放疗或放化疗;若未进行根治性子宫切除,后续考虑额外全身治疗,进入监测阶段。
局部晚期疾病(IIA-ⅣA期)
初始治疗:放化疗+近距离放疗±化疗;新辅助化疗之后再进行“放化疗+近距离放疗”。
初始治疗后需评估治疗反应:若对治疗有反应,则直接进入随访阶段;若存在局部病变:治疗,选择为全身治疗或最佳支持治疗或考虑盆腔廓清术;若存在远处转移性疾病:优先选择全身治疗或选择最佳支持治疗。
转移性疾病(B期)
全身治疗或最佳支持治疗。
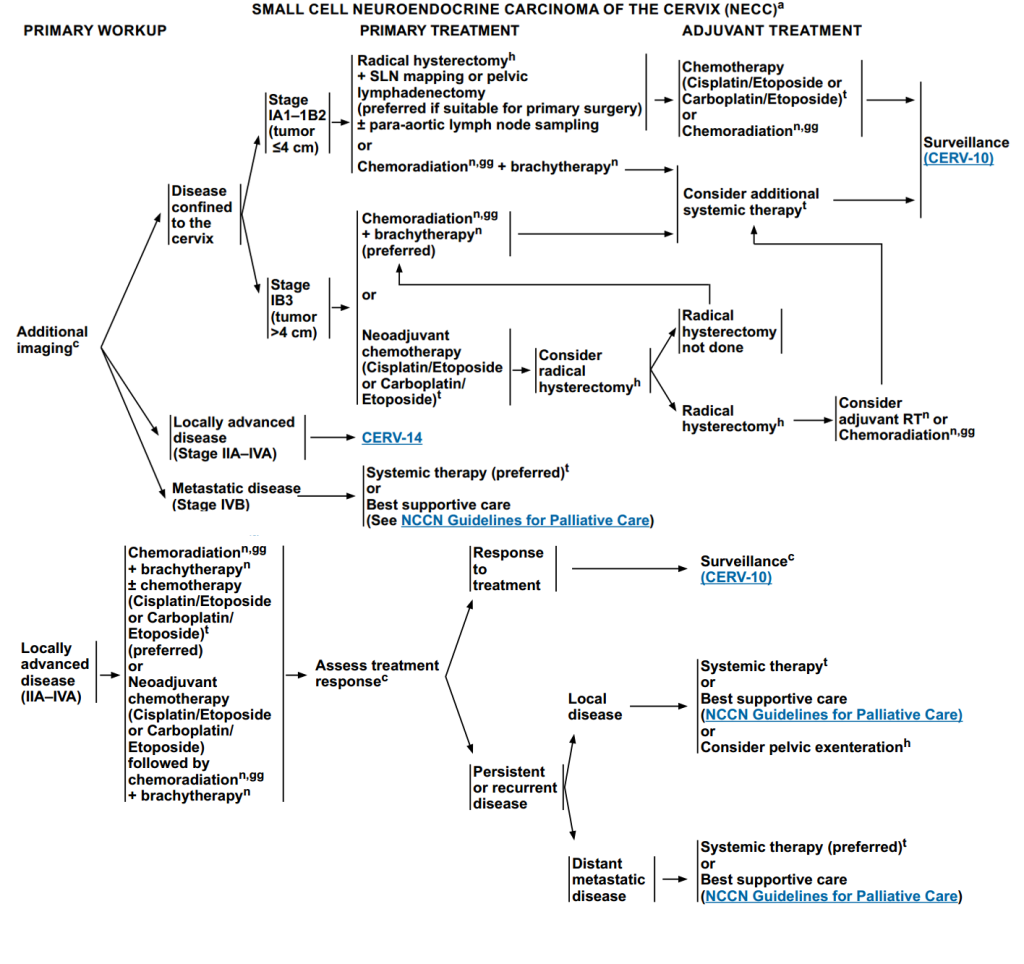
图6 NECC的治疗路径
四
宫颈癌诊疗过程中的基因检测[2,3]
1
宫颈癌筛查
HPV DNA 检测
初筛首选,识别高危HPV感染;HPV16/18阳性直接转诊阴道镜,非16/18型需进一步分流。
检测方法:PCR、实时荧光PCR、NGS(分型检测HPV 16/18/31/33等高危型)。
HPV E6/E7 mRNA检测
反映HPV致癌基因活性,区分一过性感染与持续性致癌风险,更准确地评估宫颈病变的风险。
DNA甲基化检测
通过检测肿瘤抑制基因、转录因子等的启动子甲基化状态(如PAX1、FAM19A4、SOX1等),识别宫颈癌及癌前病变风险。
检测方法:DNA甲基化特异性PCR扩增法(MSP)、全基因组甲基化测序(WGBS)、甲基化荧光定量法(Methylight)。
2
早期评估
PJS是常染色体显性遗传癌症易感综合征,由STK11基因胚系致病性突变引起,女性患者易发生宫颈胃型腺癌(G-EAC),发病率15%~30%。
STK11基因突变检测:长片段PCR、多重连接探针扩增技术(MLPA)、基因靶向微阵列。
3
免疫治疗标志物和靶向治疗相关靶点检测
免疫标志物
MMR:免疫组织化学(IHC)检测MLH1、 MSH2、MSH6、PMS2蛋白。
MSI:PCR、NGS、ctDNA-NGS。
TMB检测:WES(金标准),也可用经验证的NGS panel进行检测。
靶向治疗相关靶点
HER2基因扩增:初筛:IHC;确认:FISH(金标准)或NGS。
RET基因融合:FISH/RT-PCR(组织/细胞学样本)、NGS(组织/体液样本)等方法。
NTRK基因融合:初筛:IHC(高灵敏度、低成本);确认:RT-PCR/NGS(组织/体液样本)。
基因组的变异检测在各种肿瘤类型中越来越多的用于诊断和治疗指导,基因靶向技术结合高通量测序在宫颈癌中,检测到多个显著突变基因(SMGs)且存在HPV整合现象,这为疾病机制研究和临床干预提供了重要依据[4,5]。同时基因靶向技术结合高通量测序技术还用于免疫治疗预测标志物(MMR、TMB、MSI),辅助判断免疫治疗疗效以及用于靶向治疗相关靶点(HER2、RET、NTRK)检测,为宫颈癌患者提供个性化的靶向治疗方案选择[2]。
伯科生物在国内已经建设了全流程国产化的高通量核酸合成与应用技术转化中心,建立了GMP厂房和ISO9001、ISO13485质量体系。已经为国内外数百家知名医院、科学研究机构、临床检验所开发了上千款Gene Panel(液相基因芯片),并配套完整的检测试剂,各项性能参数均与国际竞品相当或优于(详见附表1),在基因组、转录组、甲基化组及病原体的检测应用方向均有成熟的产品管线。
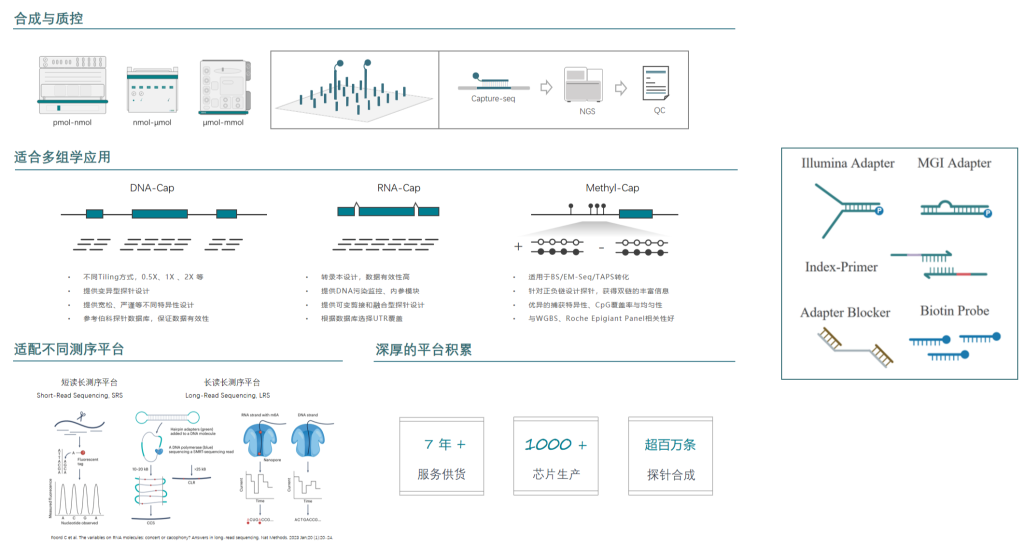
附表1: 产品简介
血液肿瘤液相基因芯片
TargetCap® Haematological Disease Research Panel是一款用于血液肿瘤研究分析的基础型panel,覆盖407个血液病相关基因,探针覆盖约2Mb区间。探针浓度已知,可独立或进一步掺入其他探针使用。
性能表现
竞品评测
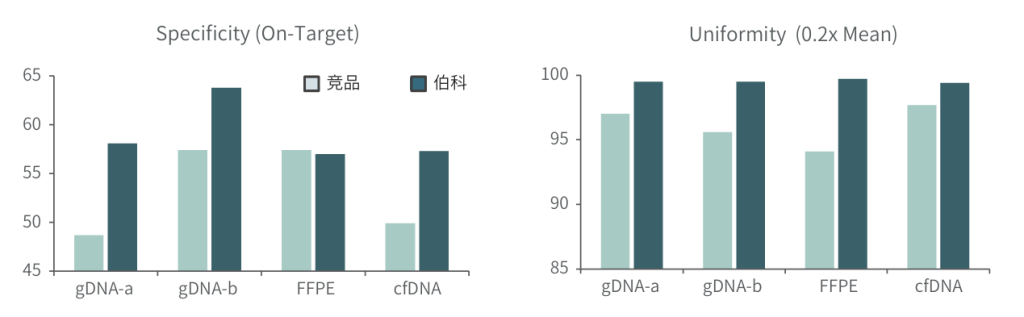
采用gDNA/cfDNA/FFPE/泛肿瘤800gDNA标准品文库,分别使用伯科商品化肿瘤大Panel-OncoGene Plus Research Panel与竞品肿瘤大Panel进行性能比较(二者大小相近),在捕获特异性上(On-Target)和覆盖均一性(0.2XMean)上,伯科均优于竞品。
对于gDNA标准品,竞品测序35.9Gb,伯科测序19.6Gb,虽然伯科测序数据少,深度低,但二者的突变频率检出无明显差异,伯科对EGFR的19号外显子缺失变异的检出优于竞品。
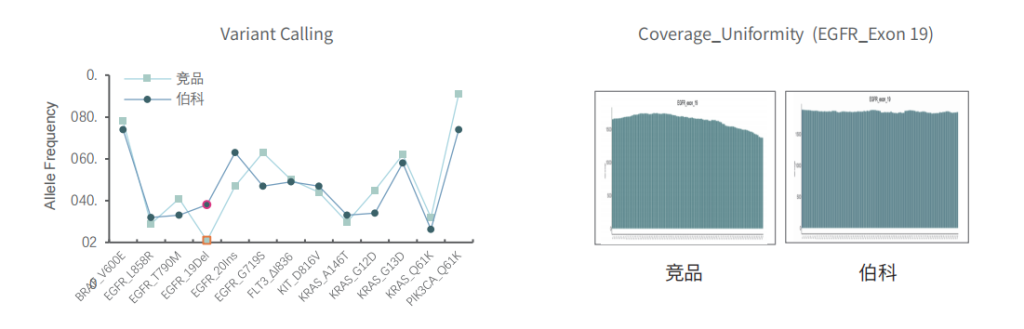
不同样本类型表现
对不同质量的gDNA样本 (WBC/FFPE, >150例),TargetCap® OncoGene Plus Research Panel表现稳定。
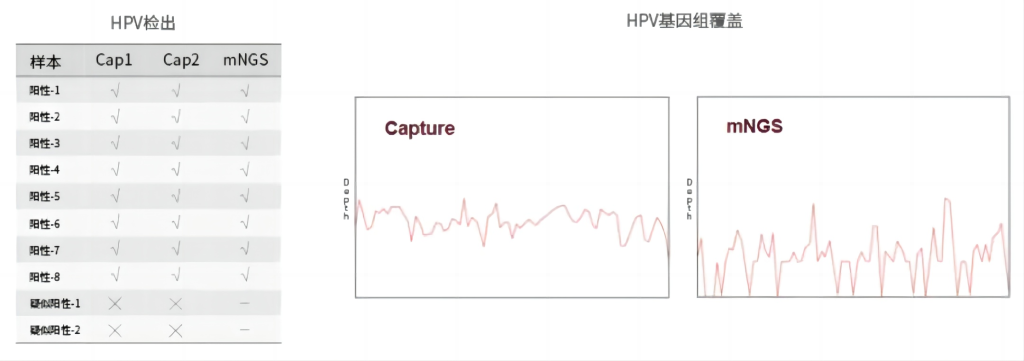
伯科HPV病毒液相基因芯片
数据表现
杂交与清洗试剂盒v2 简介
产品概述
伯科杂交与清洗试剂盒v2 (TargetCap® Hybridization and Wash Kit v2)简化了试剂组分和操作流程,同时仍保持优异的捕获性能。该试剂盒由4种缓冲液组成,分别为Hyb Buffer、Bingding Buffer、Wash Buffer 1和Wash Buffer 2,所有试剂均为1x缓冲液,可以直接使用,同时清洗步骤仅需3步,整个操作流程更加便捷。

基本捕获性能
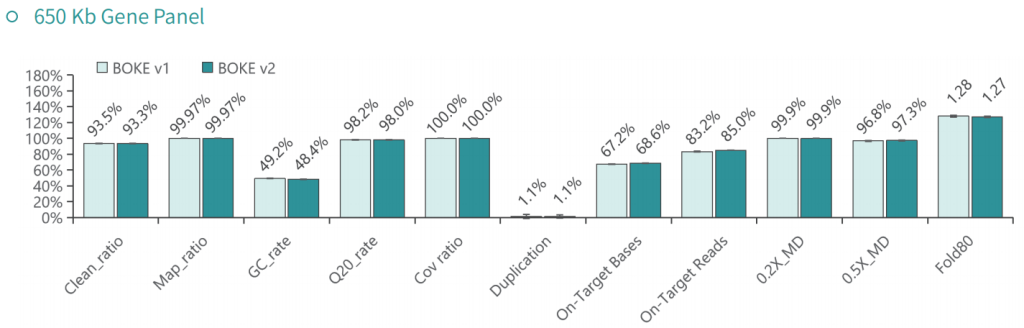
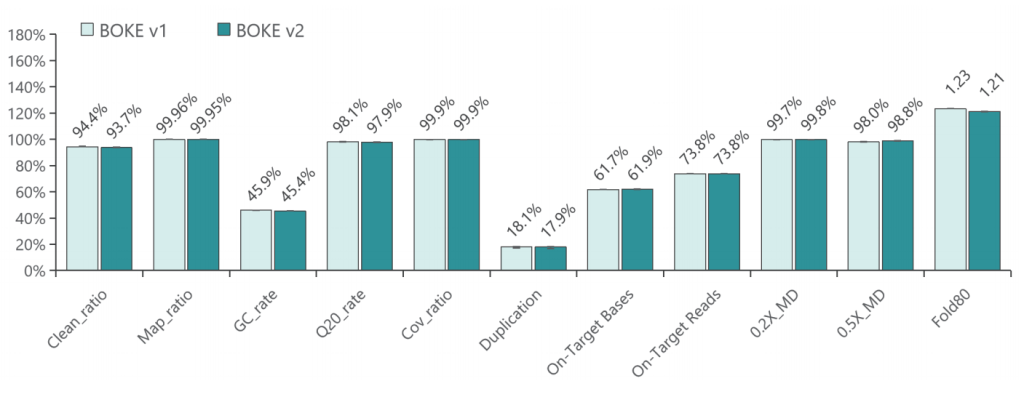
使用NA12878和NA24694 DNA标准品,分别采用不同大小的Gene Panel对TargetCap® Hybridization and Wash Kit v1和v2进行比较。结果显示,在不同大小的 Gene Panel 中, v2试剂盒的中靶率和均一性与v1试剂盒表现基本一致,v2试剂盒表现略好。
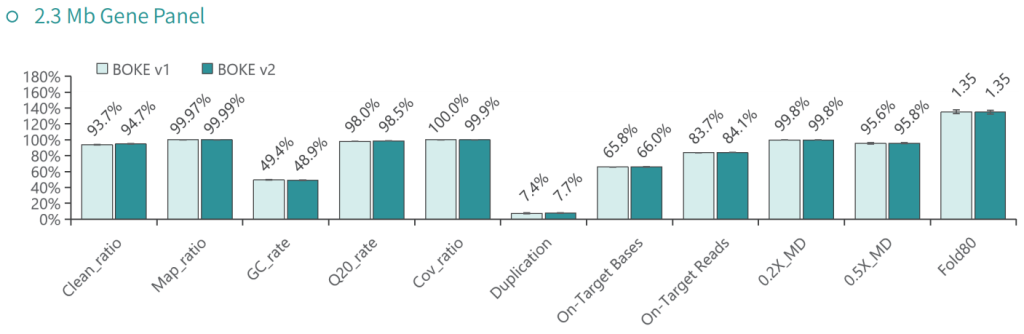
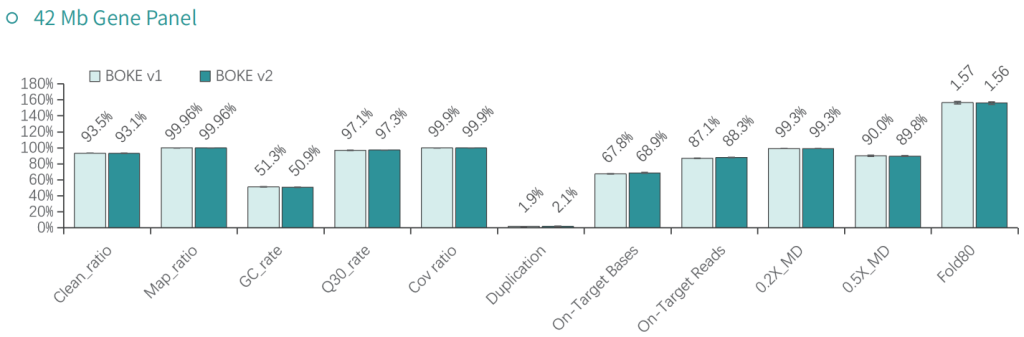
低频变异检测
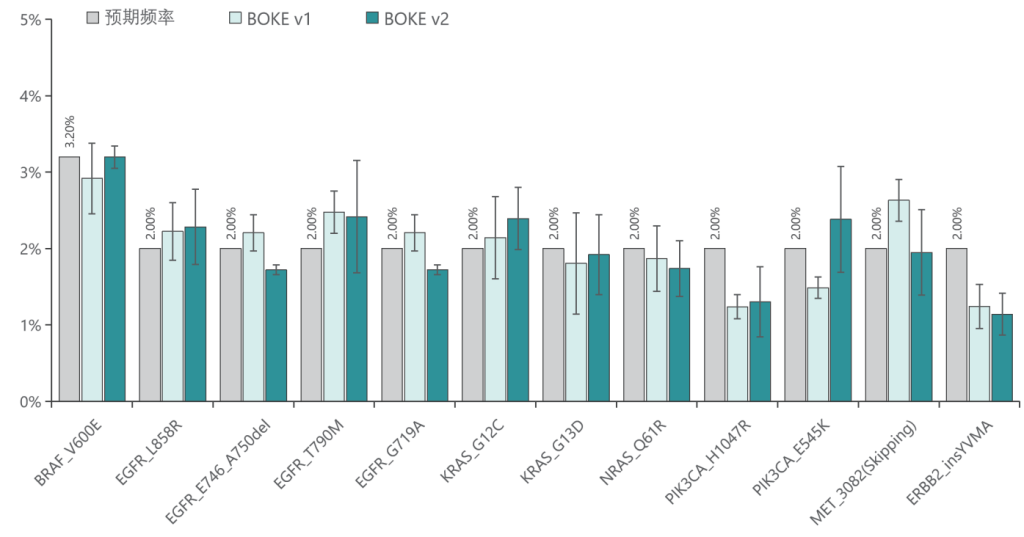
使用肿瘤 SNV gDNA 标准品Ⅱ (GW-OGTM006) 对TargetCap® Hybridization and Wash Kit v1和 v2 进行验证。GW-OGTM006 DNA标准品包含 EGFR、KRAS、NRAS、BRAF、PIK3CA、FGFR3、Her2、MET 等多个常见伴随诊断基因及位点,包含点突变、插入和缺失等多种变异类型。
a. 基本QC
采用300Kb Gene Panel对该标准品进行捕获,捕获数据显示,v1与v2试剂盒的基本捕获性能表现相当,v2略优于v1。
b. 变异检测
v1与v2试剂盒均能对12个已知变异准确检出。
参考文献:
NCCN Clinical Practice Guidelines in Oncology-Cervical Cancer(2026 Version 2).
基于临床需求的宫颈癌基因检测规范化选择中国专家共识(2025年版)[J].肿瘤学杂志,2025,31(07):557-566.
中国临床肿瘤学会(CSCO)宫颈癌诊疗指南2025[M]. 北京 :人民卫生出版社, 2025.
Integrated genomic and molecular characterization of cervical cancer. Nature. 2017 Mar 16;543(7645):378-384. doi: 10.1038/nature21386.
Assessing the Genomic Landscape of Cervical Cancers: Clinical Opportunities and Therapeutic Targets. Clin Cancer Res. 2023 Nov 14;29(22):4660-4668. doi: 10.1158/1078-0432.CCR-23-1078.


