2026 V2.0 NCCN指南|急性髓系白血病(AML)的诊断分层与精准治疗
- boke
- 2025-12-29
- 3:33 下午
一
疾病概述
急性髓系白血病(AML)是一种异质性的血液系统恶性肿瘤,是成人中最常见的急性白血病形式,其特征是外周血、骨髓(BM)和/或其他组织中髓系原始细胞的克隆性扩增。AML以及骨髓增生异常综合征(MDS)的发病率随着年龄的增加而上升。目前研究表明确定会增加AML风险的环境因素包括长期接触石油化工产品、溶剂(如苯)、杀虫剂、以及电离辐射等。
二
诊断与预后分层
1
AML诊断
血常规:白细胞计数可高、可低或正常,分类可见原始和幼稚髓细胞;血红蛋白和血小板常降低。
骨髓穿刺涂片:骨髓增生明显活跃或极度活跃,原始细胞≥20%,伴有不同程度的病态造血。
细胞化学染色:常用的有过氧化物酶(POX)染色、苏丹黑B(SB)染色、非特异性酯酶(NSE)染色等,有助于白血病细胞类型的鉴别。
免疫表型分析:通过流式细胞术检测白血病细胞表面抗原,有助于确定白血病细胞的来源和分化阶段,对诊断、分型和预后评估有重要意义。常见的髓系抗原包括CD13、CD33、CD117等。
细胞遗传学和分子遗传学检查:染色体核型分析、荧光原位杂交(FISH)、NGS测序分析染色体结构变异和FL3T-ITD等基因突变,有利于AML预后分层和治疗[2]。
2
AML预后分层
染色体核型和分子标志物是预测AML缓解率、复发风险和总生存期(OS)的最重要因素,NCCN指南采用欧洲白血病网(ELN)的风险分层建议,基于细胞遗传学、分子遗传学以等检测,将急性髓系白血病(AML)的预后分层分为三类:

图1 AML预后分层[2]
三
治疗方案
(一)APL治疗
APL是急性髓系白血病(AML)的特殊亚型,占成人AML的10%-15%。核心特征是骨髓中异常早幼粒细胞大量增殖,这些异常的细胞无法正常成熟为白细胞,还会抑制正常造血功能,导致贫血、出血、感染等问题。
1
低风险(白细胞数目≤109)
诱导治疗
首选方案:ATRA(全反式维甲酸)+每日ATO(ATO)、ATRA+间歇性ATO
特定情况使用:ATRA+伊达比星、ATRA+吉妥珠单抗奥唑米星
第28天血细胞计数恢复正常(血小板>100×109/L,中性粒细胞绝对计数[ANC] >1×109/L);进行骨髓穿刺和活组织检查,原始细胞<5%,无异常早幼粒细胞增多,进入巩固治疗。
巩固治疗
需采用与诱导方案配套的巩固方案,具体巩固方案见下表:
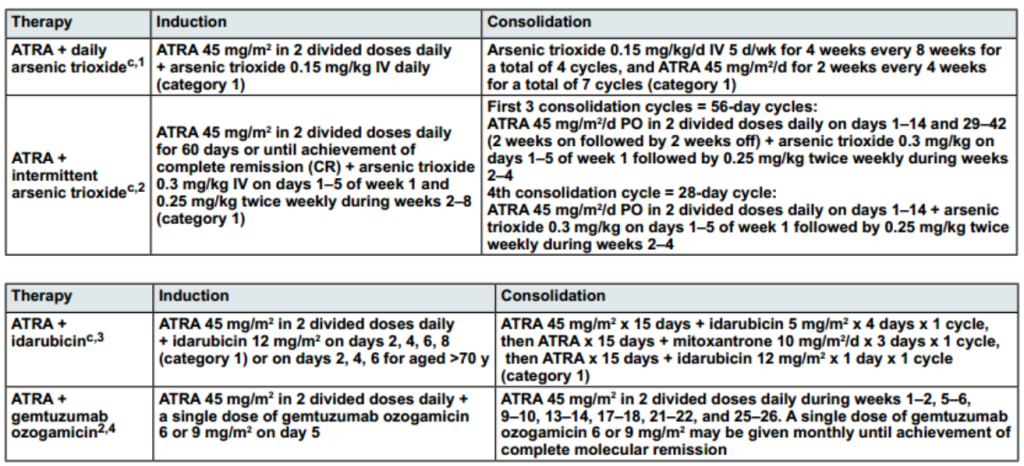
图2 低风险APL患者诱导与巩固治疗方案
2
高风险(白细胞数目>109)但无心脏问题
诱导治疗
首选方案:ATRA+伊达比星+ATO、ATRA+ATO(每日或间歇)+吉妥珠单抗奥唑米星
特殊情况使用(砷剂不可使用):ATRA+柔红霉素+阿糖胞苷、ATRA+伊达比星
与诱导方案配套的巩固方案,具体巩固方案见下表:
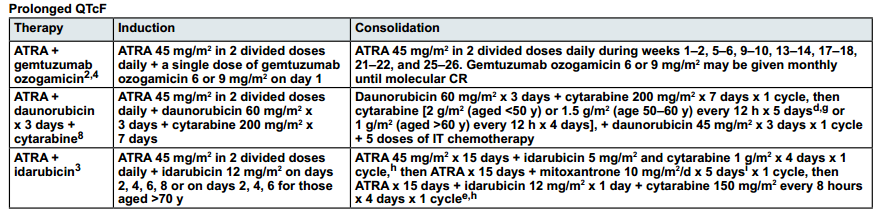
图3 高风险但无心脏问题APL患者诱导与巩固治疗方案
3
高风险(白细胞数目>109)但存在心脏问题
诱导治疗
Low EF(低射血分数):ATRA+ATO(每日或间歇)+吉妥珠单抗奥唑米星
QTcF(心率校正后的QT间期)延长:ATRA+吉妥珠单抗奥唑米星、ATRA+柔红霉素+阿糖胞苷、ATRA+伊达比星
与诱导方案配套的巩固方案,具体巩固方案见下表:
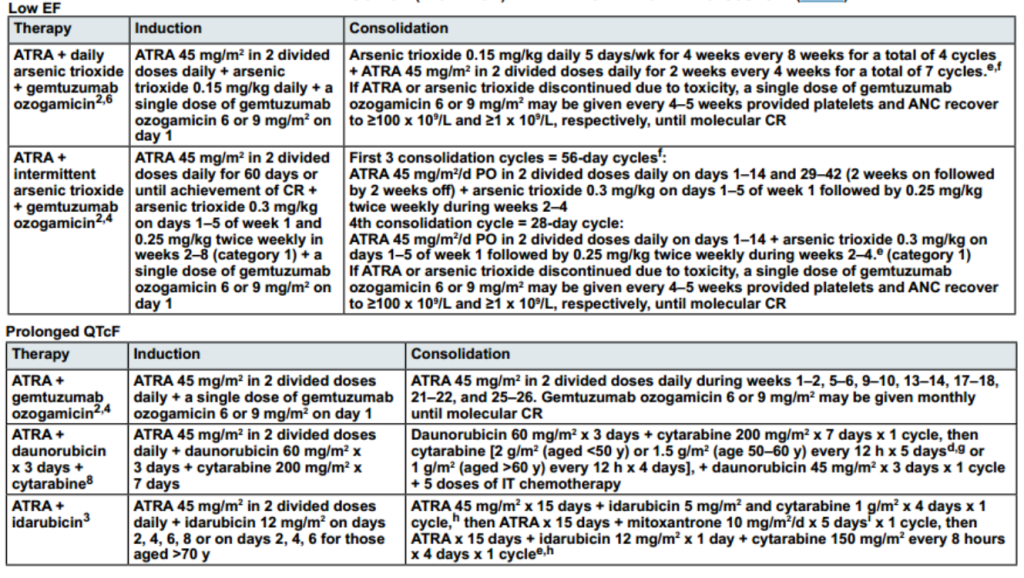
图3 高风险但存在心脏问题APL患者诱导与巩固治疗方案
注:
Low EF(低射血分数):表明可能存在心肌收缩力减低,心脏收缩功能下降,是心力衰竭的一个迹象;
QTcF(心率校正后的QT间期):QTcF延长时,可能提示心脏复极化异常,增加心律失常的风险。
巩固后治疗:
在巩固治疗结束时,应对血液样本进行PCR检测PML::RARα,以确认分子学完全缓解。
若PCR结果为阴性,进行维持治疗;若PCR结果为阴性,进入首次复发治疗。

图4 APL患者巩固后治疗方案
首次复发治疗
早期复发(<6个月),且既往接受过ATRA+ATO(未使用蒽环类药物):
采用蒽环类药物为基础的方案或 吉妥珠单抗奥佐米星。
既往未接触过ATO,或早期复发(<6个月)且既往接受过 ATRA+含蒽环类药物:
采用ATO ± ATRA ± 吉妥珠单抗奥佐米星。
接受ATO治疗后晚期复发(≥6个月):
采用ATO ± ATRA ±(蒽环类药物或吉妥珠单抗奥佐米星)。
若未达到形态学缓解,患者则需进行临床试验或者异体造血干细胞移植(Allo-HCT)。
若达到形态学缓解,考虑中枢神经系统(CNS)预防:进行鞘内化疗(甲氨蝶呤或阿糖胞苷)。之后使用骨髓样本进行PCR检测,根据结果决定后续治疗。
若PCR阴性,患者进行自体造血干细胞移植(Auto-HCT)或者ATO巩固;若PCR阳性,则需进行Allo-HCT。
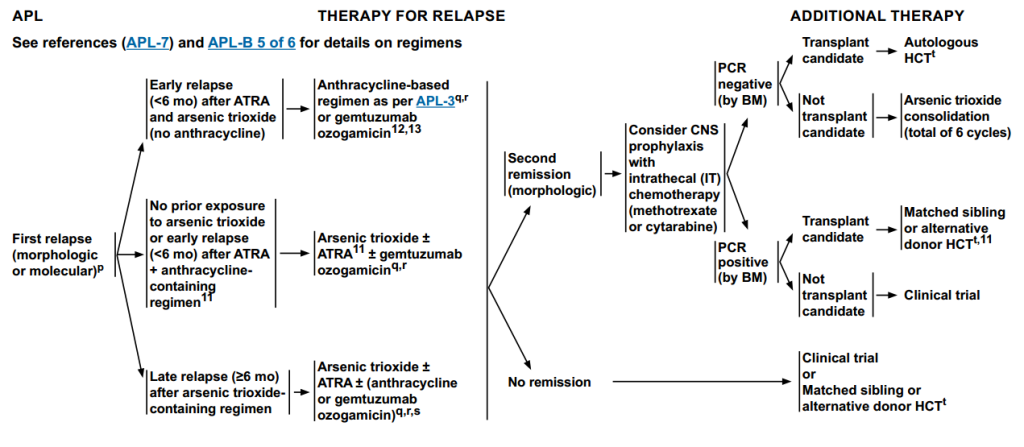
图5 APL患者复发治疗方案
(二)AML治疗
诱导治疗方案
适合强化诱导治疗患者的治疗方案
1
良好或中等风险AML患者治疗
CBF-AML
核心结合因子急性髓系白血病(CBF-AML)是指伴有t(8;21)或inv(16)/(t16;16)等特定染色体易位的AML。

图6 有利或中等风险AML患者诱导治疗方案
首选方案:标准“7+3”方案(连续使用7天阿糖胞苷+前3天柔红霉素或伊达比星)+吉妥珠单抗奥唑米星。
其他推荐方案:标准“7+3”方案、FLAG-IDA方案(氟达拉滨+阿糖胞苷+粒细胞集落刺激因子G-CSF+伊达比星)联合吉妥珠单抗奥唑米星(对>60岁患者慎用)。
特定情况下有用:对于不能耐受蒽环类药物的患者,可考虑FLAG+吉妥珠单抗奥唑米星。
通过分子突变定义的预后良好AML或其他中等风险AML
首选方案:标准 “7+3”方案。
其他推荐方案:FLAG-IDA方案(对>60岁患者慎用)、FLAG-IDA+吉妥珠单抗奥唑米星、CLAG-M(克拉屈滨+阿糖胞苷+G-CSF+米托蒽醌,对>60岁患者慎用)。
伴有FLT3突变的AML
标准 “7+3”方案+米哚妥林(适用于FLT3-ITD或TKD突变的患者)、标准 “7+3”方案+奎扎替尼(仅适用于FLT3-ITD)。
后续进入阿糖胞苷诱导后的随访和再诱导。
2
不良风险患者治疗
CBF-AML以外的治疗相关AML、既往MDS/CMML、具有符合MDS的细胞遗传学或分子学改变。
注:
治疗相关AML:指因既往接受化疗、放疗或其他细胞毒性治疗后继发发生的急性髓系白血病;MDS:骨髓增生异常综合征;CMML:慢性粒单核细胞白血病。
首选方案:CPX-351(阿糖胞苷和柔红霉素双药脂质体制剂)(年龄≥60)、标准“7+3”方案(年龄<60)
其他方案:地西他滨(第1-5天)+维奈托克、阿扎胞苷+维奈托克、CLIA +维奈托克、FLAG-IDA+维奈托克(>60岁患者慎用)
不伴有TP53突变/17p缺失的高危AML
无首选方案,建议进行临床试验
其他方案:标准“7+3”方案、CPX-351(阿糖胞苷和柔红霉素双药脂质体制剂)、FLAG-IDA方案(对>60岁患者慎用)、地西他滨(第1-5天)+维奈托克、阿扎胞苷+维奈托克、CLAG-M、CLIA +维奈托克、FLAG-IDA+维奈托克(>60岁患者慎用)
伴有TP53突变/17p缺失的高危AML
首选方案:临床试验
根据接受治疗方案的不同,后续分别进入阿糖胞苷的诱导治疗后的随访和再诱导治疗或低强度诱导治疗后的随访。

图7 不良风险AML患者诱导治疗方案
不适合或拒绝强化诱导治疗患者的治疗方案
1
伴有IDH1突变的AML
首选方案:阿扎胞苷+维奈托克、阿扎胞苷+艾伏尼布(靶向IDH1突变的口服抗癌药,抑制异常的IDH1酶活性)、地西他滨+维奈托克
其他方案:艾伏尼布单药使用
特定情况下使用:剂量阿糖胞苷(LDAC)+维奈托克(既往使用过HMA(去甲基化药物)患者)、阿扎胞苷或地西他滨(维奈托克禁忌症患者)、IDH1抑制剂—奥鲁他尼布(QT间期延长,不适合首选方案,也不适合艾伏尼布用药条件)
2
不伴有IDH1突变的AML
首选方案:阿扎胞苷+维奈托克、地西他滨+维奈托克
其他方案:克拉屈滨+LDAC+Venetoclax
特定情况下使用:低剂量阿糖胞苷(LDAC)+维奈托克(既往使用过HMA患者)、阿扎胞苷或地西他滨(维奈托克禁忌症患者)、LDAC+格拉吉布、吉瑞替尼+阿扎胞苷(FLT3突变患者)、恩西地平+阿扎胞苷(IDH2突变患者)、吉妥珠单抗奥佐米星(CD33阳性患者)
阿糖胞苷诱导后的随访和再诱导
诱导治疗14-21天之后,根据骨髓穿刺和活检结果,患者后续进行不同治疗:
若骨髓中存在残留病变,需进行再诱导
传统化疗:如标准“7+3”、“5+2”或单用阿糖胞苷
针对特定基因突变的联合方案:标准“7+3”方案+米哚妥林(FLT3突变(ITD或TKD) 患者)、标准“7+3”或“5+2”方案+奎扎替尼(FLT3-ITD突变)
去甲基化药物联合方案:阿扎胞苷或地西他滨+维奈克拉
首选且仅限在初次诱导治疗时已使用此方案,且患者属于特定高危类型:CPX-351
若骨髓处于增生低下状态
注:
骨髓处于增生低下:化疗药物起作用,在杀死肿瘤细胞的同时,会抑制骨髓造血细胞的增殖和分化。
等待血细胞计数恢复后续再次进行骨髓穿刺和活检,检测缓解程度。
若有缓解,则进行巩固治疗或继续低强度治疗;
若对诱导治疗无反应,进行Allo-HCT。若无临床试验可考虑使用阿糖胞苷±蒽环类药物;若不适合移植,则进入“复发/难治性疾病治疗”,或进行最佳支持治疗。
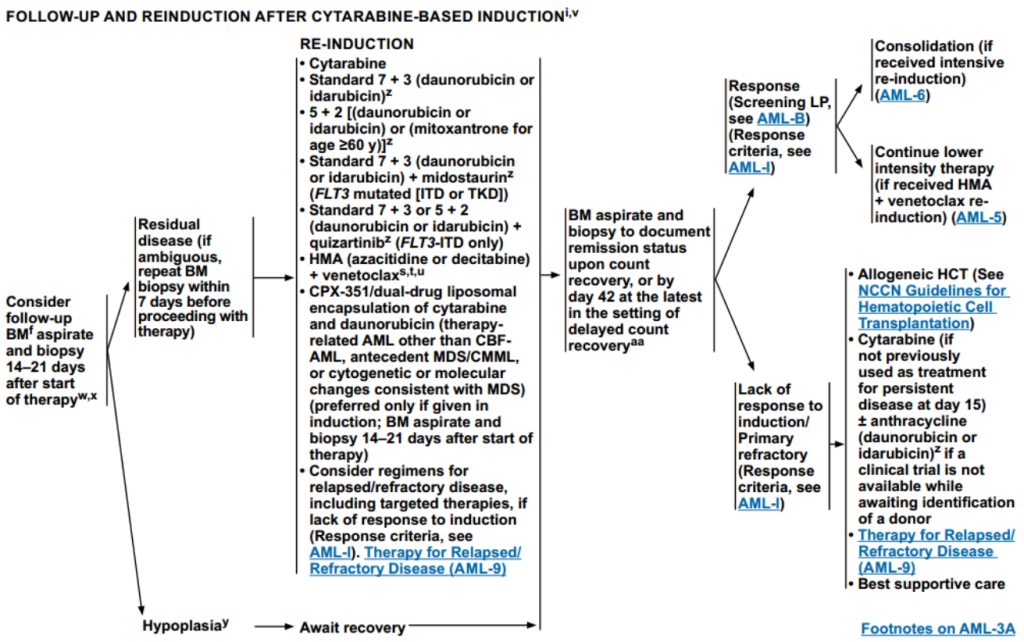
图8 阿糖胞苷诱导后的随访和再诱导
低强度诱导治疗后的随访
进行骨髓穿刺和活检和微小残留病灶(MRD)评估,以确认疾病状态(是否达到缓解)。
治疗有效,获得缓解:进行Allo-HCT或继续低强度治疗,最后进行维持治疗
治疗无效,无缓解:进入“复发/难治性疾病治疗”,或进行最佳支持治疗。

图9 低强度诱导治疗后的随访
巩固治疗方案
患者在完成诱导治疗并获得完全缓解后,根据其最初的疾病风险分层来选择后续的巩固治疗方案,以清除残留病灶、预防复发。
1
良好风险
阿糖胞苷±妥珠单抗奥唑米星(仅在诱导治疗阶段已使用过妥珠单抗奥唑米星的患者)
阿糖胞苷(5或7天)±柔红霉素或伊达比星或米托蒽醌(适用于年龄≥60岁)
阿糖胞苷+柔红霉素或伊达比星+妥珠单抗奥唑米星(仅在诱导治疗阶段已使用过妥珠单抗奥唑米星的患者)
AML伴FLT3突变
Allo-HCT(对于FLT3-ITD突变者优先使用)
阿糖胞苷+米哚妥林
阿糖胞苷+奎扎替尼
2
中等风险
阿糖胞苷、阿糖胞苷+柔红霉素或伊达比星+妥珠单抗奥唑米星(仅在诱导治疗阶段已使用过妥珠单抗奥唑米星的患者)、Allo-HCT
3
不良风险
首要方案:Allo-HCT
其他方案:阿糖孢苷、CPX-351(仅在诱导期使用过首选)、FLAG-IDA(>60岁的患者慎用,仅在诱导期使用过首选)、继续使用较低强度方案进行诱导
巩固治疗之后,可考虑进行Allo-HCT(之前未进行)或后续进入维持治疗或者监测阶段。
维持治疗方案
1
化疗后的维持治疗
非CBF-AML患者:已完成诱导化疗(可能接受过部分巩固治疗),目前处于缓解期。
首选考虑口服阿扎胞苷,直至疾病进展或出现不可接受的毒性
有FLT3突变病史的患者:曾接受过FLT3抑制剂治疗
优选奎扎替尼(FLT3-ITD突变)、米哚妥林(FLT3-ITD或TKD突变)。
2
Allo-HCT后的维持治疗
移植后处于缓解期且有FLT3突变的患者:吉瑞替尼(尤其适用于移植前未达到MRD阴性的CR1患者)、索拉非尼(仅用于FLT3-ITD)、米哚妥林、奎扎替尼(仅用于FLT3-ITD)。
移植后处于缓解期且有高危特征AML病史的患者:低剂量地西他滨+ G-CSF
复发或难治性疾病治疗方案
1
首选方案:临床试验
2
靶向治疗方案
FLT3-ITD突变AML的治疗:吉瑞替尼、HMA(阿扎胞苷或地西他滨)+索拉非尼、Quizartinib;FLT 3-TKD突变AML的治疗:吉瑞替尼;IDH2突变AML的治疗:恩西地平;IDH1突变AML的治疗:艾伏尼布;CD33阳性AML的治疗:妥珠单抗奥唑米星;KMT2A基因重排AML的治疗:瑞维美尼;NPM1突变AML的治疗:瑞维美尼
3
高强度治疗
克拉屈滨+阿糖胞苷+G-CSF±(米托蒽醌或依达比加群酯)、阿糖胞苷±(柔红霉素或伊达比星或米托蒽醌)、氟达拉滨+阿糖胞苷+G-CSF±依达拉滨±维奈托克、依托泊苷+阿糖胞苷±米托蒽醌、氯法拉滨±阿糖胞苷±依达拉滨、CLIA(克拉屈滨+伊达比星+阿糖胞苷)+维奈托克
4
低强度治疗
HMA(阿扎胞苷或地西他滨)、LDAC、(HMA或LDAC)+维奈托克
监 测
常规血液学监测:完成治疗后最初2年,每1-3个月进行一次全血细胞计数(CBC)和血小板检查;第3年至第5年,延长至每3-6个月检查一次。
骨髓检查:仅当外周涂片异常或出现血细胞减少时进行骨髓穿刺和活检
确认分子学完全缓解并监测分子学复发,如监测患者体内MRD。
基因组的变异检测在各种肿瘤类型中越来越多的用于诊断和治疗指导,基因靶向技术结合高通量测序在急性髓系白血病(AML)的诊断、预后评估、治疗指导和疾病监测中发挥着重要的作用。NGS在AML中检测出多个致病胚系变异(如RUNX1、GATA2等)与体细胞变异(如FLT3、TP53等),为AML的分子亚型分类提供依据同时还有助于家庭风险评估、遗传咨询[3,4]。基因靶向技术结合高通量测序还能够以极高的灵敏度检测MRD(检测到特定基因突变残留,如FLT3-ITD或NPM1),能更加精准区分高危与低危患者[5,6]。
伯科生物在国内已经建设了全流程国产化的高通量核酸合成与应用技术转化中心,建立了GMP厂房和ISO9001、ISO13485质量体系。已经为国内外数百家知名医院、科学研究机构、临床检验所开发了上千款Gene Panel(液相基因芯片),并配套完整的检测试剂,各项性能参数均与国际竞品相当或优于(详见附表1),在基因组、转录组、甲基化组及病原体的检测应用方向均有成熟的产品管线。
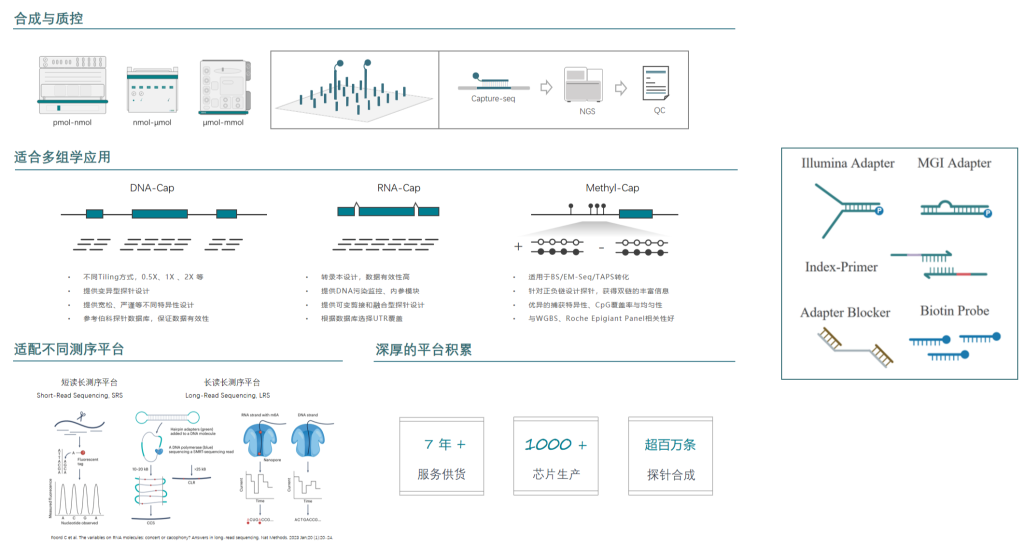
附表1: 产品简介
血液肿瘤液相基因芯片
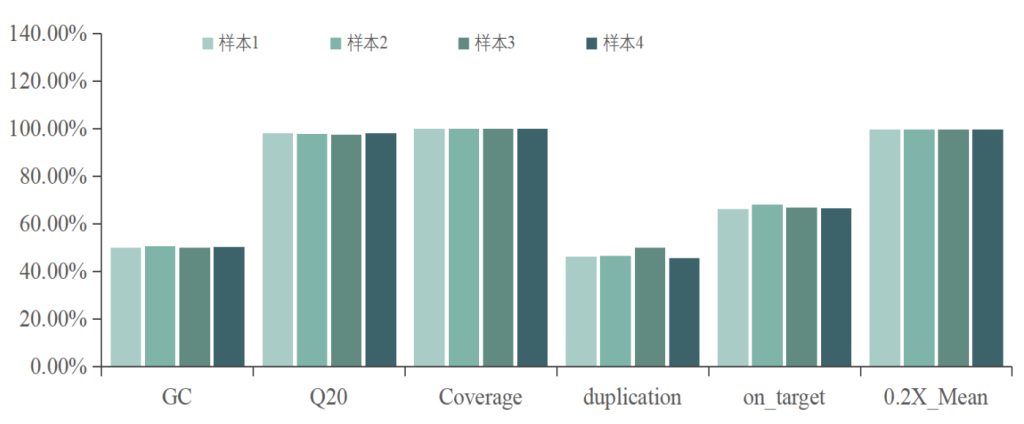
TargetCap® Haematological Disease Research Panel是一款用于血液肿瘤研究分析的基础型panel,覆盖407个血液病相关基因,探针覆盖约2Mb区间。探针浓度已知,可独立或进一步掺入其他探针使用。

数据表现
杂交与清洗试剂盒v2 简介
产品概述
伯科杂交与清洗试剂盒v2 (TargetCap® Hybridization and Wash Kit v2)简化了试剂组分和操作流程,同时仍保持优异的捕获性能。该试剂盒由4种缓冲液组成,分别为Hyb Buffer、Bingding Buffer、Wash Buffer 1和Wash Buffer 2,所有试剂均为1x缓冲液,可以直接使用,同时清洗步骤仅需3步,整个操作流程更加便捷。

基本捕获性能
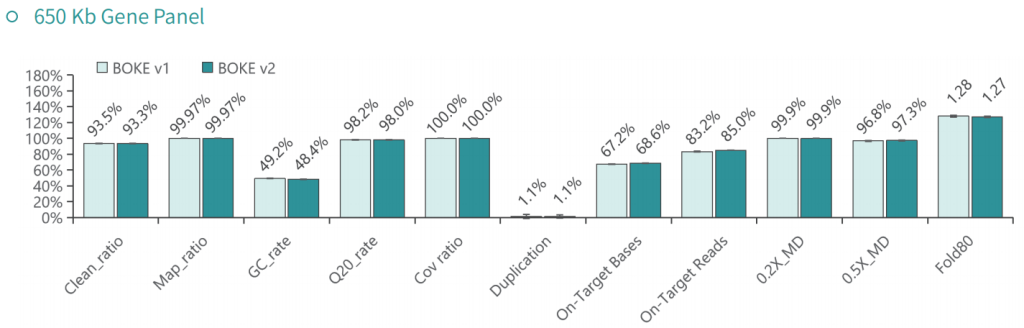
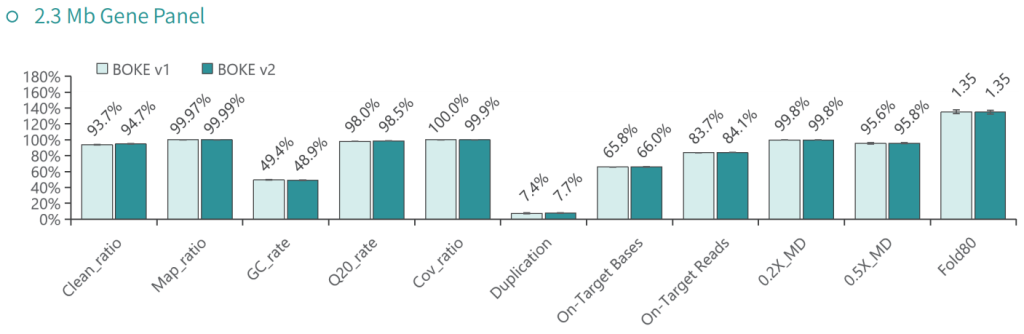
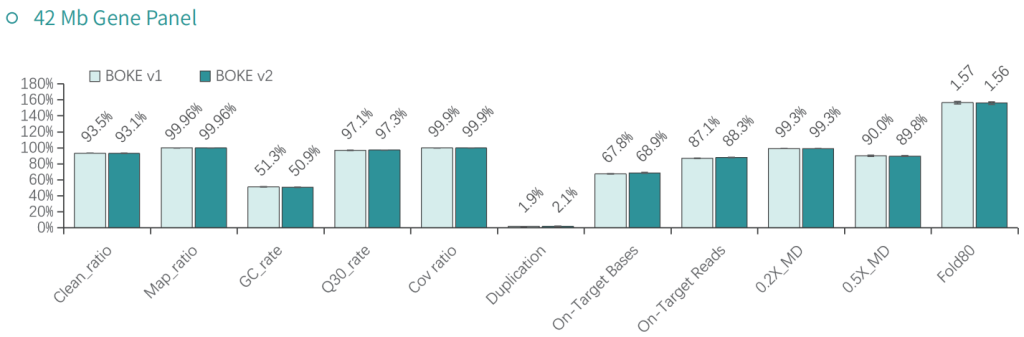
使用NA12878和NA24694 DNA标准品,分别采用不同大小的Gene Panel对TargetCap® Hybridization and Wash Kit v1和v2进行比较。结果显示,在不同大小的 Gene Panel 中, v2试剂盒的中靶率和均一性与v1试剂盒表现基本一致,v2试剂盒表现略好。
低频变异检测
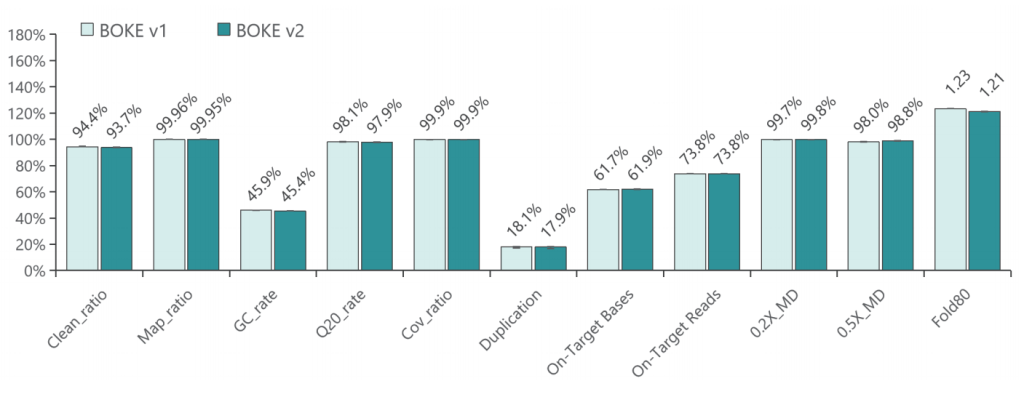
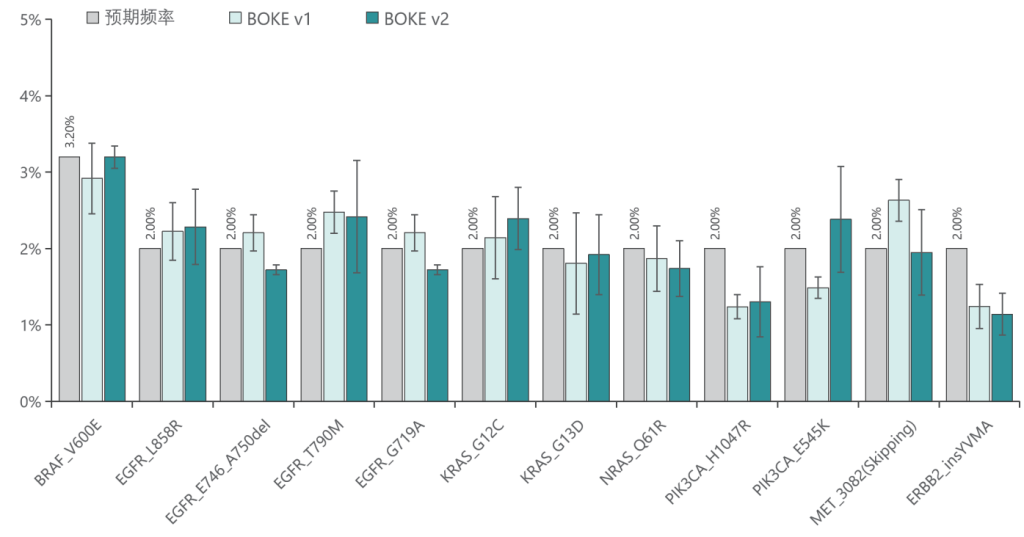
使用肿瘤 SNV gDNA 标准品Ⅱ (GW-OGTM006) 对TargetCap® Hybridization and Wash Kit v1和 v2 进行验证。GW-OGTM006 DNA标准品包含 EGFR、KRAS、NRAS、BRAF、PIK3CA、FGFR3、Her2、MET 等多个常见伴随诊断基因及位点,包含点突变、插入和缺失等多种变异类型。
a. 基本QC
采用300Kb Gene Panel对该标准品进行捕获,捕获数据显示,v1与v2试剂盒的基本捕获性能表现相当,v2略优于v1。
b. 变异检测
v1与v2试剂盒均能对12个已知变异准确检出。
参考文献:
1. 中国成人急性淋巴细胞白血病诊断与治疗指南(2024年版)
2. NCCN Clinical Practice Guidelines in Oncology-Acute Lymphoblastic Leukemia(2025 Version 2).
3. Kantarjian H, Pui CH, Jabbour E. Acute lymphocytic leukaemia. Lancet. 2025 Aug 30;406(10506):950-962. doi: 10.1016/S0140-6736(25)00864-5.
4. Muffly L, Liang EC, Dolan JG, Pulsipher MA. How I use next-generation sequencing-MRD to plan approach and prevent relapse after HCT for children and adults with ALL. Blood. 2024 Jul 18;144(3):253-261. doi: 10.1182/blood.2023023699.
5. Gocho Y, Yang JJ. Genetic defects in hematopoietic transcription factors and predisposition to acute lymphoblastic leukemia. Blood. 2019 Sep 5;134(10):793-797. doi: 10.1182/blood.2018852400.


