CFTR基因与囊性纤维化:从致病机制到靶向治疗
- boke
- 2025-12-26
- 5:47 下午
Trikafta:改写囊性纤维化命运的三联疗法
2025年,拉斯克临床医学研究奖被授予Michael J. Welsh、Jesús González、Paul A. Negulescu三位科学家,以表彰在开发治疗囊性纤维化的创新三联药物—Trikafta药物组合中所作出的关键贡献,这一疗法挽救了众多患者的生命。
一、CFTR基因概述
囊性纤维化跨膜导管调节因子(CFTR)基因位于7q31.2,全长约230kb,共27个外显子。编码序列长4443bp,编码1480个氨基酸。编码的蛋白具有两个疏水跨膜结构域(TMD1/2)和2个核苷酸结合域(NBD1/2),还含有一个调节区R。调节区R含有蛋白激酶A(PKA)和蛋白激酶C(PKC)共有的磷酸化位点,被蛋白激酶磷酸化时,可以激活CFTR的Cl⁻通道。该蛋白属于ATP结合盒(ABC)转运蛋白家族,在多种组织中都有表达,表达于汗腺、气道、胃肠道、胰腺和输精管等组织和器官[1,2]。
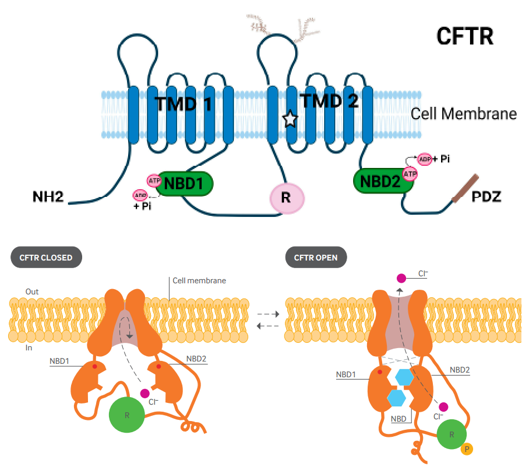
图1 CFTR蛋白结构示意图及CFTR通道打开示意图[2,7]
二、CFTR生物学功能
主要功能是调控上皮细胞顶端膜的Cl⁻、HCO₃⁻转运,影响细胞内外的电解质平衡和水分分布。
三、CFTR变异与囊性纤维化的关联
囊性纤维化(Cystic Fibrosis, CF)是一种常染色体隐性遗传性疾病,致病机制是由于CFTR基因突变导致全身外分泌腺大量黏液阻塞,进而累及呼吸、消化、内分泌、生殖等全身多系统。在高加索人群中CF发病率可高达1/800,但在中国尚无发病率数据,属罕见病。但近 10年我国报道的 CF患者数量超过了既往30年总和的2.5倍[3]。CFTR基因是目前已知的CF唯一致病基因。
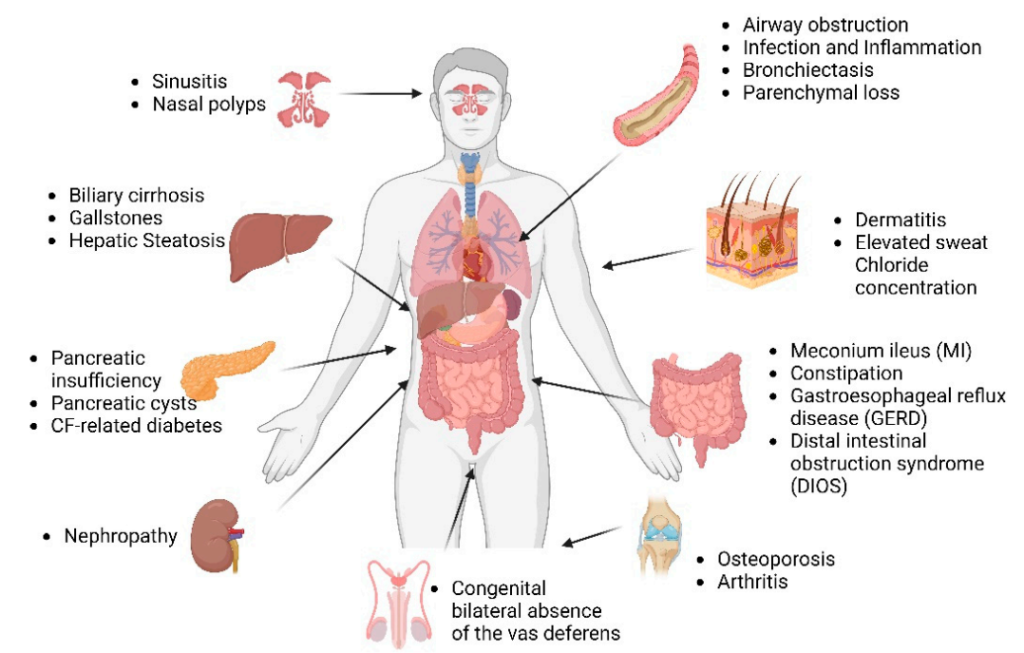
图2 囊性纤维化的多器官疾病表现[2]

图3 不同年龄段CF的临床表现[3]
目前,已经发现了超过2000种CFTR等位基因变异,包括错义突变(42%)、移码突变(15%)、剪接突变(13%)、无义突变(10%),大片段缺失或插入(5%),这些突变中有719种是致病的[2]。据其变异对CFTR功能的影响可分为6类[4-5]。
1
Ⅰ类变异,CFTR蛋白合成缺陷
突变类型:无义突变、移码突变、剪接变异。
影响机制:过早出现终止密码子,严重阻碍CFTR蛋白合成,几乎不产生功能性蛋白。
具体变异:Gly542X、Trp1282X、Arg553X、621+1G→T
2
Ⅱ类变异,蛋白加工和转运缺陷
突变类型:错义突变、氨基酸缺失。
影响机制:CFTR蛋白错误折叠,无法正常加工和转运,滞留在内质网中,随后被蛋白酶体降解。
具体变异:Phe508del、Asn1303Lys、Ile507del、Arg560Thr
Phe508del变异最为常见,约85-90%患有囊性纤维化的白色人携带至少一个Phe508del变异。
3
Ⅲ类变异,门控调节缺陷
突变类型:错义突变、氨基酸改变。
影响机制:变异导致CFTR通道门控缺陷影响离子转运效率,但蛋白结构和表达基本正常。
具体变异:Gly551Asp、Gly178Arg、Gly551Ser、Ser549Asn
4
Ⅳ类变异,离子传导缺陷
突变类型:错义突变、氨基酸改变。
影响机制:离子传导功能缺陷,导致CFTR通道对氯离子或碳酸氢根离子的通透性降低,离子流量减少。
具体变异:Arg117His、Arg347Pro、Arg117Cys、Arg334Trp
5
Ⅴ类变异,功能性蛋白在顶膜的表达减少
突变类型:剪接缺陷、错义突变。
影响机制:影响CFTR mRNA转录或翻译效率,导致细胞膜上正常CFTR蛋白丰度降低。
具体变异:3849+10kbC→T、2789+5G→A、3120+1G→A
6
Ⅵ类变异,影响定位于细胞膜的CFTR蛋白的稳定性
突变类型:错义突变、氨基酸改变。
影响机制:CFTR蛋白构象稳定性降低,易被细胞膜上的质量控制系统识别并降解,膜表面蛋白减少。
具体变异:4326delTC、Gln1412X、4279insA
I类、II类和III类突变与CFTR功能丧失相关,携带这些突变的患者平均表现为严重表型;而携带IV类、V类和VI类突变的个体具有部分CFTR蛋白功能,表现为轻度肺部表型和胰腺功能正常。
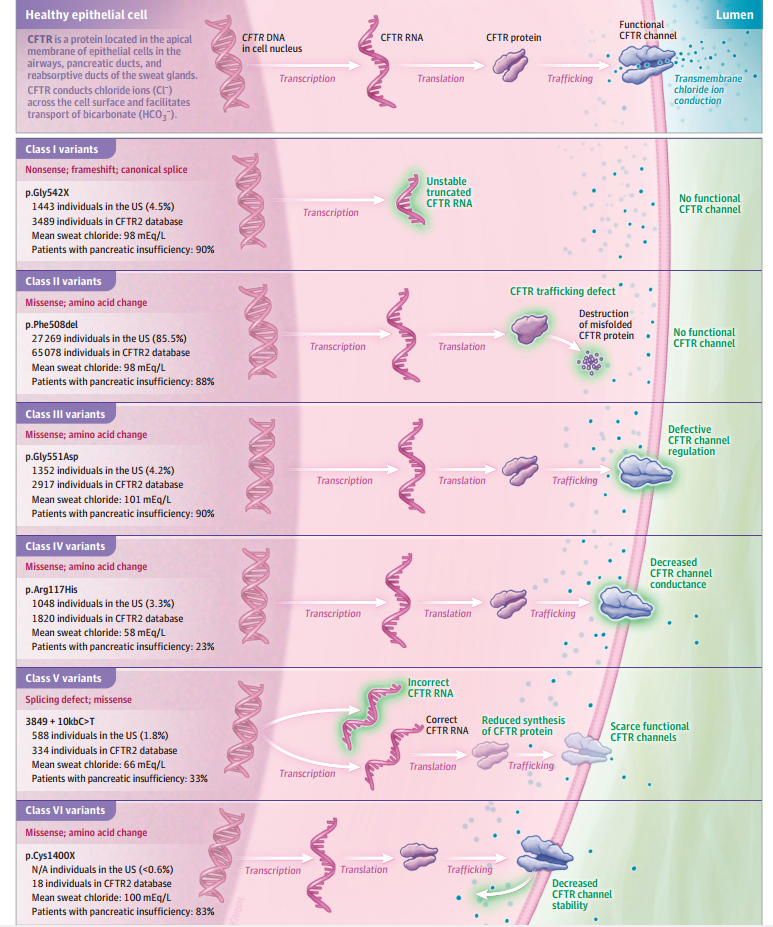
图4 CFTR变异类型及致病机制[5]
四、疾病治疗
目前有两种方法试图提供有效的疾病修饰疗法:一是使用小分子调节剂,通过调节CFTR蛋白并恢复功能性离子转运;二是使用基因治疗方法,通过引入正常CFTR基因或编辑突变基因,产生正常的CFTR蛋白[7]。
1
CFTR调节剂
(1)增效剂(Potentiators):通过与CFTR蛋白的特定区域结合,增强细胞表面CFTR通道的开放概率,促进离子的运输。
代表药物:Ivacaftor(VX-770):首个获批的CFTR调节剂,适用于G551D等门控突变(Class III)。其他在研药物:QBW251、GLPG1837等。
(2)纠正剂(Correctors):通过结合到CFTR蛋白的特定区域(通常是在跨膜结构域(TMD)形成的疏水口袋中),稳定CFTR蛋白构象,帮助蛋白正确折叠并运输至细胞膜。
代表药物:Lumacaftor(VX-809)、Tezacaftor(VX-661)
(3)通读剂(read-through agents):通读剂通过与核糖体结合,改变核糖体对终止密码子的识别精度。正常情况下,核糖体遇到终止密码子会停止翻译;而通读剂使核糖体“忽略”终止密码子,继续沿着mRNA模板进行翻译,从而允许完整的CFTR蛋白序列被合成。
代表药物:Ataluren(PTC124)
(4)稳定剂(stabilisers):稳定剂能够与CFTR蛋白的特定结构域结合,帮助其更牢固地锚定在细胞膜上;还可以通过干扰溶酶体降解途径,减少CFTR蛋白的降解速率,延长其在细胞膜表面的停留时间。
代表药物:Cavosonstat(N91115)
(5)联合疗法
目前单一调节剂证明针对CFTR蛋白本身进行修复是可行的,但其药效受限于CFTR缺陷的复杂性。如最常见的F508del突变,该突变既阻碍蛋白转运又影响蛋白发挥功能,仅靠一种调节剂,无法完成CFTR蛋白功能的挽救。
三联疗法不再满足于“单点修复”,而是通过不同作用机制的药物协同配合,实现了对复杂缺陷的“全面修复”。2019年,FDA批准首个三联方案—Trikafta上市,用于治疗囊性纤维化患者。Trikafta方案由两种纠正剂(Tezacaftor、Elexacaftor)和一种增效剂(Ivacaftor)协同使用。

三种成分通过变构调节机制协同作用,不仅增加了细胞表面CFTR蛋白的数量,还显著提高了其功能活性,从而从根本上改善囊性纤维化患者的症状[8]。Trikafta疗法让90%的CF患者从“严重疾病”变成了“慢性可控疾病”。
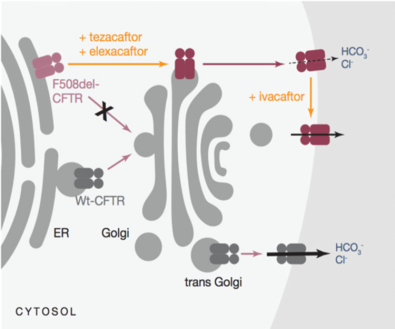
图5 Trikafta的作用机制[8]
2
基因疗法
(1)基因替代疗法(Gene Replacement)
机制:将正常的CFTR基因导入患者细胞,替代缺陷的基因,从而恢复CFTR蛋白的正常功能。
载体类型:脂质体-DNA复合物、腺病毒和腺相关病毒(AAV)载体
(2)基因编辑疗法(Genome Editing)
利用基因编辑技术(如CRISPR-Cas9)直接对细胞内的CFTR基因突变进行修复或矫正。
设计特定的引导RNA(gRNA),使其能够精准识别CFTR基因中的突变位点。Cas9蛋白在gRNA的引导下,对突变位点附近的DNA进行切割,诱导细胞自身的DNA修复机制,通过同源重组或非同源末端连接等方式将正确的基因序列引入,修复突变。

图6 CF当前治疗策略[7]
参考文献:
Farinha CM, Callebaut I. Molecular mechanisms of cystic fibrosis – how mutations lead to misfunction and guide therapy. Biosci Rep. 2022 Jul 29;42(7):BSR20212006. doi: 10.1042/BSR20212006.
Ramananda Y, Naren AP, Arora K. Functional Consequences of CFTR Interactions in Cystic Fibrosis. Int J Mol Sci. 2024 Mar 16;25(6):3384. doi: 10.3390/ijms25063384.
囊性纤维化诊断与治疗中国专家共识(2023版)[J].中华结核和呼吸杂志,2023,46(4):352-372.
Elborn JS. Cystic fibrosis. Lancet. 2016 Nov 19;388(10059):2519-2531. doi: 10.1016/S0140-6736(16)00576-6.
Ong T, Ramsey BW. Cystic Fibrosis: A Review. JAMA. 2023 Jun 6;329(21):1859-1871. doi: 10.1001/jama.2023.8120. PMID: 37278811.
Cutting GR. Cystic fibrosis genetics: from molecular understanding to clinical application. Nat Rev Genet. 2015 Jan;16(1):45-56. doi: 10.1038/nrg3849.
Quon BS, Rowe SM. New and emerging targeted therapies for cystic fibrosis. BMJ. 2016 Mar 30;352:i859. doi: 10.1136/bmj.i859.
Zaher A, ElSaygh J, Elsori D, ElSaygh H, Sanni A. A Review of Trikafta: Triple Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) Modulator Therapy. Cureus. 2021 Jul 3;13(7):e16144. doi: 10.7759/cureus.16144.


