选择性起始密码子影响线粒体功能与罕见人类疾病的关键机制
- boke
- 2025-12-19
- 5:31 下午
一、研究背景
罕见遗传病总计影响数百万人群,为有效诊断和治疗罕见病,需要对蛋白和基因功能进行研究。传统基因注释方法主要依赖最长的AUG起始开放阅读框,忽略了由选择性翻译起始产生的蛋白异构体多样性。
线粒体功能至关重要,其失调与众多罕见病相关。线粒体通过内共生进化后,细胞需要解决同一蛋白在线粒体和细胞核/质等多区室中发挥功能的难题。目前为实现同一蛋白在不同区室发挥功能,细胞进化出两种策略:一是基因重复,同源蛋白获得不同的定位信号;二是选择性解码,通过调控转录、剪接和翻译对单个基因进行选择性解码,获得不同的蛋白异构体。但目前对产生能够在多个细胞区室内发挥作用的蛋白的分子机制了解甚少。
在人类细胞中,可通过核糖体渗漏扫描、内部核糖体进入、非标准起始密码子起始、上游开放阅读框(uORF)再起始等机制驱动替代密码子,产生N端截短或N端延伸的蛋白质异构体。这些异构体意义广泛,尤其在罕见病中功能值得深入研究。
二、主要结论
本研究揭示了选择性起始密码子是真核细胞产生双/多定位蛋白异构体的普遍机制,且表明该机制与线粒体内共生进化密切相关。提出了“异构体选择性等位基因(ISAs)”新概念,其突变能够选择性地影响特定异构体,从而解释部分疾病的临床表型的异质性。该研究强调了某些变异间接通过影响转录、剪接和翻译的调节而致病,而不是对蛋白编码区的直接影响。
研究结果表明在遗传诊断中必须考虑替代起始密码子和异构体特异性影响,还为罕见病治疗提供新思路。
三、详细结果
1
替代性N端异构体普遍存在不同的亚细胞定位
通过核糖体印迹分析(Ribo-seq)发现Hela细胞中2697 个基因可产生两种或以上替代性N端异构体。利用亚细胞定位预测算法和C端GFP标记技术证实这些替代异构体与注释异构体常表现出不同的亚细胞定位。
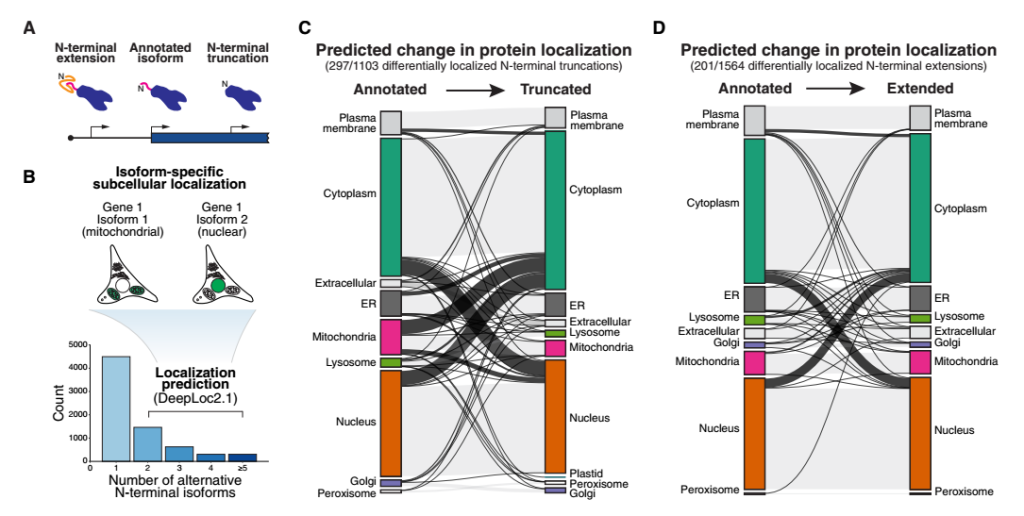
图1 替代N-末端异构体的普遍差异定位
2
蛋白变体亚细胞定位改变存在多种机制
鉴定出四种导致亚细胞定位变化的机制:
(1)N端截短可去除靶向信号,从而重定向蛋白定位。
(2)N端延伸可引入完整的信号序列。
(3)N端延伸可完善注释蛋白中的部分信号序列。
(4)N端延伸通过“掩蔽”注释N端靶向信号,阻止其被识别,从而改变蛋白亚细胞定位。
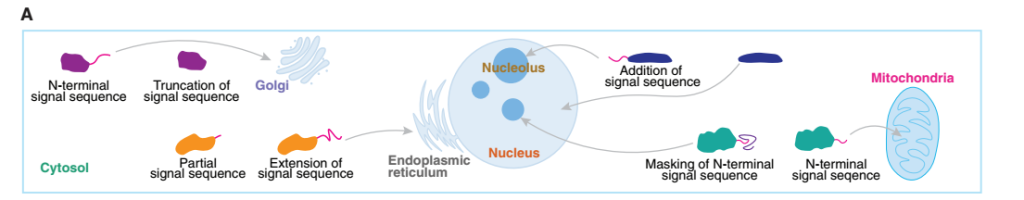
图2 选择性起始密码子选择可能改变亚细胞定位的机制的示意模型。
3
选择性翻译与双重定位机制起源于早期真核生物进化
研究发现选择性翻译异构体在真核生物中高度保守,起源于早期真核生物的祖先细菌。双重定位异构体高度保守,且与线粒体内共生同时期出现。
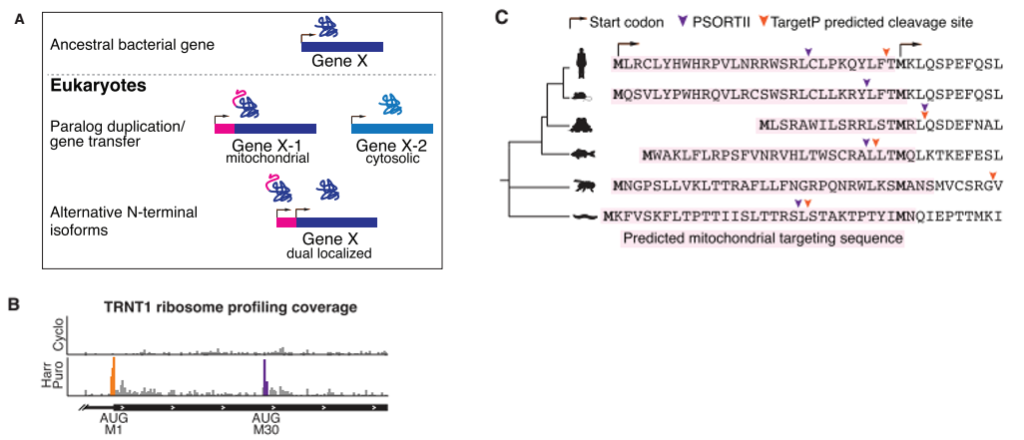
图3 产生线粒体和细胞核双重定位异构体的选择性翻译机制在物种间高度保守。
4
异构体选择性敲除等位基因揭示异构体特异性功能
利用CRISPR-Cas9技术,研究人员构建了仅破坏特定蛋白质异构体的“异构体选择性敲除”细胞系,发现不同的异构体分别在胞质翻译和线粒体翻译等不同过程中发挥重要作用。这表明替代性起始密码子在产生多种蛋白异构体中的重要性,每种异构体均对细胞功能和活力均有重要作用。
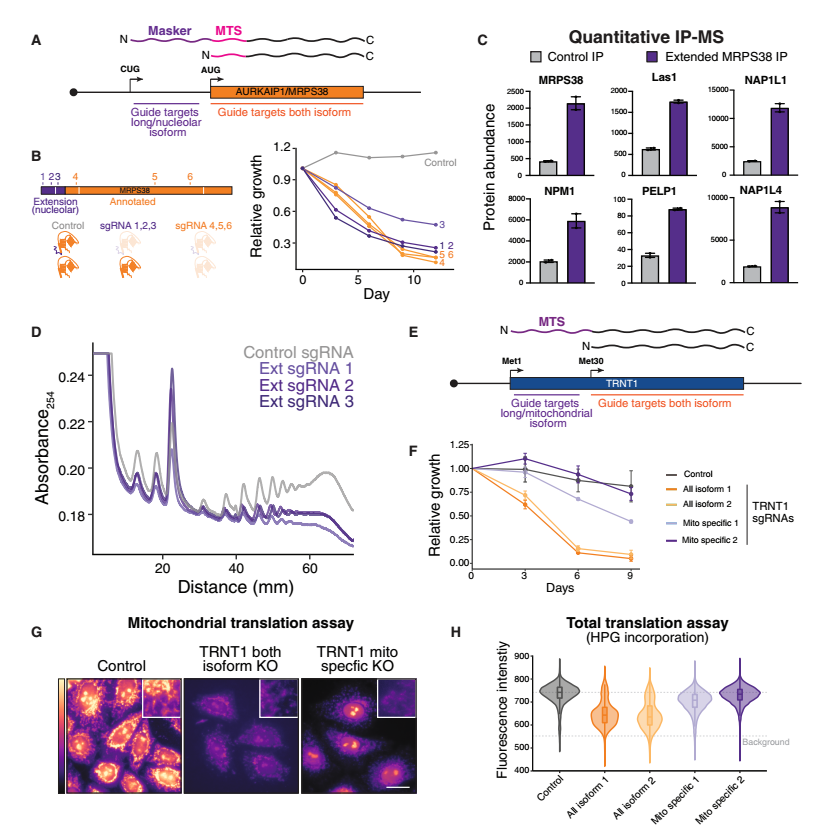
图4 选择性起始密码子促进蛋白质双重功能。
5
罕见病中存在大量ISAs,选择性突变会导致独特的疾病表型
通过对ClinVar 数据库分析,鉴定出许多与罕见病相关的异构体选择性等位基因(ISAs)。通过对有独特SIFD综合征表型的患者研究发现,TRNT1基因突变选择性地影响了线粒体或细胞核异构体,不同异构体功能可导致不同的临床症状。以上结果强调了选择性起始密码子使用和N端异构体在罕见病中的重要性,故在遗传和临床研究中需考虑突变的异构体影响。
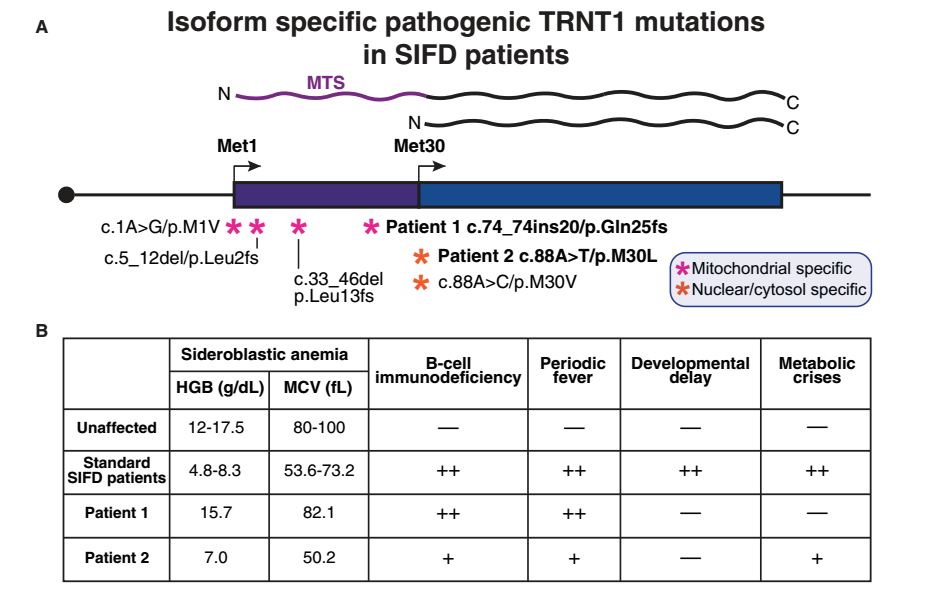
图5 非典型SIFD患者中的TRNT 1异构体选择性突变及表型。
参考文献:
Ly J, Di Bernardo M, Tao YF, et al. Alternative start codon selection shapes mitochondrial function and rare human diseases. Mol Cell. 2025 Nov 20;85(22):4198-4214.e11. doi: 10.1016/j.molcel.2025.10.013.


