肿瘤 PD-1/PD-L1 免疫治疗与肿瘤突变负荷(TMB)检测的研究进展
- boke
- 2025-11-12
- 3:29 下午
肿瘤免疫逃逸是癌症进展的核心机制,其中 PD-1/PD-L1 信号通路通过抑制 T 细胞活化帮助肿瘤逃避免疫监视 [2,3],而肿瘤突变负荷(TMB)通过量化体细胞突变总数反映肿瘤新抗原生成潜力 [1,4],二者均为免疫检查点抑制剂(ICI)疗效的关键预测生物标志物 [1,2,3,4]。
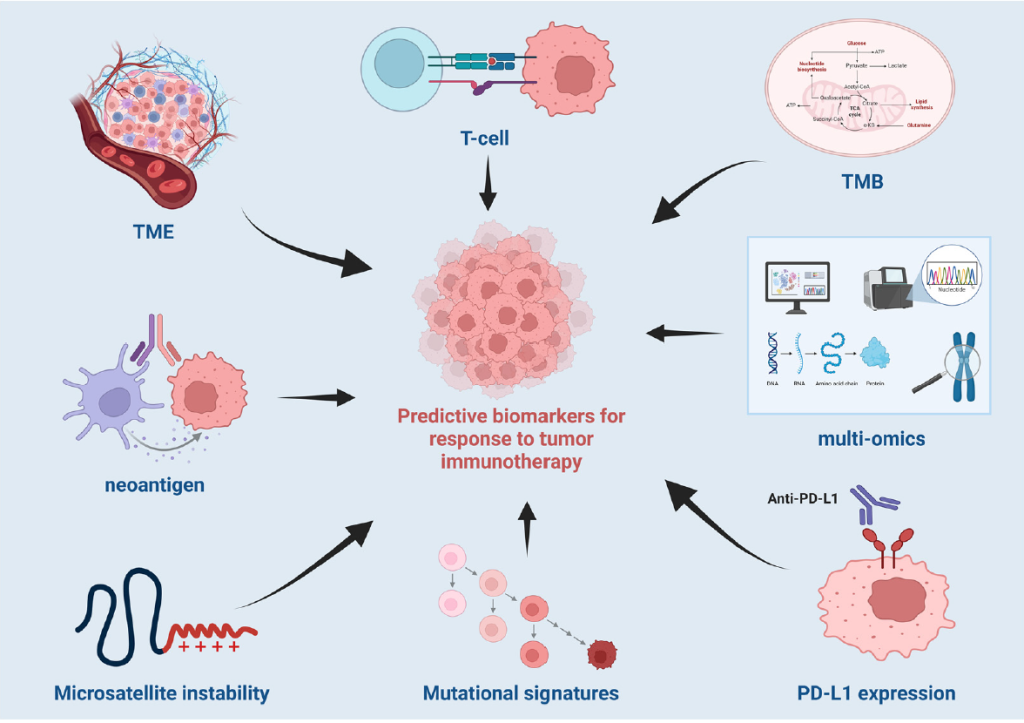
Decoding tumor immunotherapy: a multi-dimensional perspective on key biomarkers and treatment response.
PD-1/PD-L1 的病理生理机制与表达调控
一、病理生理功能
PD-1 属于 CD28/CTLA-4 免疫球蛋白超家族,是细胞表面抑制性受体,主要表达于活化的 T 细胞、B 细胞、NK 细胞及固有淋巴细胞(ILCs)[2,3],其配体 PD-L1 广泛表达于造血细胞、非造血细胞及肿瘤细胞,PD-L2 则局限于活化的巨噬细胞、树突状细胞(DC)[2,3]。
生理状态下,PD-1 与配体结合可抑制 TCR 信号传导,防止 T 细胞过度活化、维持外周免疫耐受 [2,3];病理状态下,肿瘤细胞通过高表达 PD-L1,与 T 细胞表面 PD-1 结合阻断 T 细胞活化,实现免疫逃逸 [2,3,4]。例如,卵巢癌腹腔积液中 PD-1+NK 细胞的细胞毒性被 PD-L1 抑制 [2],而肺癌患者外周血 PD-1+NK 细胞表现为 CD107a 表达降低、穿孔素 / 颗粒酶 B 释放减少 [2]。
二、表达调控机制
1. PD-1 的调控
细胞类型特异性表达:T 细胞中 PD-1 表达与 TCR 信号强度相关,慢性抗原刺激(如肿瘤、病毒感染)导致 PD-1 持续高表达 [2,3],NK 细胞中 PD-1 仅在 CMV 血清阳性人群的成熟亚群中稳定表达,且需糖皮质激素(如皮质醇)与 IL-15、IL-18、IL-12 联合诱导 [2,3]。
分子调控:转录水平受 NFATc1、RBPJκ、STAT3/4/5 等转录因子调控 [3],表观遗传层面,PD-1 启动子去甲基化可诱导耗竭型 T 细胞中 PD-1 过表达 [3,4],翻译后修饰(如岩藻糖基化、泛素化)也影响其表达 [3].
糖皮质激素的作用:糖皮质激素可通过糖皮质激素受体(GR)增强 T 细胞、NK 细胞中 PD-1 表达,并上调 Tim3、Lag3 等其他抑制性受体,且与 ICI 治疗应答失败相关 [2]。
2. PD-L1 的调控
转录调控:外在因素(如 T 细胞 / NK 细胞分泌的 IFNγ、IL-6、TNF)和内在因素(如 EGFR、PI3K/AKT、MAPK 致癌通路激活)均可诱导 PD-L1 表达 [3,4].例如,霍奇金淋巴瘤、小细胞肺癌(SCLC)中 CD274(PD-L1 编码基因)拷贝数扩增可导致 PD-L1 高表达 [3]。
非编码 RNA 调控:miRNA(如 NSCLC 中 miR-4458 靶向 STAT3 抑制 PD-L1,乳腺癌中 miR-561-3p 下调 PD-L1)和 lncRNA(如胃癌中 lncRNA SNHG15 通过抑制 miR-141 上调 PD-L1,黑色素瘤中 lncRNA NEAT1 与 PD-1/PD-L1 治疗应答相关)可调控 PD-L1 mRNA 稳定性 [3]。
翻译后修饰:磷酸化、糖基化、泛素化等修饰影响 PD-L1 蛋白稳定性,例如泛素化可促进 PD-L1 降解 [3,4]。
PD-1/PD-L1 靶向治疗的临床应用
一、批准药物与适应症
FDA 已批准多种抗 PD-1/PD-L1 单克隆抗体用于多癌种治疗,关键适应症及临床试验数据如下表所示 [2,3,4]。
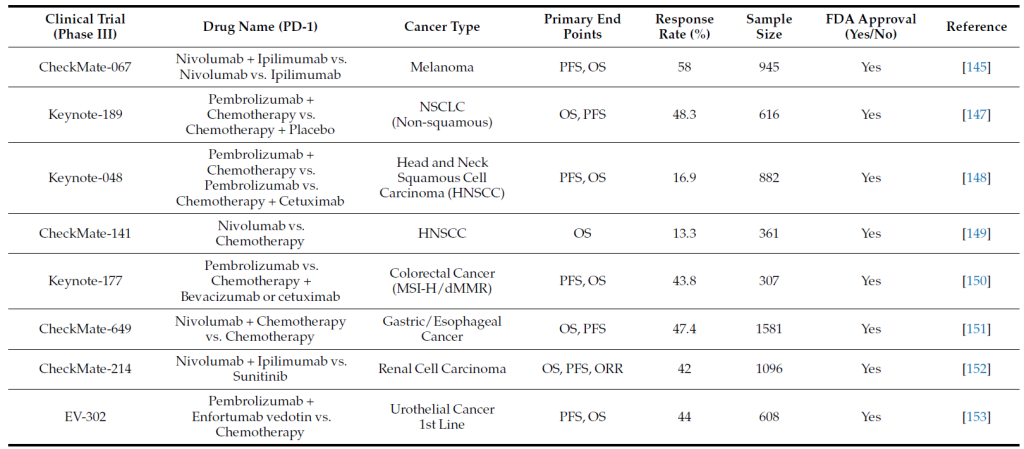
Anti PD-1 inhibitors
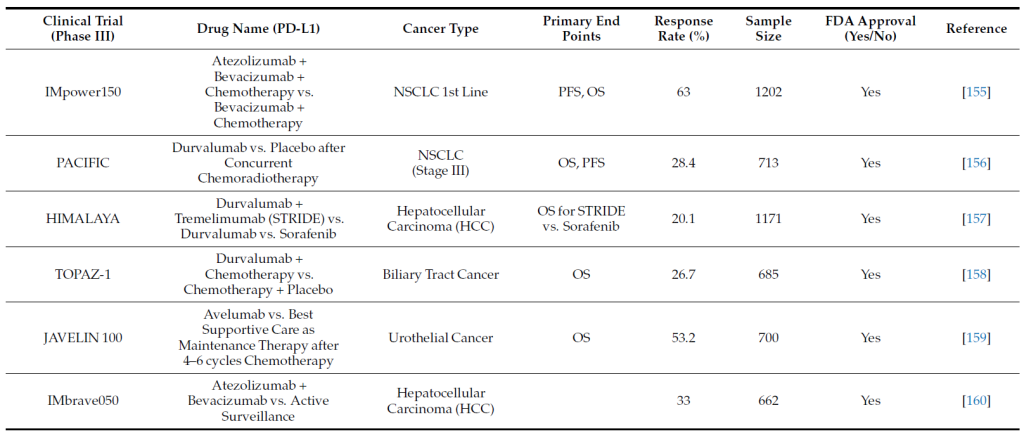
Anti PD-L1 inhibitors.
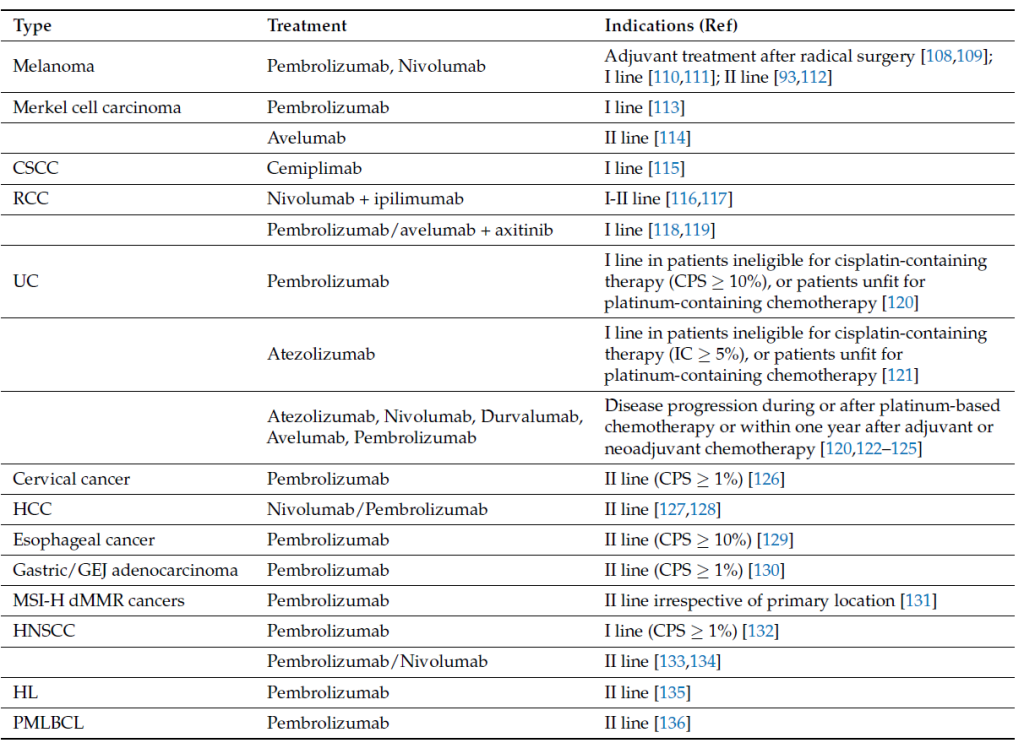
Current indications for anti PD1/PD-L1 therapy in different advanced/metastatic tumor types
二、儿童肿瘤中的应用
儿童肿瘤中 PD-L1 表达水平较低且异质性高,目前研究集中于血液系统肿瘤(如霍奇金淋巴瘤、急性白血病)及实体瘤(如神经母细胞瘤)[2]。
神经母细胞瘤:72% 患者检测到 PD-L1 表达,且与低生存率相关 [2];I 期试验(NCT02914405)评估抗 GD2 抗体 + 131I-MIBG + 纳武利尤单抗的疗效 [2]。
淋巴瘤:纳武利尤单抗单药或联合伊匹木单抗在儿童霍奇金淋巴瘤中显示安全性及临床获益,但在横纹肌肉瘤、尤文肉瘤等实体瘤中单药活性有限 [2]。
监管批准:2017 年 FDA 批准帕博利珠单抗用于儿童难治性 / 复发性霍奇金淋巴瘤 [2]。
肿瘤突变负荷(TMB)的定义与检测方法
一、定义与生物学意义
TMB 指肿瘤基因组中体细胞非同义突变(错义突变、无义突变、插入缺失)的总数,反映肿瘤新抗原生成潜力 ——TMB 越高,产生免疫原性新抗原的概率越高,越易被免疫系统识别 [1,2,4]。
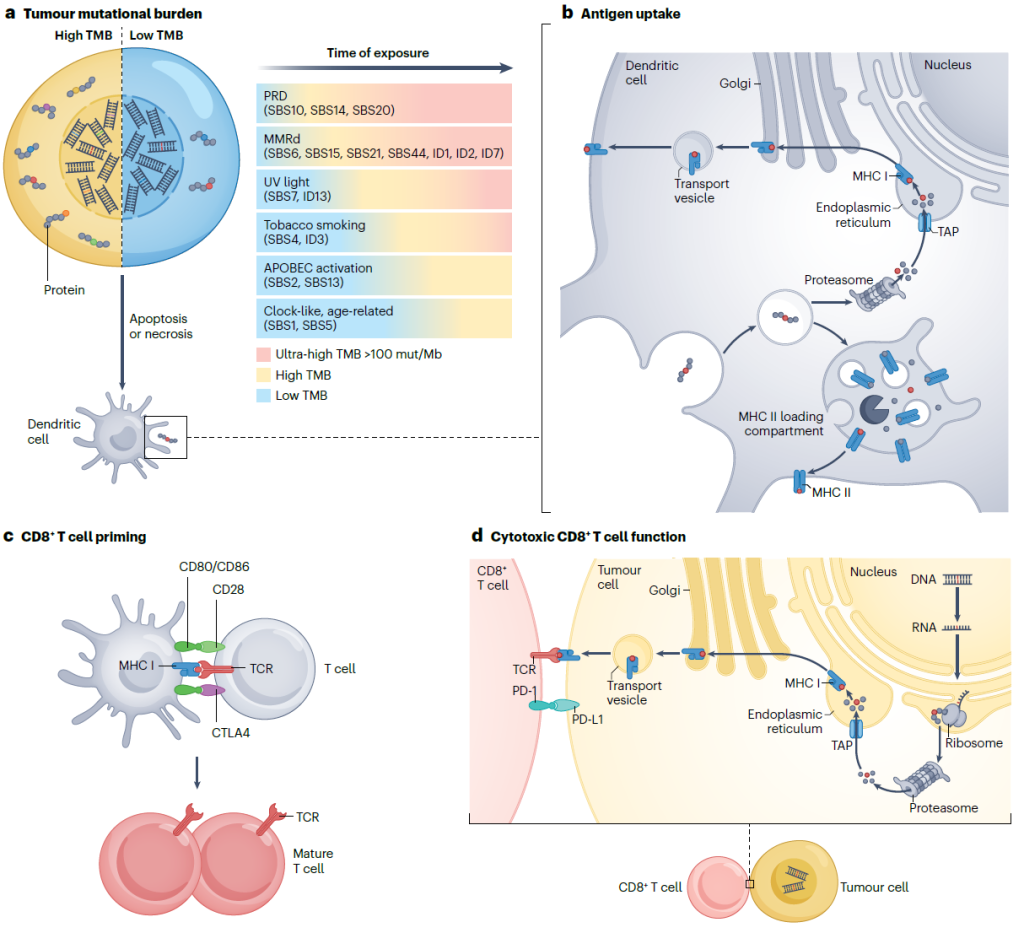
Simplified representation of the effect of TMB on the tumour-specific immune response
泛癌种分析(TCGA 队列)显示,TMB-H 与以下因素相关 [1,4]:
DNA 修复缺陷:错配修复缺陷(MMRd,如结直肠癌、胃癌)、校对缺陷(PRD,如 POLE/POLD1 突变)[1,4]。
致癌物暴露:烟草烟雾(肺癌)、紫外线(黑色素瘤)[1,4]。
二、检测方法
1.主流方法对比

2.关键技术参数
Panel 大小:推荐≥1 Mb,小 Panel(<0.5 Mb)预测价值显著低于 WES;1-1.5 Mb Panel 略逊于 WES [1,4]。
肿瘤纯度:样本纯度应≥60%,纯度 <40% 会导致 TMB 显著低估(如 20% 纯度样本 TMB 降低 32%)[1,4]。
种系突变过滤:需通过 gnomAD 数据库过滤常见 SNP,非白人患者因数据库偏差可能导致 TMB 高估,需进行 ancestry 校正 [1,4]。
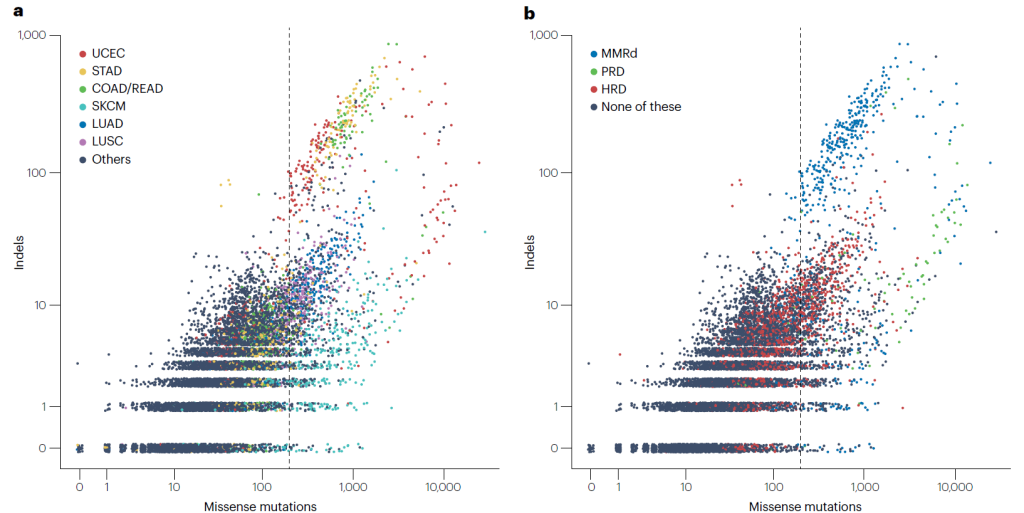
Pan-cancer analysis of missense mutation and indel burden.
TMB 的临床价值与挑战
一、 临床价值:ICI 疗效预测
1. 泛癌种证据
KEYNOTE-158 试验:TMB-H(≥10 mut/Mb)实体瘤患者 ORR 随 TMB 升高而增加(TMB<10/10-13/>13 mut/Mb:6.7%/12.5%/37%)[1,4]。
CheckMate-227 试验:TMB-H(≥10 mut/Mb)晚期 NSCLC 患者接受纳武利尤单抗 + 伊匹木单抗治疗,中位 PFS 7.2 个月 vs 5.5 个月(化疗),且不受 PD-L1 表达影响 [1]。
血液 TMB(bTMB):以血浆为样本,适用于组织获取困难患者[1]。MYSTIC 试验证实 bTMB≥20 mut/Mb 可预测 NSCLC 患者接受度伐利尤单抗 + 曲美木单抗的获益 [1]。
2.罕见癌种应用
默克尔细胞癌(MCC):TMB-H 与 PD-1 抑制剂疗效改善相关;阴茎鳞状细胞癌(PSCC)、胆囊癌(GBC)中,TMB 可提供预测信息 [4]。
未知原发部位癌(CUP):10%-20% CUP 患者为 TMB-H(12-17 mut/Mb),TMB-H 患者接受纳武利尤单抗 + 伊匹木单抗治疗的 ORR 60% vs 7.7%(TMB 低)[1]。
3.种族差异:Sisoudiya SD 等 2024 年研究提示,TMB 联合 PD-L1 表达的预测有效性存在种族差异,需在个性化方案中考虑 [4]。
二、 争议与挑战
1. 技术与解读挑战
阈值争议:10 mut/Mb 阈值区分应答者能力有限(KEYNOTE-158 中 TMB<10、10-13、>13 mut/Mb 的响应率分别为 6.7%、12.5%、37%)[1]。不同癌种阈值差异大,如结直肠癌 TMB-H 阈值为 52 mut/Mb(前 20% 分位数)[1]。
癌种特异性:TMB 与 NSCLC、黑色素瘤的 OS 正相关,但与胶质瘤无关 [1,4]。排除 MSI-H 后,10 mut/Mb 阈值仅对转移性 HNSCC、NSCLC、黑色素瘤有效 [1,4]。
联合治疗失效:ICI 联合化疗时,TMB 丧失预测价值(如 KEYNOTE-189、KEYNOTE-407 试验中的 NSCLC 患者)[1,4]。
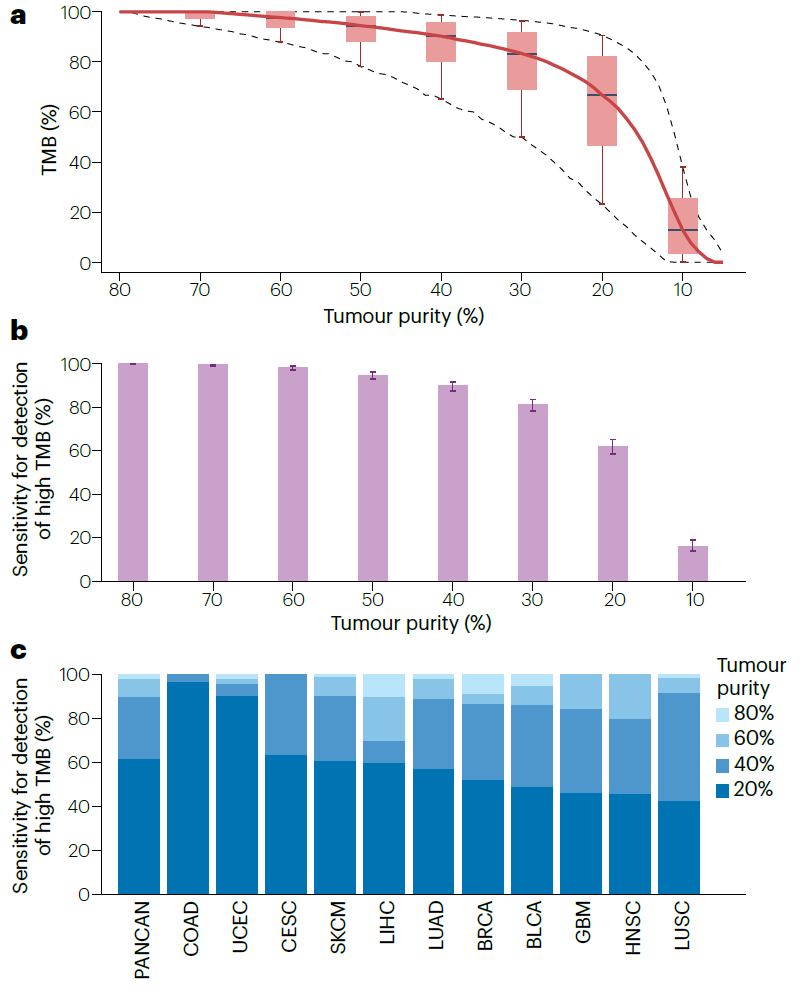
Influence of tumour purity on TMB measurement
TMB 的改良策略
为提升 TMB 预测准确性,现有研究提出多种改良标志物 [1,4]。
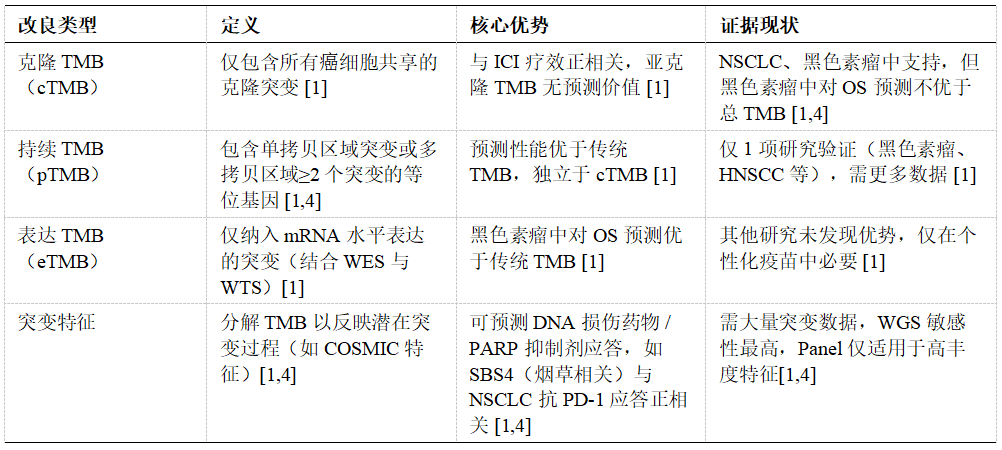
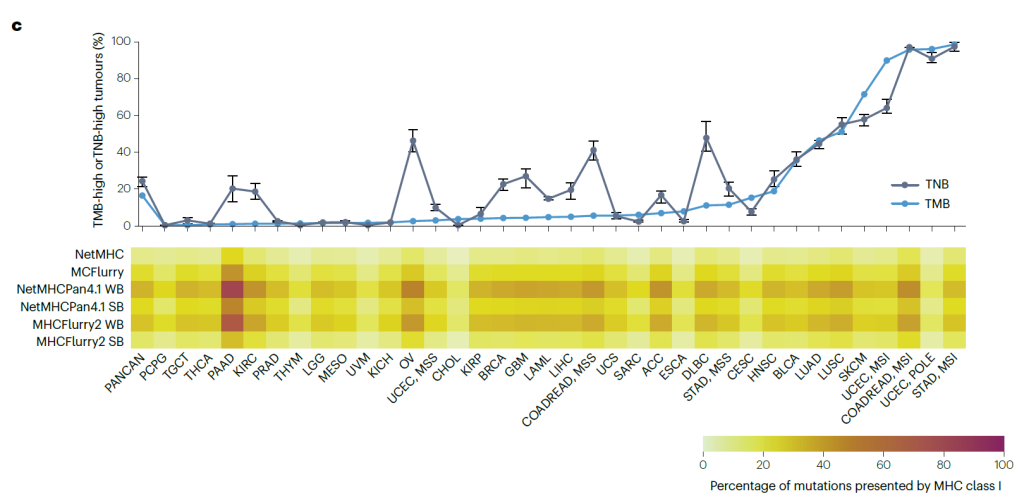
Immunogenicity of mutations and tumour neoantigen burden.
其他关键生物标志物
1.新抗原:新抗原是肿瘤细胞中非同义体细胞突变产生的肿瘤特异性肽序列,不存在于正常组织中,无自身免疫风险,是 ICIs 疗效的有效预测指标 [4]。
预测方法:依赖 NGS 技术(WGS、WES、靶向 Panel)及生物信息学工具,整合变异等位基因频率、基因表达水平、突变克隆性等因素提升准确性 [4]。
临床价值:高新抗原负荷(NAL)与 T 细胞浸润增加、ICIs 疗效改善相关;“免疫治疗评分(ITS)” 整合 NAL、TMB 及遗传因素,预测性能优于传统 TMB [4]。
个性化疫苗:基于新抗原的个性化疫苗在胶质母细胞瘤(GBM)、黑色素瘤等癌种中显示免疫原性和安全性,可诱导强效 T 细胞反应 [4]。
2.微卫星不稳定性(MSI):MSI 由错配修复(MMR)系统缺陷引起,导致突变积累,MSI-H 肿瘤对 ICIs 反应显著优于微卫星稳定(MSS)肿瘤[4]。
临床证据:胃癌:MSI-H 患者接受 ICIs 治疗后生存改善,优于化疗 [4]; 结直肠癌(CRC):MSI-H CRC 接受新辅助免疫治疗反应良好,男性患者 OS 较差 [4]; 子宫内膜癌:MSI-H 肿瘤接受化疗联合免疫治疗后 PFS 改善 [4];卵巢癌:建议将 MSI/MMR 缺陷检测纳入临床实践,MSI-H 可能对 ICIs 敏感 [4]。
3.RNA测序相关标志物
PD-L1 表达:PD-L1 高表达与 PD-1/PD-L1 抑制剂疗效正相关,是研究最广泛的基因表达标志物 [4]。
IFN-γ 特征:IFN-γ 反应基因上调提示肿瘤微环境(TME)炎症,与 ICIs 良好反应相关 [4]。
免疫相关基因:抗原呈递基因(MHC I/II 类分子)、IFN 信号通路基因高表达的肿瘤,ICIs 反应更佳 [4]。
4.DNA甲基化谱:DNA 甲基化通过调控 TME 和基因表达影响 ICIs 疗效,特定基因甲基化水平与治疗反应相关 [4]。
EPIMMUNE 标志物:301 个 CpG 位点组成的标志物,可独立预测 NSCLC 患者 PD-1 阻断治疗的 PFS 和 OS [4]。
CYTIP 与 TNFSF8 基因:应答者与非应答者在这两个基因的差异甲基化区域(pDMRs)甲基化水平显著不同,与抗 PD-1 疗效相关 [4]。
5.组蛋白修饰谱:组蛋白修饰(乙酰化、甲基化等)改变染色质结构和基因转录,影响肿瘤免疫原性和 ICIs 疗效 [4]。
H3K27me3 与 H3K4me3:H3K27me3 与基因沉默相关,H3K4me3 与基因激活相关,在 NSCLC、肝癌(HCC)中可作为预后标志物 [4]。
HDAC6 抑制:可激活黑色素瘤中 PD-L1 表达,影响 ICIs 疗效 [4]。
PD-1/PD-L1 治疗与 TMB 检测的联合应用
一、生物标志物的协同作用
- 独立性:
TMB 与 PD-L1 是独立的预测标志物,二者联合可提升预测准确性 [1,2,3]。例如,CheckMate-012 试验中,TMB-H 且 PD-L1 阳性(≥1%)患者的 ORR 达 62.5%,显著高于单一标志物阳性人群 [1]。 - TMB与MSI联合:
在 CRC、GBC 中,TMB 联合 MSI 可增强预测能力,MSI-H 且 TMB-H 患者 ICIs 反应最佳 [4]。 - 多模态模型:
黑色素瘤中 “TMB+PD-L1 + 炎症基因表达谱” 模型,预测性能优于单独 TMB;整合 TILs、免疫基因表达谱可进一步优化 [1,3,4]。
二、临床实践中的优化方向
检测标准化:推广≥1 Mb Panel,优先选择肿瘤纯度≥60% 的样本 [1]。通过国家测序项目(如英国 10 万基因组计划、德国 GenomeDE)或集中化分子诊断中心,解决 NGS 技术与生物信息学 expertise 的可及性差异”。
改良标志物整合及验证:将 DNA 甲基化(如 EPIMMUNE 标志物)、组蛋白修饰特征纳入复合标志物,改善 TMB-H 但 ICI 耐药患者的筛选 [4]。需在大型前瞻性队列中头对头比较 cTMB、pTMB、HLA 校正 TMB 等,明确最优标志物 [1,4]。
泛癌模型应用:利用 TCGA 等公共数据构建泛癌预测模型,结合癌种特异性阈值(如 CRC TMB-H=52 mut/Mb)提升适用性 [4]。
癌种特异性阈值:在 CD8+T 细胞浸润与肿瘤新抗原负荷(TNB)显著相关的癌种(如子宫内膜癌、黑色素瘤)中,10 mut/Mb 阈值有效 [1],他癌种需单独验证 [1]。
克服耐药:深入研究 MDSCs、M2 型巨噬细胞介导的免疫抑制,开发联合靶向药物(如抑制 MDSCs 的药物)[2,3,4]。尤其是针对 TMB-H 但 ICI 耐药的患者,需检测抗原处理 / 呈递缺陷(如 B2M 突变、JAK1/2 突变),并整合这些因素到复合标志物中 [1]。
多组学模型临床转化:推动机器学习 / 深度学习模型在临床中的应用,解决数据标准化、模型可解释性问题 [4]。
肿瘤免疫治疗反应的预测模型
一、公共数据集
TCGA 与 ICGC:提供多组学数据(基因组、转录组、表观基因组),助力识别 ICIs 疗效相关分子特征,但缺乏 ICIs 治疗临床注释 [4]。
应用价值:通过分析 TMB、免疫浸润(CIBERSORT/TIMER 工具)构建泛癌预测模型,识别 CD8+ T 细胞高浸润(与良好反应相关)、Tregs/MDSCs 富集(与不良反应相关)等特征 [4]。
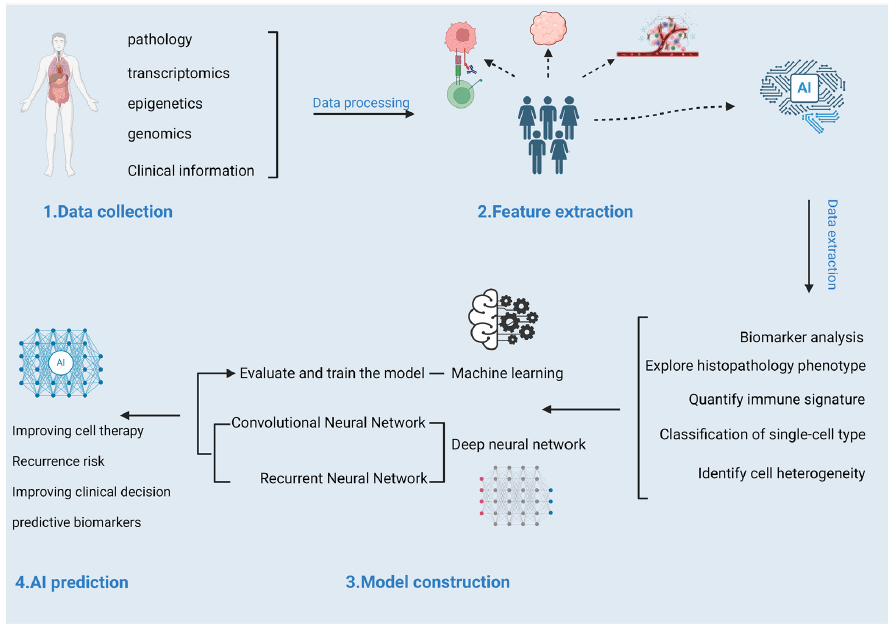
Integrating multi-omics data for AI-driven tumor immunotherapy: from data collection to predictive biomarkers
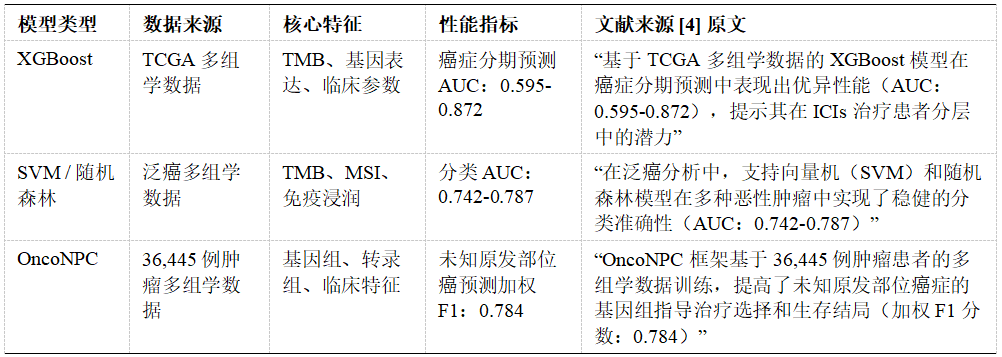
二、基于机器学习(ML)的模型
三、基于深度学习(DL)的模型
卷积神经网络(CNN): 一项研究利用深度学习分析 PET/CT 图像,通过小型残差卷积网络(SResCNN)开发深度学习评分(DLS)预测 PD-L1 表达状态,训练队列的 AUC 分别为 0.89 和 0.84。分类 TME(免疫 / 基质微环境):一项研究采用生物引导的深度学习方法,训练多任务模型从放射学图像中预测 TME 状态,内部验证队列 AUC 为 0.94-0.96。
循环神经网络(RNN):一项研究采用迁移学习结合 CNN 和 RNN,分析局部晚期 NSCLC 患者的时间序列 CT 图像,模型在预测生存方面的 AUC 达 0.74。
基于突变的 DL 模型:一项研究提出基于突变的深度学习模型,在 9 种癌症类型中,该模型的平均一致性指数为 0.59±0.13,优于金标准 Cox 比例风险模型(0.52±0.10)。
结 论
PD-1/PD-L1 靶向治疗已彻底改变肿瘤治疗格局 [2,3,4],而 TMB、新抗原、MSI 等作为 ICI 疗效的关键预测标志物,在泛癌种及特定癌种中均展现出重要价值 [1,4]。
然而,PD-L1 检测的方法异质性、TMB 的阈值争议、多组学数据标准化不足及模型可解释性有限,仍需通过检测标准化、改良标志物开发及多模态整合解决 [1,2,3,4]。
未来,通过深入理解免疫微环境与肿瘤基因组、表观基因组的相互作用,将 PD-1/PD-L1 治疗与多组学标志物及 AI 预测模型精准结合,有望实现肿瘤免疫治疗的个体化与高效化 [1,2,3,4]。
参考文献
1.Jan Budczies, et al. Tumour mutational burden: clinical utility, challenges and emerging improvements. Nature Reviews Clinical Oncology volume 21, pages725–742 (2024).
2.Enrico Munari, et al. PD-1/PD-L1 in Cancer: Pathophysiological, Diagnostic and Therapeutic Aspects. Int. J. Mol. Sci. 2021, 22, 5123.
3.Areti Strati, et al. Targeting the PD-1/PD-L1 Signaling Pathway for Cancer Therapy: Focus on Biomarkers. Int. J. Mol. Sci. 2025, 26, 1235.
4.Weichu Tao, et al. Towards the Prediction of Responses to Cancer Immunotherapy: A Multi-Omics Review. Life 2025, 15, 283.


