EGFR 突变型非小细胞肺癌患者的个性化治疗:从基因变异到精准方案
- boke
- 2025-11-07
- 5:52 下午
表皮生长因子受体(EGFR)基因激活突变的发现,彻底改变了非小细胞肺癌(NSCLC)的治疗格局,推动了靶向酪氨酸激酶抑制剂(TKIs)的研发[1]。与传统治疗相比,这类疗法能显著提高患者生存率,并减少不良反应[1]。
近年来的研究进展,极大地重塑了 EGFR 突变型NSCLC的治疗模式:TKIs 已被纳入早期和局部晚期疾病的治疗体系,Ⅲ 期临床试验也在转移性疾病中探索了联合治疗策略。尽管这些强化治疗方案能改善无进展生存期(PFS),但同时也增加了毒性反应风险和治疗成本,因此精准筛选患者(基于基因检测与基因变异特征)以最大化治疗获益至关重要[1]。
生物标志物(如共突变、循环肿瘤 DNA)的最新研究数据,为优化治疗决策提供了新方向;此外,对 EGFR TKIs 耐药机制(基于耐药相关基因变异)的深入理解,也进一步拓宽了治疗选择[1]。
EGFR 基因变异类型及生物学特征
不同 EGFR 基因变异的结构影响与信号通路激活模式不同,直接决定治疗敏感性与预后,主要分为以下四类:
1
经典样突变(classical-like mutations)[1]
核心类型:19 号外显子缺失(ex19del)、21 号外显子 L858R 点突变、21 号外显子 L861Q 点突变,占所有 EGFR 突变的 80%-85%;
变异特征:突变位点均远离 EGFR 激酶结构域的 ATP 结合口袋(药物作用位点),不改变口袋构象,不影响 EGFR TKIs 与口袋的结合;
生物学效应:ex19del/L858R:通过缩短 α 螺旋 N 端侧前导环,限制 α 螺旋运动,使其维持 “向内” 的活性构象;L861Q:突变位于 α 螺旋邻近区域,结构影响与 ex19del/L858R 相似,均导致 EGFR 无需配体即可持续激活,依赖 MAPK/PI3K-AKT 通路驱动肿瘤生长;
治疗敏感性:对一、二、三代 EGFR TKIs 均敏感,其中三代 TKI(奥希替尼)疗效最优 ——FLAURA 试验中,ex19del/L858R 患者接受奥希替尼治疗的中位 OS 达 38.6 个月;L861Q 患者接受奥希替尼治疗的 ORR 约 60%-70%,中位 PFS 12-14 个月。
2
P 环和 αC 螺旋压缩突变(PACC 突变)[1]
核心类型:18 号外显子 G719X 点突变(G719A/G719C/G719S)、20 号外显子 S768I 点突变,占所有 EGFR 突变的 5%-10%,属于 “少见激活突变”;
变异特征:突变位点直接影响 EGFR 蛋白的 P 环(磷酸盐结合环)与 αC 螺旋之间的空间结构,导致该区域压缩变形,间接改变 ATP 结合口袋的构象(但不阻断口袋);
生物学效应:构象改变使一代 / 三代 EGFR TKIs 与口袋的结合亲和力下降,但二代 TKI(阿法替尼)因不可逆结合模式,仍可有效抑制突变型 EGFR 活性;临床前模型显示,阿法替尼对 PACC 突变的抑制活性(IC50 0.3-0.8nM)显著高于一代 TKI 吉非替尼(IC50 5-12nM)和三代 TKI 奥希替尼(IC50 2.5-4.0nM);
治疗敏感性:优先对二代 TKI 敏感,LUX-Lung 试验显示,阿法替尼治疗 PACC 突变患者的 ORR 为 71.0%,中位 PFS 10.7 个月;对三代 TKI 敏感性较弱,回顾性数据显示奥希替尼治疗 PACC 突变患者的 ORR 约 45%,中位 PFS 8-9 个月。
3
T790M 样突变(T790M-like mutations)[1]
核心类型:分为 “原发性 T790M 突变” 和 “获得性 T790M 突变”,前者罕见(发生率 <1%),后者是一代 / 二代 EGFR TKI 耐药的最主要机制(发生率 >50%);
变异特征:突变位于 EGFR 激酶结构域的 “守门人” 残基(20 号外显子 Thr790→Met790),Met 残基的侧链体积大于 Thr,不直接阻断 ATP 结合口袋,但增强 EGFR 与 ATP 的结合亲和力(约为野生型的 10 倍);
生物学效应:一、二代 TKI(吉非替尼、阿法替尼)与 ATP 竞争结合口袋时,因 ATP 亲和力显著升高而失效;三代 TKI(奥希替尼)因可与口袋底部的 Cys797 残基共价结合,且对 T790M 突变型 EGFR 的亲和力(IC50=1.6nM)远高于野生型(IC50=48nM),可绕过 ATP 竞争机制发挥作用;
治疗敏感性:对一、二代 TKI 耐药,对三代 TKI 高度敏感 ——AURA3 试验中,获得性 T790M 突变患者接受奥希替尼治疗的 ORR 71%,中位 PFS 10.1 个月,中位 OS 26.8 个月;原发性 T790M 突变患者(多合并 ex19del/L858R)对奥希替尼的疗效与获得性突变患者一致。
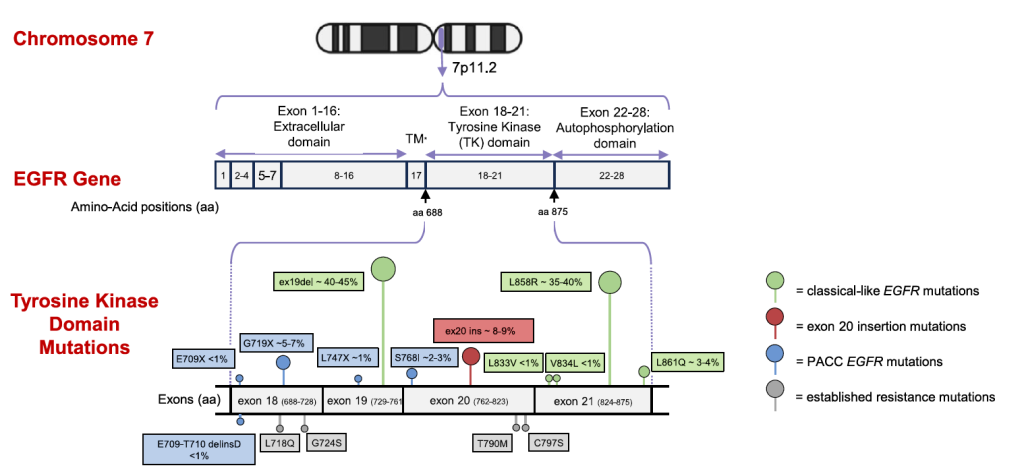
EGFR tyrosine kinase domain mutations
4
20 号外显子插入突变(ex20ins)[1,2,3]
核心类型:90% 为 α 螺旋后环区(767-775 位氨基酸)的 3-21bp 框内插入 / 重复(如 D770_N771insNPG、V769_D770insASV),10% 为 α 螺旋 C 端(762-766 位氨基酸)插入(如 A763_Y764insFQEA),占所有 EGFR 突变的 4%-10%;
变异特征:插入片段通过 “推动”α 螺旋使其维持 “向内” 的活性构象,同时导致 α 螺旋和 P 环向 ATP 结合口袋移位,产生强烈空间位阻;晶体结构显示,该类突变不降低 EGFR 与 ATP 的亲和力,但显著阻碍一、二、三代 TKIs 进入口袋;
生物学效应:EGFR 持续激活且对常规 TKIs 产生原发性耐药,仅特殊亚型(如 A763_Y764insFQEA,插入位于 α 螺旋内部,构象接近经典样突变)对一代 TKI 敏感;
治疗敏感性:对一、二、三代 TKIs 耐药(缓解率 3%-8%,PFS <3 个月),仅对新型选择性抑制剂(波齐替尼、莫博赛替尼、埃万妥单抗)有效 —— 如莫博赛替尼治疗铂类后进展患者的 ORR 28%,中位 PFS 7.3 个月。
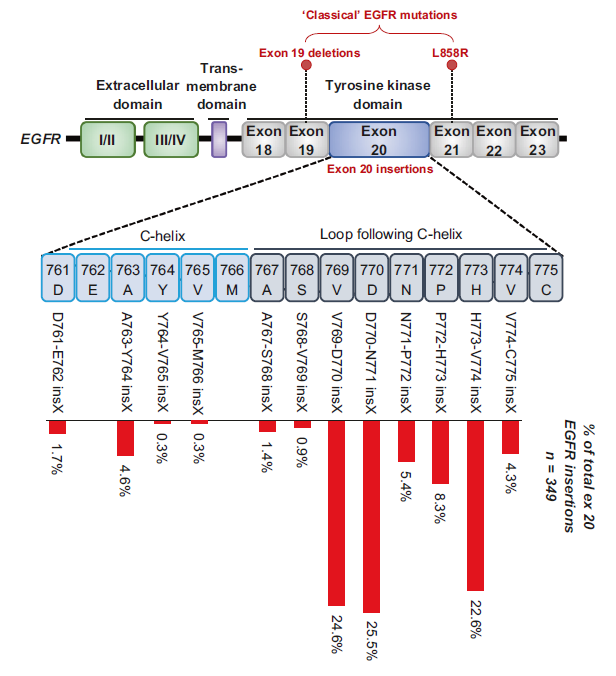
EGFR Exon 20 insertion mutations in NSCLC.
伴随变异(共突变与胚系突变)[1]
1
共突变(非独立突变类型,与上述四类突变共存)
最常见类型:TP53 突变(发生率 40%-50%)、PIK3CA 突变(5%-10%)、RB1 缺失(3%-5%);
临床影响:TP53 突变:促进基因组不稳定性,增加 MET 扩增、小细胞转化等耐药机制的发生率,使 EGFR TKI 治疗的中位 PFS 从 16.5-19.0 个月缩短至 9.5-12.0 个月;PIK3CA 突变:激活 PI3K-AKT 通路旁路,削弱 EGFR TKI 对下游信号的抑制效果,中位 OS 从 38.6 个月缩短至 24.5 个月;
应对策略:TP53 突变患者优先选择 “EGFR TKI + 化疗” 联合方案(如 FLAURA2 试验中联合化疗的 PFS HR=0.52);PIK3CA 突变患者可尝试 “EGFR TKI + PI3K 抑制剂”(如阿培利司,ORR 35%-40%)。
2
胚系突变(罕见,多为 T790M 样突变的特殊形式)
核心类型:EGFR T790M 胚系变异(最常见)、G724S、R776H、V769M 等,发生率 <1%;
人群特征:多为女性、欧洲裔、无吸烟史,常表现为双侧多发磨玻璃肺结节(惰性生长);95% 患者会同时存在体细胞 EGFR 激活突变(ex19del/L858R,即 “二次打击”);
临床意义:携带 T790M 胚系突变人群 60 岁前患肺癌风险 >50%,需从 40 岁开始每年进行低剂量 CT 筛查;治疗方案与体细胞 “激活突变 + T790M 突变” 一致,优先使用奥希替尼。
EGFR 突变型 NSCLC 的基因检测:方法与临床推荐应用
基因检测是 EGFR 突变型 NSCLC 精准治疗的前提,可明确变异类型、指导治疗选择、监测耐药机制,主要包括组织检测与液体活检两类技术[1,3]。
1
主要检测方法对比
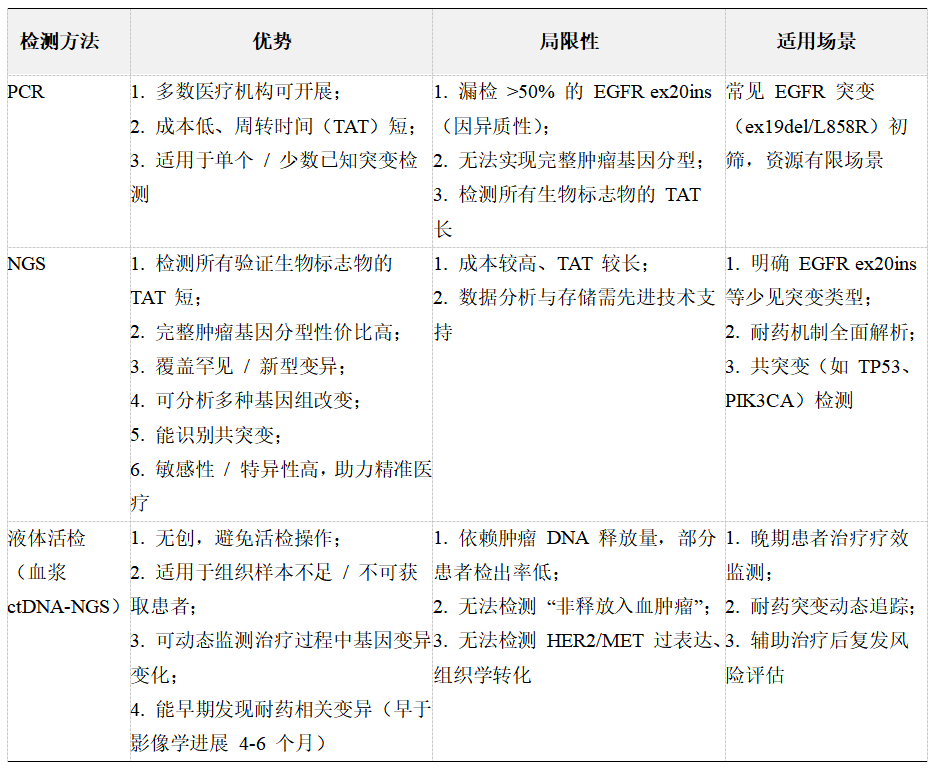
2
临床推荐应用场景
2.1 初诊患者:明确变异类型以指导一线治疗
所有疑似 EGFR 突变型 NSCLC 患者,优先通过 NGS 检测组织样本(若组织可获取),明确是否为 ex19del/L858R(常见突变)、ex20ins 或其他少见突变[1,3];
组织样本不足时,采用血浆 ctDNA-NGS 补充检测,尤其需确认是否存在 ex20ins(避免 PCR 漏检)[1,3];
检测范围需包含 EGFR 18-21 号外显子,同时推荐检测 TP53、PIK3CA 等共突变(预测疗效与耐药风险)[1]。
2.2 辅助治疗:疗效预测与复发监测
术后 IB-IIIA 期 EGFR 常见突变患者,通过 ctDNA 检测基线突变状态:ctDNA 阳性患者从辅助奥希替尼中获益更显著(DFS HR=0.18),ctDNA 阴性患者获益较弱(HR=0.45)[1];
辅助 TKI 治疗期间,每 2-3 个月进行一次 ctDNA 检测:ctDNA 持续阴性提示低复发风险(5 年无复发生存率 92%),ctDNA 转阳提示复发风险增加 8 倍[1]。
EGFR TKI 治疗进展后,优先进行组织活检 + NGS 检测;若组织不可获取,采用血浆 ctDNA-NGS 补充[1];
检测内容需覆盖:EGFR 继发突变(T790M、C797S、G724S)、靶点外变异(MET 扩增、HER2 扩增、RET/ALK 融合)、共突变及组织学转化相关标志物[1];
若 ctDNA 检测到明确耐药变异(如 T790M、MET 扩增),即使影像学未进展,也应考虑提前调整治疗方案;若 ctDNA 阴性但影像学进展(如寡进展),需再次组织活检确认机制[1]。
EGFR TKI药物作用机理
1
一代 EGFR TKI
代表药物:吉非替尼(gefitinib)、厄洛替尼(erlotinib)、埃克替尼(icotinib)[1]。
作用机制:可逆性 EGFR 酪氨酸激酶抑制剂,与 ATP 竞争结合 EGFR 激酶域的 ATP 结合口袋[1];对野生型 EGFR 激酶域有一定活性,部分不良反应与此相关。[1]
治疗敏感性:对经典样突变(ex19del、L858R)敏感[1];对 PACC 突变(G719X、S768I)敏感性低(IC50 5-12nM)[1];对 T790M 样突变耐药[1];对 ex20ins 突变(除 A763_Y764insFQEA 外)耐药,缓解率 3%-8%,中位 PFS<3 个月。[2]
关键临床数据:
(1)IPASS 试验:吉非替尼治疗经典 EGFR 突变患者 ORR 72.1%,显著优于化疗(1.1%),PFS 显著延长。[1,2]
(2)EURTAC 试验:厄洛替尼治疗经典突变患者 ORR 64%,中位 PFS 9.7 个月,优于化疗(18% ORR、5.2 个月 PFS)。[2]
(3)CTONG1104 试验(辅助治疗):吉非替尼辅助治疗 II-IIIA 期经典突变患者,中位 DFS 30.8 个月,优于化疗(19.8 个月),但长期随访无 OS 获益。[1]
(4)CONVINCE 试验:埃克替尼一线治疗经典突变患者,疗效不劣于化疗。[1]
2
二代 EGFR TKI
代表药物:阿法替尼(afatinib)、达可替尼(dacomitinib)、来那替尼(neratinib)[1,2]。
作用机制:不可逆性抑制剂,与 EGFR 激酶域的 Cys797 残基共价结合[1];同时抑制 EGFR、HER2、HER4 激酶域[1,2]。
治疗敏感性:对经典样突变(ex19del、L858R)敏感[1];对 PACC 突变(G719X、S768I)敏感性高(阿法替尼 IC50 0.3-0.8nM),为该类突变首选[1];对 T790M 样突变耐药[1];对 ex20ins 突变疗效有限,阿法替尼治疗 ORR 8.7%,中位 PFS 2.7 个月[2];达可替尼仅对含 770 位甘氨酸插入的 ex20ins 突变(如 D770delinsGY)有部分响应[2]。
关键临床数据:
(1)LUX-Lung 系列试验:阿法替尼治疗经典突变患者 PFS 优于一代 TKI;治疗 PACC 突变患者 ORR 71.0%,中位 PFS 10.7 个月[1,2]。
(2)ARCHER 1050 试验:达可替尼治疗经典突变患者中位 PFS 14.7 个月,优于吉非替尼(9.2 个月),获 FDA 批准用于转移性经典突变 NSCLC[2]。
(3)来那替尼 phase II 试验:治疗经典突变患者 ORR 仅 3%,无肺癌相关获批适应症[2]。
3
三代 EGFR TKI
代表药物:奥希替尼(osimertinib)、拉泽替尼(lazertinib)、阿美替尼(aumolertinib)、伏美替尼(furmonertinib)、贝福替尼(befotertinib)。[1,3]
作用机制:不可逆性抑制剂,共价结合 EGFR 激酶域的 Cys797 残基[1];对突变型 EGFR(尤其是 T790M 突变)亲和力高,对野生型 EGFR 抑制较弱[1];具有较强的血脑屏障穿透性,对 CNS 转移有效。[1]
治疗敏感性:对经典样突变(ex19del、L858R)高度敏感[1];对 T790M 样突变(原发性 / 获得性)高度敏感[1];对 PACC 突变敏感性较弱,回顾性数据 ORR 约 45%,中位 PFS 8-9 个月[1];对 ex20ins 突变(除特殊亚型外)耐药,部分药物(奥希替尼)在临床前模型显示弱活性,相关临床试验(NCT03414814)仍在进行。[2]
关键临床数据:
(1)FLAURA 试验:奥希替尼一线治疗经典突变患者,中位 PFS 18.9 个月、OS 38.6 个月,均优于一代 TKI。[1]
(2)AURA3 试验:奥希替尼治疗获得性 T790M 突变患者,ORR 71%,中位 PFS 10.1 个月,OS 26.8 个月。[1]
(3)LASER301 试验:拉泽替尼一线治疗经典突变患者,PFS 获益与奥希替尼相当。[1]
(4)中国研究(阿美替尼、伏美替尼、贝福替尼):一线治疗经典突变患者,中位 PFS 均优于一代 TKI。[1]
(5)LAURA 试验:奥希替尼用于不可切除 III 期经典突变患者放化疗后巩固治疗,中位 PFS 39.1 个月,显著优于安慰剂。[1]
不同 EGFR 基因变异对应的治疗方案
1
早期(I-III 期)EGFR 突变型 NSCLC 的治疗
1.1 常见突变(ex19del/L858R):辅助治疗与巩固治疗
(1)辅助治疗[1]
术后辅助奥希替尼:推荐用于 IB-IIIA 期患者(无论是否接受辅助化疗),3 年治疗时长可显著改善 DFS(中位未达到 vs. 27.5 个月,HR=0.20),II-IIIA 期患者 5 年 OS 绝对获益 12%(85% vs. 73%);
一代 TKI 辅助治疗:吉非替尼等仅短期改善 DFS(CTONG1104 试验 30.8 个月 vs. 19.8 个月),长期随访无 OS 获益,不推荐作为首选。
(2)不可切除 III 期:放化疗后巩固治疗
同步放化疗后,采用奥希替尼巩固治疗(直至疾病进展 / 毒性不可耐受),中位 PFS 39.1 个月(vs. 安慰剂 5.6 个月,HR=0.16),且显著降低 CNS 复发风险(HR=0.17);
不推荐度伐利尤单抗(PACIFIC 试验中 EGFR 突变亚组无 DFS 获益)。
1.2 少见突变(非 ex20ins):辅助治疗现状[1]
目前缺乏前瞻性试验数据(ADAURA、NeoADAURA 等试验排除少见突变患者);
回顾性数据提示:PACC 突变患者可尝试辅助阿法替尼(基于其对 PACC 突变的抑制活性),经典样突变(如 L861Q)可参考常见突变方案使用奥希替尼,但需谨慎。
1.3 ex20ins:早期治疗现状
无前瞻性试验数据,回顾性研究显示:辅助化疗(顺铂 + 长春瑞滨)疗效有限,中位 DFS 4.2-5.8 个月;常规 EGFR TKI(如奥希替尼)辅助治疗无效[2,3];
推荐参加针对性临床试验(如 NCT05609267,评估新型 ex20ins 抑制剂辅助治疗疗效)[3]。
2
转移性(IV 期)EGFR 突变型 NSCLC 的一线治疗
2.1 常见突变(ex19del/L858R):单药与联合方案
(1)单药 TKI[1]
三代 TKI 优先:奥希替尼为标准方案,中位 PFS 18.9 个月、OS 38.6 个月(均优于一代 TKI);拉泽替尼(LASER301 试验)、阿美替尼 / 伏美替尼(中国研究)疗效与奥希替尼相当;
一代 / 二代 TKI:吉非替尼、阿法替尼等仅用于无法获取三代 TKI 场景,中位 PFS 10-14 个月。
(2)联合方案(高风险人群优选)[1]
奥希替尼 + 化疗:FLAURA2 试验显示,联合卡铂 + 培美曲塞(4 周期,后续培美曲塞维持)中位 PFS 25.5 个月(vs. 奥希替尼单药 16.7 个月,HR=0.62),基线脑转移患者获益更显著(中位 PFS 24.9 个月 vs. 13.8 个月);
埃万妥单抗 + 拉泽替尼:MARIPOSA 试验显示,中位 PFS 23.7 个月(vs. 奥希替尼 16.6 个月,HR=0.70),OS 显著获益(未达到 vs. 36.7 个月,HR=0.75),高风险亚组(CNS 转移、TP53 共突变)获益更优;
不推荐方案:奥希替尼联合贝伐珠单抗 / 雷莫芦单抗(无 III 期获益证据,且毒性增加)。
2.2 少见突变(非 ex20ins):以阿法替尼为基础
PACC 突变(G719X、S768I):优先选择阿法替尼(LUX-Lung 试验 ORR 71.0%,中位 PFS 10.7 个月);ACHILLES 试验显示阿法替尼优于化疗(PFS 10.6 个月 vs. 5.7 个月,HR=0.422)[1];
经典样突变(L861Q):可选择奥希替尼(基于其 CNS 穿透性优势),或阿法替尼[1];
联合方案探索:埃万妥单抗 + 拉泽替尼(CHRYSALIS-2 试验 ORR 55%,中位 PFS 19.5 个月),适合单药 TKI 疗效不佳患者[3]。
2.3 ex20ins:新型抑制剂为核心[3]
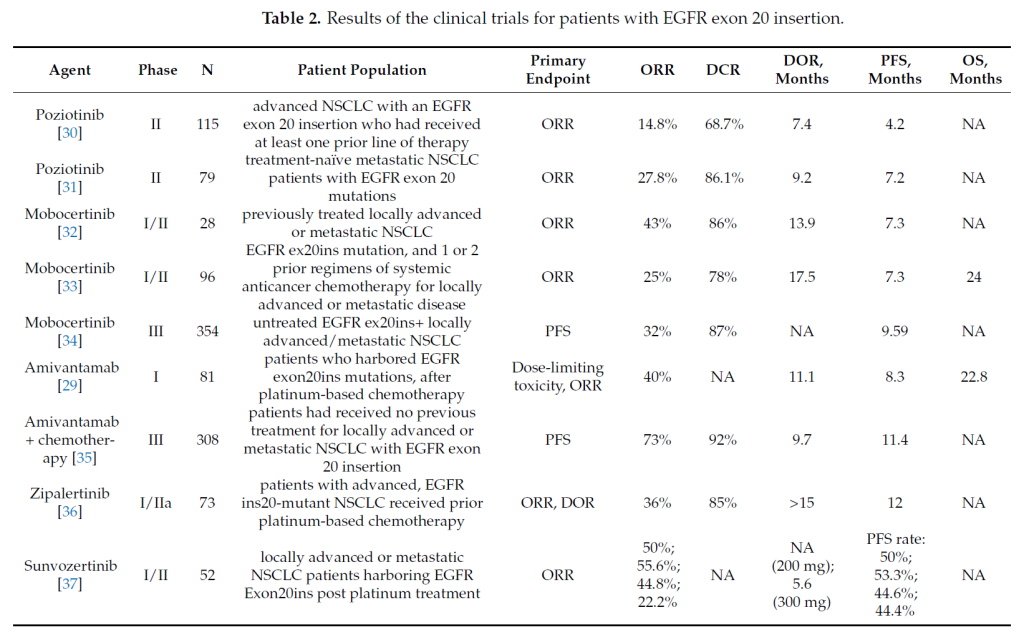
一线治疗推荐:
体能状态良好(ECOG PS 0-1)患者,优先参加新型抑制剂临床试验(如波齐替尼联合化疗)[2,3];无临床试验时,选择 “铂类 + 培美曲塞” 或舒沃替尼 / 莫博赛替尼(基于患者耐受性);不推荐一、二、三代 TKI 单药或 ICIs 联合方案[2]。
3
转移性患者的巩固性局部治疗(寡转移灶)[1]
一线 EGFR TKI 治疗有效且仅存在 ≤5 个转移灶的患者,对残留病灶进行立体定向放疗,可改善 PFS 与 OS:
SINDAS 试验:TKI + 放疗中位 PFS 20.2 个月(vs. TKI 单药 12.5 个月,HR=0.22),OS 25.5 个月(vs. 17.6 个月,HR=0.44);胸部放疗联合埃克替尼:中位 PFS 17.1 个月(vs. 10.6 个月,HR=0.57),OS 34.4 个月(vs. 26.2 个月,HR=0.62);注意事项:胸部放疗期间需暂时停用奥希替尼(避免严重肺炎),但停药时间不宜过长(23% 的患者停药后 8 天内疾病反跳)。
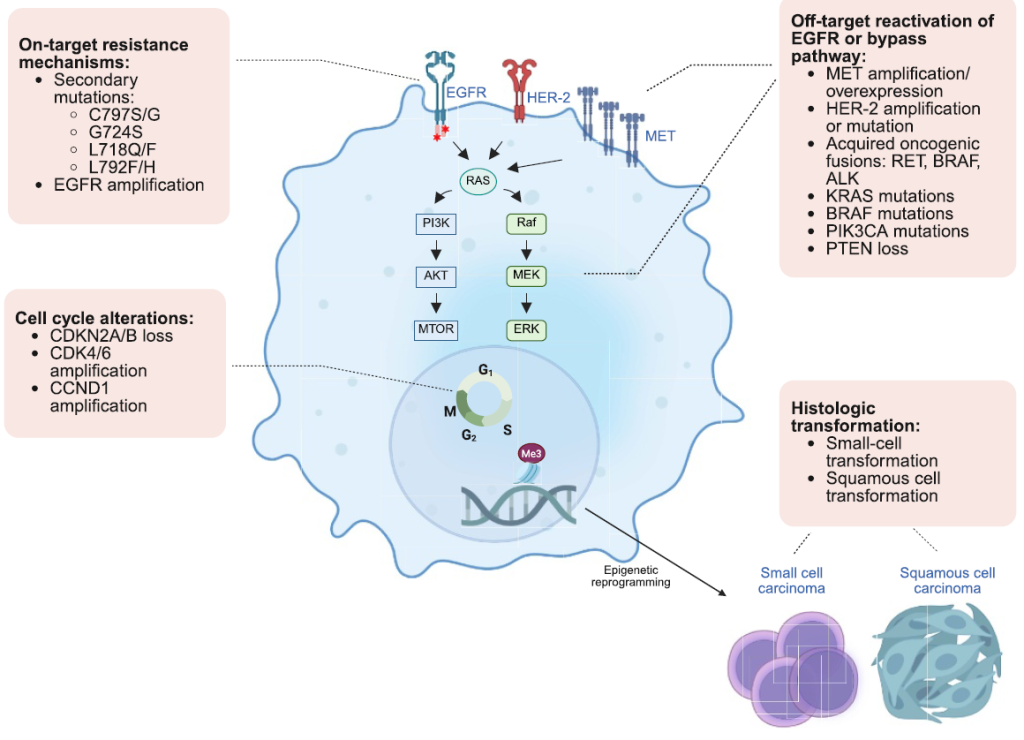
EGFR TKI 治疗耐药相关基因变异与耐药后治疗
耐药机制分为 “靶点内变异” “靶点外变异” 及 “非基因组机制”,需根据基因检测结果选择对应方案[1,2,3]。
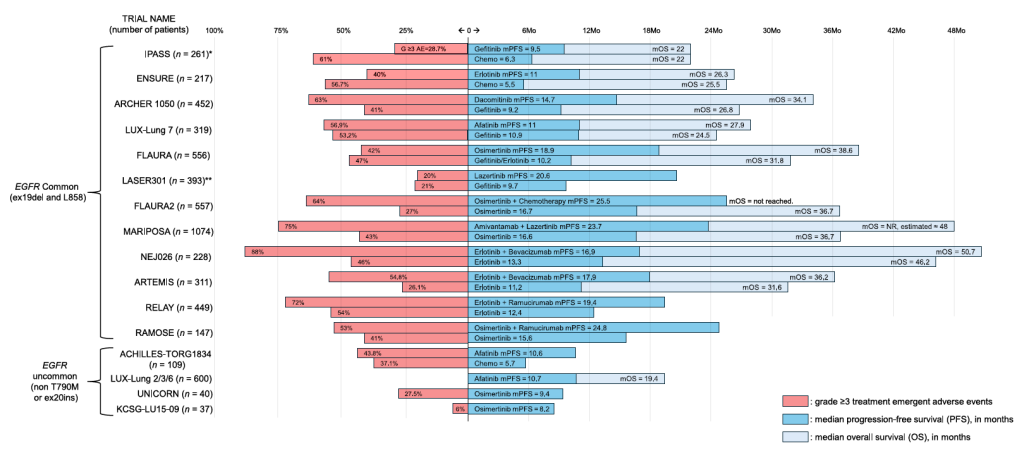
Key clinical data from trials in the first-line metastatic setting of EGFR-mutant NSCLC.
1
靶点内耐药变异及治疗
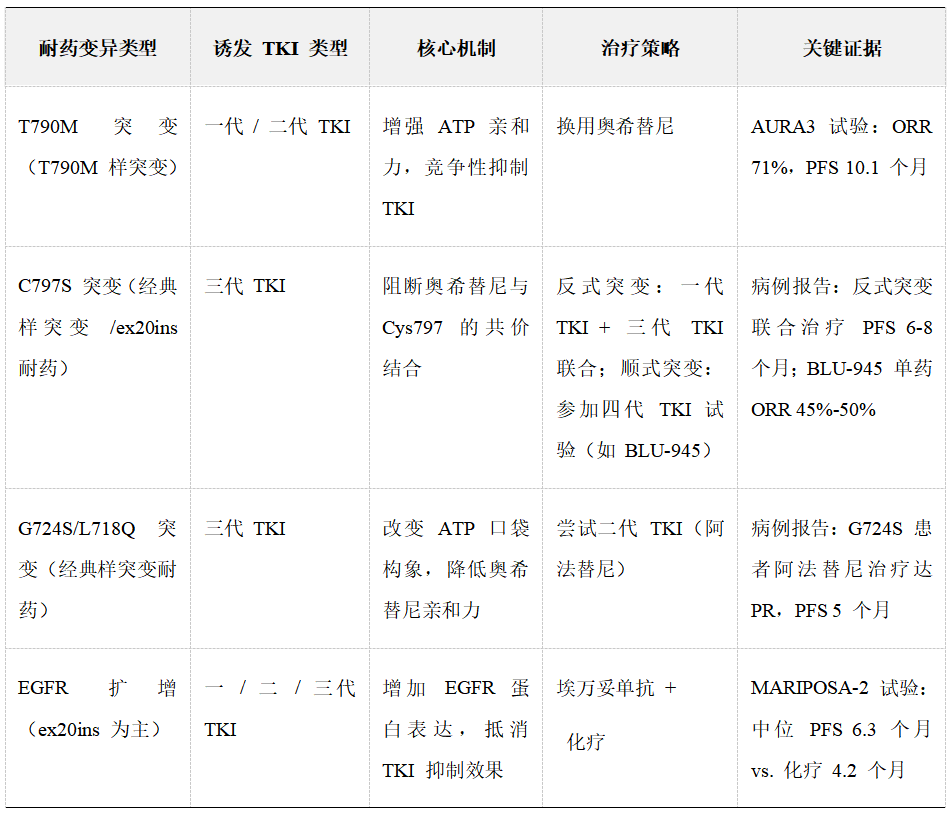
2
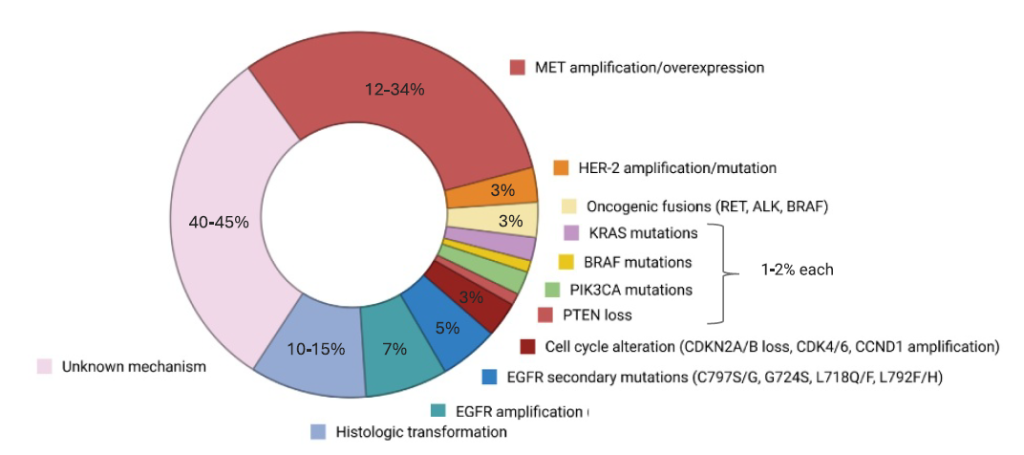
靶点外耐药变异及治疗
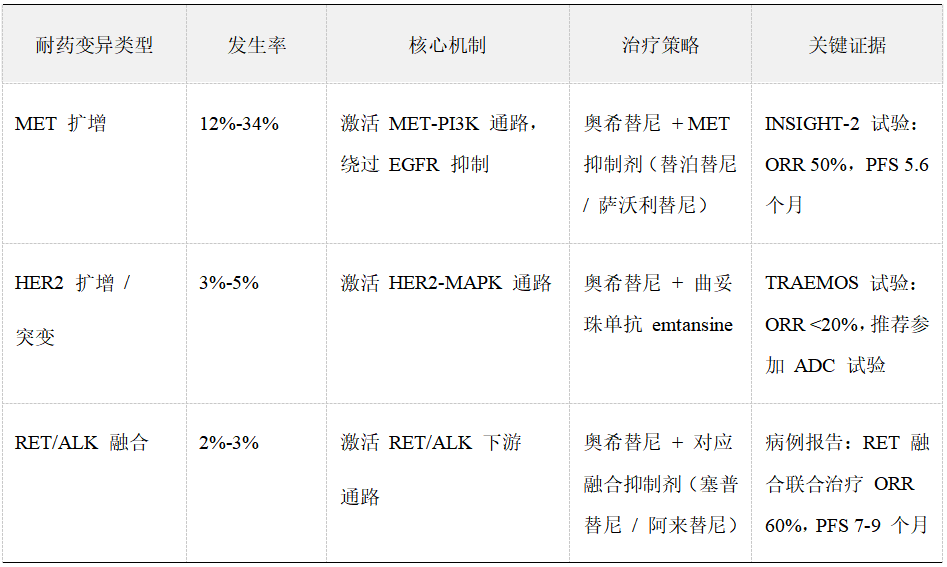
3
非基因组耐药机制的处理
(1)组织学转化(小细胞癌 / 鳞癌转化)[1]
发生率 10%-15%,常见于三代 TKI 耐药后,需通过组织活检确认;
治疗方案:参照小细胞肺癌 / 鳞癌标准方案,如 “依托泊苷 + 铂类”(小细胞转化)、“紫杉醇 + 铂类”(鳞癌转化);
注意事项:转化后患者预后差,中位 OS 仅 6-9 个月,推荐联合 EGFR TKI 维持 EGFR 抑制。
(2)药物耐受持续细胞(DTPs)[1]
机制:表观遗传修饰导致细胞周期停滞,耐受 TKI 毒性;
处理策略:探索 “TKI + 表观遗传药物”(如 HDAC 抑制剂),目前处于临床前阶段,暂无推荐方案。
4
无明确耐药机制的进展后治疗(非选择性策略)
化疗:铂类 + 培美曲塞为标准方案,中位 PFS 4-5 个月,OS 14-15 个月[1];
埃万妥单抗 + 化疗:MARIPOSA-2 试验显示,中位 PFS 6.3 个月(vs. 化疗 4.2 个月,HR=0.48),CNS PFS 12.5 个月(vs. 8.3 个月,HR=0.55),适合无明确靶点患者[1,3];
不推荐方案:ICIs 联合化疗(CheckMate 722、KEYNOTE-789 试验均为阴性),仅在无其他选择时谨慎使用[1]。

特殊人群的治疗考量(基于基因变异背景)
1
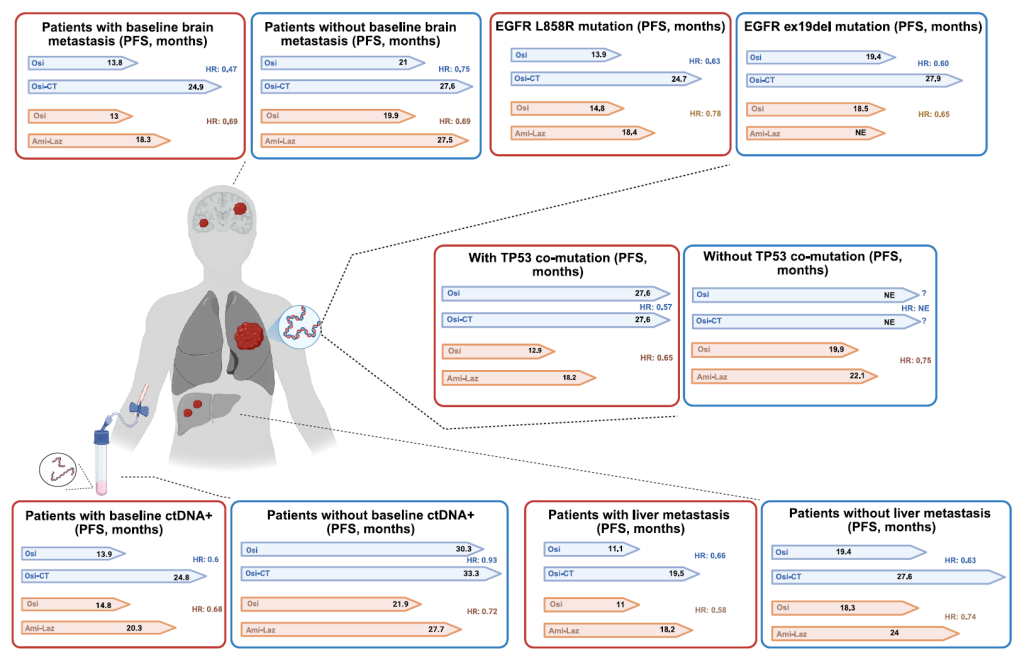
CNS 转移患者(EGFR 突变型 NSCLC 发生率 40%-60%)
治疗核心:选择血脑屏障穿透性强的药物,优先基于 EGFR 变异类型选择[1]:
常见突变:奥希替尼(CNS ORR 54%-70%,中位 CNS PFS 8.5-16.5 个月);埃万妥单抗 + 拉泽替尼(CNS PFS HR=0.52)[1,3];
ex20ins:舒沃替尼(临床前脑穿透性良好)、埃万妥单抗(部分脑膜转移患者脑脊液肿瘤细胞清除)[3];
局部治疗时机:有症状 CNS 转移灶优先放疗(立体定向放疗为主),无症状灶优先三代 TKI 治疗,进展后再放疗[1]。
2
老年患者(≥70 岁)
常见突变:辅助奥希替尼安全性可控(3 级及以上不良反应发生率 23%);转移性患者优先奥希替尼(中位 OS 29.3 个月,3 级毒性 28%),身体弱患者可减量至 40mg/d[1];
ex20ins:选择耐受性好的药物(如舒沃替尼,腹泻发生率低),避免波齐替尼(高皮肤毒性)[3]。
生物标志物指导的个性化治疗策略
Clinical and molecular poor prognostic factors
1
疗效预测生物标志物
(1)循环肿瘤 DNA(ctDNA)
辅助治疗:术后基线 ctDNA 阳性患者辅助奥希替尼 DFS 获益更显著(HR=0.18),ctDNA 持续阴性者 5 年无复发生存率 92%[1];
转移性治疗:治疗 2 周期后 ctDNA 清除者中位 PFS 28.3 个月(vs. 11.2 个月,HR=0.31);“埃万妥单抗 + 拉泽替尼” 治疗后 ctDNA 清除率 68%(vs. 奥希替尼 42%),清除者 OS 更长[1,3]。
(2)共突变状态
TP53 突变:携带患者 TKI 治疗中位 PFS 缩短(9.5-12.0 个月 vs. 16.5-19.0 个月),联合化疗获益更优(FLAURA2 试验 HR=0.52)[1];
PIK3CA 突变:携带患者中位 OS 缩短(24.5 个月 vs. 38.6 个月),联合 PI3K 抑制剂试验中 ORR 35%-40%[1]。
2
耐药监测与动态治疗调整
监测频率:EGFR TKI 治疗期间每 2-3 个月进行 ctDNA 检测[1];
调整策略:ctDNA 检测到耐药突变(如 T790M、MET 扩增),即使影像学未进展也需提前调整;ctDNA 阴性但影像学进展,需组织活检确认机制[1];
早期干预:提前换用奥希替尼(T790M 突变)中位 PFS 11.2 个月(vs. 进展后 6.8 个月);提前联合 MET 抑制剂 ORR 58%(vs. 进展后 42%)[1]。
未来研究方向与挑战
1
新型治疗药物研发:
(1)四代 EGFR TKIs
BLU-945:对 ex19del/L858R/C797S 三重突变 IC50=0.5nM,单药 ORR 45%-50%,联合奥希替尼 ORR 60%-65%[1];
BBT-176:对四重突变(ex19del/L858R/T790M/C797S)活性,单药 ORR 35%-40%[1]。
(2)抗体 – 药物偶联物(ADCs)
Telisotuzumab vedotin(c-MET 靶向):奥希替尼进展后 ORR 58%,联合奥希替尼 ORR 65%[1,3];
Datopotamab deruxtecan(TROP2 靶向):TKI 进展后 ORR 35%-40%,适合无明确靶点患者[1,3]。
2
挑战与未解决的问题
(1)罕见耐药机制的应对
20%-30% 患者耐药机制不明(如未知旁路激活),需单细胞测序、空间转录组解析,开发多靶点抑制剂;这类患者中位 OS 仅 9-12 个月,治疗选择有限[1]。
(2)免疫治疗在 EGFR 突变型 NSCLC 中的定位
仅高 TMB(≥10 mut/Mb)、PD-L1 高表达(≥50%)患者可能获益,临床试验(如 NCT05262403)探索奥希替尼联合 PD-L1 抑制剂;需联合免疫调节剂逆转免疫抑制微环境[1]。
结论
EGFR 突变型非小细胞肺癌的治疗已进入精准医疗时代,从早期辅助治疗到晚期一线治疗,EGFR TKIs(尤其是三代 TKI 奥希替尼)及联合治疗方案(如 “奥希替尼联合化疗”“埃万妥单抗 + 拉泽替尼”)显著改善了患者生存。生物标志物(如 ctDNA、共突变)的应用,为疗效预测、耐药监测和动态治疗调整提供了重要工具;针对罕见耐药机制的新型药物(如四代 EGFR TKIs、MET 靶向 ADC)和优化的联合治疗策略(如 “埃万妥单抗 + 化疗”),进一步拓宽了治疗选择。
对于不同 EGFR 变异亚型,需实施分层治疗:常见突变(ex19del/L858R)以三代 TKI 单药或联合化疗为核心,高风险人群优先选择双靶向联合方案;少见突变(PACC 型)以阿法替尼为基础,联合方案可作为单药疗效不佳的补充;ex20ins 亚型需依赖新型抑制剂(如埃万妥单抗、舒沃替尼),一线联合化疗展现出更优潜力。
同时,临床实践中仍需关注特殊人群的治疗优化:CNS 转移患者优先选择血脑屏障穿透性强的药物(如奥希替尼、舒沃替尼),老年患者需平衡疗效与毒性(如低剂量奥希替尼),妊娠哺乳期患者需结合孕周和肿瘤进展制定个体化方案。
未来,随着单细胞测序、空间转录组等技术的应用,罕见耐药机制的解析将更深入;新型药物(如四代 TKIs、多靶点 ADC)的研发和精准降阶治疗策略(如基于 ctDNA 的辅助治疗时长调整)的验证,将进一步推动 EGFR 突变型 NSCLC 患者的长期生存改善。但同时也需解决检测可及性(降低 ctDNA NGS 成本、缩短周转时间)、免疫治疗定位不明确等挑战,通过多学科协作和临床研究转化,最终实现全周期的个体化治疗。
参考文献
1.Maxime Borgeaud, et al. Personalized care for patients with EGFR-mutant nonsmall cell lung cancer: Navigating early to advanced disease management. CA Cancer J Clin. 2025;75:387–409.
2.Donghyun Seo and Jun Hyeok Lim. Targeted Therapies for EGFR Exon 20 Insertion Mutation in Non-Small-Cell Lung Cancer. Cancer. Int. J. Mol. Sci. 2024, 25, 5917.
3.Simon Vyse and Paul H. Huang. Targeting EGFR exon 20 insertion mutations in non-small cell lung cancer. Signal Transduction and Targeted Therapy (2019) 4:5.


