癌症基因变异与基因检测的临床应用:从机制解析到精准治疗转化
- boke
- 2025-11-07
- 5:33 下午
癌症的遗传基础:癌基因与抑癌基因
癌症是一组以异常且不受控的细胞增殖为特征的疾病,其主要诱因是基因变异。这类因具备驱动肿瘤发生能力而被称为 “驱动突变” 的变异,会使体细胞相较于邻近细胞获得特定选择优势。它们发生在一组 “癌症驱动基因” 中,这些基因的突变形式会影响关键细胞功能的稳态调控,并将其命名为 “癌基因”。自遗传学建立以来,癌症研究的核心目标之一便是跨肿瘤类型识别这些癌基因。对癌基因的识别,推动了靶向抗癌治疗范式的发展,更广泛地说,也为寻找预后及治疗反应的基因组生物标志物奠定了基础。
20 世纪 80 年代中期,研究证实存在第二类癌症基因,即 “肿瘤抑制基因”,也称为“抑癌基因”。与癌基因不同,抑癌基因的失活会引发细胞转化,且通常需要两个等位基因均丧失活性。抑癌基因的发现也解释了家族性癌症的发生机制:若遗传了抑癌基因的一个等位基因的失活突变,只需发生第二次打击,个体患癌概率便会显著升高。
依据 “癌基因 – 抑癌基因” 这一清晰分类,20 世纪 80 年代至 21 世纪初,研究人员识别出数十个编码癌基因(如 MYC、RET、PDGFRA、MET、KIT、FLT3、EGFR、BRAF)和抑癌基因(如 TP53、TGFRB2、RB1、PTEN、CHEK2、CDKN2A、BRCA1、BRCA2、APC)的基因组位点。部分抑癌基因的胚系突变还被证实与癌症易感性相关。开创性研究进一步证实,扩增、缺失、易位、启动子高甲基化等影响这些基因的其他变异类型,同样对细胞转化至关重要。
肿瘤发生的共识至今仍然是:仅少数影响驱动基因的突变事件是恶性转化的根源。驱动基因主要影响少数关键细胞功能,即 “癌症特征”。根据这一理论,受驱动变异影响,恶性细胞具备以下能力:(1)抵抗凋亡;(2)维持增殖信号(即使缺乏胞外信号);(3)逃避细胞生长抑制;(4)启动侵袭与转移;(5)实现无限增殖;(6)诱导血管生成;(7)紊乱能量代谢;(8)逃避免疫清除。
基因变异类型与特征:体细胞变异与胚系变异
一、体细胞变异:肿瘤发生的直接推手
肿瘤发生遵循 “变异 – 选择” 达尔文进化模式,体细胞突变导致细胞差异(变异),正向选择使优势突变细胞克隆扩增;正向选择信号包括突变频率异常、蛋白质特定区域聚集、高功能影响突变富集等,可用于识别驱动基因;不同癌症及样本间突变数量存在显著差异。
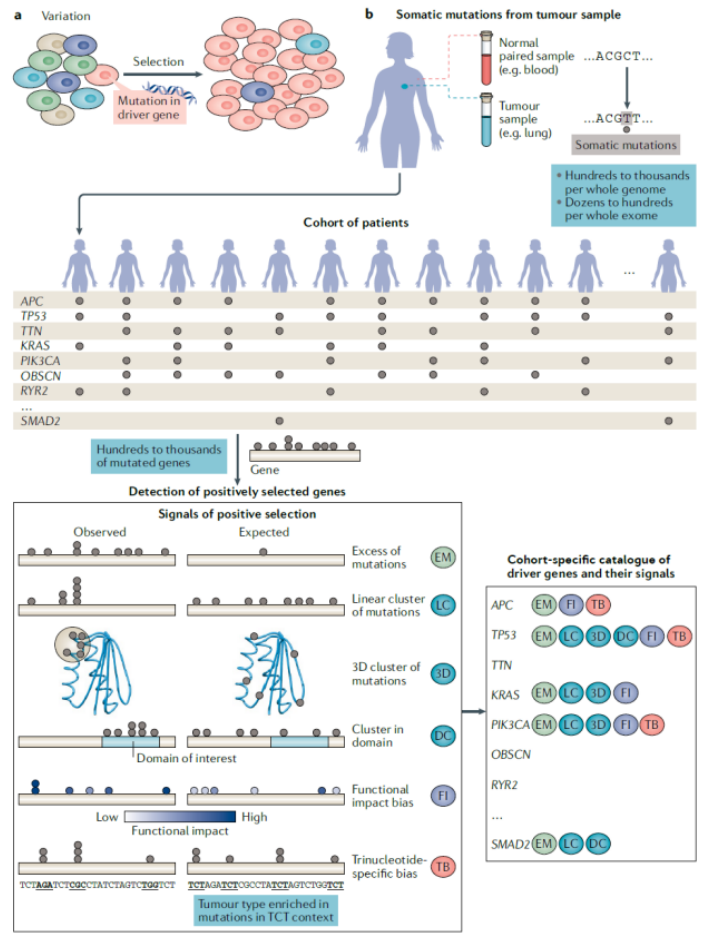
Signals of positive selection identify driver genes.
体细胞变异需通过生物信息学方法(如 dNdScv、OncodriveFML 等 7 种工具)区分 “驱动突变”(促癌功能)与 “乘客突变”(无生物学活性):
1.癌基因激活突变:呈 “显性作用”,单等位基因突变即可驱动肿瘤,多表现为 “窄突变簇 + 错义突变富集”—— 如 KRAS 第 12/13 号密码子突变簇聚集该基因 85% 的突变(结直肠癌样本),EGFR 19del/L858R 突变激活 RAS-MAPK 通路,驱动非小细胞肺癌(NSCLC)增殖;BRAF V600E 突变在黑色素瘤、结直肠癌中高频出现,通过持续激活 MEK-ERK 通路促进细胞恶性转化。
2.抑癌基因失活突变:需 “双等位基因失活”,多表现为 “宽突变簇 + 无义 / 剪接突变富集”—— 如 BRCA1/2 失活导致同源重组缺陷(HRD),使卵巢癌、乳腺癌细胞 DNA 修复能力丧失;RB1 在膀胱腺癌中无义突变富集,触发 mRNA 无义介导降解,丧失细胞周期调控功能;PTEN 缺失在子宫内膜癌中发生率 66%,解除对 PI3K-AKT 通路的抑制,推动肿瘤进展。
3.关键通路变异:RAS-MAPK、PI3K-AKT-mTOR、DNA 修复通路的变异是跨癌种共通驱动因素 —— 如 MET exon14 跳跃突变在 NSCLC 中发生率 3%-4%,通过逃避蛋白降解激活通路;FGFR3 融合在膀胱癌中驱动肿瘤,均为明确药物靶点。
二、胚系变异:肿瘤易感与治疗的双重关联
胚系变异可遗传给后代,主要涉及 “遗传性肿瘤易感基因”:
1.易感机制:BRCA1/2 突变携带者乳腺癌风险达 65%-85%、卵巢癌风险 15%-40%;Lynch 综合征相关 MLH1/MSH2/MSH6/PMS2 突变,使结直肠癌、子宫内膜癌风险升高 10-20 倍。
2.治疗价值:10%-20% 的癌症患者携带致病性胚系变异,这类检测不仅能使遗传风险人群癌症早诊率提升 40%,且部分变异同时为治疗靶点 —— 如 BRCA1/2 胚系突变患者,既需加强筛查,也可通过 PARP 抑制剂治疗获益。
IntOGen 流程收集了 66 种癌症类型、221 个队列(样本量 10-973 个)、共 28,076 个样本的体细胞单核苷酸变异(SNV)与短插入 / 缺失(indel)数据,共识别 568 个突变型驱动基因,含 152 个新基因。 这些变异不仅是肿瘤发生的分子根源,更是精准药物研发的核心靶点。
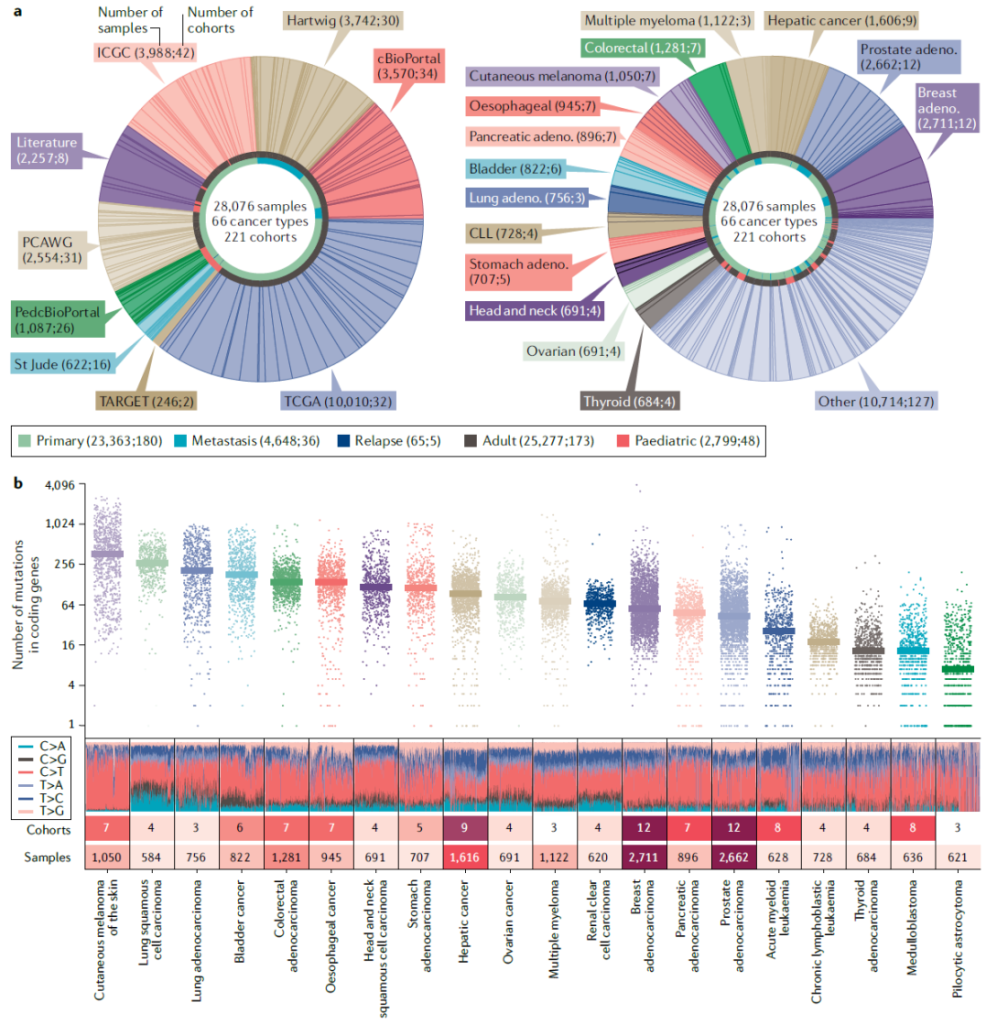
Application of the IntOGen pipeline to datasets of tumour mutations
Distribution of the prevalence of driver genes across cancer types in the compendium.
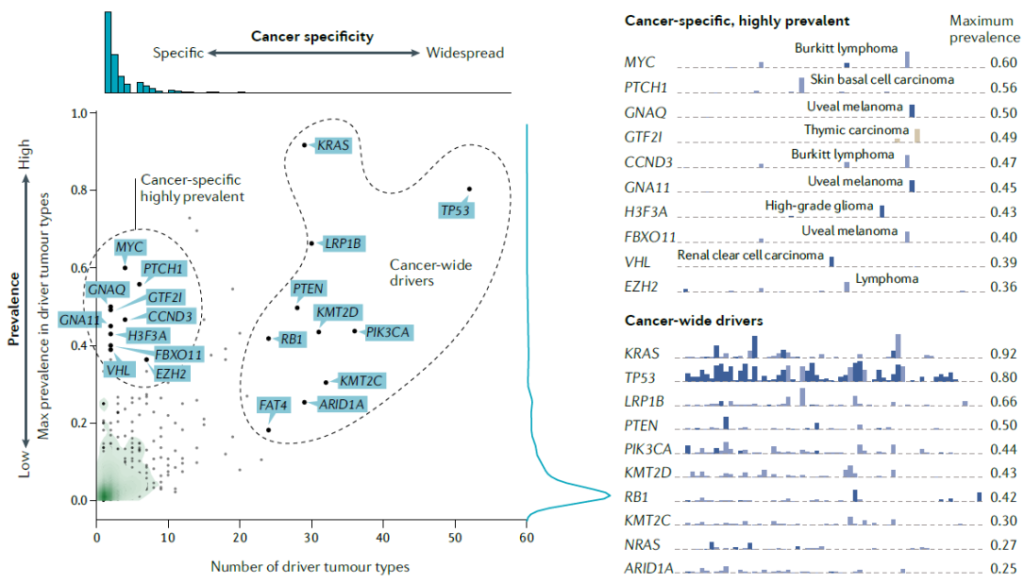
Distribution of the prevalence of driver genes across cancer types in the compendium.
肿瘤基因变异与药物研发
一、基因变异与药物靶点的关联性:精准治疗的核心逻辑
不同变异类型通过 “功能改变 – 通路影响” 形成明确的药物靶点关联,分为三类核心场景:
1. 可靶向激活型变异:直接抑制突变癌蛋白
这类变异多为癌基因功能获得性突变,对应小分子抑制剂或抗体药物,疗效明确:
EGFR 突变:NSCLC 中 EGFR 19del/L858R 突变患者,接受奥希替尼治疗的总生存期(OS)达 38.6 个月,较化疗时代(<12 个月)提升 3 倍;非经典突变(G719X、S768I)对阿法替尼敏感,客观缓解率(ORR)58%。
BRAF V600E 突变:黑色素瘤患者接受维莫非尼 + 考比替尼联合治疗,OS 达 22.3 个月;结直肠癌患者需联合抗 EGFR 抗体(西妥昔单抗),ORR 提升至 48%。
融合基因:ALK 融合 NSCLC 患者用艾乐替尼,无进展生存期(PFS)达 34.8 个月;NTRK 融合在泛癌中发生率 < 1%,拉罗替尼治疗 ORR 达 75%。
2. 可靶向失活型变异:利用合成致死(Synthetic Lethality)机制
这类变异多为抑癌基因功能缺失,通过 “合成致死” 策略,即“双重缺陷导致细胞死亡” 的逻辑靶向互补通路:
BRCA1/2 失活:卵巢癌患者接受鲁卡帕利治疗,PFS 达 16.6 个月,显著优于安慰剂组 5.4 个月(p<0.0001,ARIEL3 研究);胰腺癌、前列腺癌中 BRCA 突变患者,PARP 抑制剂同样可延长生存。
HRD 阳性:ATM、BRIP1 等基因变异导致的 HRD,使肿瘤对 PARP 抑制剂敏感,HRD 阳性患者 PFS 获益是 HRD 阴性患者的 2.8 倍。
3. 耐药相关变异:指导治疗方案动态调整
治疗过程中出现的二次变异是耐药主因,需通过基因检测动态监测:
EGFR T790M 突变:一代 EGFR-TKI 耐药后,50%-60% 患者出现该突变,换用三代奥希替尼后 PFS 达 10.1 个月(AURA 3 研究);
KRAS G12C 抑制剂耐药:耐药后常出现 KRAS G12V、MET 扩增,需联合 MET 抑制剂或换用多靶点药物;
复合耐药机制:如 EGFR C797S+MET 扩增,通过 “奥希替尼 + 赛沃替尼” 联合治疗,ORR 达 49%(SAVANNAH 研究)。
二、药物研发与临床转化:从靶点到治疗的全链条落地
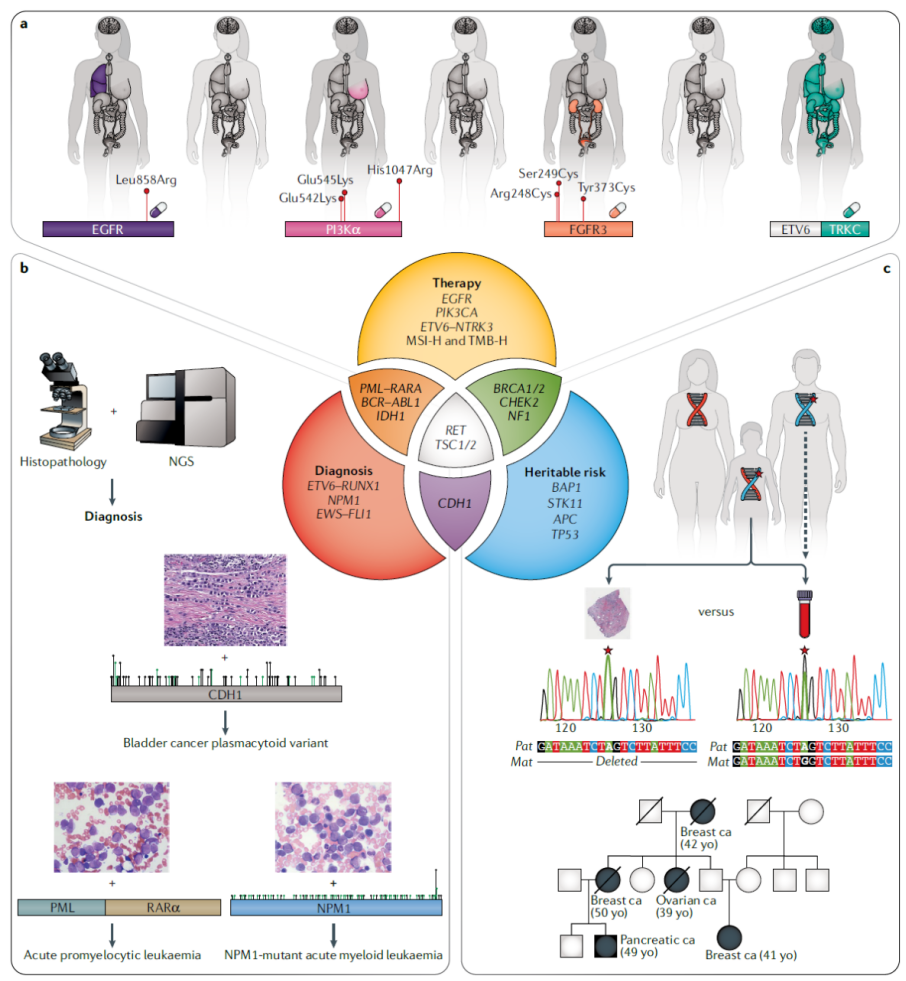
Clinical applications of tumour sequencing
基于变异靶点的药物研发需经历 “临床前设计→临床试验→上市应用” 三阶段,EGFR-TKI 的研发历程是该闭环的典范:
1. 临床前研发:靶点特征导向的药物设计
结构导向设计(SBDD):一代 EGFR-TKI(吉非替尼)针对 EGFR 激酶域 ATP 结合口袋,体外对 19del/L858R 突变 IC₅₀达 10-20 nM,但对野生型 EGFR 抑制较强(IC₅₀≈50 nM);三代奥希替尼引入丙烯酰胺基团与 C797 共价结合,对 T790M 突变 IC₅₀仅 1.6 nM,选择性提升 30 倍;四代 BLU-945 针对 C797S/T790M/19del 三重突变,靶向 “开关口袋”,解决三代耐药。
体内模型验证:NSCLC PDX 模型显示,奥希替尼 10 mg/kg 抑瘤率超 80%,吉非替尼同剂量不足 20%;食蟹猴模型中,奥希替尼皮肤毒性发生率 < 30%,低于二代阿法替尼的 80%。
2. 临床试验转化:Biomarker 指导的精准设计
I/II 期探索:吉非替尼 IDEAL 1/2 试验发现亚洲、不吸烟、腺癌患者 ORR 更高,后续证实这类患者 EGFR 突变率超 60%;阿法替尼 LUX-Lung 2 试验纳入非经典突变患者,ORR 达 58%。
III 期确证:IPASS 研究首次按 “EGFR 突变状态” 分层,突变阳性患者吉非替尼组 mPFS 9.5 个月 vs 化疗组 6.3 个月(HR=0.48,p<0.001);AURA 3 研究针对 T790M 突变患者,奥希替尼组 mPFS 10.1 个月 vs 化疗组 4.4 个月(HR=0.30,p<0.001)。
联合治疗破耐药:SAVANNAH 研究(奥希替尼 + 赛沃替尼)针对 MET 扩增耐药,ORR 49%;DESTINY-Lung01 研究中 DS-8201 单药在 EGFR-TKI 耐药患者 ORR 达 57%。
3. 上市后应用:从晚期到全程管理
真实世界证据补充:中国 CTONG 1509 延伸研究显示,阿美替尼对 19del/L858R 患者 mOS 达 30.2 个月,脑转移患者 mPFS 15.3 个月;
适应症拓展:ADAURA 研究将奥希替尼用于 II-III A 期辅助治疗,mDFS 65.8 个月 vs 安慰剂组 28.1 个月(HR=0.23,p<0.001);
诊疗路径整合:中国《CSCO 肺癌指南》将 EGFR 检测列为晚期 NSCLC 一线必检,检测率从 2015 年 35% 提升至 2023 年 89%,匹配治疗率达 78%。
肿瘤诊疗中基因检测的核心重要性:连接变异与治疗的桥梁
一、肿瘤基因检测的发展及应用
基因检测是将 “基因变异机制” 转化为 “临床精准治疗” 的核心枢纽,通过解析肿瘤分子特征,破解 “同癌异治”“异癌同治” 的关键密码,彻底重塑传统诊疗范式。
1.技术迭代:从单靶点到多维度检测
近十年基因检测已从单基因 PCR 演进为覆盖数百个基因的 NGS Panel,可同步捕获 SNV、indel、融合、CNV 及 TMB 等信息,检测成功率达 93%(BALLETT 研究)。
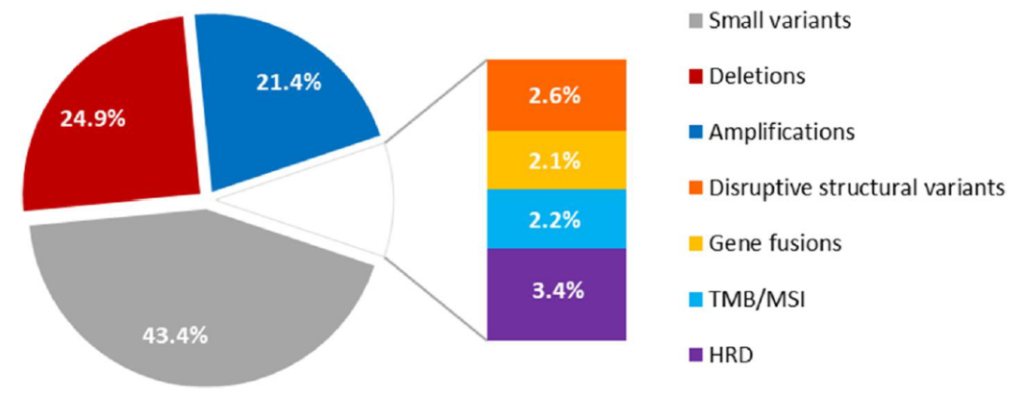
Proportion of clinically useful genomic information by mutation class
2.临床需求:指南推荐的标准流程
国际指南(ASCO、ESMO)已将 NGS 检测列为晚期癌症(如 NSCLC、结直肠癌)一线标准流程——81% 的晚期患者可通过全面基因组谱分析(CGP)检出可行动标志物,显著高于传统小 panel 的 21%,且这些标志物直接关联靶向 / 免疫治疗获益。
3.延伸价值:预后判断与遗传风险评估
基因检测不仅指导治疗选择,还可评估预后(如 TP53 突变提示不良预后)与遗传风险:BRCA1/2 突变患者的一级亲属通过 “级联检测”,可提前干预降低患癌风险;Lynch 综合征患者每 1-2 年肠镜检查,结直肠癌发生率降低 60%。
二、基因检测的临床收益:以 PFS/OS 为核心的生存改善
基因检测通过 “精准匹配治疗” 为患者带来显著生存获益,其价值在多癌种、多治疗线数中均得到验证,核心体现在无进展生存期(PFS)与总生存期(OS)的双重提升。
1.跨癌种生存数据:从 “疾病控制” 到 “长期生存”
系统综述(14 项研究,35975 例患者)显示,CGP 指导的靶向治疗可使晚期患者 OS 显著延长:
NSCLC:EGFR 突变者用奥希替尼 OS 达 38.6 个月,较化疗时代提升 3 倍;
胃食管腺癌:CGP 匹配靶向抗体联合化疗,OS 从 9.0 个月延长至 15.7 个月(p=0.05,Catenacci 研究);
卵巢癌:BRCA1/2 突变者用鲁卡帕利 PFS 达 16.6 个月,显著优于安慰剂组 5.4 个月(p<0.0001,ARIEL3 研究)。
在 PFS 方面,高 “治疗 – 靶点匹配分数” 是关键:匹配分数 > 50% 的患者 PFS 达 6.5 个月,显著优于低匹配分数组(3.1 个月,p<0.001,Sicklick 研究);即使是难治性癌症(如胆管癌、肉瘤),CGP 指导临床试验入组也使 PFS 获益提升 30%-56%。
2.免疫治疗相关收益
TMB-H(≥10 mut/Mb)患者接受免疫检查点抑制剂的 ORR 达 40%,OS 较 TMB-L 患者延长 12.3 个月;MSI-H/dMMR 患者用帕博利珠单抗 2 年 OS 率 60%,显著高于普通人群。
3.亚组差异与增益因素
癌种特异性:常见癌种(乳腺癌、肺癌)治疗匹配率 25%-30%(药物获批更多),少见癌种(胆管癌)虽匹配率 10%-15%,但 CGP 可通过临床试验提升生存;
分子特征:HRD 阳性患者 PARP 抑制剂 PFS 获益是 HRD 阴性患者的 2.8 倍;MET exon14 跳跃突变 NSCLC 患者用 MET 抑制剂 OS 达 12.4 个月,远超化疗 5.6 个月;
MTB 参与:遵循 MTB 推荐方案的患者,治疗匹配率提升 40%-60%,OS/PFS 显著优于医生自选方案(HR=0.63,95% CI 0.50-0.80,p<0.001),如 Kato 研究中 MTB 指导组临床获益率 55.8% vs 医生自选组 4.3%(p<0.0001)。
三、基因检测的核心内容:检测基因选择与技术方法体系
基因检测的 “精准性” 依赖于合理的检测基因 panel 设计与适宜技术的选择,需结合临床指南、癌种特征及治疗需求综合确定。
核心检测基因:从 “泛癌种必检” 到 “癌种特异性”
1. 泛癌种核心可行动基因(基于驱动频率与临床证据)
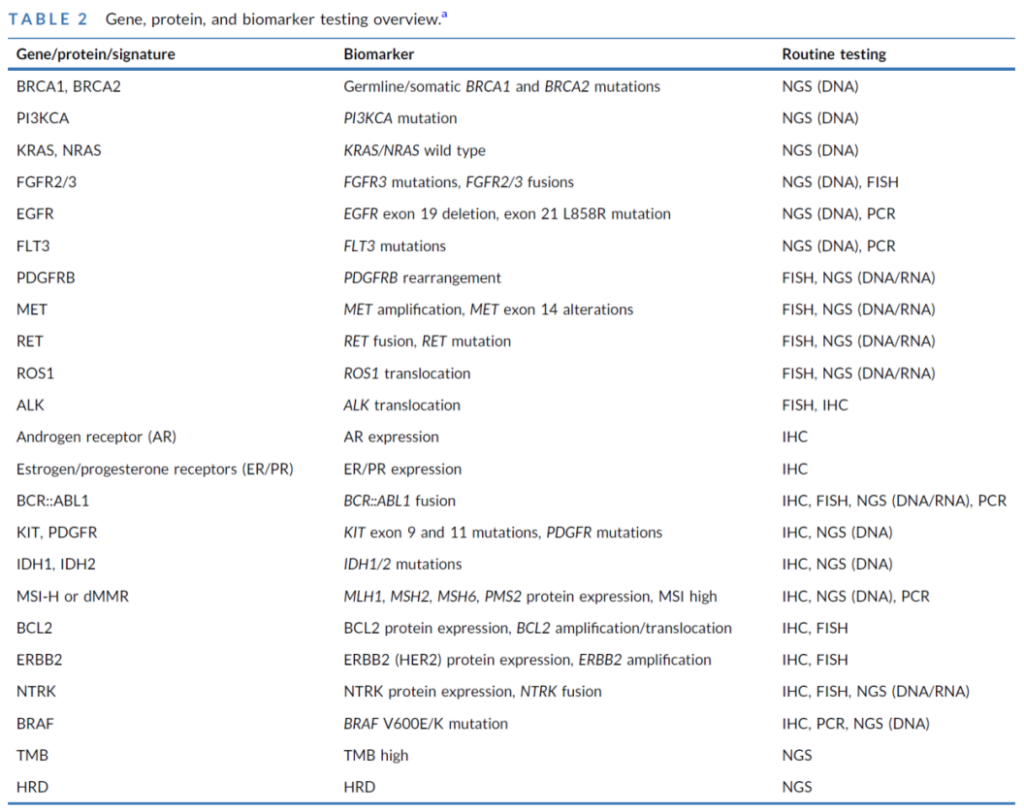
2. 检测 panel 设计原则
最小 panel(2-100 基因):覆盖 NCCN 指南 “必检基因”(如 NSCLC 检测 EGFR、ALK、ROS1、BRAF、KRAS、MET),适合资源有限场景;
中大型 panel(200-1000 基因):覆盖 SNV、indel、融合、CNV 及 TMB/MSI,适合晚期泛癌种患者;
WES/WGS:覆盖所有编码区或全基因组,可发现罕见变异(如 FGFR3-TACC3 融合)。
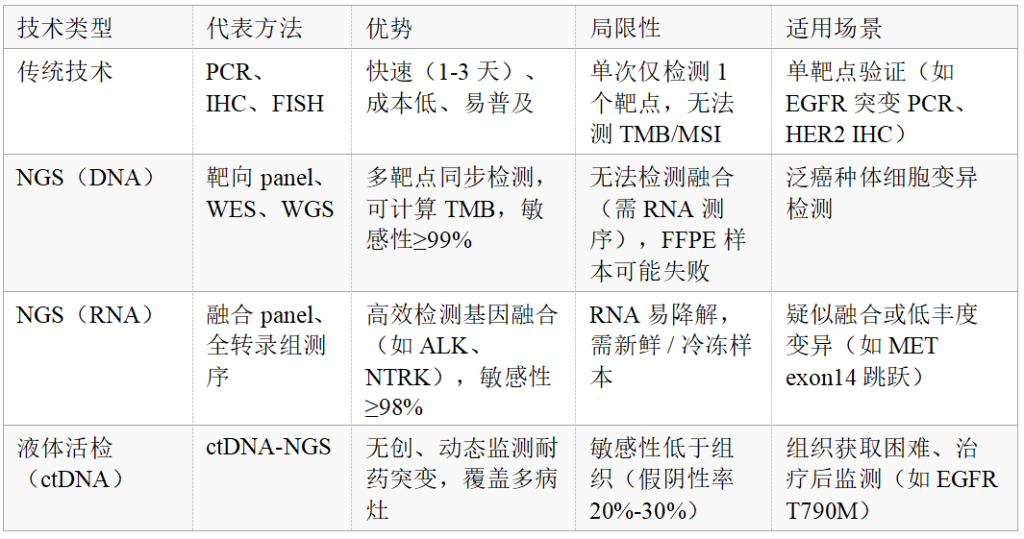
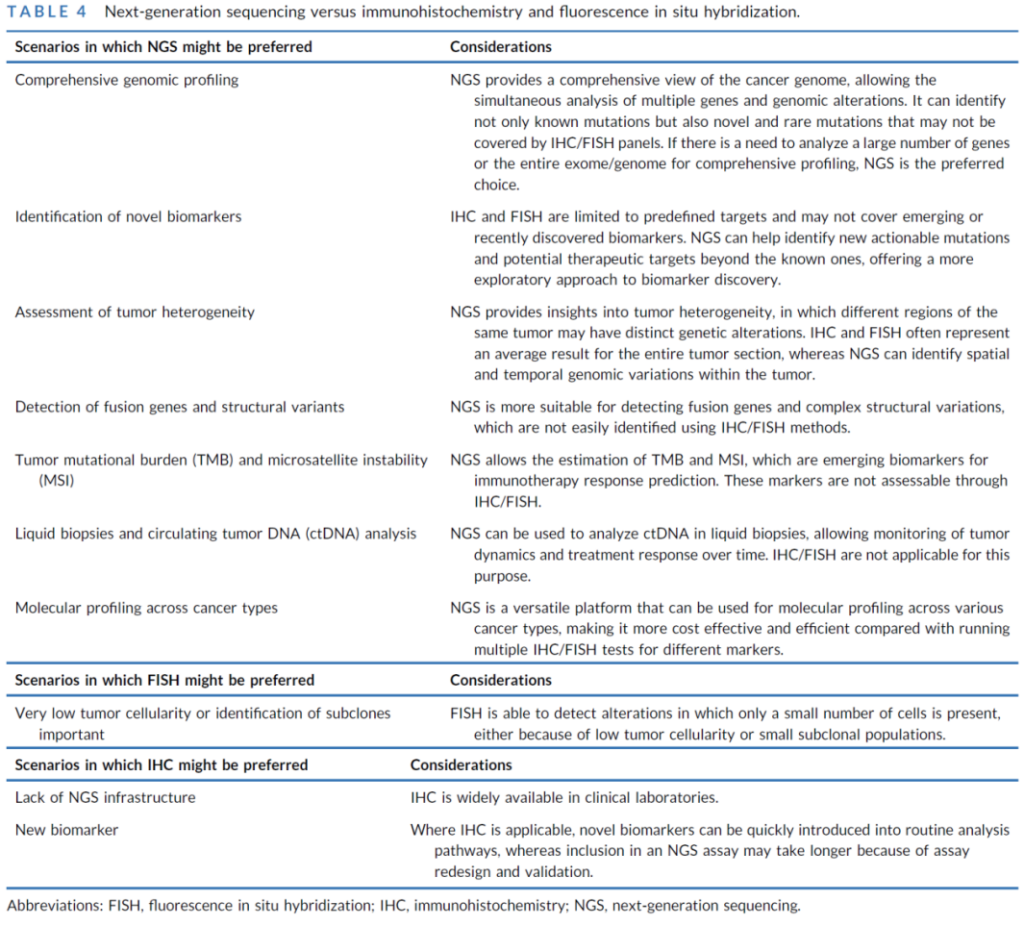
检测技术体系:从 “传统单靶点” 到 “NGS 多维度”
1. 主流技术对比与选择策略
技术标准化关键指标
样本质量:肿瘤组织需≥20% 肿瘤细胞,ctDNA 需≥0.1% VAF,FFPE 样本存放不超过 2 年;
检测性能:NGS 需≥99% 敏感性与特异性,VAF 检测下限≤5%(组织)/≤0.1%(ctDNA),TMB 计算需覆盖≥300 个基因;
周转时间(TAT):标准化实验室 TAT 中位数 29 天(组织)、14 天(ctDNA),超过 60 天会延误治疗,需通过自动化文库制备缩短 TAT。
四、基因检测结果的解读:数据库支撑与临床注释体系
基因检测结果的临床转化依赖于标准化的数据库解读与注释流程,需结合 “变异致病性分级 – 可行动性评估 – 临床建议生成” 形成闭环,确保结果准确转化为治疗决策。
核心解读数据库:从 “学术资源” 到 “临床工具”
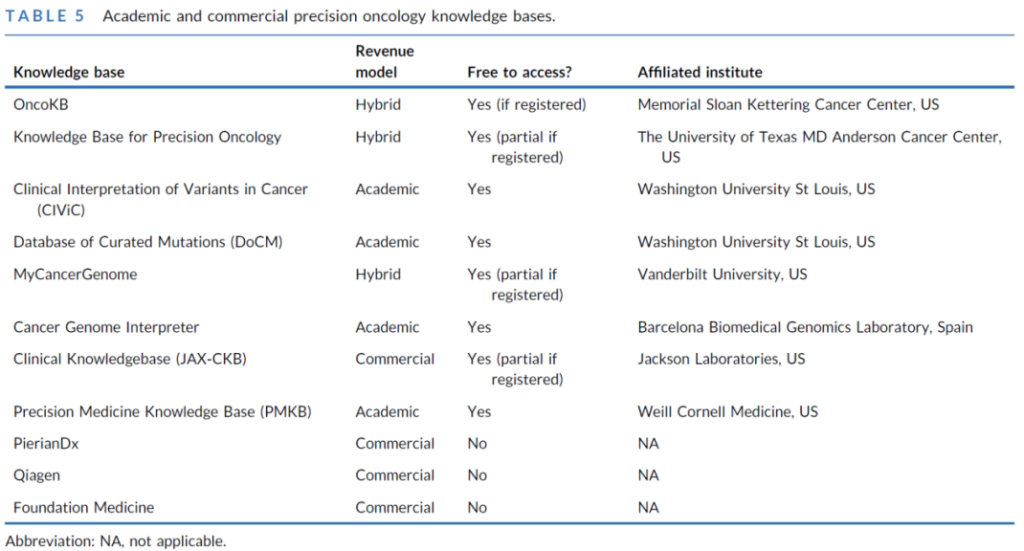
解读流程与注释标准
1. 标准化解读流程(CA 2024 推荐)
变异筛选:排除 “乘客突变”(如 TP53 P72R,无致癌证据),保留 “驱动突变”(如 EGFR 19del,明确促进肿瘤发生);
致病性分级:依据 AMP/ASCO/CAP 共识分为 4 类(表 1),仅 “致病性”“可能致病性” 用于治疗决策;
可行动性评估:通过 OncoKB/ESMO ESCAT 确定等级,优先推荐 1 级(如 EGFR 19del→奥希替尼);
临床建议生成:结合患者合并症、既往治疗,匹配药物或临床试验(如 TMB-H 患者匹配 KEYNOTE-158 试验)。
2. AMP/ASCO/CAP 变异分类体系
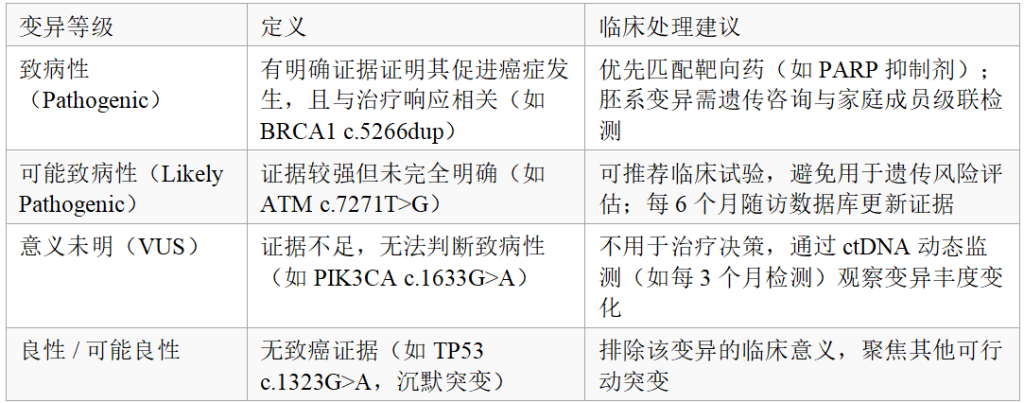
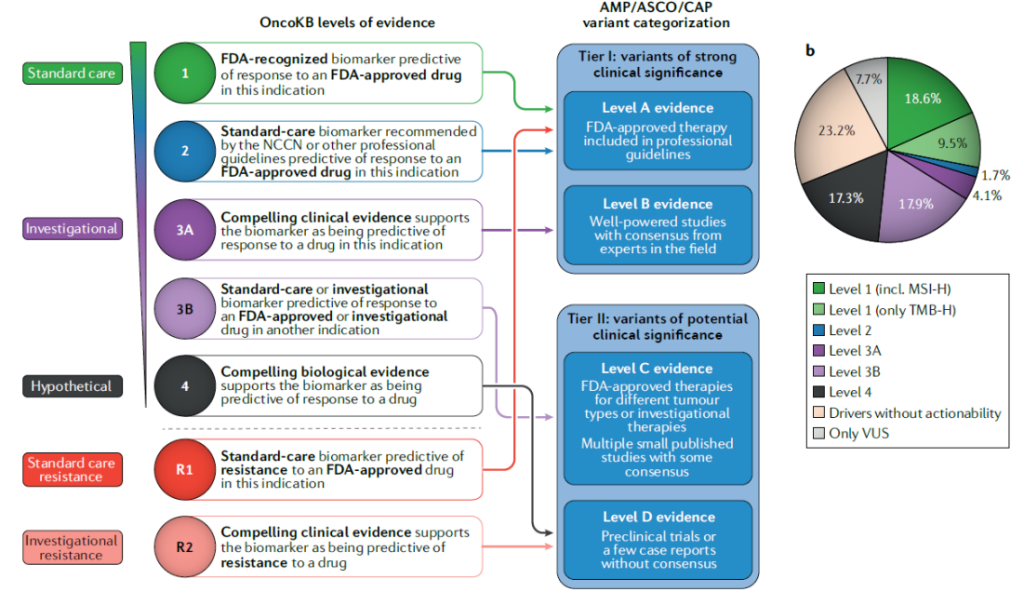
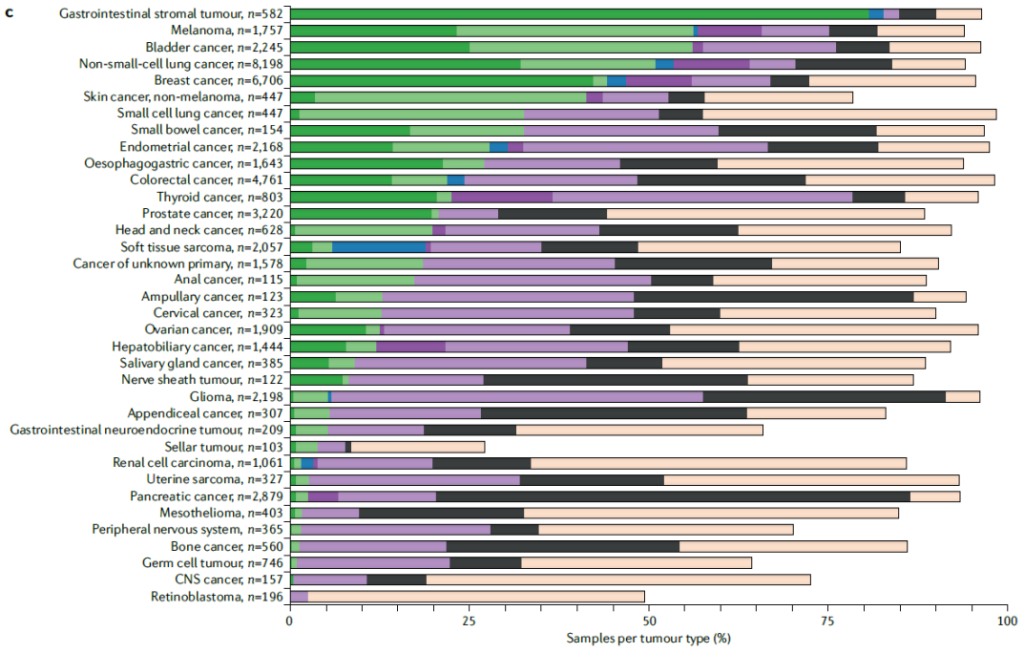
3. 临床报告核心要素
样本信息:肿瘤类型(如 NSCLC)、样本类型(组织 /ctDNA)、肿瘤细胞比例(如 30%)、VAF 值(如 EGFR 19del,VAF=25%);
变异详情:基因名称、变异位点、蛋白改变、变异等级(如 KRAS G12C,Pathogenic)、检测方法(如 NGS Panel);
临床建议:分 “治疗建议”“遗传建议”“随访建议”,明确用药方案与监测频率。
解读挑战与解决方案
罕见变异解读:建立 MTB 网络(如比利时 nMTB),每周讨论复杂病例,2025 年数据显示其可使罕见变异解读效率提升 50%;
多变异共存:通过 OncoKB API 对接实验室 LIS 系统,自动生成变异分级与治疗优先级(如 KRAS G12C 为 1 级证据,优先推荐 KRAS 抑制剂);
胚系 vs 体细胞区分:配对正常组织(如血液)检测,对比肿瘤与正常组织 VAF(如 BRCA2 VAF≈50% 为胚系,VAF≈20% 为体细胞);
VUS 处理:动态随访数据库,部分 VUS 随证据积累升级为致病性;通过 ctDNA 监测 VAF 变化,若随肿瘤进展升高,提示可能为驱动变异。
总结与展望
癌症的遗传学基础核心是 “癌基因 – 抑癌基因”,二者通过影响 “癌症特征”共同推动肿瘤发生。体细胞变异遵循 “变异 – 选择” 达尔文进化模式,突变产生细胞遗传差异,正向选择使优势突变细胞克隆扩增;胚系变异存在于所有细胞且可遗传,同时部分变异可作为治疗靶点。二者共同构成癌症发生的分子根源,为后续基因检测解析特征、精准匹配治疗奠定基础。
肿瘤基因检测已成为肿瘤精准医疗的 “基础设施”,其通过解析分子特征连接 “肿瘤基因变异机制” 与 “临床治疗”,形成 “变异 – 靶点 – 药物 – 检测 – 解读 – 治疗” 的完整闭环;通过解析分子特征为临床决策提供依据,通过数据库解读实现结果标准化,通过药物研发与临床转化落地治疗价值。
EGFR-TKI 的研发与转化历程证实,肿瘤基因检测的精准医疗不仅能显著改善患者生存,更能重塑药物研发范式,为其他靶点(如 ALK、RET、KRAS)提供可复制的实践路径。
当前,基因检测的应用正从晚期癌症向早期拓展,从单一癌种向泛癌种延伸,未来需进一步解决罕见变异解读、复合耐药应对、技术可及性等问题,通过 AI 辅助药物设计、液体活检动态监测与多学科协作的深度整合,推动肿瘤治疗从 “个体化” 向 “治愈导向” 迈进。
参考文献:
1.Francisco Martínez-Jiménez, et al. A compendium of mutational cancer driver genes. Nat Rev Cancer. 2020 Oct;20(10):555-572. doi: 10.1038/s41568-020-0290-x.
2.Ben Kinnersley, et al. Analysis of 10,478 cancer genomes identifies candidate driver genes and opportunities for precision oncology. Nature Genetics | Volume 56 | September 2024 | 1868–1877
3.Raffaella Casolino MD, et al. Interpreting and integrating genomic tests results in clinical cancer care: Overview and practical guidance. CA Cancer J Clin. 2024;74:264–285.
4.Debyani Chakravarty and David B. Solit. Clinical cancer genomic profiling. Nat Rev Genet. 2021 Aug;22(8):483-501. doi: 10.1038/s41576-021-00338-8.
5.Pieter-Jan Volders, et al. A nationwide comprehensive genomic profiling and molecular tumor board platform for patients with advanced cancer. npj Precision Oncology volume 9, Article number: 66 (2025)
6.Sewanti Limaye, et al. Usefulness of Comprehensive Genomic Profiling in Clinical Decision-Making in Oncology:A Systematic Review. Journal of Immunotherapy and Precision Oncology 2025 | Volume 8 | Issue 1 | 55


