NCCN指南 2025 | 遗传性肿瘤基因检测方案与风险管理
- boke
- 2025-10-31
- 5:59 下午
在临床工作中,经常遇到有些家属因为家族中有人患乳腺癌而担心自己会不会也患癌,并且经常询问是否有必要进行相应的基因检测:测不测?测什么?有什么意义?这是目前遗传筛查中受检者比较关注的几个问题。
对于这些问题,我们系统整理了美国国家综合癌症网络(NCCN)发布的《遗传性/家族性高风险评估-结直肠癌、子宫内膜癌、胃癌-Version 1.2025》以及《遗传性/家族性高风险评估-乳腺癌、卵巢癌、胰腺癌、前列腺癌-Version 2.2026》中基因检测相关内容,仅供参考。
概要
生殖细胞系检测通过明确胚系致病性 / 可能致病性(P/LP)变异,为遗传性肿瘤的病因诊断、风险分层、精准干预及家族防控提供关键依据。
多基因检测(MGPT)作为主流技术策略,可高效覆盖多癌种相关基因,其应用需结合临床需求与证据支撑,平衡检测价值与风险。
遗传筛查中生殖细胞系检测的临床意义
1
明确遗传病因,界定家族风险
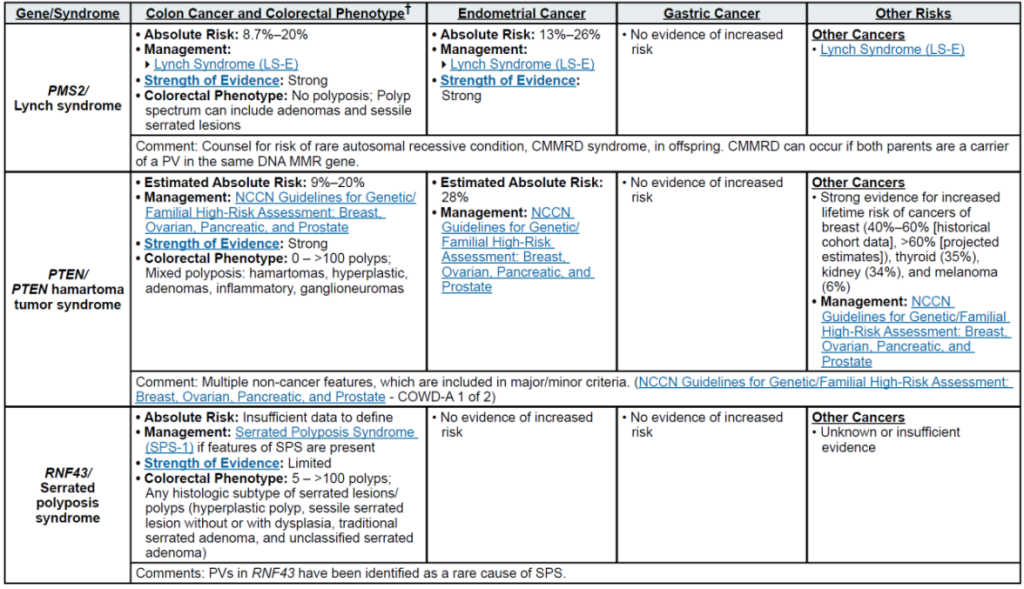
通过检测区分 “遗传性” 与 “散发性” 肿瘤:例如,结直肠癌患者检出 MLH1/PMS2 胚系变异可确诊林奇综合征(LS),其一级亲属结直肠癌风险较普通人群升高 8-10 倍;而体细胞 STK11 变异提示散发病例,无需延伸家族筛查。
同时可明确遗传模式,如 BRCA1/2(常染色体显性)、MUTYH 双等位基因(常染色体隐性),精准锁定家族高风险人群,避免过度或不足干预。
2
优化个体化筛查方案
不同基因变异的癌种特异性风险与发病年龄差异显著,检测结果指导 “量体裁衣” 式筛查:
CDH1 变异(遗传性弥漫型胃癌,HDGC):男性 80 岁前胃癌累积风险 37.2%-42%,需 30 岁起每年胃镜监测;
BRCA1/2 变异(乳腺癌 / 卵巢癌):女性 25-29 岁起每年乳腺 MRI,35-40 岁(BRCA1)/40-45 岁(BRCA2)评估风险降低性双侧输卵管卵巢切除术(RRSO);
APC 变异(家族性腺瘤性息肉病,FAP):10-15 岁起每年结肠镜,腺瘤无法内镜管理时行结肠切除术。
3
指导治疗与风险降低干预
部分基因变异直接关联治疗方案选择与预防性干预:
BRCA1/2/PALB2 变异:乳腺癌 / 卵巢癌患者可使用 PARP 抑制剂(奥拉帕利、他拉唑帕利);
LS 患者:每日服用 600mg 阿司匹林(至少 2 年)可降低 35% 结直肠癌风险;
FAP 患者:因结直肠癌终生风险近 100%,需在腺瘤负荷超标时行直肠结肠切除术 + 回肠储袋 – 肛管吻合术(PC/IPAA)。
4
推动家族级联检测,阻断疾病传递
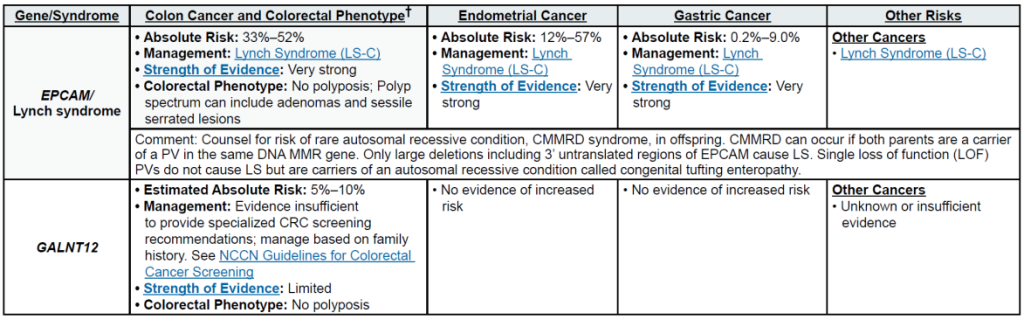
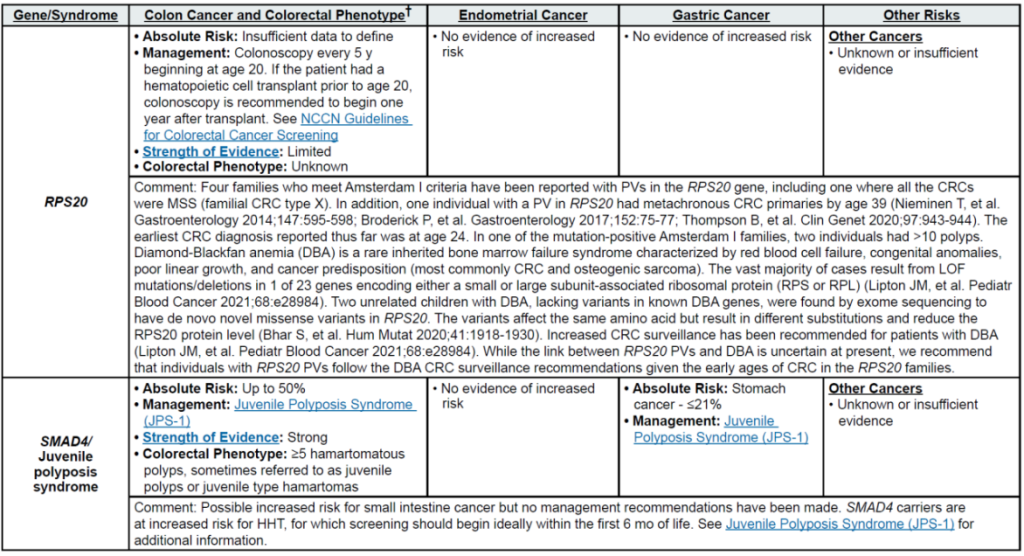
明确家族特异性 P/LP 变异后,可对亲属开展级联检测:例如,LS 家族中 MLH1 变异携带者的一级亲属检测阳性率约 50%,阳性者启动 LS 专属筛查(20-25 岁起每 1-2 年结肠镜),阴性者按普通人群管理;SMAD4 变异(幼年性息肉病综合征,JPS)携带者需在出生后 6 个月内筛查遗传性出血性毛细血管扩张症(HHT),避免严重血管并发症。
肿瘤确诊患者的肿瘤检测与生殖细胞系检测的协同作用
临床应用中,对于确诊的肿瘤患者,肿瘤检测与生殖细胞系检测二者协同遵循 “肿瘤初筛→生殖系确诊→双结果指导干预” 路径。
肿瘤检测针对肿瘤组织样本,核心作用是:
遗传易感初筛:结直肠癌患者先做肿瘤 IHC(MLH1、MSH2、MSH6、PMS2)+MSI 检测,若 IHC 提示蛋白缺失或 MSI-H→提示 LS 可能,再进一步行生殖系检测;乳腺癌患者先做肿瘤体细胞 BRCA1/2 检测,阳性者(提示胚系变异率 30%-50%)需生殖系验证;
区分胚系与体细胞变异:肿瘤组织检出 BRCA2 变异时,需生殖系检测确认 —— 若生殖系阳性→遗传风险(需家族管理),若阴性→仅指导个体 PARP 抑制剂治疗;
补充罕见变异线索:肿瘤 MSI-H 但生殖系核心基因(MLH1/MSH2 等)阴性时,提示可能存在 RPS20 等罕见变异,为超范围检测提供依据。
双检测协同的临床路径(核心癌种实践)。
MGPT 策略的应用实践
MGPT 通过下一代测序(NGS)一次性检测多个癌症相关基因,是应对遗传性肿瘤遗传异质性的核心工具,其应用需严格遵循临床需求导向。
1
MGPT 的核心优势
高效性:同时覆盖高 / 中 / 低外显率基因,适用于家族史复杂(如同时存在乳腺癌与结直肠癌)或单基因检测阴性但高度怀疑遗传易感的人群。例如,疑似 LS 患者行 MGPT(含 MLH1、MSH2、MSH6、PMS2、EPCAM),检出率较单基因检测提升 37%,可避免遗漏 EPCAM 缺失等罕见变异;
成本效益:针对 LS、FAP 等疾病,MGPT 与肿瘤 IHC/MSI 检测的成本比约 1:1.5,但可同时评估多癌种风险(如 BRCA2 变异同时提示乳腺癌、卵巢癌、胰腺癌风险),长期降低家族整体医疗支出;
临床可行动性:可发现意外 P/LP 变异(如检测 LS 时同时检出 TP53 变异,提示李 – 弗劳门尼综合征(LFS)),及时调整管理方案(如 LFS 需加做全身 MRI 监测)。
2
MGPT 的适用与禁忌场景
适用场景
个人 / 家族史提示多种遗传易感(如同时患乳腺癌与结直肠癌); 单基因检测阴性但符合遗传性肿瘤临床标准(如佩 – 杰综合征(PJS)临床诊断阳性但 STK11 测序阴性); 需同时评估多癌种风险(如 BRCA1/2 变异者需同步评估卵巢癌、胰腺癌风险); 少数族裔人群(需覆盖 Founder 突变,如德系犹太人的 APC I1307K、BRCA1/2 特定 founder 突变)
禁忌场景
家族中已知明确单基因 P/LP 变异(如典型 FAP 的 APC 截短变异,优先单基因检测) 家族史明确指向某一综合征(如仅结直肠息肉病,无其他癌种史) 无临床指征的 “泛癌种” 检测(如健康人群盲目检测低外显率基因) 样本质量不足(如化疗后血液样本易出现体细胞污染)
3
MGPT 的挑战与应对策略
意义未明变异(VUS)高发:结直肠癌患者 MGPT 中 VUS 检出率 29%-63%,非裔、西班牙裔等少数族裔因参考数据库不足,VUS 率达 27.8%-32.1%。应对:检测前需明确告知 VUS 局限性,每 3-5 年联系实验室更新解读,避免基于 VUS 调整临床管理;
中等外显率基因证据矛盾:如 CHEK2、ATM 等基因,部分研究显示 CHEK2 变异升高结直肠癌风险,部分研究提示无差异。应对:结合家族史个体化评估,如 CHEK2 1100delC 变异者若一级亲属有结直肠癌,筛查起始年龄提前至 40 岁,否则按普通人群管理;
检测质量差异:商用 MGPT 在基因覆盖范围、变异解读标准上差异显著。应对:选择 CLIA/CAP 认证实验室,优先检测包含 NCCN 推荐核心基因的面板(如结直肠癌相关 12 个核心基因、乳腺癌相关 BRCA1/2/PALB2 等),肿瘤组织检出疑似胚系变异时需用血液 / 唾液样本验证。
不同遗传性肿瘤的遗传相关基因(按疾病分类)
(一)结直肠相关遗传性综合征
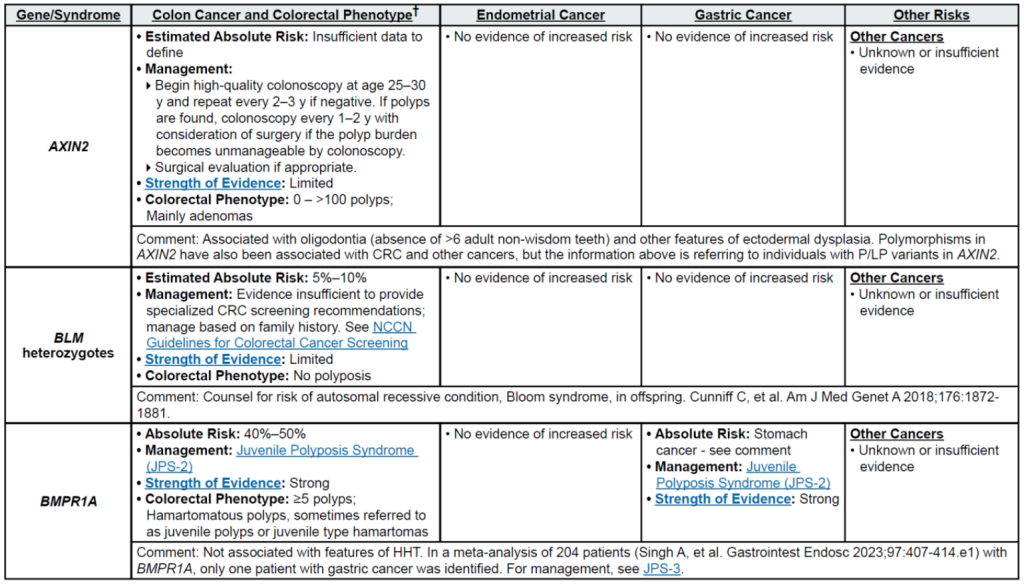
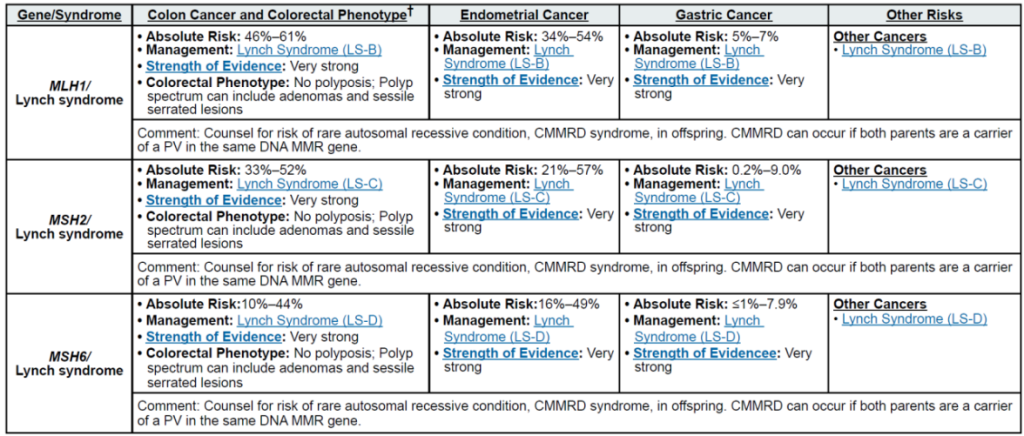
遗传相关基因
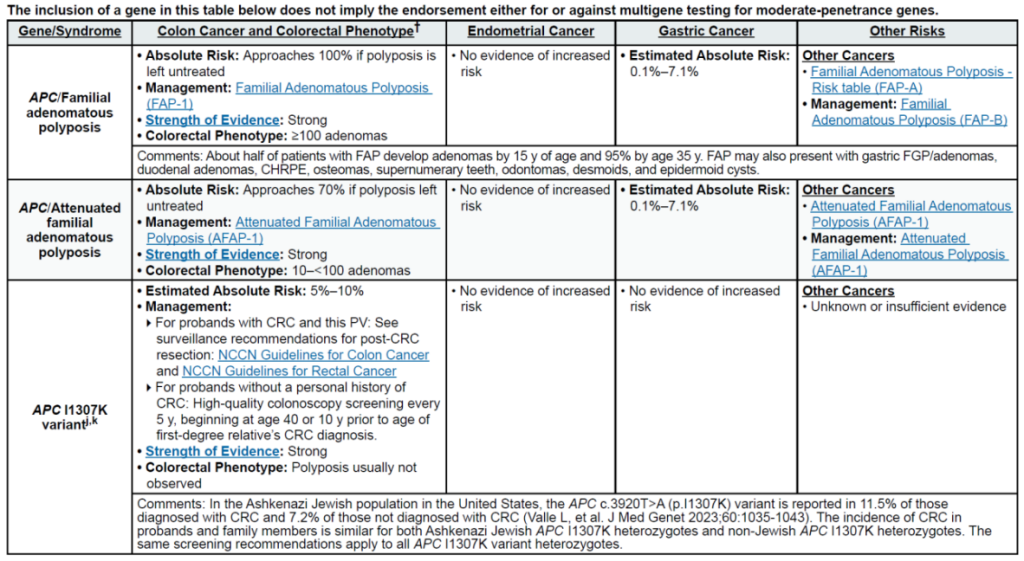
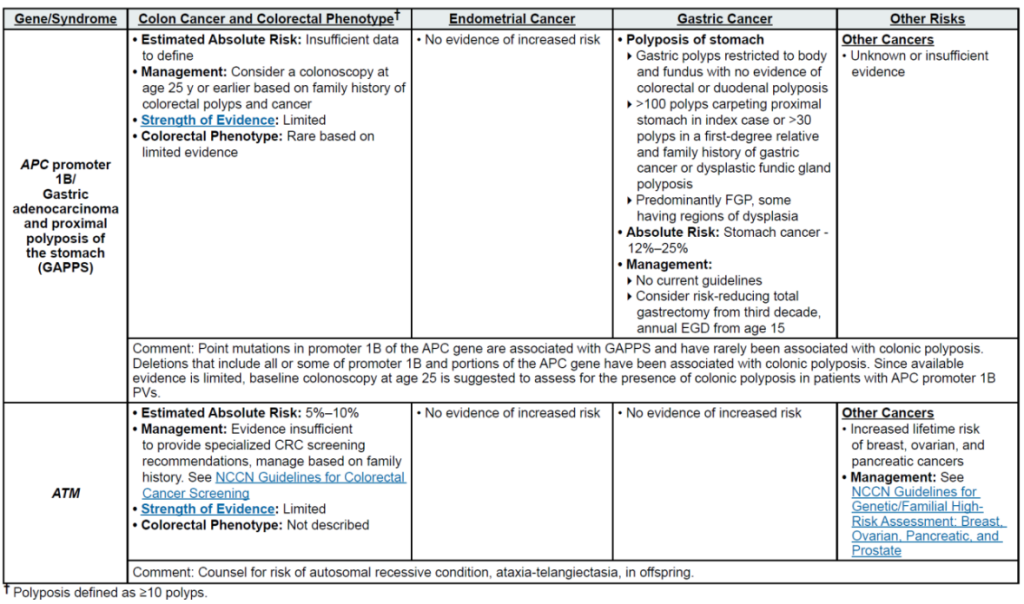
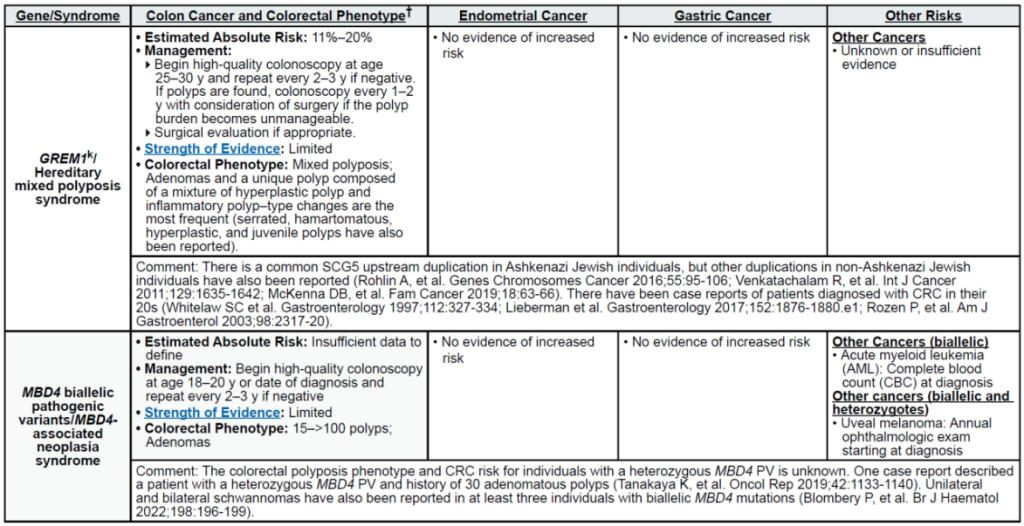
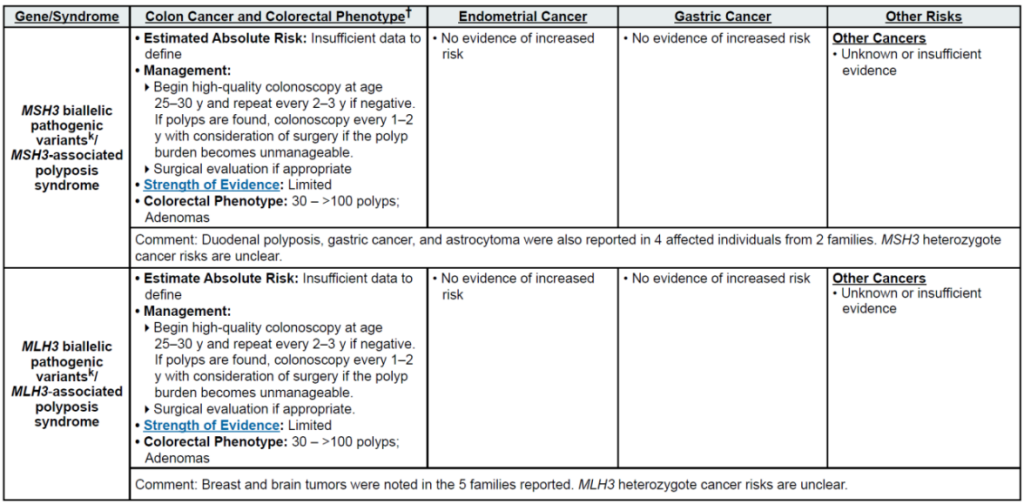
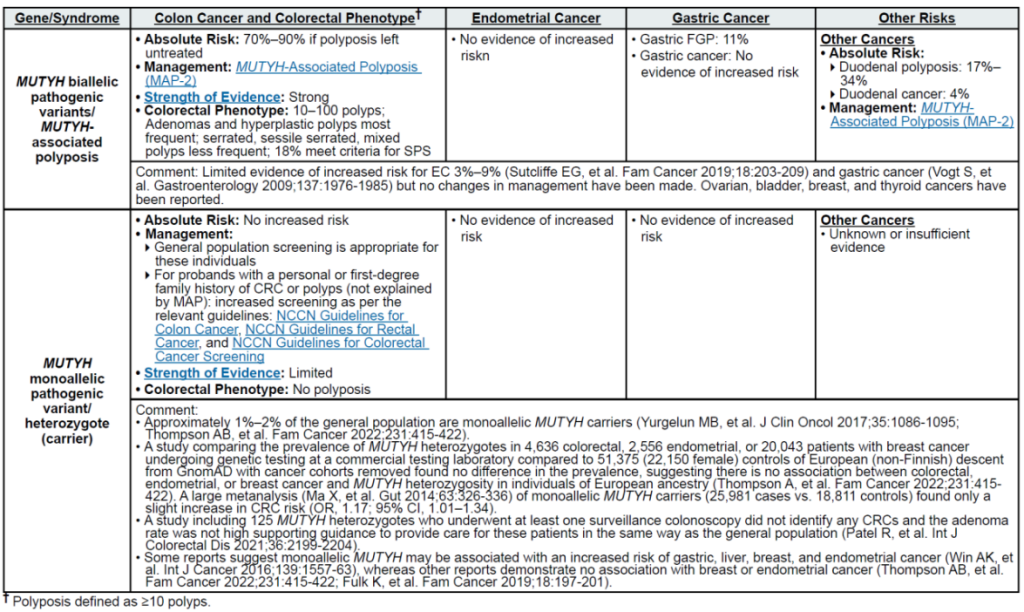
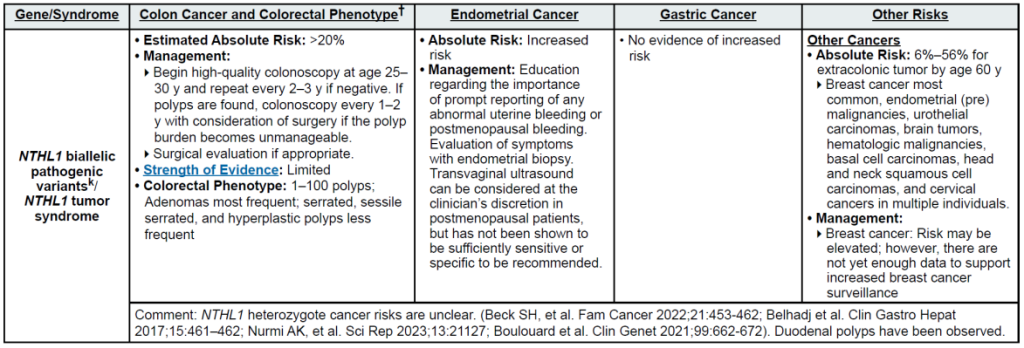
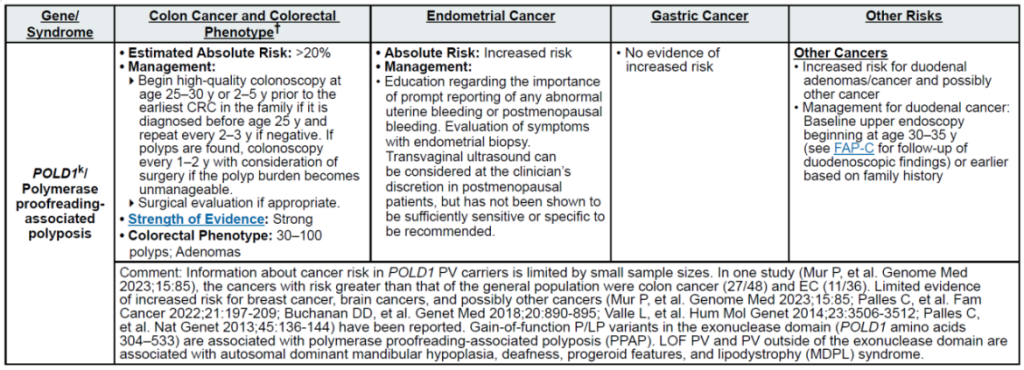
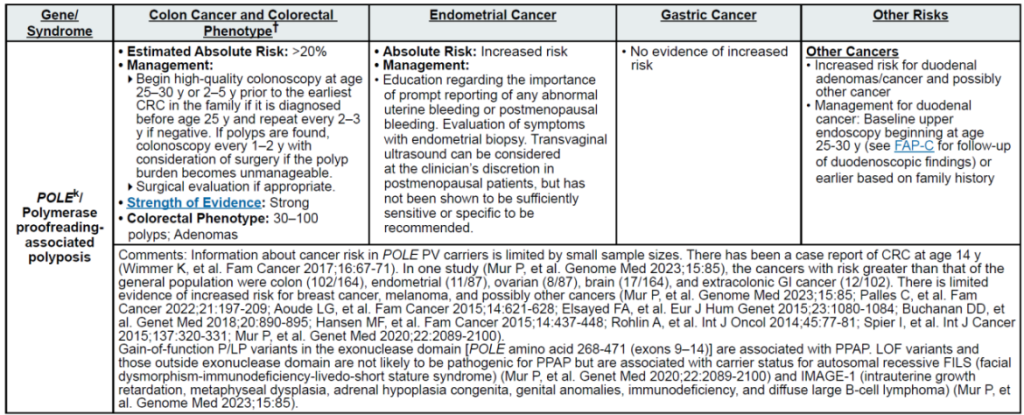
高外显率基因:MLH1、MSH2、MSH6、PMS2、EPCAM(林奇综合征,LS);APC(家族性腺瘤性息肉病 FAP、衰减型 FAP/AFAP、胃腺瘤与胃近端息肉病 GAPPS,GAPPS 特指 APC 启动子 1B 变异);STK11(佩 – 杰综合征 PJS);BMPR1A、SMAD4(幼年性息肉病综合征 JPS);MUTYH(双等位基因,MUTYH 相关息肉病 MAP);NTHL1(双等位基因,NTHL1 肿瘤综合征);POLD1、POLE(外切酶结构域变异,聚合酶校对相关息肉病 PPAP)
中 penetrance 基因:RNF43(罕见)、MUTYH(双等位基因,锯齿状息肉病综合征 SPS)
其他关联基因:无额外明确关联基因(治疗相关息肉病 TAP 无核心致病基因,由腹部盆腔放疗 + 烷化剂化疗等获得性因素导致)
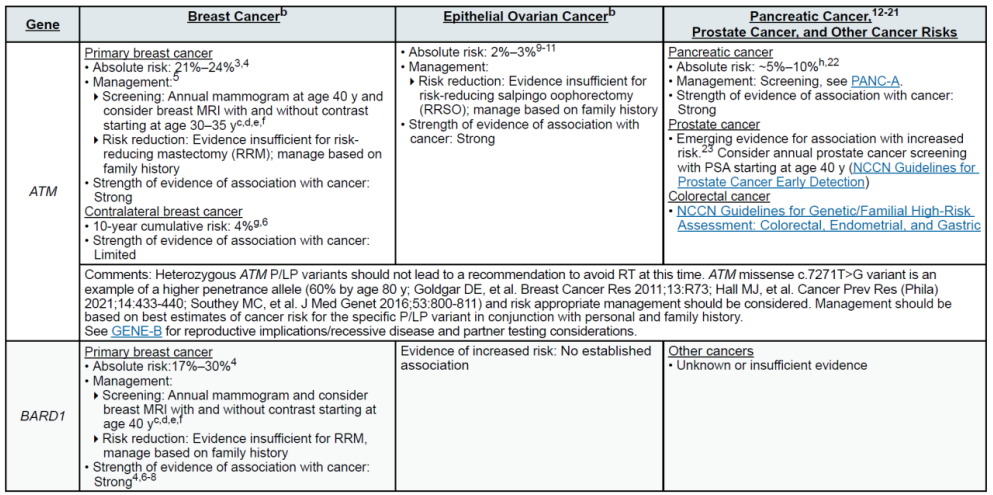
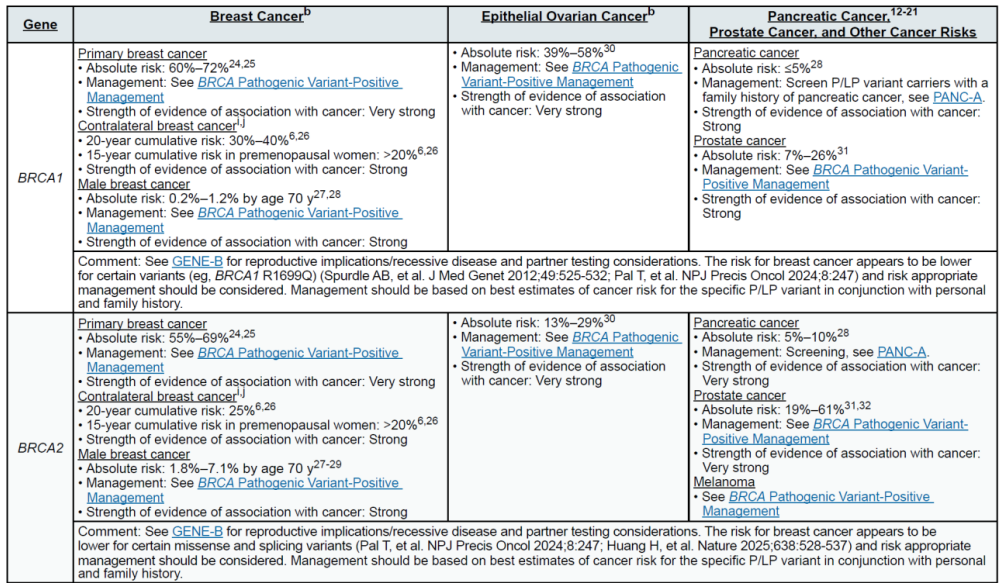
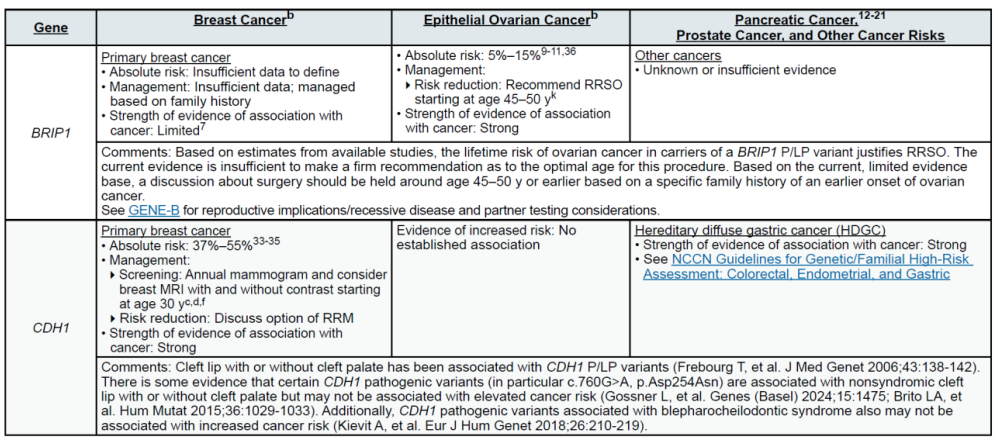
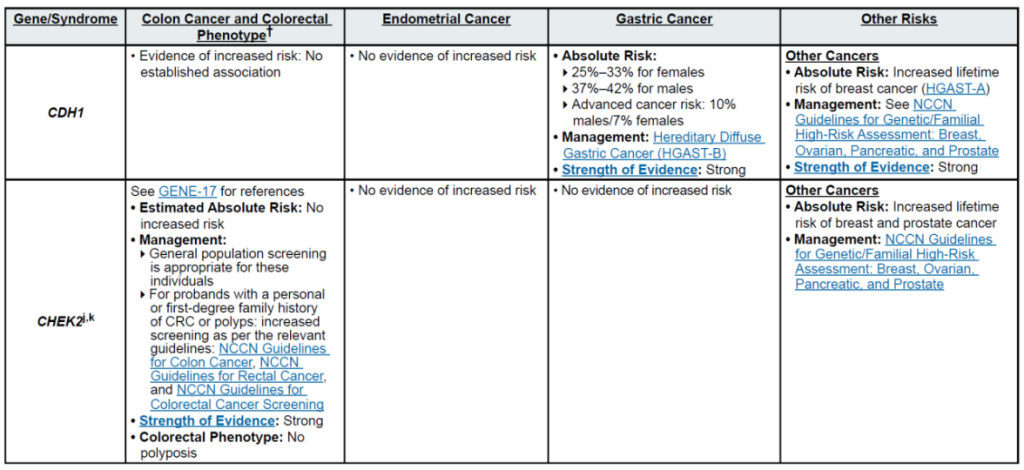
(二)乳腺癌(含男性乳腺癌)
遗传相关基因
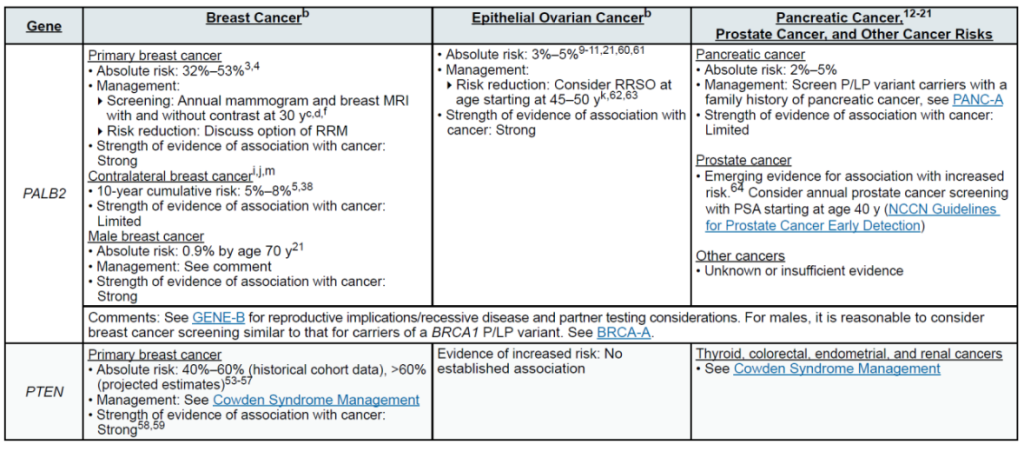
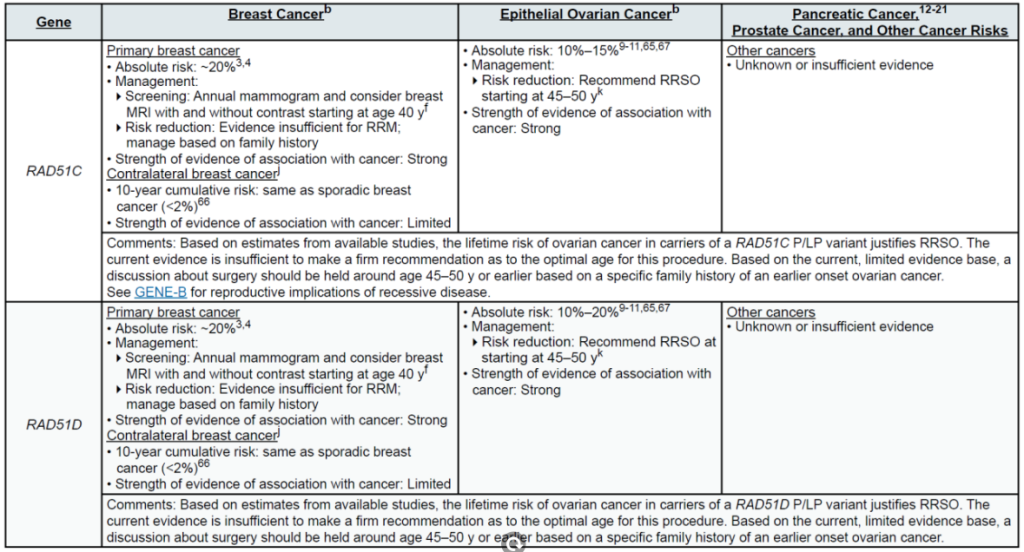
高外显率基因:BRCA1、BRCA2、CDH1、PALB2、PTEN、STK11、TP53
中 penetrance 基因:ATM、BARD1、CHEK2、NF1、RAD51C、RAD51D
其他关联基因:MLH1、MSH2、MSH6、EPCAM(林奇综合征相关,增加乳腺风险)
(三)卵巢癌(含输卵管癌、原发性腹膜癌)
遗传相关基因
高外显率基因:BRCA1、BRCA2
中 penetrance 基因:BRIP1、RAD51C、RAD51D、PALB2
其他关联基因:MLH1、MSH2、MSH6、EPCAM(林奇综合征,增加浆液性卵巢癌风险);DICER1、SMARCA4(非上皮性卵巢癌,如性索间质瘤、小细胞卵巢癌)
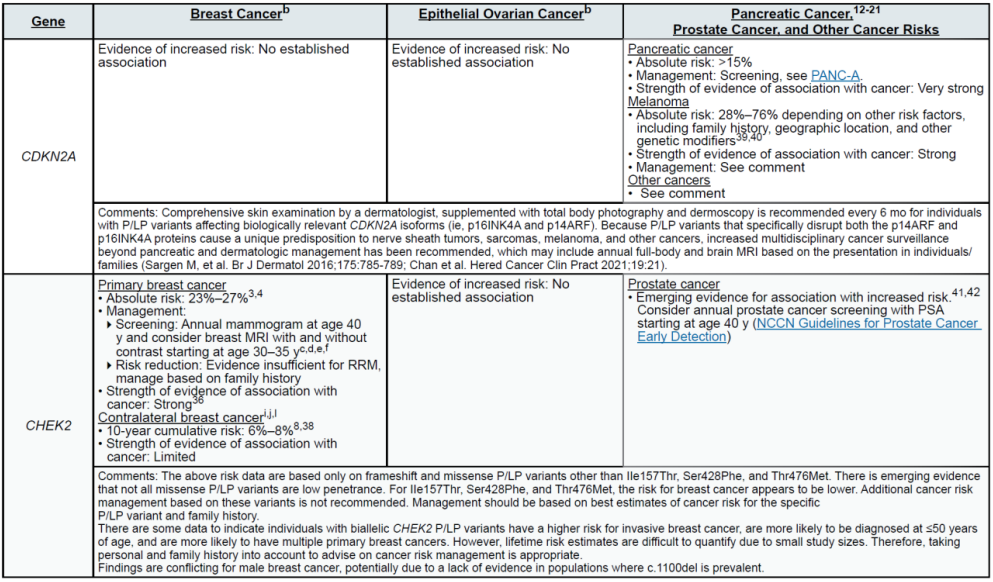
(四)胰腺癌(外分泌型为主)
遗传相关基因
高外显率基因:CDKN2A、STK11、TP53
中 penetrance 基因:ATM、BRCA2
其他关联基因:BRCA1、MLH1、MSH2、MSH6、EPCAM、PALB2(需合并家族史)
(五)前列腺癌
遗传相关基因
高外显率基因:BRCA2、HOXB13(G84E 变异为主)
中 penetrance 基因:ATM、CHEK2、PALB2
其他关联基因:BRCA1、TP53(增加侵袭性前列腺癌风险)
(六)遗传性弥漫型胃癌(HDGC)
遗传相关基因
高外显率基因:CDH1(唯一核心致病基因)
中 penetrance 基因:无
其他关联基因:无(CDH1 变异同时增加女性小叶型乳腺癌风险,需同步参考乳腺癌管理)
(七)Li-Fraumeni 综合征(LFS)相关肿瘤
遗传相关基因
高外显率基因:TP53(胚系 P/LP 变异,唯一核心基因)
中 penetrance 基因:无
其他关联基因:无(关联肿瘤含软组织肉瘤、骨肉瘤、早发乳腺癌、肾上腺皮质癌、结直肠癌、胃癌等)
(八)Cowden 综合征(PTEN 错构瘤肿瘤综合征,PHTS)
遗传相关基因
高外显率基因:PTEN(胚系 P/LP 变异,唯一核心基因) 中 penetrance 基因:无 其他关联基因:无(关联肿瘤含乳腺癌、甲状腺癌、子宫内膜癌、结直肠癌、肾癌)
(九)其他罕见遗传性综合征
遗传相关基因
高外显率基因:APC(启动子 1B 变异,胃腺瘤与胃近端息肉病 GAPPS);WNK2(罕见,锯齿状息肉病综合征 SPS)
中 penetrance 基因:无
其他关联基因:RPS20(新兴基因,关联遗传性非息肉病性结直肠癌与 Diamond-Blackfan 贫血;证据有限,暂归为其他关联基因)
超范围检测的临床原则
超范围检测指超出 “疾病特异性核心基因” 的检测(如 LS 检测中加入 RPS20、FOCAD 等新兴基因),需严格遵循 “临床需求导向、证据支撑、风险可控” 原则,避免盲目扩大检测范围。
(一)超范围检测的前提条件
1.专业遗传咨询前置
所有超范围检测需由遗传咨询师或临床遗传医师完成术前咨询,明确:①检测目的(如排查罕见综合征、评估多癌种风险);②检测局限性(如新兴基因无明确管理指南);③结果解读与后续路径(如 VUS 或低外显率基因变异的处理)。
2.样本与实验室规范
样本选择:优先使用血液 / 唾液样本,造血干细胞移植后或血液肿瘤患者需用成纤维细胞培养样本,避免体细胞污染导致假阳性;
实验室资质:必须选择 CLIA/CAP 认证实验室,超范围检测需包含 “胚系 vs 体细胞变异鉴别” 模块;
变异解读:需遵循 ACMG/AMP 指南,超范围基因的 P/LP 变异需有至少 2 项独立证据支持(如家系共分离、功能实验验证)。
(二)超范围检测的核心原则
1.临床可行动性优先
仅纳入有明确 NCCN 指南管理建议的基因,排除 “无干预价值” 的基因:例如,可超范围检测 RNF43(SPS 罕见病因,有结肠镜监测指南),但不建议检测 FOCAD(无充分结直肠癌风险证据,无筛查建议)。对中等外显率基因(如 ATM),需结合家族史制定方案(如 ATM 变异者若一级亲属有胰腺癌,50 岁起行 EUS 筛查)。
2.证据等级导向
根据 NCCN 证据强度分级选择超范围基因:
优先检测:证据 “强” 或 “极强”(如 GAPPS 的 APC 启动子 1B 变异,基于人群队列研究);
谨慎检测:证据 “有限”(如 RPS20,仅个案报道),需告知 “结果仅供参考,不改变现有筛查方案”;
避免检测:无证据支持的 “泛癌种基因”,防止过度医疗。
3.特殊人群针对性调整
种族特异性:德系犹太人超范围检测需包含 APC I1307K(结直肠癌风险升高 2.17 倍)、GREM1(遗传性混合息肉病综合征);东亚裔 FAP 患者需加测胃相关基因(胃癌风险 7.1%,高于非亚裔);
儿童患者:超范围检测需聚焦儿童高发风险(如 FAP 的肝母细胞瘤监测相关基因、LFS 的 TP53),避免检测成人主导癌种基因(如前列腺癌相关 HOXB13)。
4.排除明确单基因综合征
若家族史或临床表型明确指向某一综合征,需优先单基因检测。
遗传性肿瘤的风险管理要点
风险管理需贯穿 “筛查 – 干预 – 随访 – 家族防控” 全流程,核心是基于基因变异类型、癌种风险与个体情况,制定 “精准化、动态化” 方案。
(一)个体化筛查策略(分癌种 / 基因)
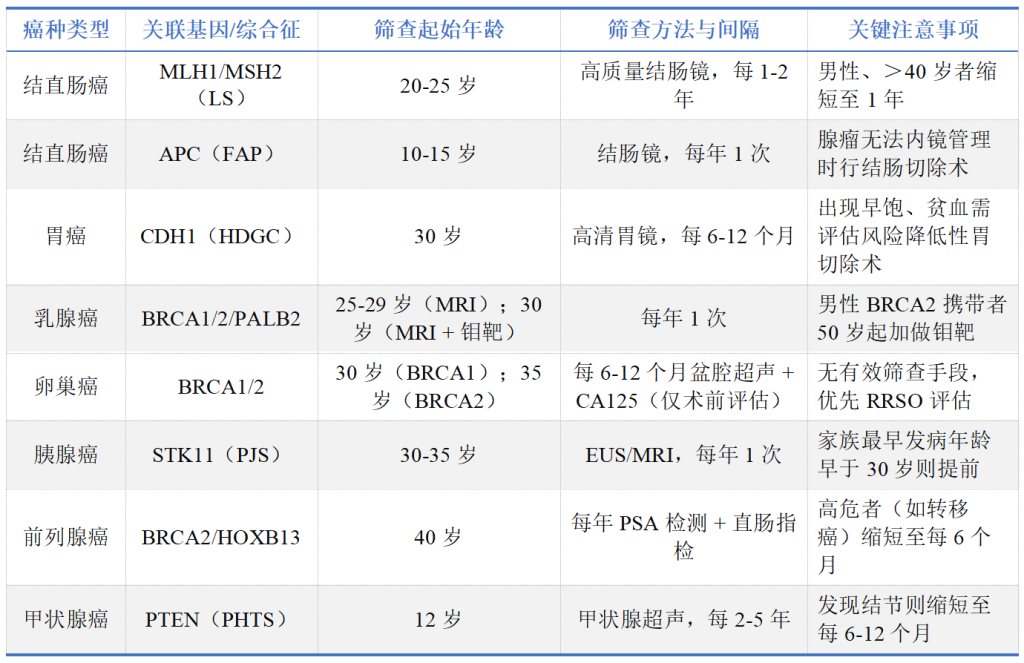
(二)风险降低干预措施
1.手术干预(严格指征):需经多学科团队(遗传学、外科、内镜科)评估,平衡风险与获益。
2.化学预防(循证选择)
3.生活方式干预(基础保障)
戒烟限酒:PJS(肺癌风险升高)、LS(结直肠癌风险)患者严格戒烟;
饮食调整:LS 患者避免加工红肉,FAP 患者减少高糖饮食;
体重管理:BRCA1/2 携带者控制 BMI<25,降低乳腺癌风险(肥胖者风险升高 1.3 倍)。
(三)家族成员管理(级联检测与分层)
1.已知家族变异者
一级亲属:在 “筛查起始年龄前 5 年” 行基因检测(如 LS 家族 MLH1 变异,亲属 20 岁起检测),阳性者启动对应筛查,阴性者按普通人群管理;
远亲:若一级亲属未检测或拒绝检测,需向二级亲属提供检测(如 LS 家族中,二级亲属 40 岁起行结肠镜)。
2.双等位基因变异携带者
如 MUTYH、NTHL1 双等位基因变异(常染色体隐性),需告知 “后代遗传风险 25%”,建议配偶行基因检测:若配偶为携带者,后代需在儿童期启动筛查(如 NTHL1 后代 18 岁起行结肠镜);若配偶非携带者,后代无需特殊管理。
(四)动态随访与多学科协作(MDT)
1.随访动态调整
息肉 / 病变负荷:SPS 患者切除≥10mm 息肉后,复查间隔缩短至 1 年;FAP 患者十二指肠 Spigelman Ⅳ 期,每 3-6 个月行胃镜;
治疗后调整:LFS 患者放疗后 5 年起,启动放疗部位二次肿瘤筛查;治疗相关息肉病(TAP)患者放疗后 3 年起行结肠镜。
2.MDT 协作场景
复杂病例:胰腺癌 / 十二指肠癌筛查、FAP 十二指肠手术需在高容量中心,由遗传学、内镜科、外科、影像科共同决策;
儿童患者:PJS 儿童小肠息肉内镜干预、FAP 儿童肝母细胞瘤监测,需儿科与成人科室协同。
(五)特殊人群管理(儿童、癌症幸存者)
1.儿童患者
高发风险监测:FAP 患儿 5 岁前每 3-6 个月腹部超声 + AFP(筛查肝母细胞瘤);PJS 患儿 8-10 岁起行胃肠镜 + 小肠显像;
辐射防护:LFS 患儿全身肿瘤监测用 MRI,避免 PET-CT 辐射暴露。
2.癌症幸存者
LFS 患者:避免不必要放疗(二次肿瘤风险升高 2.9 倍),优先手术 / 化疗;
BRCA1/2 变异者:乳腺癌术后需继续监测卵巢癌(RRSO 前)、胰腺癌(50 岁起);
TAP 患者:放疗后终身监测结直肠,规范筛查者结直肠癌发生率仅 3%(未筛查者 18%)。
附录:基于基因检测结果的癌症风险管理