促衰老与抗衰老基因介绍(七)| LMNA基因及其变异相关疾病的研究进展
- boke
- 2025-10-24
- 5:40 下午
LMNA 基因不仅在调控细胞衰老过程中发挥核心作用,其变异还与心血管疾病、代谢疾病、肌肉疾病等多系统疾病的发生发展密切相关,是引发 “核纤层蛋白病(laminopathies)” 的关键致病基因。
1. 概述
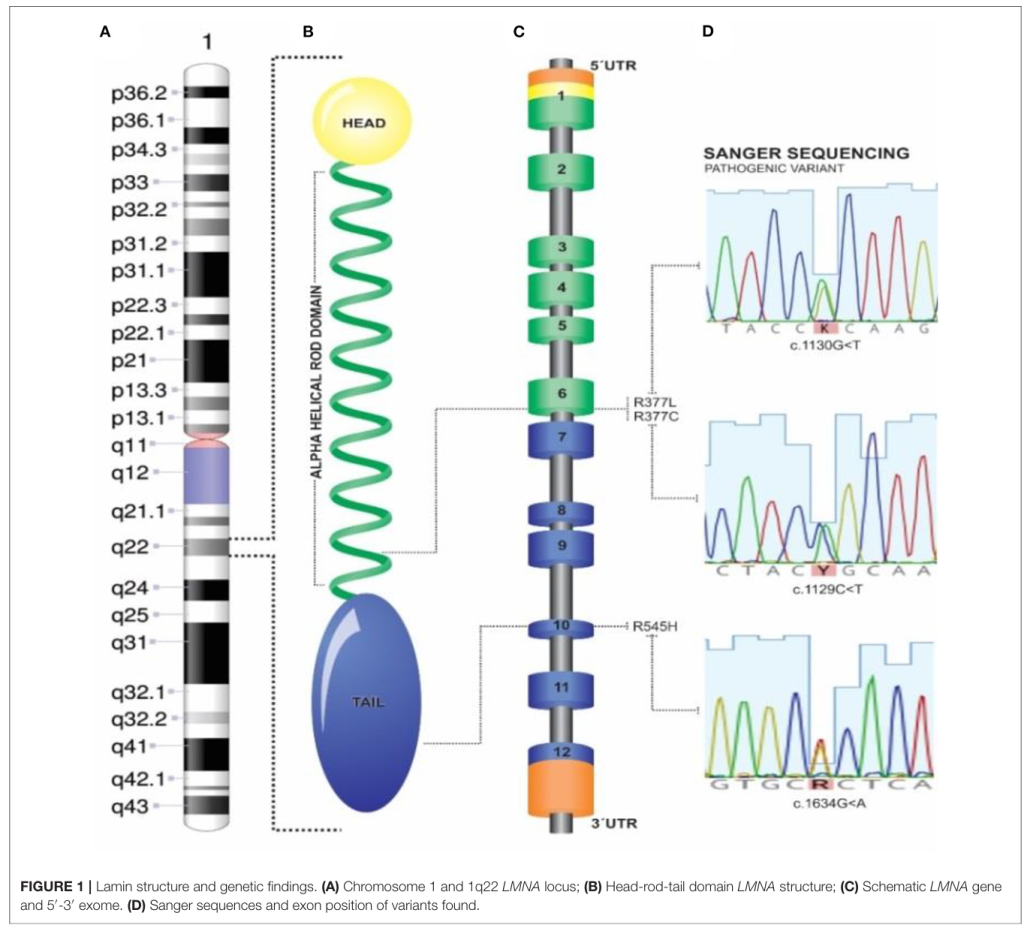
Lamin structure and genetic findings.
2. LMNA 基因与 lamin A/C 的生物学功能
LMNA 基因编码的 lamin A/C 共享 N 端头部结构域、中央杆状结构域(rod domain),仅 C 端尾部结构域存在差异(lamin A 含法尼基化位点,lamin C 缺失该区域),其核心功能贯穿细胞核结构维持、基因组调控及细胞衰老进程 [13,18]。
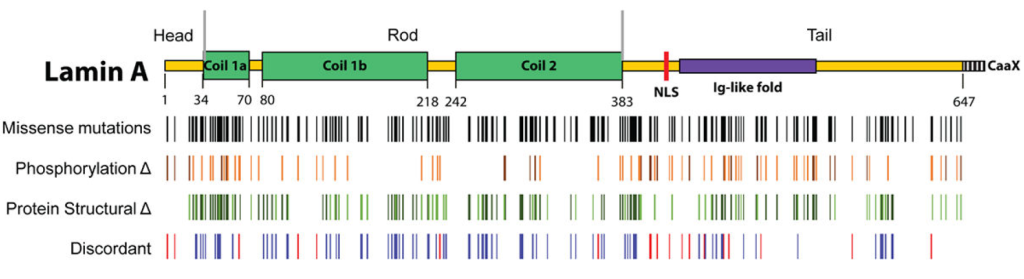
Map depicting LMNA missense mutations, predicted phosphorylation changes, predicted protein structural changes along the lamin A protein backbone.
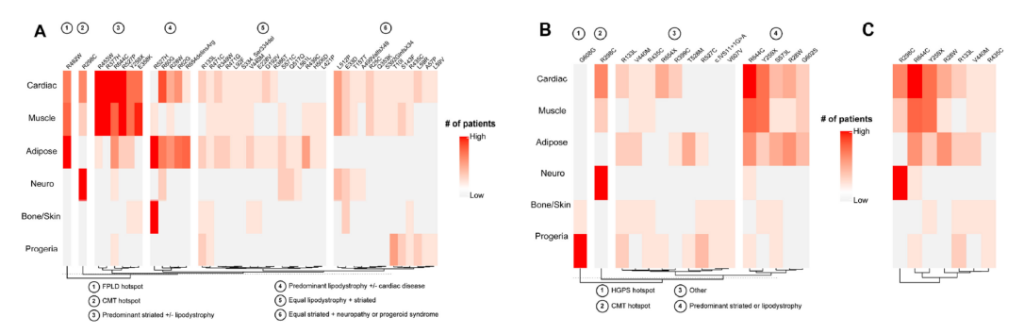
LMNA mutations can be pleiotropic, sometimes causing overlapping phenotypes, disparate individual phenotypes, or both.
2.1 维持细胞核结构与机械稳定性
Lamin A/C 通过杆状结构域的同源二聚化与多聚化形成纤维网络,附着于内核膜内侧,为细胞核提供机械支撑并抵抗外界应力 [13,21]。
研究证实,LMNA 变异(如 R189Q、E317K)会破坏纤维聚合,导致核形态异常(核突起、蜂窝状结构)、核膜脆弱,进而引发心肌细胞、肌细胞等机械敏感细胞的功能障碍,这是横纹肌病变(如扩张型心肌病、肌营养不良)的核心致病基础之一 [21]。
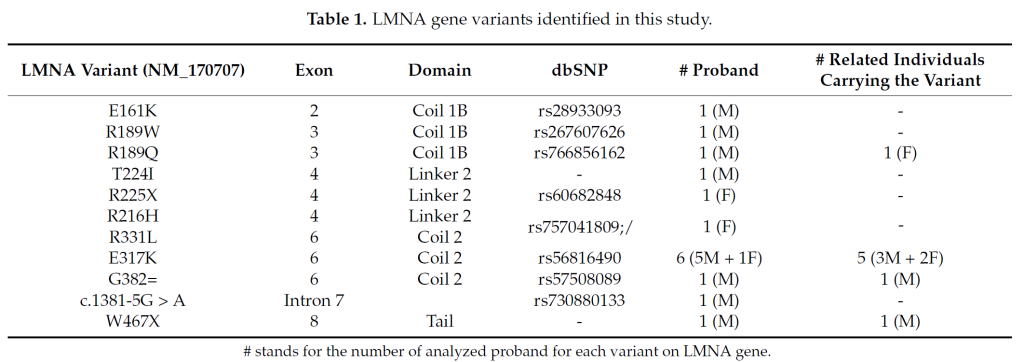
LMNA gene variants identified in this study
2.2 调控基因组功能与细胞信号通路
Lamin A/C 可作为 “染色质组织者”,通过与核纤层相关蛋白(如 emerin、BANF1)及转录因子(如 PPARγ)相互作用,调控 DNA 复制、转录及染色质沉默 [13,24]。例如,正常状态下 lamin A 可结合脂代谢相关基因启动子以维持脂肪细胞分化,而家族性部分脂肪营养不良(FPLD)相关的 LMNA R482W 突变会干扰该结合,导致脂肪组织分化障碍,引发皮下脂肪丢失与代谢异常 [1,13]。此外,lamin A/C 还参与 DNA 损伤修复通路,其功能异常会激活 p38、ERK 等应激激酶,加速细胞衰老 [14,18]。
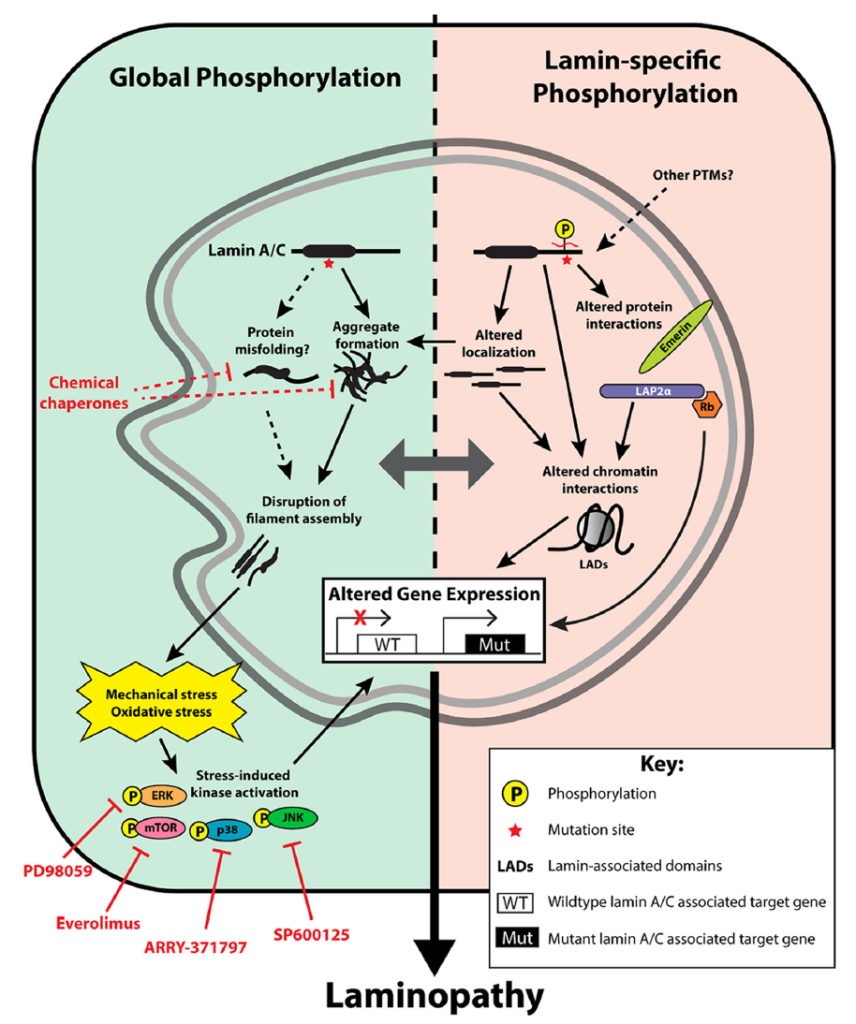
Proposed phosphorylation-related laminopathy disease mechanisms.
2.3 参与细胞分化与衰老过程
Lamin A/C 的表达具有 “发育依赖性”—— 胚胎干细胞中低表达,细胞分化后显著上调,是细胞成熟的标志 [18];正常衰老过程中,低水平 “早老蛋白(progerin,LMNA 异常剪接产物)” 会缓慢积累并破坏核功能,而 LMNA G608G 等突变会导致早老蛋白大量产生,引发早老综合征(HGPS),患者表现为加速衰老、动脉粥样硬化,寿命通常不超过 15 岁 [18]。同时,表型衰老(如 65-75 岁无法完成爬楼梯)与 LMNA 等衰老相关基因的高有害性外显子变异(CADD>15)密切相关,进一步证实 LMNA 在衰老调控中的核心地位 [14]。
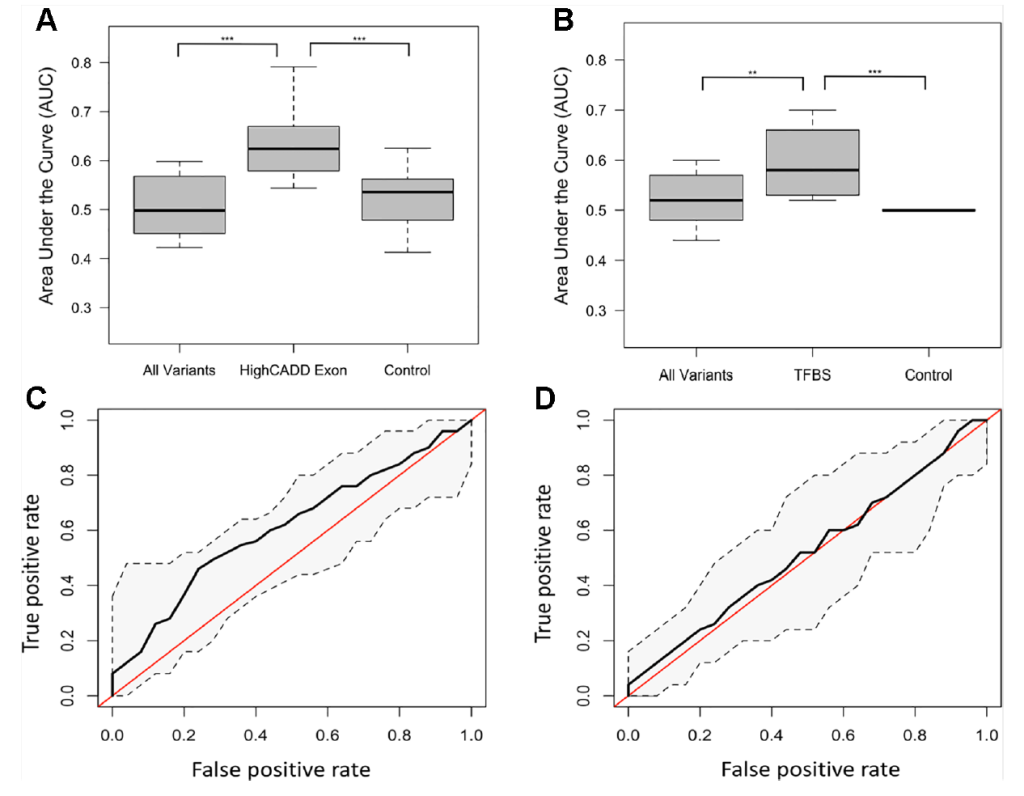
Different subsets of variants defined as top predictive models using random forest and support vector machine (SVM) learning methods.
3. LMNA 变异的分类及与疾病的关联
LMNA 变异类型涵盖错义突变、无义突变、移码突变、剪接位点突变及启动子区多态性,不同变异的位置、类型与疾病表型高度关联,可分为五大疾病谱系,各谱系的核心特征及研究证据如下:
3.1 心血管系统疾病
心血管疾病是 LMNA 变异最常见且致死性最高的表型,以扩张型心肌病(DCM)、心律失常及传导障碍为核心,部分还涉及动脉僵硬度异常与先天性心脏病(CHD)[6,7,9,21,22]:
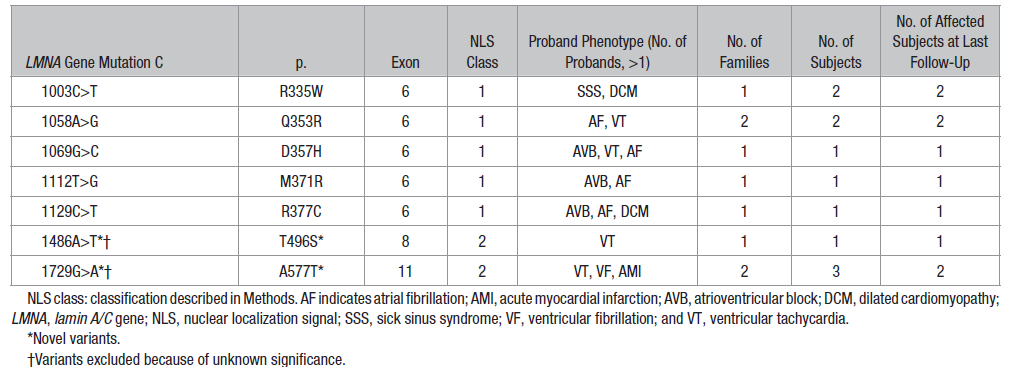
扩张型心肌病(DCM):LMNA 突变占家族性 DCM 的 10%,是单基因 DCM 的主要病因 [6,21]。变异类型对疾病严重程度影响显著 —— 截断变异(无义、移码、剪接突变)比错义变异致病性更强:携带截断变异的患者左心室射血分数(LVEF)降低的发生率(45.5%)显著高于错义变异患者,且发病年龄更早(中位数 10 岁 vs 18 岁,P<0.001)[8,9];热点突变 R644C 甚至可引发 “多器官受累型 DCM”,同时合并脂肪营养不良与神经病变 [3]。
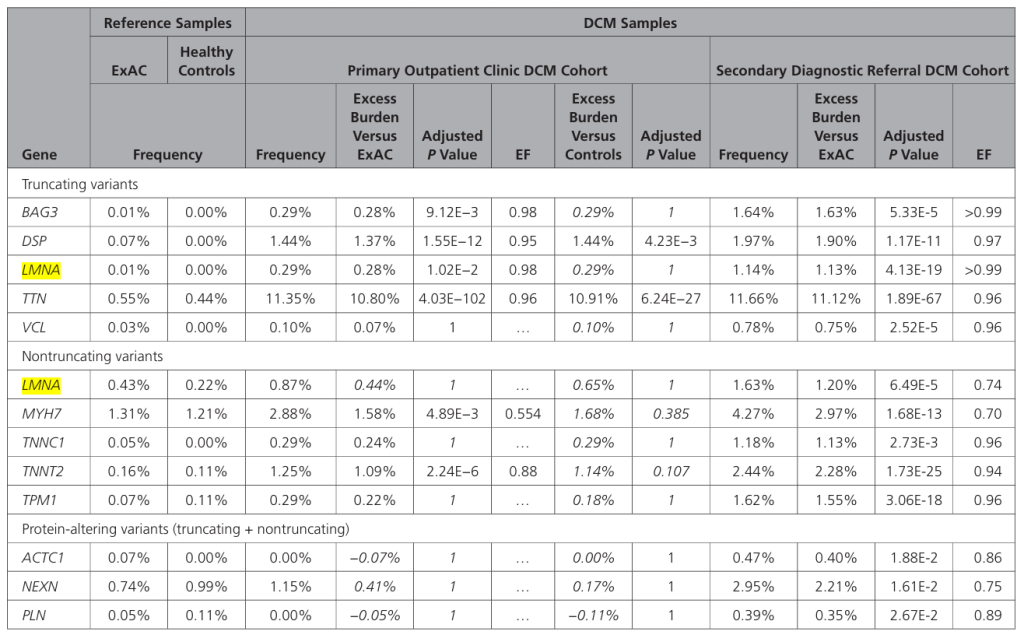
Genes With Significant Rare Variant Enrichment in DCM
The clinical features in patients with LMNA- related muscular dystrophy.
心律失常与传导障碍:44.5% 的 LMNA 相关心肌病患者以室性心律失常(VA)起病,22.2% 以房室传导阻滞(AVB)起病,61.1% 在随访中出现复发性 VA,66.6% 需植入埋藏式心脏转复除颤器(ICD),且 66.6% 的 ICD 植入者接受过有效电击治疗 [21]。值得注意的是,即使在 “孤立性心房颤动(lone AF)” 患者中(无基础心脏结构异常、高血压等),也存在 0.67% 的罕见 LMNA 变异携带率,提示 AF 可能是 LMNA 变异的早期 “孤立表型”,需通过基因检测识别 [2]。
动脉僵硬度与先天性心脏病(CHD):日本人群研究显示,LMNA 启动子区 – 1030C/T 多态性与肱踝脉搏波传导速度(baPWV)升高独立相关(β=0.142,P=0.028),是动脉粥样硬化的潜在遗传标志物 [4];CHD 相关研究则发现,病例组与对照在 LMNA 基因 31 个 CpG 位点中的 17 个存在显著甲基化差异(FDR P≤0.05),左心发育不良综合征患者 3’UTR 区 cg09820673 位点甲基化水平最低,提示表观遗传调控参与 CHD 发病 [22]。
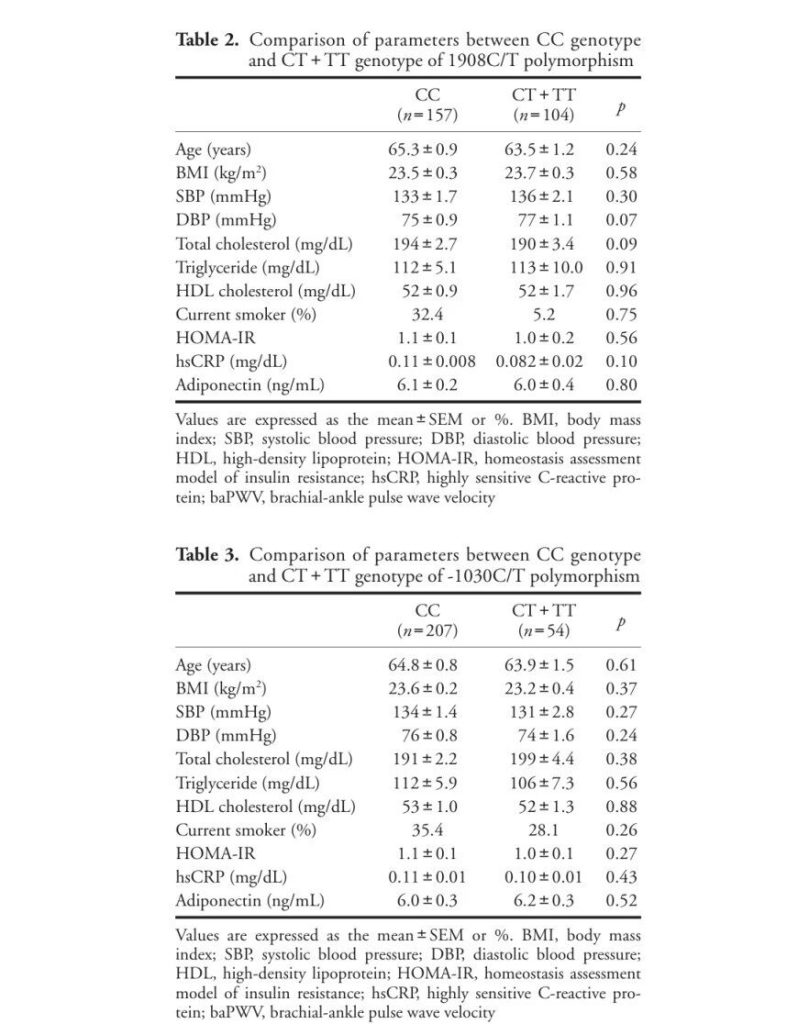
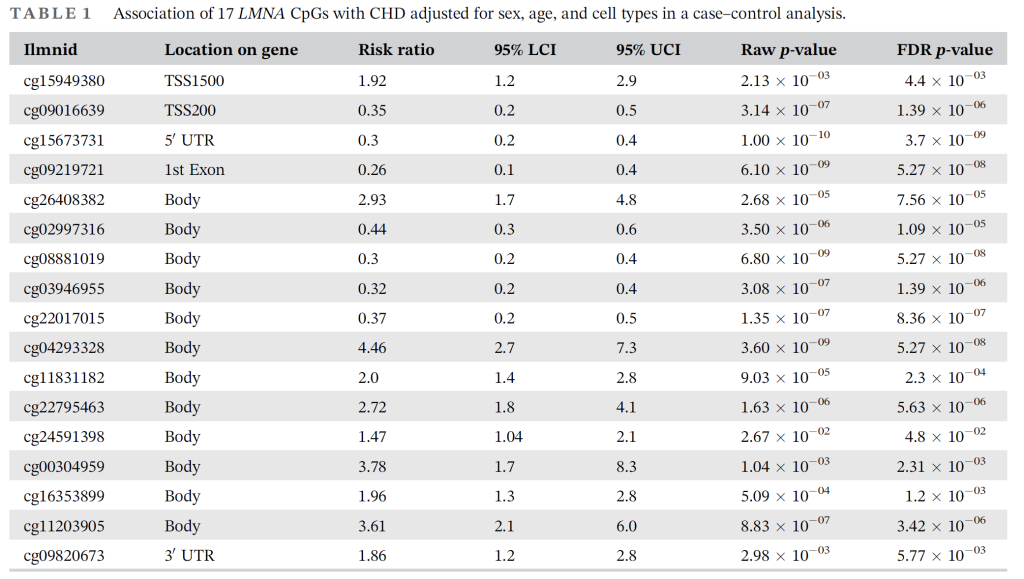
3.2 代谢系统疾病
LMNA 变异通过干扰脂肪细胞分化、胰岛素信号通路,引发脂肪营养不良、2 型糖尿病(T2D)及肥胖等代谢异常 [1,3,5,11]:
家族性部分脂肪营养不良(FPLD):巴西多中心队列研究显示,85.8% 的 FPLD 患者携带 LMNA 致病性变异(其余为 PPARG、PLIN1 等基因变异),热点突变为 R482W/Q/L [1]。患者临床特征以 “选择性脂肪丢失 + 代谢紊乱” 为主:皮下脂肪丢失、糖尿病患病率 57.5%(女性占 50.9%)、甘油三酯中位数 199 mg/dL(34.9%≥500 mg/dL,8.5% 曾发胰腺炎)、代谢相关脂肪性肝病(MAFLD)患病率 56.6%,且随访期间总死亡率 3.8%,均死于心血管事件 [1]。近年还发现 “非经典 FPLD 表型”—— 如携带 LMNA c.1745G>T(p.Arg582Leu)、c.1892G>A(p.Gly631Asp)新变异的患者,无典型皮下脂肪萎缩,但存在早发性糖尿病(32-35 岁发病)与重度高甘油三酯血症(850-920 mg/dL),其机制与脂肪组织炎症(IL-6、TNF-α 上调)及分化障碍(PPARγ、C/EBPα 下调)相关 [11]。
Number of cases and genetic data per center.
2 型糖尿病(T2D):外显子聚合联盟(ExAC)60706 人队列研究发现,LMNA p.G602S 变异与 T2D 显著相关(P=0.02,优势比 = 4.58),且该变异在非裔美国人中频率更高(等位基因频率 0.297%),是该人群 T2D 的潜在风险标志物 [3]。此外,表型组关联研究(PheWAS)显示,LMNA 突变携带者中,TCF7L2 基因常见变异(rs7903146)会进一步增加 T2D 风险(OR=2.1),提示 “LMNA 主效突变 + 常见易感变异” 的协同作用可能加重代谢异常 [10]。
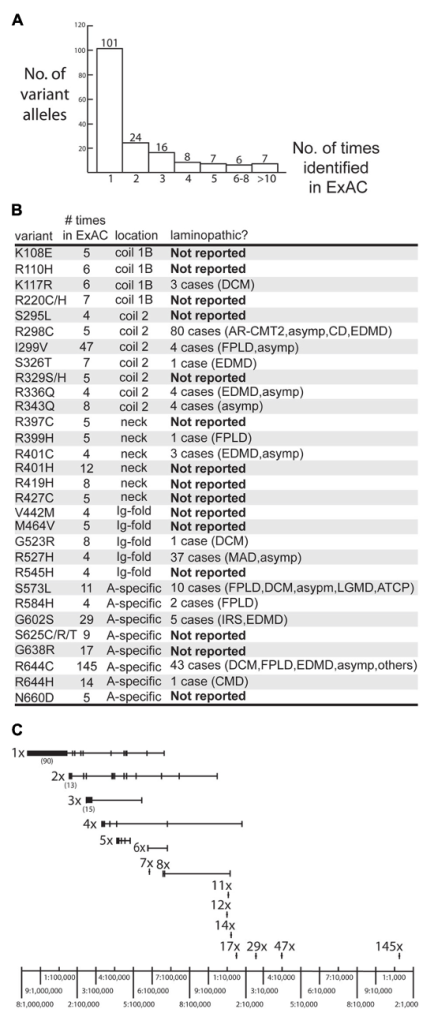
Overview of LMNA missense variants identified in the ExAC cohort
肥胖:印度北部非糖尿病亚裔人群研究显示,LMNA 1908C>T 变异的 T 等位基因与全身性肥胖显著相关 ——T/T 基因型患者发生全身性肥胖的风险是 C/C 基因型的 5.6 倍(OR=5.6,95% CI:2.5-12.2,P=0.001),携带至少一个 T 等位基因(C/T 或 T/T 基因型)者风险增加 2.7 倍(OR=2.7,95% CI:1.8-4.1,P=0.001)[5]。
3.3 肌肉系统疾病
LMNA 相关肌营养不良是一组遗传性肌病,以进行性肌无力为核心,常伴心脏受累,中国多中心队列研究(112 例患者)揭示其关键特征 [8,15]:
临床表型:发病年龄中位数 16 岁(68.8% 在 18 岁前发病),主要累及肢带肌(89.3%)、面肌(64.3%)与颈肌(57.1%);42.9% 患者出现运动能力下降(如爬楼梯困难),28.6% 需借助辅助器具行走;血清肌酸激酶(CK)中位数 2850 U/L(范围 320-12500 U/L),肌电图均提示肌源性损害 [8]。
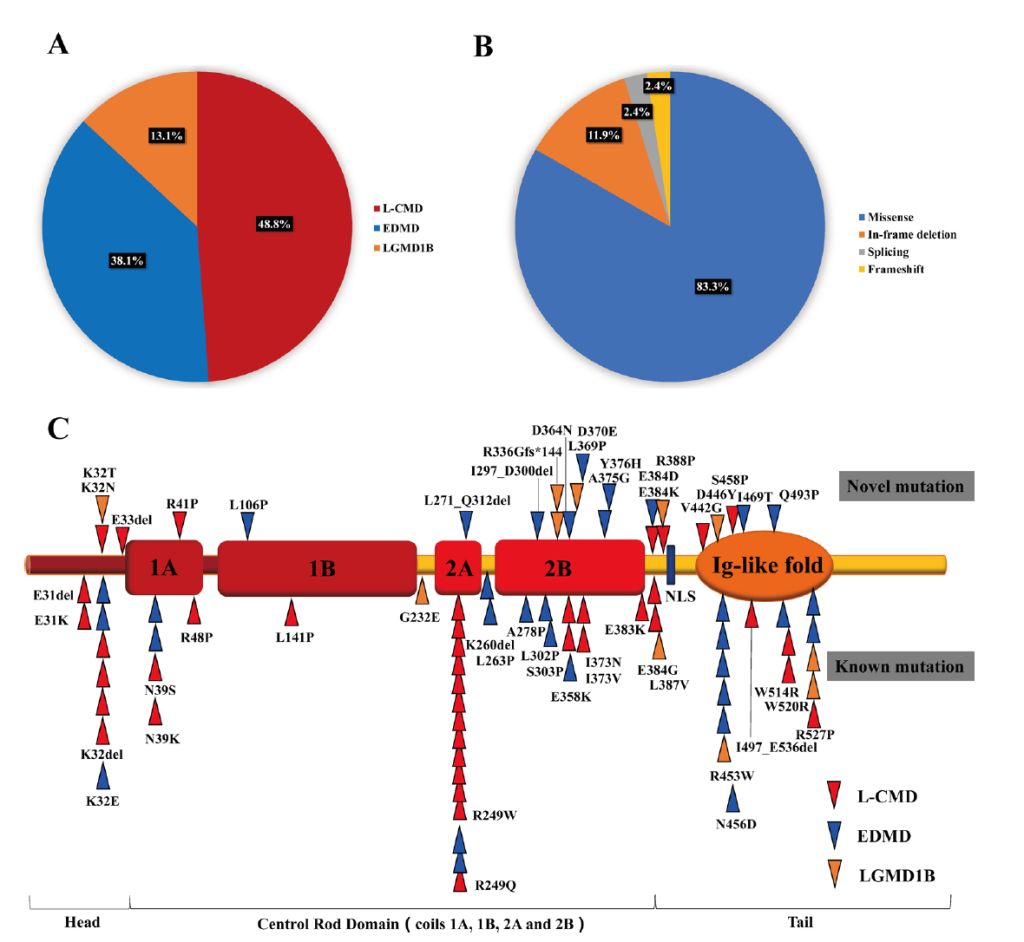
The genetic features in patients with LMNA- related muscular dystrophy.
心脏受累:35.7% 患者合并心脏病变,包括心脏传导阻滞(21.4%)、扩张型心肌病(14.3%),且心脏受累患者的发病年龄(12 岁)显著早于无心脏受累者(18 岁,P=0.003)[8]。
基因型特征:共检出 43 种 LMNA 变异(28 种错义、8 种无义、5 种移码、2 种剪接位点变异),其中 15 种为国际首次报道;基因型 – 表型关联显示,携带截断变异的患者心脏受累风险是错义变异患者的 4.2 倍(OR=4.2,95% CI:1.8-9.8,P=0.001)[8]。此外,26 例儿科患者研究发现,34.6% 的患者额外携带肌病相关基因(如 GAA、AGRN、FLNC)的有害变异,且这些患者均表现为早发、严重表型(如恶性心律失常、需植入 ICD),提示 “LMNA 主效变异 + 修饰变异” 是表型异质性的重要原因 [15]。
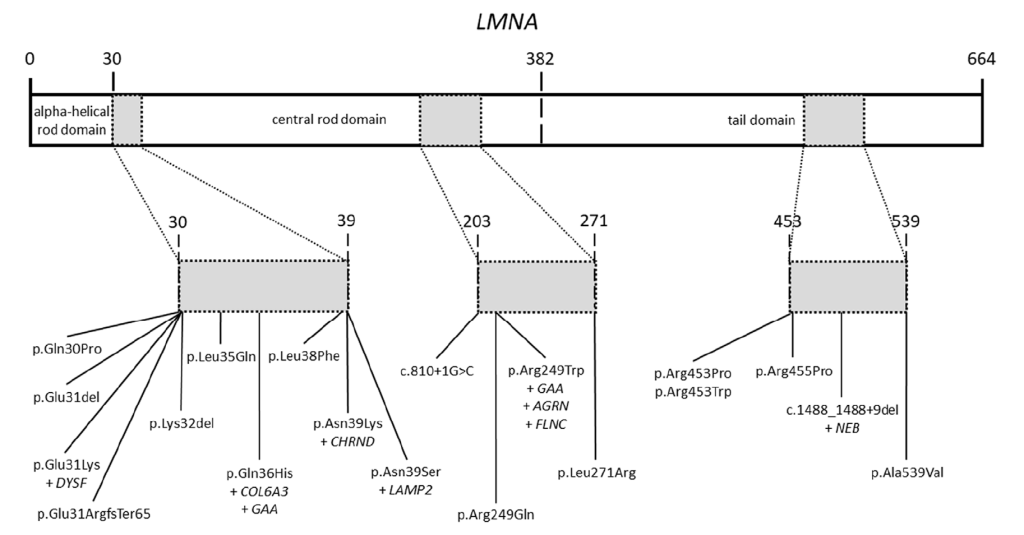
Rare variants in the LMNA gene. Domains of the LMNA gene including rare variants identified in our patients. All rare variants are located in three main zones of the gene.
3.4 衰老相关疾病
LMNA 变异是早老综合征的主要病因,同时参与正常衰老的调控 [14,18]:
早老综合征(HGPS):由 LMNA G608G 突变引发,该突变激活隐蔽剪接位点,产生缺失 ZMPSTE24 蛋白酶识别位点的早老蛋白 [18]。早老蛋白持续法尼基化并锚定核膜,导致核形态异常、DNA 损伤修复障碍,患者表现为加速衰老(如皮肤萎缩、脱发)、心血管老化(动脉粥样硬化),寿命通常不超过 15 岁 [18]。
表型衰老预测:200 例受试者(100 例 “早老”:65-75 岁无法完成爬楼梯 / 15 分钟步行;100 例 “晚老”:>75 岁可完成上述运动)研究显示,整合 LMNA 等衰老相关基因高有害性外显子变异(CADD>15)的随机森林模型,可有效预测表型衰老状态(发现队列 AUC=0.62,验证队列误分类率仅 2%),且模型中权重最高的变异来自 DNA 损伤修复通路(PARP1、ERCC5),提示 LMNA 通过调控该通路参与衰老进程 [14]。
3.5 其他罕见疾病
神经病变:腓骨肌萎缩症(CMT)患者多携带 LMNA 纯合突变(如 R298C),而杂合突变多引发其他表型(如心肌病、脂肪营养不良),提示突变剂量效应可能影响神经病变的发生 [13]。
骨与皮肤疾病:下颌肢端发育不良(MAD)与 LMNA 尾部免疫球蛋白样结构域突变(如 R527H/C)相关,患者表现为下颌发育不全、肢端骨溶解,部分合并脂肪营养不良与皮肤色素异常,其机制与突变破坏蛋白 – 蛋白相互作用、影响骨 / 皮肤细胞分化相关 [13]。
4. LMNA 相关疾病的基因型 – 表型关联规律
LMNA 变异的疾病表型受突变位置、变异类型、人群背景三方面因素调控,形成明确的关联规律 [8,9,12,13,16]:
4.1 突变位置决定疾病谱系
LMNA 基因不同结构域的突变对应特定疾病类型,呈现 “结构域 – 表型” 特异性 [13]:
杆状结构域(rod domain):突变多导致横纹肌病变(扩张型心肌病、肌营养不良),如 R60G 突变会降低 p38 MAPK 对 lamin A 的磷酸化活性,引发扩张型心肌病伴传导障碍 [13];
尾部结构域(tail domain):突变多引发代谢疾病(FPLD、T2D)与骨 / 皮肤疾病,如 R482W 突变干扰 lamin A 与 PPARγ 的结合,导致脂肪分化异常 [1,13];
头部结构域(head domain):突变多与早老症相关,如 T10I 突变仅引发 lamin A 磷酸化异常,无显著结构改变,但会加速细胞衰老[13]。
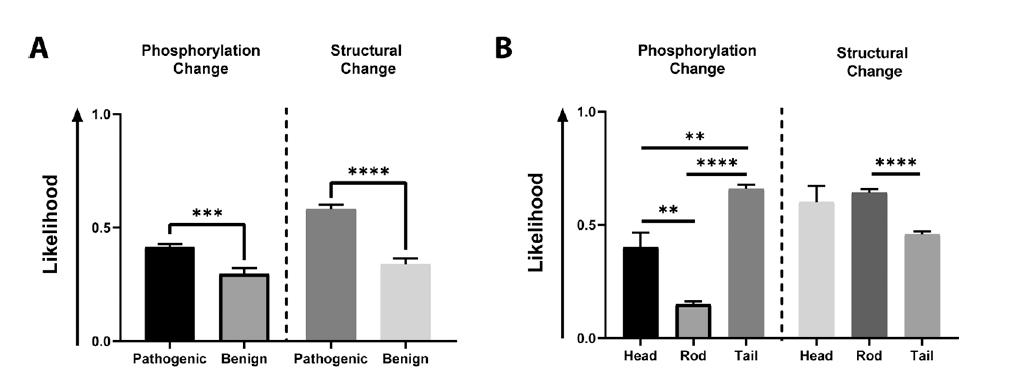
Predicted LMNA mutation-driven phosphorylation and protein structural changes are associated with disease.
4.2 变异类型影响疾病严重程度
变异类型直接决定疾病的发病年龄与严重程度,总体规律为 “截断变异> 错义变异 > 调控区变异”[9,16]:
截断变异(无义、移码、剪接突变):致病性最强,与早发、严重表型相关 —— 心脏疾病中,截断变异携带者传导障碍发病年龄比错义变异早 10 年(38 岁 vs 48 岁,P=0.002),左心室射血分数降低风险高 4.2 倍(HR=4.2,P=0.001)[9];
错义变异:表型相对温和,部分变异(如 p.Arg216Cys、p.Arg331Gln)仅导致晚发传导障碍,扩张型心肌病发生率低,预后较好 [16];
启动子 / 甲基化变异:多引发慢性、非致命性疾病(如动脉僵硬度升高、CHD),无急性风险,但会增加远期疾病负担 [4,22]。
4.3 人群背景导致表型差异
种族差异:LMNA 1908C/T 变异在印度人群中与肥胖相关(T 等位基因频率 0.29),而在欧洲人群中无此关联 [5];EMD 基因 p.D149H 变异(与 lamin A 结合)在东亚人群中频率高达 0.8297%,与 “健康脂质谱” 相关(甘油三酯降低 0.336,P=0.0368),而在其他种族中罕见 [24];
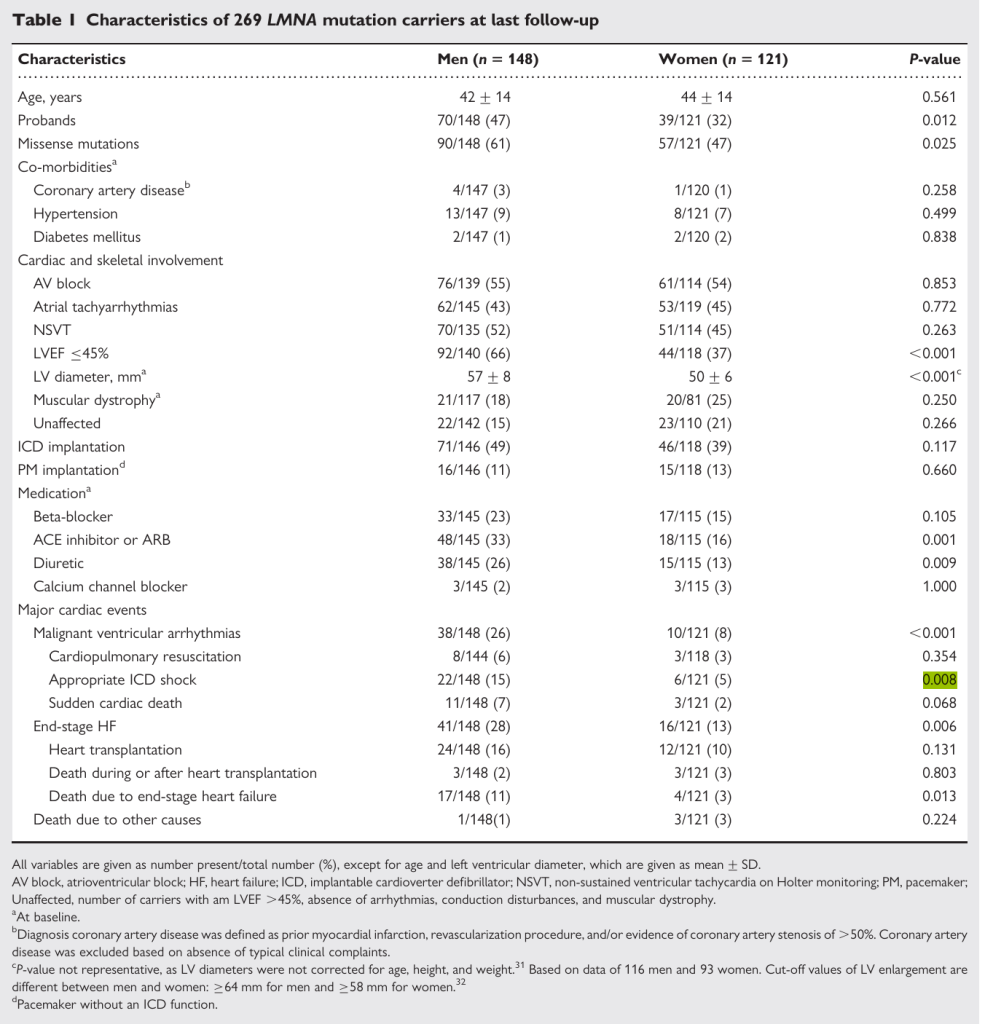
性别差异:男性 LMNA 突变携带者预后显著差于女性 —— 男性扩张型心肌病患者左心室射血分数≤45% 发生率(58.7%)是女性(34.5%)的 1.7 倍,恶性室性心律失常发生率(26.4%)是女性(8.1%)的 3.3 倍,中位生存年龄比女性短 9 年(62 岁 vs 71 岁,P=0.008)[12]。
5. 治疗策略与临床管理启示
目前 LMNA 相关疾病尚无根治手段,但基于致病机制的靶向干预与精准风险分层已取得进展 [13,18,21]:
5.1 靶向治疗策略
基于 LMNA 变异的致病机制(结构异常、磷酸化异常、早老蛋白积累等),可分为四类靶向方向 [13,18]:
针对结构异常:化学分子伴侣(如 4 – 苯基丁酸)可改善 lamin A 折叠,减少聚集,适用于横纹肌病变(如扩张型心肌病、肌营养不良)[13];
针对磷酸化异常:PKC/CDK 抑制剂可恢复 lamin A 磷酸化平衡,用于代谢疾病(如 FPLD),如 R482W 突变患者可通过 PKC 抑制剂改善脂代谢紊乱 [13];
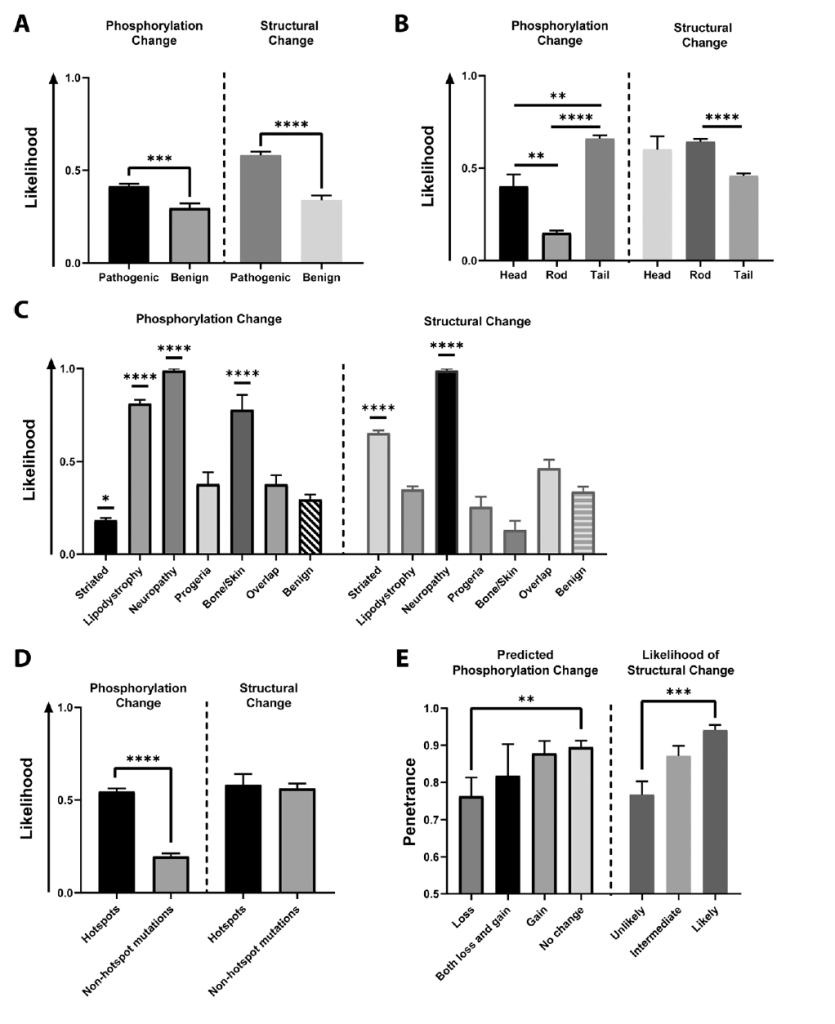
predicted LMNA mutation-driven phosphorylation and protein structural changes are associated with disease. LMNA13
针对早老蛋白积累:法尼基转移酶抑制剂(FTI,如 lonafarnib)可减少早老蛋白核膜锚定,改善早老综合征患者血管病变;自噬激活剂(如雷帕霉素、利美尼定)可促进早老蛋白降解,延缓衰老进程 [18];CRISPR/Cas9 基因编辑技术可靶向破坏核纤层蛋白 A/progerin,使早衰小鼠寿命增加约 25%[18];
针对表观遗传异常:甲基转移酶抑制剂(如 5 – 氮杂胞苷)可逆转 Zmpste24 缺陷小鼠的 rDNA 超甲基化,为 CHD 等表观遗传相关疾病提供干预思路 [18]。

5.2 临床管理建议
基因检测指征:对家族性扩张型心肌病、早发性代谢综合征(<40 岁发病)、肌营养不良患者,应优先检测 LMNA 基因;孤立性心房颤动患者若有家族史或不明原因传导异常,也需纳入 LMNA 筛查范围 [1,2,6,8];
风险分层策略:根据变异类型制定随访频率 —— 截断变异携带者每 6 个月复查心电图与超声心动图,错义变异者每年复查;男性、截断变异、非持续性室性心律失常、左心室射血分数 <45% 的患者,需纳入 “高风险” 管理 [9,12,21];
干预时机:满足 “男性、非持续性室性心律失常、非错义变异、左心室射血分数 < 45%” 中 2 项的患者,应尽早植入 ICD 以预防猝死;左房扩大可作为无症状 LMNA 变异携带者的早期监测指标(2 例 22-27 岁无症状携带者仅表现左房扩大)[21]。
6. 总结与展望
LMNA 基因作为 “多效性疾病基因”,其变异通过破坏核纤层结构、干扰基因组功能及细胞信号通路,引发多系统疾病,且不同变异的位置、类型与人群背景共同决定疾病表型 [1,3,6,8,13]。
当前研究已明确 LMNA 变异的核心关联规律,为临床诊断、风险分层及靶向干预提供了依据,但仍存在三方面关键挑战:一是多数新变异(如 132 个新错义变异)的功能机制未明确,难以制定针对性干预方案 [3];二是现有研究以欧洲、巴西、中国等特定人群为主,缺乏非洲裔、中东人群等的大规模数据,种族特异性关联规律尚未完全揭示 [5,17,24];三是靶向治疗的组织特异性不足,如法尼基转移酶抑制剂可能导致中心体分离缺陷,限制其临床应用 [18]。
未来研究应聚焦三大方向:一是结合单细胞测序与类器官技术,解析 LMNA 变异在不同细胞类型(如心肌细胞、脂肪细胞)中的功能差异;二是开展多族裔全基因组/全外显子组研究与多基因风险评分(PRS)构建,优化不同人群的风险预测模型 [19];三是开发组织特异性递送系统(如心脏靶向纳米颗粒),提高治疗药物的安全性与有效性 [18]。通过基础研究与临床实践的深度融合,有望实现 LMNA 相关疾病的精准诊断与有效干预,最终改善患者预后。
参考文献
1.N. R. Guidorizzi, et al. Comprehensive analysis of morbidity and mortality patterns in familial partial lipodystrophy patients: insights from a population study. Frontiers in Endocrinology 2024
2.G. D. Pessente, et al. Effect of Occurrence of Lamin A/C (LMNA) Genetic Variants in a Cohort of 101 Consecutive Apparent “Lone AF” Patients: Results and Insights. Frontiers in Cardiovascular Medicine 2022
3.Alyssa Florwick, et al. LMNA Sequences of 60,706 Unrelated Individuals Reveal 132 Novel Missense Variants in A-Type Lamins and Suggest a Link between Variant p.G602S and Type 2 Diabetes. Frontiers in Genetics 2017
4.H. Akasaka, et al. A promoter polymorphism of lamin A/C gene is an independent genetic predisposition to arterial stiffness in a Japanese general population (the Tanno and Sobetsu study). Journal of atherosclerosis and thrombosis 2009
5.Mukti Sharma, et al. Genotype of the LMNA 1908C>T variant is associated with generalized obesity in Asian Indians in North India. Clinical Endocrinology 2011. Circulation 2020
7.J. Lazarte, et al. LMNA Variants and Risk of Adult-Onset Cardiac Disease. Journal of the American College of Cardiology 2022
8.Yanbin Fan, et al. Clinical spectrum and genetic variations of LMNA-related muscular dystrophies in a large cohort of Chinese patients. Journal of Medical Genetics 2020
9.Suguru Nishiuchi, et al. Gene-Based Risk Stratification for Cardiac Disorders in LMNA Mutation Carriers. Circulation: Cardiovascular Genetics 2017
10.J. Erdmann, et al. What can we learn from common variants associated with unexpected phenotypes in rare genetic diseases? Orphanet Journal of Rare Diseases 2021
11.Camille Desgrouas, et al. Unraveling LMNA Mutations in Metabolic Syndrome: Cellular Phenotype and Clinical Pitfalls. Cells 2020
12.I. Rijsingen, et al. Gender‐specific differences in major cardiac events and mortality in lamin A/C mutation carriers. European Journal of Heart Failure 2013
13.Eric W. Lin, et al. Genotype‐phenotype analysis of LMNA‐related diseases predicts phenotype‐selective alterations in lamin phosphorylation. The FASEB Journal 2020
14.Megan E. Breitbach, et al. Exonic Variants in Aging-Related Genes Are Predictive of Phenotypic Aging Status. Frontiers in Genetics 2019
15.Sergi César, et al. LMNA-related muscular dystrophy: Identification of variants in alternative genes and personalized clinical translation. Frontiers in Genetics 2023
16.G. Captur, et al. Lamin missense mutations—the spectrum of phenotype variability is increasing. European Journal of Heart Failure 2018
17.Amal Elfatih, et al. Analysis of incidental findings in Qatar genome participants reveals novel functional variants in LMNA and DSP. Human Molecular Genetics 2022
18.A. Zhavoronkov, et al. Potential therapeutic approaches for modulating expression and accumulation of defective lamin A in laminopathies and age-related diseases. Journal of molecular medicine 2012
19.D. Kramarenko, et al. Polygenic Risk Scores in Dilated Cardiomyopathy: Towards the Future. Current Cardiology Reports 2025
20.A. Baban, et al. Cardiovascular Involvement in Pediatric Laminopathies. Report of Six Patients and Literature Revision. Frontiers in Pediatrics 2020
21.Valentina Ferradini, et al. Clinical Features of LMNA-Related Cardiomyopathy in 18 Patients and Characterization of Two Novel Variants. Journal of Clinical Medicine 2021
22.Nandini Mukherjee, et al. DNA methylation of the Lamin A/C gene is associated with congenital heart disease. Birth Defects Research 2024
23.M. Puckelwartz, et al. Genomic Context Differs Between Human Dilated Cardiomyopathy and Hypertrophic Cardiomyopathy. Journal of the American Heart Association : Cardiovascular and Cerebrovascular Disease 2021
24.Tejas Dharmaraj, et al. Rare BANF1 Alleles and Relatively Frequent EMD Alleles Including ‘Healthy Lipid’ Emerin p.D149H in the ExAC Cohort. Front. Cell Dev. Biol. 2019


