促衰老与抗衰老基因介绍(六)| ACBP/DBI 的功能及其与疾病的关联
- boke
- 2025-10-17
- 1:53 下午
酰基辅酶 A 结合蛋白(Acyl-CoA Binding Protein,ACBP)又称地西泮结合抑制剂(Diazepam Binding Inhibitor,DBI),作为核心促衰老基因之一,在衰老基因调控网络中发挥 “加速者” 作用,同时也在代谢紊乱、神经退行性疾病、癌症中发挥差异化作用;并与疾病发生发展、诊断及治疗潜力相关。
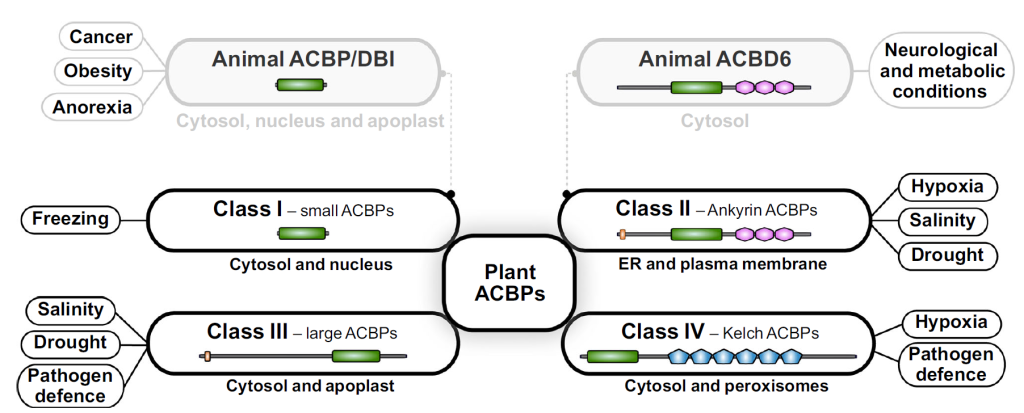
Functional and structural diversification of acyl-Coenzyme A binding proteins (ACBPs) discussed
ACBP/DBI 的发现、分子特征与组织分布
1
发现背景:双重命名与功能起源
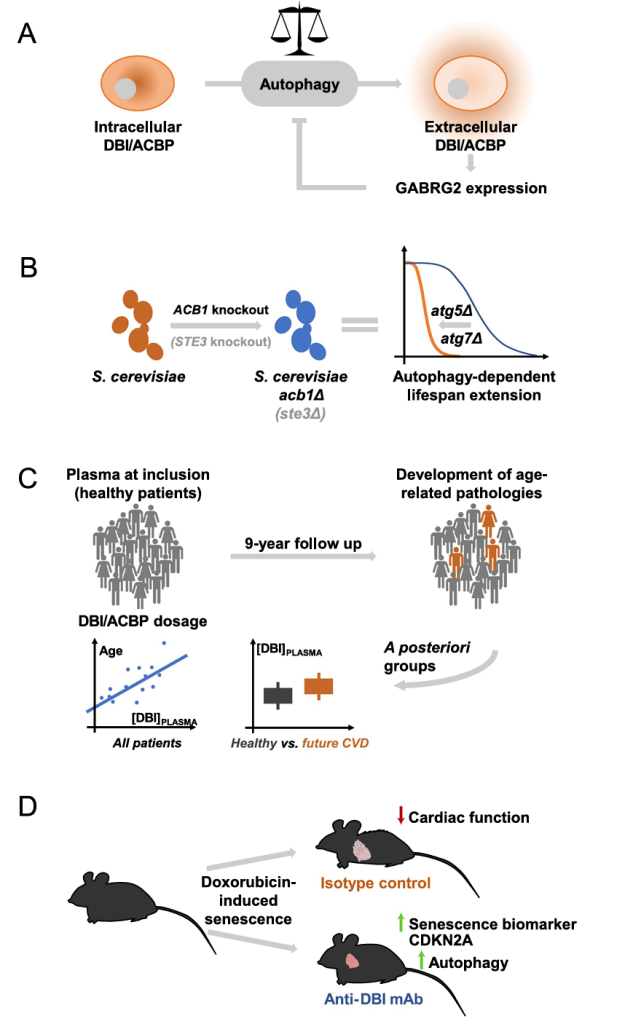
ACBP/DBI是进化保守的多功能蛋白,其发现与功能研究同步推进:1983 年 Costa 团队在大鼠脑中首次分离该蛋白,因能从 γ- 氨基丁酸 A(GABAA)受体置换地西泮而命名为 DBI [2];后续在肝脏中发现相同多肽,因其可终止脂肪酸合成,故命名为 ACBP,二者实为同一蛋白的功能特异性命名 [1]。
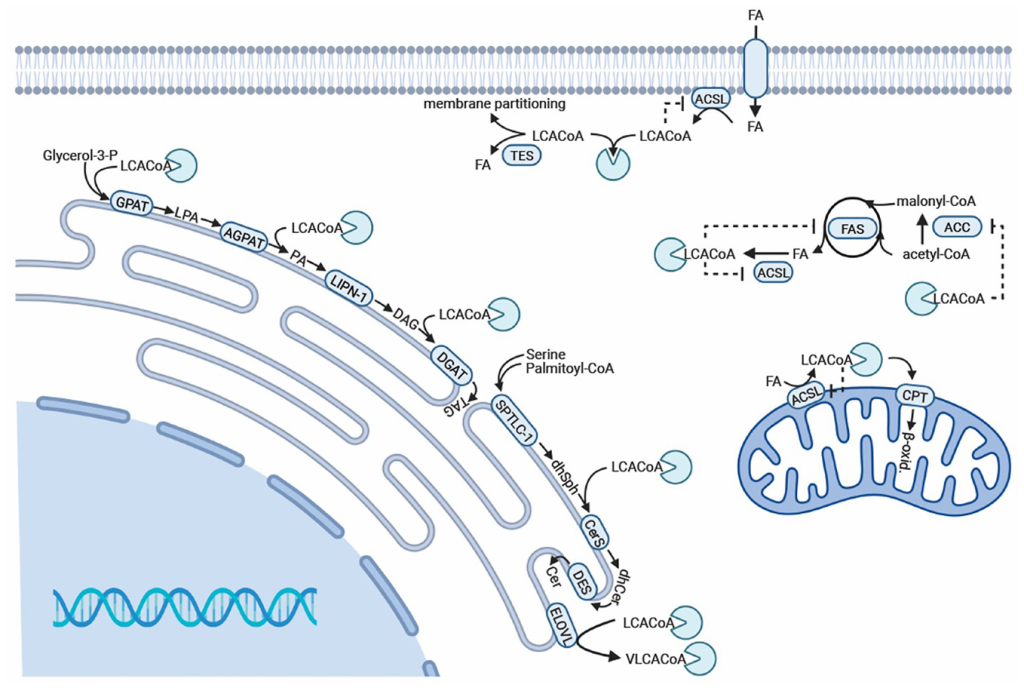
Selected intracellular functions of ACBP/DBI.
2
分子特征:结构决定功能的核心基础
ACBP/DBI 为 9 kDa 多肽,核心功能依赖保守的酰基辅酶 A 结合(ACB)结构域(约 10 kDa):该结构域以 “four α-helix bundle” 折叠形成壳状空间,通过 “3′- 核糖磷酸结合、腺苷部分相互作用、酰基链疏水作用” 三种机制,对 C₁₄-C₂₂ 长链酰基辅酶 A(LCA-CoA)具有高亲和力,可封存 LCA-CoA 避免其水解或非特异性作用[2]。作为 LCA-CoA 的关键转运载体,ACBP 家族分两类:单结构域蛋白(如哺乳动物 ACBP/DBI)可在细胞内外发挥作用;多结构域蛋白(如 ACBD6)含锚蛋白重复序列等附加结构,介导蛋白质相互作用(如与 N – 豆蔻酰基转移酶结合)[3,4]。
LCA-CoA 由长链酰基辅酶 A 合成酶(long-chain acyl-CoA synthetase,ACSL)通过 ATP 依赖硫酯化生成,是脂质代谢、膜合成的核心中间产物,其两亲性(amphipathic,分子同时具有亲水基团(hydrophilic moiety)和疏水基团(hydrophobic moiety))需依赖 ACBP/DBI 转运以维持细胞结构稳定[4,5]。
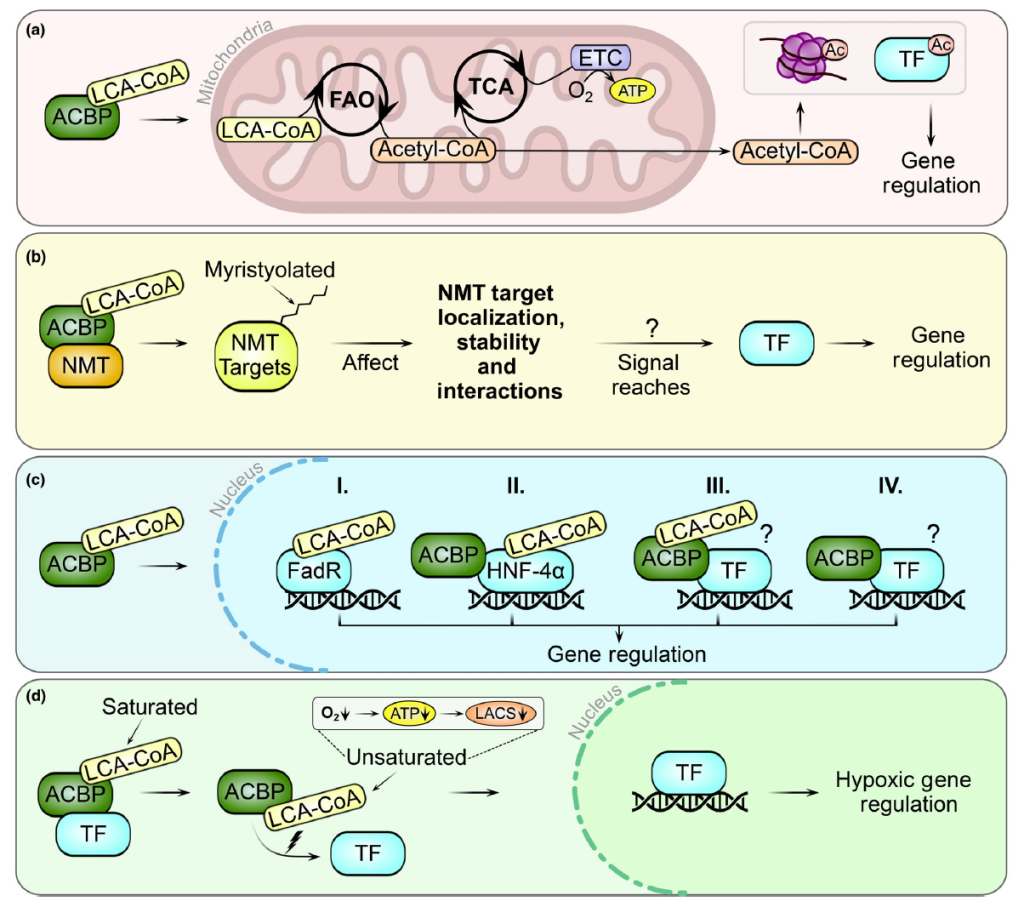
Acyl-Coenzyme A-binding protein (ACBP)–long-chain acyl-Coenzyme A (LCA-CoA) complexes in gene regulatory processes.
3
组织与异构体分布:功能特异性的空间基础
3.1 组织分布:中枢 – 外周的差异化富集
在大脑中,DBI 及其两种主要加工产物 ——DBI 33-50(即十八肽神经肽,ODN)和 DBI 17-50(即三十四肽神经肽,TTN)在神经元中的分布具有不均一性,其中 DBI 浓度最高(10-50μM)的脑区包括下丘脑、杏仁核、小脑,以及丘脑、海马体和大脑皮层的特定区域,同时 DBI 也存在于特化的神经胶质细胞(星形胶质细胞和伯格曼胶质细胞)中 [2]。
在外周组织中,DBI 浓度最高的部位是肾上腺皮质的球状带和束状带细胞,以及睾丸的间质细胞,且这些细胞类型恰好也是线粒体苯二氮䓬类受体( Mitochondrial Benzodiazepine Receptor,MBR) 高度富集的区域,提示二者功能存在关联 [2]。
3.2 异构体分布:优势表达保障功能一致
从分子异构体来看,无论人类细胞或组织类型如何(睾丸除外),ACBP/DBI 均以单一异构体 ACBP1 为主,约占所有 DBI 转录本的 90%,而在睾丸中 ACBP1 占比约 70%,这种异构体的优势表达为其功能的一致性提供了分子基础 [8]。
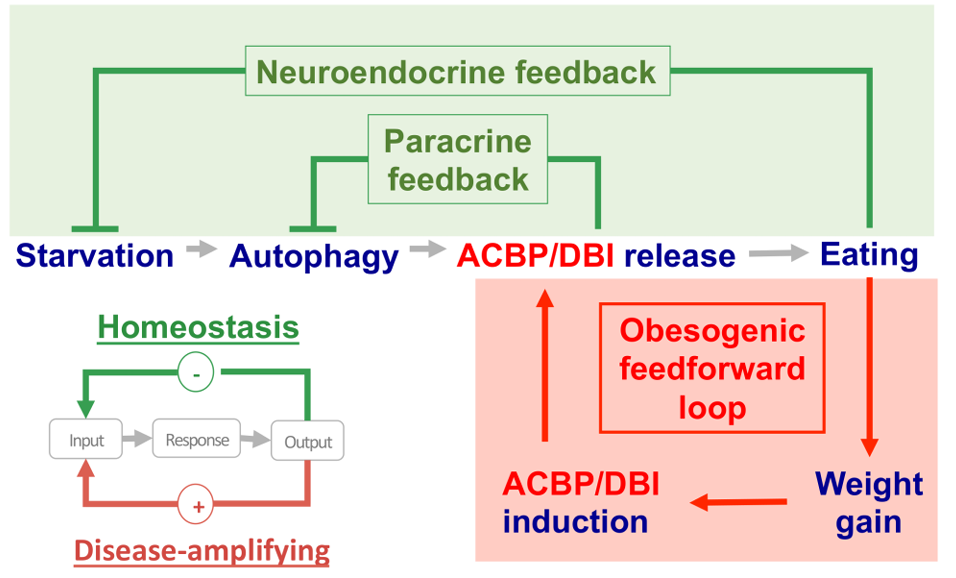
Hypothetical involvement of the appetite-stimulatory effects of ACBP/DBI-in two distinct circuitries.
保守的 ACB 结构域:LCA-CoA 动态变化的传感器与检测技术
1
ACB 结构域的功能特性
不同 ACB 亚型的氨基酸组成存在细微差异,导致其对 LCA-CoA 的结合偏好性不同——例如部分亚型对不饱和 LCA-CoA 的亲和力高于饱和型,这一特性使 ACB 结构域成为 LCA-CoA pool组成细微代谢波动的潜在传感器 [4,9]。Protein Data Bank的结构数据显示,配体与 ACB 结构域结合不会引发构象变化,提示 ACBP 介导的 LCA-CoA 信号可能依赖 “竞争性结合” 或 “特定 LCA-CoA 物种引发的空间效应”,进而影响 ACBP 与其他蛋白质的相互作用 [3]。
2
LCA-CoA 研究的技术进展
LCA-CoA pool对代谢与环境信号(营养可利用性、胁迫、细胞能量状态)响应迅速,但低丰度、不稳定性、快速周转率及复杂亚细胞区室化使其精准检测面临挑战 [10,11]。
近年 “细胞培养 – 亚细胞分级分离稳定同位素标记技术(SILEC-SF)” 通过在分级分离全过程嵌入同位素标记标准品,减少样品损失与处理偏差,提高酰基辅酶 A 定量准确性,已揭示缺氧时线粒体琥珀酰辅酶 A 水平降低等亚细胞特异性代谢变化,但该技术依赖细胞系标准品,在代谢异质性复杂组织中应用受限 [10]。另一项关键技术是 “长链酰基辅酶 A 高响应生物传感器(LACSerHR)”,基于细菌脂肪酸代谢调控转录因子(结合 LCA-CoA 后调节 DNA 结合活性),利用构象敏感型黄色荧光蛋白(cpYFP),通过 LCA-CoA 结合引发的荧光变化实时在体监测 LCA-CoA 波动,已证实铁死亡过程中 “LCA-CoA 合成酶 4(ACSL4)依赖的 LCA-CoA 变化” 及 2 型糖尿病(T2DM)中 LCA-CoA 代谢的波动,但无法区分不同 LCA-CoA 物种,且受 pH 敏感性影响 [11,12,13]。
ACBP/DBI 的核心生物学功能
1
神经调节功能:GABA 能信号与神经甾体代谢的调控
ACBP/DBI 及其加工产物在神经系统中的核心功能之一是调控 GABA 能信号通路与神经甾体生成,具体表现为两种作用模式:一是直接与 GABAA 受体相关的 BZD 识别位点结合,二是与神经胶质细胞的 MBR 结合并调节神经甾体生成的速率和种类 [2]。大脑中由神经胶质细胞生成的部分神经甾体(如硫酸孕烯醇酮、硫酸脱氢表雄酮、3α- 羟基 – 5α- 孕烷 – 20 – 酮及 3α,21 – 二羟基 – 5α- 孕烷 – 20 – 酮),在nM浓度范围内即可作为 GABAA 受体功能的强效正向或负向变构调节剂,而 ACBP/DBI 通过调节这些神经甾体的生成,间接参与 GABA 能神经传递的精细调控 [2]。
此外,胞外 ACBP/DBI 可作为神经肽,结合 GABAA 受体影响神经发生、凋亡及食欲刺激等过程,且降低 ACBP/DBI 与 LCA-CoA 结合亲和力的突变并不会削弱其食欲刺激效应,证实该功能的 LCA-CoA 非依赖性 [1,6,15]。肥胖患者的胞外 ACBP/DBI 水平升高,厌食症患者则降低,这使其成为厌食症的潜在治疗靶点 [16,17]。
ACBP/DBI 作为 GABA 受体的变构结合蛋白,其功能异常与神经发育障碍密切相关,例如在自闭症谱系障碍(ASD)相关的 GABA 能信号通路中,DBI 是关键候选基因之一,且在 ASD 伴严重语言障碍的患者中,DBI 蛋白表达水平显著降低,同时其表达量与自闭症诊断访谈量表修订版(ADI-R)多个条目的评分存在相关性 [18,19]。
在 Zellweger 综合征(一种由过氧化物酶体生物发生缺陷引起的致命性遗传性疾病)中,DBI 的表达受抑可能导致 GABA 能信号过度激活,进而引发患者特征性的肌张力低下和新生儿惊厥,这一假说也得到了 Zellweger 综合征与 “苯二氮䓬胚胎病”(孕期滥用 GABAA 激动剂导致的畸形综合征)表型高度相似的支持 [20]。
此外,在伴痴呆的神经退行性疾病中,ACBP/DBI 的脑脊液(CSF)水平呈现疾病特异性变化:伴痴呆的帕金森病患者和阿尔茨海默病患者的脑脊液 DBI 水平升高,而亨廷顿舞蹈症患者的脑脊液 DBI 水平降低,这种变化被推测与不同神经退行性疾病中 GABA 能系统的功能或结构改变直接相关 [21]。
2
代谢调节功能:脂质代谢、葡萄糖利用与食欲控制
ACBP/DBI 在代谢调节中的核心作用首先体现在脂质代谢领域,它能够结合并转运LCA-CoA分子,而 LCA-CoA 是脂质代谢、膜生物合成及能量产生过程中的关键中间产物,因此 ACBP/DBI 被认为是细胞内 LCA-CoA 转运和利用的核心调控因子 [4,22]。
在动物细胞内,ACBP/DBI 可将 LCA-CoA 转运至线粒体,通过脂肪酸氧化(FAO)生成乙酰辅酶 A:乙酰辅酶 A 一方面作为三羧酸循环(TCA)底物驱动电子传递链(ETC)产生 ATP,另一方面转运至胞质与细胞核,作为组蛋白与转录因子(TF)乙酰化的底物,进而调控基因表达 [22,23]。
在单细胞真核生物中,ACBP 的脂质代谢功能同样保守,例如酵母中敲除 ACBP 同源基因 Acb1p 后,会出现细胞器形态异常(包括液泡碎片化、多层质膜及大小不一的囊泡积累),且极长链脂肪酸、长链碱基和神经酰胺的水平受到严重影响,提示 ACBP 在特定脂质(而非所有脂质)的代谢过程中发挥特异性调控作用 [24]。
在 2 型糖尿病(T2DM)相关的心肌代谢紊乱中,ACBP 作为显著上调的脂质代谢基因,其表达水平在糖尿病患者和糖尿病小鼠的心脏中均显著升高;心肌细胞特异性敲除 ACBP 可增强糖尿病心肌细胞对葡萄糖的利用,从而代偿 ATP 生成不足,减轻 T2DM 诱导的心脏重构(如心脏肥大、纤维化)和超微结构损伤,改善心肌收缩功能,而心脏特异性过表达 ACBP 则会重现心脏功能障碍 [25]。进一步研究发现,在 T2DM 心肌中,ACBP 可与肌球蛋白结合蛋白 C3(MyBPC3)结合,阻止 MyBPC3 协助肌球蛋白与肌动蛋白形成横桥结构,直接损害心肌收缩功能,同时过氧化物酶体增殖物激活受体 γ(PPARγ)可通过调控 ACBP 的转录活性,参与这一代谢 – 结构耦合的调控过程 [25]。通过 LACSerHR 技术已证实 T2DM 中 LCA-CoA 代谢的波动,为 ACBP 调控 T2DM 心肌脂质代谢提供了技术支撑 [11]。
从遗传关联来看,ACBP 基因的单核苷酸多态性(SNP)与 T2DM 发病风险相关,例如在两个高加索人群队列中,ACBP 基因的 rs2084202 位点(剪接变体 ACBP 1c 的潜在启动子 SNP)次要等位基因均与 T2DM 发病风险降低相关(比值比分别为 0.63 和 0.72),提示该 SNP 可能通过调控 ACBP 表达影响 T2DM 易感性 [26]。
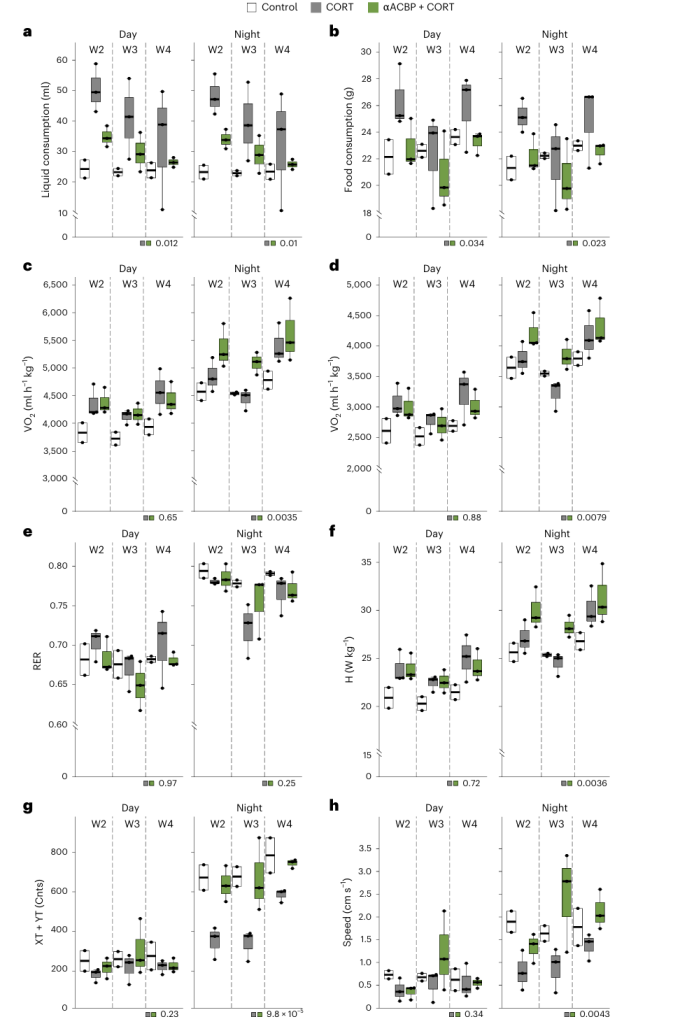
ACBP/DBI 还是一种强效的食欲刺激因子和体重稳态调控因子,其血浆水平呈现 “双向调节” 特征:在饥饿状态下,1-2 天饥饿的小鼠和 1-3 周自愿禁食的人类血浆 ACBP/DBI 浓度均会急性升高;而在慢性营养过剩导致肥胖的情况下,肥胖小鼠和人类的血浆 ACBP/DBI 水平也会升高,这种矛盾现象的原因在于 ACBP/DBI 的食欲刺激作用可使肥胖成为自我维持的状态 [8,27]。
在动物模型中,脂肪组织特异性敲除 ACBP/DBI 足以阻止高脂饮食(HFD)诱导的小鼠体重增加,直接证明 ACBP/DBI 在脂肪组织介导的体重调控中的关键作用 [27]。进一步研究揭示了 ACBP/DBI、GABAA 受体(GABAAR)与 PPARγ 构成的致肥胖前馈循环:PPARγ 是 ACBP/DBI 在肝脏、脂肪组织等代谢活跃器官中表达上调的关键转录因子,PPARγ 激动剂罗格列酮可诱导 ACBP/DBI 表达上调及体重增加,而敲除 ACBP/DBI 可阻断这一效应;同时,HFD 可诱导 ACBP/DBI 与 PPARγ 的相互上调,形成恶性循环;若 GABAAR γ2 亚基发生 F77I 单点突变(使 ACBP/DBI 无法结合 GABAAR),则可阻止 HFD 诱导的体重增加、肝脂肪变性和高血糖,打破这一致肥胖循环 [29]。
此外,ACBPs 还可通过蛋白质 – 蛋白质相互作用调节酶活性以参与代谢调控:动物中的 ACBD6(含 C 端锚蛋白重复序列的多结构域 ACBP)可通过 ANK 结构域与 N- 豆蔻酰基转移酶(NMTs)相互作用,保护 NMTs 免受高丰度 “非豆蔻酰 LCA-CoA” 的抑制,增强 NMT 活性 [7]。CBD6 功能异常与 “N- 豆蔻酰化蛋白网络紊乱相关的神经系统及代谢疾病” 相关,斑马鱼与爪蟾细胞的蛋白质组学研究显示,ACBD6 缺陷对 RNA 加工与胁迫响应有广泛影响 [31,32]。
3
自噬抑制功能:衰老与细胞稳态的调控
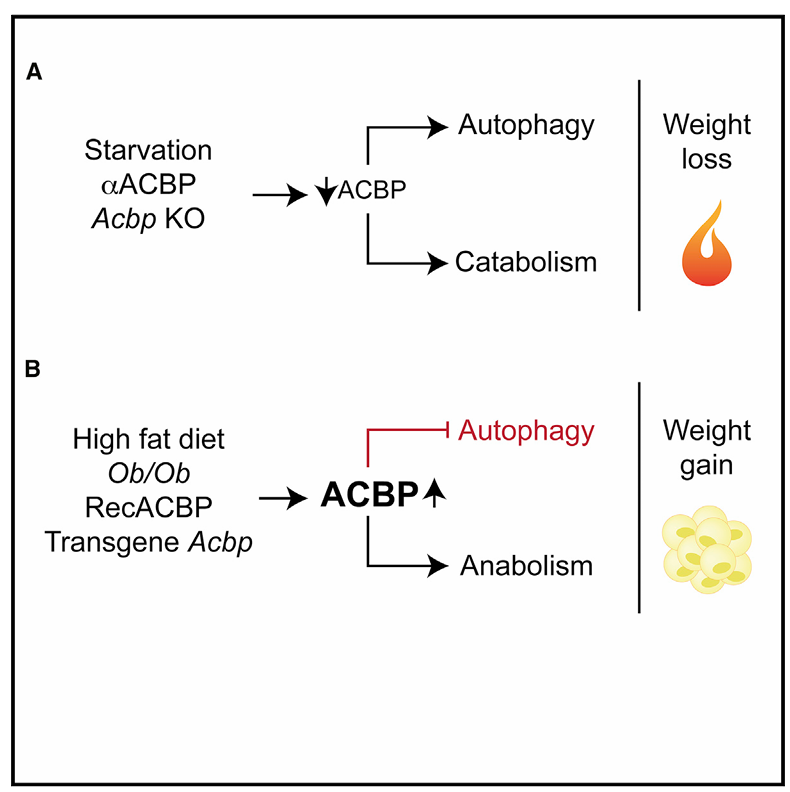
ACBP/DBI 是一种在进化上保守的旁分泌自噬抑制剂,其自噬抑制功能与衰老过程密切相关,也被认为是与衰老及疾病相关的 “自噬检查点”[6,34]。
在酵母时序寿命实验中,敲除 ACBP/DBI 的同源基因 Acb1p 可诱导自噬,并以自噬依赖的方式显著延长酵母寿命,直接证明 ACBP/DBI 对自噬和寿命的调控作用。
在人类中,循环 ACBP/DBI 蛋白水平随年龄增长而升高,且这种升高与体重指数(BMI)无关,同时 ACBP/DBI 水平过高可作为健康人群未来发生心血管疾病(如心脏手术、心肌梗死、中风)的预测指标,提示 ACBP/DBI 不仅是生理年龄的标志物,更是反映生理状态的生物年龄标志物 [34]。
在动物模型中,通过抗体介导的 ACBP/DBI 中和,可减轻蒽环类药物加速的小鼠心脏衰老迹象,包括降低衰老标志物 CDKN2A/p16(细胞周期蛋白依赖性激酶抑制剂 2A)的表达水平,改善心脏功能,表明靶向 ACBP/DBI 可干预年龄相关的器官衰老 [34]。此外,血浆 ACBP/DBI 浓度还与心血管风险因素直接相关:与甘油三酯水平呈正相关,与高密度脂蛋白水平呈负相关,且这些关联在多变量回归模型中独立于年龄和 BMI,进一步支持 ACBP/DBI 在衰老相关代谢紊乱中的调控作用 [34]。
Evidence in favor of pro-aging effects of DBI/ACBP
4
跨物种的基因调控与信号传导功能
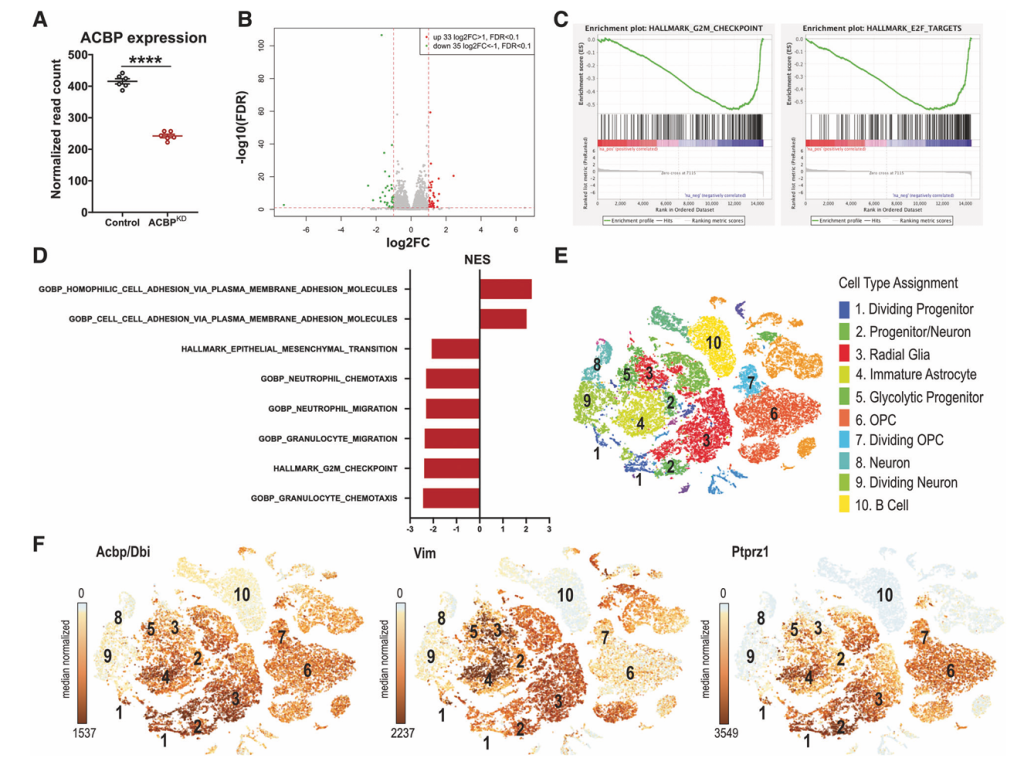
在动物体内,ACBP/DBI 可通过协调乙酰辅酶 A 代谢和酶活性,借助广泛的信号网络影响基因表达,实现代谢状态与基因调控的耦合 [22]。例如,在胶质母细胞瘤(成人最常见的恶性脑肿瘤)中,ACBP/DBI 高表达可通过介导 LCA-CoA 线粒体转运、促进脂肪酸氧化为肿瘤生长与侵袭供能;敲低 ACBP/DBI 会导致乙酰辅酶 A 生成减少,抑制组蛋白乙酰化进而引发广泛基因表达变化,证实其对肿瘤相关基因调控的影响 [23]。
尽管 ACBPs 在 “调节乙酰辅酶 A 水平” 与 “调节 NMT 活性” 中的作用依赖于 LCA-CoA 结合,但其部分功能(如胞外 ACBP/DBI 的食欲刺激作用)无需该相互作用,这种 “依赖与非依赖 LCA-CoA” 的双重功能,进一步体现其在基因调控与信号传导中的多样性 [7,15,23]。
ACBP downregulation affects cell migration and invasion transcriptional pathways in GBM cells.
ACBP/DBI 与人类疾病的关联及潜在治疗价值
1
代谢性疾病:从 2 型糖尿病到库欣综合征
如前所述,ACBP/DBI 在 T2DM 的发生发展中具有双重作用:一方面,ACBP 基因的 rs2084202 位点多态性与 T2DM 风险降低相关,提示遗传层面的保护作用 [26];另一方面,在 T2DM 患者的心脏中 ACBP 表达上调,通过干扰心肌代谢(抑制葡萄糖利用)和结构(结合 MyBPC3)导致心肌功能障碍,提示组织特异性的致病作用 [25]。通过 SILEC-SF 技术已揭示 T2DM 心肌细胞中亚细胞特异性代谢变化,为 ACBP 调控 T2DM 心肌脂质代谢的机制提供了佐证 [10]。这种矛盾现象可能源于 ACBP/DBI 在不同组织中的功能特异性,也表明靶向 ACBP/DBI 治疗 T2DM 需考虑组织靶向性。
在库欣综合征(由内源性糖皮质激素升高或外源性糖皮质激素使用引起)中,ACBP/DBI 是关键的致病性因子:库欣综合征患者和模型小鼠的血浆 ACBP/DBI 浓度均显著升高,而通过六种不同方法(诱导 ACBP/DBI 自身抗体、注射中和性单克隆抗体、全身或肝细胞特异性敲除 DBI 基因、突变 ACBP/DBI 受体 GABRG2、注射三碘甲状腺原氨酸(T3)、注射甲状腺激素受体 β 激动剂雷美替罗阻断 DBI 转录)抑制 ACBP/DBI 后,均可完全消除库欣综合征的临床表现,包括食物摄入增加、体重增加、脂肪过度堆积、肝损伤、高甘油三酯血症和 T2DM [35]。这一研究明确了 ACBP/DBI 作为库欣综合征治疗靶点的可行性,为该疾病的精准治疗提供了新方向。
Metabolic effects of ACBP/DBI neutralization in mice undergoing glucocorticoid treatment
2
癌症:从风险标志物到免疫治疗靶点
ACBP/DBI 与癌症的关联主要体现在三个方面:风险预测、疾病进展调控和免疫治疗响应。
在风险预测方面,血浆 ACBP/DBI 水平随年龄和 BMI 升高而增加,而高龄和肥胖是癌症的重要风险因素;进一步研究发现,因 BRCA1、BRCA2 和 TP53 基因突变导致癌症易感综合征的患者,以及在确诊癌症前 0-3 年的无已知易感综合征患者,其血浆 ACBP/DBI 水平均显著高于年龄和 BMI 匹配的无癌对照组,表明 ACBP/DBI 是癌症发生的独立风险标志物 [36]。
在疾病进展调控方面,小鼠实验证实,通过基因敲除或抗体中和抑制 ACBP/DBI,可显著延缓癌症的发生或进展 [36]。在分子机制上,ACBP/DBI 可通过介导 LCA-CoA 线粒体转运、促进脂肪酸氧化为肿瘤生长与侵袭供能,例如在胶质母细胞瘤中,敲低 ACBP/DBI 可降低肿瘤细胞的侵袭与增殖能力,同时因乙酰辅酶 A 生成减少抑制组蛋白乙酰化,引发广泛基因表达变化 [23]。
在免疫治疗响应方面,在乳腺癌、非小细胞肺癌和肉瘤的化学免疫治疗模型中,中和 ACBP/DBI 可增加肿瘤组织中未耗竭效应 T 细胞的浸润,同时减少调节性 T 细胞(Treg)的浸润,从而增强抗肿瘤免疫应答,改善癌症控制效果 [36]。这些发现表明 ACBP/DBI 是 “可干预的自噬检查点”,靶向 ACBP/DBI 有望成为癌症免疫治疗的新策略。
在特定癌症类型中,ACBP/DBI 的作用具有组织特异性:在结直肠癌(CRC)中,DBI 与 CRC 风险降低相关(OR=0.79,95% CI=0.69-0.90),且 DBI 表达水平与肿瘤免疫微环境的良性重塑相关(与 Treg、骨髓来源的抑制性细胞(MDSC)呈负相关,与活化的 CD8+T 细胞和 CD4+T 细胞呈正相关),同时 DBI 高表达与 CRC 患者生存期改善及免疫治疗应答率提高相关,提示 DBI 在 CRC 中发挥保护性作用 [37]。而在肌层浸润性膀胱癌(MIBC)中,DBI 是静止期癌症干细胞(CSC)的关键基因,其表达水平与肿瘤组织学分级正相关;进一步研究预测,对乙酰氨基酚可通过降低 DBI 表达,减少 CSC 的干细胞特性,从而抑制 MIBC 的耐药性和复发,为 MIBC 的 CSC 靶向治疗提供了新候选药物 [33]。
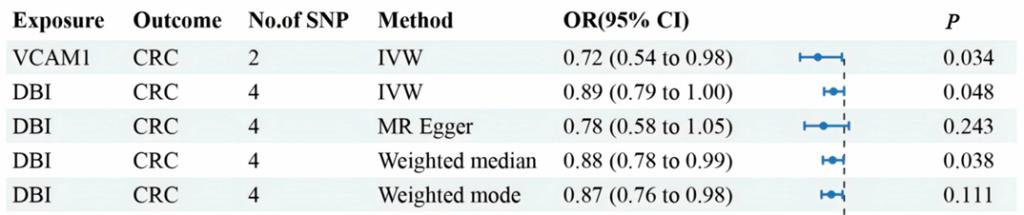
Forest plots illustrating the results of the validation stage for essential cis-pQTLs in UKB-PPP
3
神经精神疾病:ASD、神经退行性疾病与血压调节
在 ASD 中,ACBP/DBI 的功能异常主要集中在 GABA 能信号通路:DBI 作为 GABA 受体的变构结合蛋白,在 ASD 伴严重语言障碍的患者中表达显著降低,且其表达量与 ADI-R 量表中语言相关条目的评分相关,提示 DBI 可能通过调控 GABA 能信号影响 ASD 患者的语言功能 [19];此外,在 ASD 相关的拷贝数变异(CNV)分析中,DBI 所在的 GABA 能信号通路是关键通路之一,进一步支持 DBI 在 ASD 发病中的作用 [18]。同时,胞外 ACBP/DBI 作为神经肽结合 GABAA 受体的功能,也为其调控 ASD 相关神经信号提供了额外机制 [1]。
在伴痴呆的神经退行性疾病中,ACBP/DBI 的脑脊液水平呈现疾病特异性变化:阿尔茨海默病和伴痴呆的帕金森病患者脑脊液 DBI 升高,亨廷顿舞蹈症患者降低,这种变化被推测与不同疾病中 GABA 能系统的损伤程度和模式相关,有望成为神经退行性疾病诊断和鉴别诊断的潜在生物标志物 [21]。
在血压调节中,ACBP/DBI 通过参与突触活动,介导基因 – 抑郁症状(DEPR)的相互作用,影响血压稳态:在一项涵盖 564,680 名不同人群(非洲裔、亚裔、欧洲裔、西班牙裔)的全基因组关联研究(GWAS)中,DBI 被鉴定为与血压相关的基因 – DEPR 相互作用位点之一,且该位点在非欧洲裔人群中更为显著,提示 DBI 在情绪障碍与高血压共病中的作用,为高血压的个体化治疗(尤其是合并抑郁症状的患者)提供了新思路 [30]。
4
炎症性肠病(IBD):黏膜保护与免疫调节
在 IBD 中,ACBP/DBI 主要通过甲基化调控参与溃疡性结肠炎(UC)的发病:DBI 基因的 cg11066750 位点甲基化可通过增强 DBI 表达,发挥保护 UC 的作用;同时,DBI 蛋白水平升高与 UC 发病风险降低相关(OR=0.79,95% CI=0.69-0.90),提示 DBI 可能通过调节肠道黏膜免疫或代谢,减轻 UC 的炎症损伤 [28]。这一发现不仅丰富了 IBD 的发病机制(尤其是肠 – 脑相互作用层面),也为 UC 的靶向治疗提供了新候选分子。
5
肠道微生物与 ACBP/DBI:无显著生理关联
尽管 ACBP/DBI 在人类代谢中发挥关键作用,但人类肠道微生物组中 ACBP/DBI 的同源基因极为罕见,仅存在于少数致病性或环境性微生物(如酿酒酵母、奇异劳特罗普菌、克斯特氏不动杆菌)中,且这些微生物的丰度与 BMI 无关联 [14]。对 1899 份健康个体肠道样本的生物信息学分析表明,微生物来源的 ACBP/DBI 样蛋白在生理状态下不影响人类的体重调节,提示人类自身的 ACBP/DBI 是代谢调控的主要执行者,而肠道微生物 ACBP/DBI 的作用可能仅在特定病理(如致病性微生物感染)条件下显现 [14]。
总结与展望
ACBP/DBI 作为一种进化保守的蛋白质,其功能覆盖神经调节、代谢调控、自噬抑制和基因表达耦合等多个领域,展现出 “多效性” 特征 —— 在动物中,可通过 LCA-CoA 依赖途径调控脂质代谢、乙酰辅酶 A 介导的基因表达及自噬,通过 LCA-CoA 非依赖途径影响 GABA 能神经信号与食欲 [1]。同时,ACBP/DBI 与多种人类疾病(代谢性疾病、癌症、神经精神疾病、IBD)密切相关,既可为疾病的诊断和风险预测提供生物标志物,也可作为潜在治疗靶点。
当前研究已明确 ACBP/DBI 在库欣综合征、癌症免疫治疗、T2DM 心肌功能障碍中的治疗潜力,但仍存在若干待解决的问题:一是 ACBP/DBI 在不同组织中的功能特异性机制(如在 CRC 中的保护作用与在 MIBC 中的致病作用);二是 ACBP/DBI 与其他信号通路(如 GABAAR、PPARγ)的相互作用网络在不同疾病中的差异;三是组织特异性靶向 ACBP/DBI 的药物研发(如针对心肌或肿瘤微环境的抑制剂)。
未来通过整合多组学技术(单细胞测序、代谢组学)、模式动物研究及新型 LCA-CoA 检测技术,有望进一步揭示 ACBP/DBI 的功能多样性机制。
此外,跨物种比较研究可明确 ACBP/DBI 功能的进化保守性与特异性,为理解 “代谢 – 基因 – 疾病” 调控网络提供统一框架,推动其在疾病诊断和治疗中的临床转化 [22,36]。
参考文献:
1.Thierry Alquier, et al. From benzodiazepines to fatty acids and beyond: revisiting the role of ACBP/DBI. Trends Endocrinol Metab. 2021 Nov;32(11):890-903.
2.E Costa 1, et al. Diazepam Binding Inhibitor (DBI): A Peptide with Multiple Biological Actions. Life Sci. 1991;49(5):325-44.
3.Islinger M, et al. The diversity of ACBD proteins – from lipid binding to protein modulators and organelle tethers. BBA-Molecular Cell Research 2020 1867: 118675.
4.Neess D, et al. Long-chain acyl- CoA esters in metabolism and signaling: Role of acyl-CoA binding proteins. Progress in Lipid Research 2015 59:1–25.
5.Grevengoed TJ, Klett EL, Coleman RA. 2014. Acyl-CoA metabolism and partitioning. Annual Review of Nutrition 34:1–30.
6.Montegut L. Abdellatif M. Motino O. Madeo F. Martins I. Quesada V. Lopez-Otin C. Kroemer G. 2023 Acyl coenzyme A binding protein (ACBP): an aging- and disease-relevant “autophagy checkpoint” Aging Cell 22: e13910. Moradi A, Lung SC, Chye ML. 2024. Interaction of Soybean (Glycine max (L.)
7.Soupene E, Schatz UA, Rudnik-Schoneborn S, Kuypers FA. 2020. Requirement of the acyl-CoA carrier ACBD6 in myristoylation of proteins: activation by ligand binding and protein interaction. PLoS ONE 15: 229718.
8.Sijing Li, et al. Elevated plasma levels of the appetite-stimulator ACBP/DBI in fasting and obese subjects. Cell Stress 2021
9.Schmidt RR, Fulda M, Paul MV, Anders M, Plum F, Weits DA, Kosmacz M, Larson TR, Graham IA, Beemster GTS et al. 2018. Low-oxygen response is triggered by an ATP-dependent shift in oleoyl-CoA in Arabidopsis. Proceedings of the National Academy of Sciences, USA 115: E12101.
10.Trefely S, Huber K, Liu J, Noji M, Stransky S, Singh J, Doan MT, Lovell CD, von Krusenstiern E, Jiang H et al. 2022. Quantitative subcellular acyl-CoA analysis reveals distinct nuclear metabolism and isoleucine-dependent histone propionylation. Molecular Cell 82: 447–462.
11.Wang W, Wang P, Zhu L, Liu B, Wei Q, Hou Y, Li X, Hu Y, Li W, Wang Y et al. 2024. An optimized fluorescent biosensor for monitoring long-chain fatty acyl-CoAs metabolism in vivo. Biosensors and Bioelectronics 247: 115935.
12.Petrescu AD, Payne HR, Boedecker A, Chao H, Hertz R, Bar-Tana J, Schroeder F, Kier AB. 2003. Physical and functional interaction of Acyl-CoA-binding protein with hepatocyte nuclear factor-4 alpha. Journal of Biological Chemistry 278: 51813–51824.
13.van Aalten DM, DiRusso CC, Knudsen J. 2001. The structural basis of acylcoenzyme A-dependent regulation of the transcription factor FadR. European Molecular Biology Organization 20: 2041–2050.
14.A. M. Thomas, et al. Genes Encoding Microbial Acyl Coenzyme A Binding Protein/Diazepam-Binding Inhibitor Orthologs Are Rare in the Human Gut Microbiome and Show No Links to Obesity. Applied and Environmental Microbiology 2021
15.Joseph A, Moriceau S, Sica V, Anagnostopoulos G, Pol J, Martins I, Lafarge A, Maiuri MC, Leboyer M, Loftus J et al. 2020. Metabolic and psychiatric effects of acyl coenzyme A binding protein (ACBP)/diazepam binding inhibitor (DBI). Cell Death & Disease 11: 502.
16.Bravo-San Pedro JM, Sica V, Martins I, Pol J, Loos F, Maiuri MC, Durand S, Bossut N, Aprahamian F, Anagnostopoulos G et al. 2019. Acyl-CoA-binding protein is a lipogenic factor that triggers food intake and obesity. Cell Metabolism 30: 754–767.
17.Chen H, Moriceau S, Joseph A, Mailliet F, Li S, Tolle V, Duriez P, Dardennes R,Durand S, Carbonnier V et al. 2024. Acyl-CoA binding protein for the experimental treatment of anorexia. Science Translational Medicine 16: 715.
18.A. Griswold, et al. Evaluation of copy number variations reveals novel candidate genes in autism spectrum disorder-associated pathways. Human Molecular Genetics 2012
19.Chatravee Pichitpunpong, et al. Phenotypic subgrouping and multi-omics analyses reveal reduced diazepam-binding inhibitor (DBI) protein levels in autism spectrum disorder with severe language impairment. PLoS ONE 2019
20.R. Breitling, et al. Pathogenesis of peroxisomal deficiency disorders (Zellweger syndrome) may be mediated by misregulation of the GABAergic system via the diazepam binding inhibitor. BMC Pediatrics 2004
21.C. Ferrarese, et al. Cerebrospinal fluid levels of diazepam‐binding inhibitor in neurodegenerative disorders with dementia. Neurology 1990
22.Allegra Wundersitz, et al. Acyl-CoA-binding proteins: bridging long-chain acyl-CoA metabolism to gene regulation. New Phytol. 2025 Jun;246(5):1960-1966.
23.Duman C, Di Marco B, Nevedomskaya E, Ulug B, Lesche R, Christian S, Alfonso J. 2023. Targeting fatty acid oxidation via Acyl-CoA binding protein hinders glioblastoma invasion. Cell Death and Disease 14: 296.
24.N. Færgeman, et al. Acyl-CoA binding proteins; structural and functional conservation over 2000 MYA. Molecular and Cellular Biochemistry 2007
25.Teng Wu, et al. Metabolic Coordination Structures Contribute to Diabetic Myocardial Dysfunction. Circ Res. 2025 Apr 25;136(9):946-967.
26.E. Fisher, et al. Association of acyl-CoA-binding protein (ACBP) single nucleotide polymorphisms and type 2 diabetes in two German study populations. Molecular Nutrition & Food Research 2007
27.A. Joseph, et al. Effects of acyl-coenzyme A binding protein (ACBP)/diazepam-binding inhibitor (DBI) on body mass index. Cell Death and Disease 2021
28.Meng Zhang, et al.Multi-omics insight into the molecular networks of mental disorder related genetic pathways in the pathogenesis of inflammatory bowel disease.Translational Psychiatry 2025
29.Gerasimos Anagnostopoulos, et al. An obesogenic feedforward loop involving PPARγ, acyl-CoA binding protein and GABAA receptor. Cell Death and Disease 1 April 2022
30.Songmi Lee, et al.A Large-Scale Genome-wide Association Study of Blood Pressure Accounting for Gene-Depressive Symptomatology Interactions in 564,680 Individuals from Diverse Populations. Research Square 2025
31.Kaiyrzhanov R, Rad A, Lin SJ, Bertoli-Avella A, Kallemeijn WW, Godwin A, Zaki MS, Huang K, Lau T, Petree C et al. 2024. Bi-allelic ACBD6 variants lead to a neurodevelopmental syndrome with progressive and complex movement disorders. Brain 147: 1436–1456.
32.Yeetong P, Tanpowpong N, Rakwongkhachon S, Suphapeetiporn K, Shotelersuk V. 2023. Neurodevelopmental disorder, obesity, pancytopenia, diabetes mellitus, cirrhosis, and renal failure in ACBD6-associated syndrome: a case report. Neurology Genetics 9: e200046.
33.Jiaxi Yao, et al. Single-Cell Sequencing Reveals that DBI is the Key Gene and Potential Therapeutic Target in Quiescent Bladder Cancer Stem Cells. Frontiers in Genetics 2022
34.Léa Montégut, et al. DBI/ACBP is a targetable autophagy checkpoint involved in aging and cardiovascular disease. Autophagy 2022
35.Hui Pan, et al. Pathogenic role of acyl coenzyme A binding protein (ACBP) in Cushing’s syndrome. Nat Metab. 2024 Dec;6(12):2281-2299.
36.Léa Montégut, et al.Neutralization of the autophagy-repressive tissue hormone DBI/ACBP enhances anticancer immunosurveillance.Autophagy. 2024 Dec;20(12):2836-2838.
37.Ting Tian, et al. DBI as a Novel Immunotherapeutic Candidate in Colorectal Cancer: Dissecting Genetic Risk and the Immune Landscape via GWAS, eQTL, and pQTL. Biomedicines 2025


