ESC | 降脂靶点的演变:从分子机制到转化意义
- boke
- 2025-09-19
- 4:28 下午
2025年发表于《欧洲心脏病学杂志》的专题综述,系统梳理了降脂治疗靶点的演变历程,涵盖现有成熟靶点与新型在研靶点,结合分子机制、临床证据及研发进展,为血脂异常与心血管疾病(CVD)的治疗提供了全面参考。
核心背景
疾病负担:CVD 是全球首要致死 / 致残原因,血脂异常是关键可改变风险因素;传统以低密度脂蛋白胆固醇(LDL-C)为核心靶点,但患者仍存在显著残余风险。
风险扩展:致动脉粥样硬化脂蛋白谱从 LDL-C 扩展至富含甘油三酯(TG)的脂蛋白(VLDL、IDL)、脂蛋白 (a) [Lp (a)],且载脂蛋白 B(ApoB)因反映致动脉粥样硬化颗粒数量,被证实是更优的 CVD 风险预测指标。
临床价值:降脂及脂蛋白调控靶点领域正不断发展,为对现有疗法耐药或存在特定脂质谱异常的患者提供了新策略。
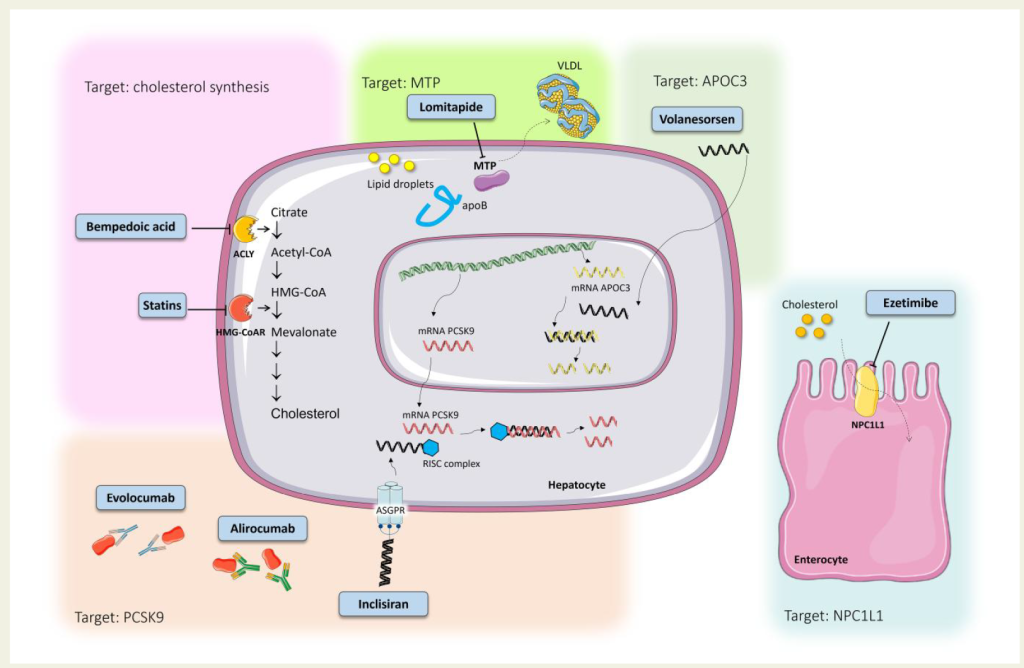
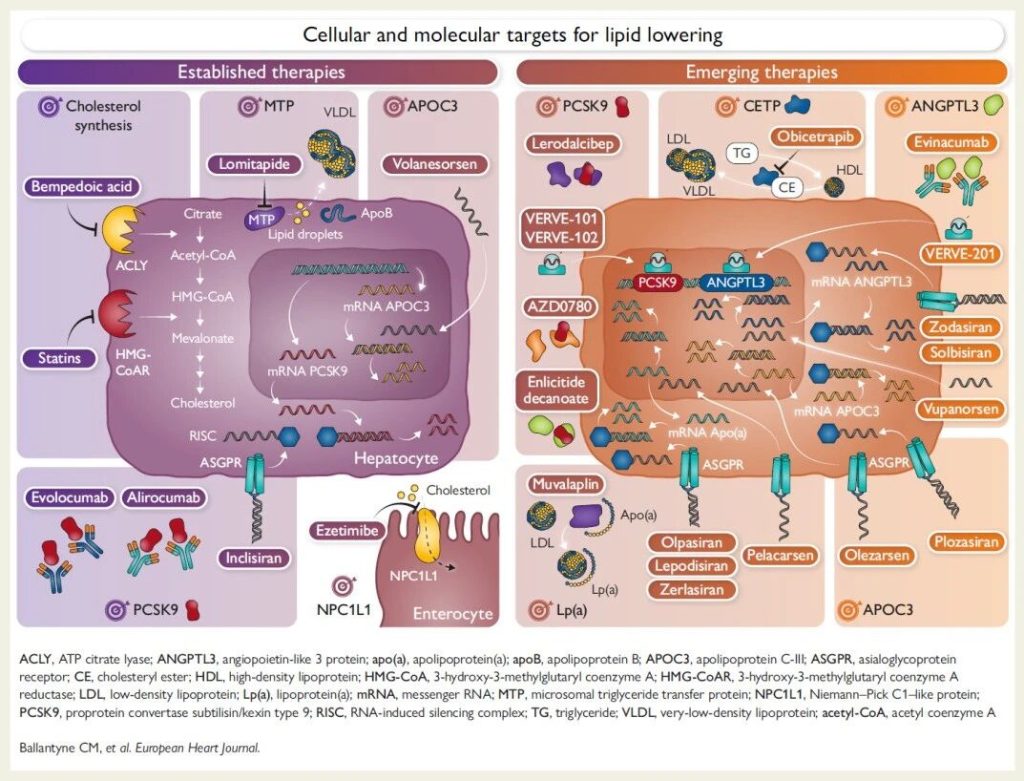
Figure 1 Cellular and molecular targets of current lipid-lowering therapies.
一
现有降脂靶点
HMG-CoAR
代表性药物:他汀类
HMG-CoAR 是胆固醇合成通路中的限速酶,也是降脂治疗的关键靶点,尤其用于治疗高胆固醇血症。HMG-CoAR 的抑制主要通过他汀类药物实现:他汀类药物降低胆固醇合成速率,导致细胞内胆固醇水平下降,进而代偿性上调 LDLR 表达,增加血液中 LDL 颗粒的摄取,显著降低循环 LDL-C 水平。
他汀类药物的随机对照试验(RCT)一致显示其临床获益:不同剂量和强度的他汀类药物可使 LDL-C 水平降低 30%-50%,且在一级和二级预防中均能降低心血管风险。
一项纳入 14 项他汀类药物随机试验、共 90056 名参与者的荟萃分析显示,他汀类药物使 LDL-C 水平降低约 1 mmol/L,可安全地将 5 年内主要冠脉事件、血运重建和缺血性卒中的发生率降低约 20%。
另一项纳入 26 项随机试验、共 17 万名参与者的荟萃分析表明,通过强化他汀治疗进一步降低 LDL-C,相较于非强化他汀治疗,可进一步降低主要血管事件的发生率,即使在 LDL-C 浓度较低的人群中也是如此。
综上,HMG-CoA 还原酶是重要的治疗靶点,可通过调节胆固醇水平助力 CVD 预防;他汀类药物抑制该酶,仍是临床实践中降脂治疗策略的核心。
ACLY
代表性药物:Bempedoic acid(贝派地酸)
ACLY(ATP 柠檬酸裂解酶) 在脂肪酸和胆固醇合成中起核心作用:它催化细胞质中柠檬酸转化为乙酰辅酶 A 和草酰乙酸,这是为脂肪酸和胆固醇合成提供乙酰辅酶 A 的关键步骤。鉴于其在细胞脂质通路中的核心地位,ACLY 已成为代谢紊乱(尤其是高胆固醇血症)的潜在治疗靶点。
贝派地酸是一种 ACLY 抑制剂,可抑制内源性胆固醇合成,为无法耐受他汀类药物或需进一步降脂的患者提供了替代选择。事实上,贝派地酸是一种前体药物,需在肝脏中被极长链酰基辅酶 A 合成酶 1(仅在肝细胞中表达,在骨骼肌细胞中完全缺失)转化为活性形式,这意味着 ACLY 抑制仅发生在肝脏,而不涉及其他组织。
贝派地酸可使 LDL-C 降低约 20%-30%,且因其活性形式仅在肝脏中生成,可能减少他汀类药物常见的肌肉相关副作用。
在 CLEAR 结局试验中,贝派地酸使他汀不耐受患者的主要不良心血管事件风险总体降低 13%,在高风险一级预防人群中降低 30%。
综上,贝派地酸靶向 ACLY,有助于控制胆固醇水平并降低心血管风险,尤其适用于无法耐受他汀类药物或需额外降脂治疗的患者。
PCSK9
PCSK9 是一种丝氨酸蛋白酶,主要在肝脏合成并分泌到血浆中。它与 LDLR 结合后,会促进 LDLR 的溶酶体降解,从而抑制其在细胞表面的再循环 —— 这导致 LDLR 表面表达减少、LDL 摄取受损,最终使血浆 LDL-C 水平升高。
目前已有多种策略用于靶向 PCSK9 治疗高胆固醇血症:
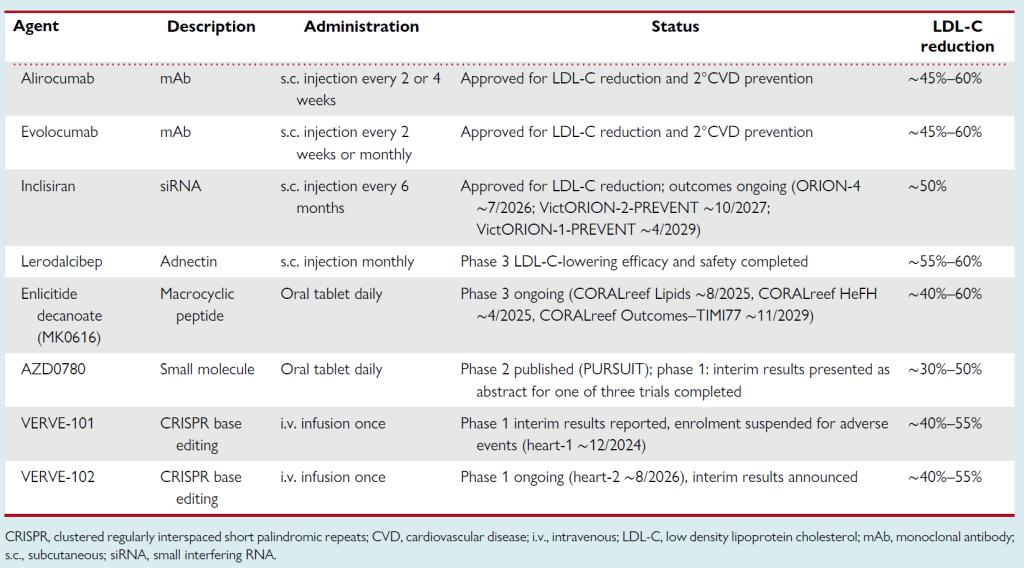
Table 1 PCSK9-targeting therapies: stage in development
单克隆抗体:靶向循环 PCSK9 的依洛尤单抗(evolocumab)和阿利西尤单抗(alirocumab)已获批用于高胆固醇血症和 CVD 治疗,在最大耐受剂量他汀类药物和依折麦布的基础上,可使 LDL-C 水平降低高达 50%-60%,并使主要不良心血管事件减少 50%。
基因沉默药物:英克司兰(inclisiran,一种小干扰 RNA,siRNA)可实现相似的 LDL-C 降低效果,已获批用于该适应症;其心血管结局试验目前正在进行中。
其他在研策略:
口服抑制剂MK0616:凭借其大环结构,结合 PCSK9 中与 LDLR 的 EGF-A 结构域相互作用的关键区域,阻止 PCSK9 与 LDLR 结合。II期试验显示,其可使高胆固醇血症成人患者的 LDL-C 降低高达 60%,III 期试验(包括结局研究)正在进行中。
小分子口服 PCSK9 抑制剂 AZD0780:结合 PCSK9 C 端结构域的口袋,抑制 PCSK9-LDLR 复合物的溶酶体转运(与上述阻断结合的机制不同,但同样可上调 LDLR 表达以降低 LDL-C)。在高胆固醇血症患者的 II 期试验(PURSUIT)中,AZD0780 可使 LDL-C 降低约 30%-50%,且不良事件发生率与安慰剂相似,存在剂量依赖性降脂效果及达标率提升。
Lerodalcibep:一种由 PCSK9 结合结构域(锚蛋白)和人血清白蛋白组成的小型重组融合蛋白,可高特异性、高亲和力结合 PCSK9,设计为患者每月皮下注射一次小剂量。II 期研究显示,在最大耐受剂量他汀类药物治疗仍有 LDL-C 升高的患者中,Lerodalcibep可使 LDL-C 降低 77%;在杂合子家族性高胆固醇血症(HeFH)患者中,可降低约 60%(近 70% 患者的 LDL-C 降低≥50%),安全性与安慰剂相似。III 期试验显示,在高 / 极高心血管风险且需进一步降脂的患者中,治疗 52 周时 LDL-C 降低约 60%,90% 的参与者同时实现 LDL-C 降低≥50% 及达到 ESC/EAS 推荐目标。然而,在纯合子家族性高胆固醇血症(HoFH)患者中比较Lerodalcibep与依洛尤单抗的 3 期交叉试验中,Lerodalcibep未显示出非劣效性(LDL-C 降低率分别为 4.9% 和 10.3%)。
基因编辑药物 VERVE-101:一种基于 CRISPR 的碱基编辑疗法,旨在永久性灭活肝脏中的 PCSK9。在 HeFH 患者(平均 LDL-C 为 193 mg/dL)的 Ib 期临床试验(Heart-1)中期结果中,高剂量单次静脉输注可使 LDL-C 降低 39%-55%。尽管早期概念验证结果积极,但因不良事件暂停入组;采用不同脂质纳米颗粒递送系统的类似基因编辑药物 VERVE-102 的 Ib 期试验(Heart-2)正在进行中,14 名参与者的初步数据显示,高剂量时 LDL-C 呈剂量依赖性降低 46%-53%。
NPC1L1
代表药物:依折麦布
NPC1L1(尼曼 – 皮克 C1 样蛋白 1) 是一种跨膜蛋白,主要定位于肠细胞的顶膜,作为固醇转运体,介导小肠中膳食胆固醇的吸收,并平衡胆固醇的肝胆排泄 —— 通过将胆固醇从肠腔转运至肠细胞,NPC1L1 参与全身胆固醇代谢。
人群研究表明,高胆固醇吸收是 ASCVD 的独立预测因素;且 NPC1L1 基因功能缺失变异与血浆 LDL-C 水平降低、冠心病风险降低相关,基于此,NPC1L1 被列为血脂异常的潜在治疗靶点。
依折麦布是 NPC1L1 抑制剂,通过抑制肠道胆固醇吸收,间接上调肝脏 LDLR 表达,从而有效降低血浆胆固醇水平。
在 “改善结局:依折麦布联合辛伐他汀疗效国际试验(IMPROVE-IT)” 中,急性冠脉综合征患者接受辛伐他汀联合依折麦布治疗,相较于辛伐他汀单药治疗,心血管事件发生率降低。这一证据支持他汀类药物联合依折麦布作为血脂异常治疗的基石,开启了降脂联合治疗的现代时代。
与此一致,RACING 试验显示,在 ASCVD 患者中,中等强度他汀联合依折麦布在 3 年心血管事件方面不劣于高强度他汀单药治疗,且联合治疗组达到 LDL-C <70 mg/dL 的患者比例更高。
在耶拿目标队列研究(Jena auf Ziel)中,心肌梗死入院时即启动高强度他汀(阿托伐他汀 80 mg)联合依折麦布治疗,80% 的患者实现 LDL-C <55 mg/dL。
在 SWEDEHEART 注册研究中,心肌梗死后早期启动高强度他汀联合依折麦布治疗,34% 的患者达到非 HDL-C 目标,且早期达标患者后续心血管事件风险降低。
另一项 SWEDEHEART 分析显示,心肌梗死后 1-12 周内启动他汀 – 依折麦布联合治疗的患者,心血管事件风险低于晚期启动或未启动依折麦布的患者(尽管基线时对照组存在差异)。
MTP
代表药物:洛美他派
MTP (微粒体甘油三酯转移蛋白)定位于肝细胞和肠细胞的内质网,介导含 ApoB 脂蛋白的形成。MTTP 基因的严重突变可导致无 β 脂蛋白血症(一种罕见遗传病,特征为缺乏含 ApoB 的脂蛋白),提示抑制 MTP 可能降低循环中胆固醇和含 ApoB 脂蛋白的浓度。
洛美他派(lomitapide)是一种 MTP 抑制剂,通过直接减少脂蛋白合成,以不依赖 LDLR 的途径降低 LDL-C 水平。因此,洛美他派被研发并获批用于 HoFH 患者的治疗 —— 即使携带 LDLR 无效突变的 HoFH 患者,也可实现≥40% 的 LDL-C 降低。洛美他派治疗可使大部分 HoFH 患者停止脂蛋白血浆置换治疗。
在洛美他派的长期随访(>9 年)中,观察到肝脏改变,但未伴随临床相关的肝损伤迹象。监测肝脂肪蓄积和肝酶水平至关重要,且应配合低脂饮食,以最大限度降低发生肝脂肪变性及其并发症的风险。
尽管如此,MTP 抑制仍是少数可通过不依赖 LDLR 机制有效降低 LDL-C 的策略之一,这使洛美他派成为 HoFH 患者的优势药物。
二
新型降脂靶点
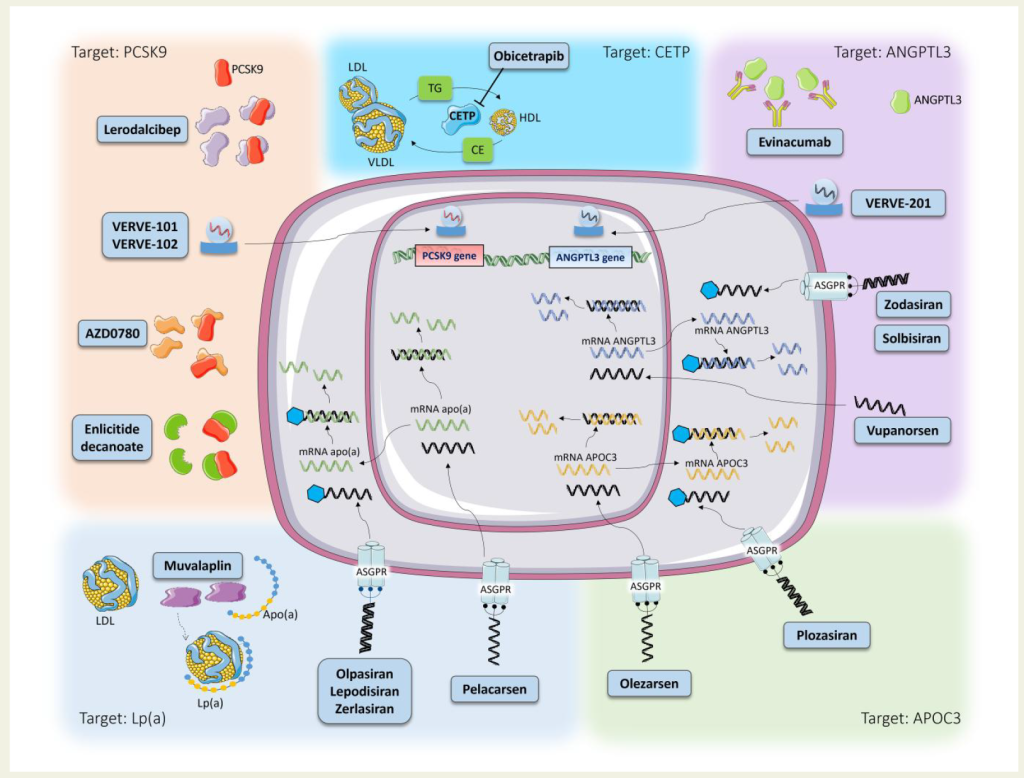
Figure 2 Cellular and molecular targets of novel lipid-lowering therapies.
ANGPTL3
ANGPTL3(血管生成素样蛋白 3) 仅在肝脏中产生,在脂质代谢中起重要作用:分泌到血液后,ANGPTL3 会抑制脂蛋白脂肪酶(LPL),从而减少富含甘油三酯脂蛋白的清除,升高血浆 TG 水平;同时,它还会抑制主要作用于 HDL 中磷脂的内皮脂肪酶。
ANGPTL3 功能缺失突变的个体表现为 TG、HDL-C 和 LDL-C 水平降低,即 “家族性复合低脂血症”;ANGPTL3 缺陷与冠心病风险降低相关,提示抑制 ANGPTL3 可能是降低 LDL-C 水平和心血管风险的有效手段。值得注意的是,ANGPTL3 抑制带来的 LDL-C 降低不依赖于 LDLR 活性,这对 LDLR 残余功能极少的 HoFH 患者尤为重要。
靶向 ANGPTL3 的主要药物:
依维苏单抗(Evinacumab):一种靶向循环 ANGPTL3 的单克隆抗体,无论 HoFH 患者的 LDLR 功能如何,均可使其 LDL-C 降低 50%。长期开放标签试验证实,依维苏单抗总体耐受性良好,且降脂效果可维持长达 2.5 年;有报道显示,两名携带 LDLR 无效突变的儿童患者使用依维苏单抗后,动脉粥样硬化斑块出现消退;此外,依维苏单抗还可使难治性高胆固醇血症(包括 HeFH)患者的 LDL-C 降低 > 50%。
武帕诺森(Vupanorsen):一种 N – 乙酰半乳糖胺(GalNAc)修饰的反义寡核苷酸(ASO),靶向肝脏 ANGPTL3 mRNA。尽管武帕诺森可降低糖尿病、肝脂肪变性和高甘油三酯血症患者的血浆 TG 和含 ApoB 致动脉粥样硬化脂蛋白水平,但在高胆固醇血症患者中,其对 LDL-C 和 ApoB 的降低效果温和,且与肝脂肪蓄积增加相关,因此已终止临床研发。
佐达西兰(Zodasiran, ARO-ANG3):一种 GalNAc 偶联的 siRNA,靶向肝脏 ANGPTL3 mRNA。在混合性血脂异常成人患者中,佐达西兰治疗 24 周可显著降低 TG 水平;目前正在进行 II 期试验,评估其在 HoFH 患者中的疗效(NCT05217667)。
索尔比西兰(Solbisiran, LY3561774):另一种 GalNAc 偶联的 siRNA,靶向 ANGPTL3。在混合性血脂异常患者的 II 期剂量递增试验中,中剂量索尔比西兰使 ApoB 降低 14%(主要终点)、TG 降低 50%、LDL-C 降低 17%;尽管 ANGPTL3 降低呈剂量依赖性(54%-77%),但低剂量和高剂量时 ApoB 降低无统计学意义。
- VERVE-201:
一种体内 CRISPR 碱基编辑疗法,旨在改变 ANGPTL3 基因中的单个 DNA 碱基,永久性灭活其肝脏表达,从而持久降低 LDL-C 和 TG 水平。临床前数据显示,VERVE-201 可精准且永久性灭活 ANGPTL3,有望成为 HoFH 等高风险患者的治疗选择;目前正在进行 VERVE-201 在难治性高胆固醇血症患者中的 Ib 期试验(NCT06451770)。
APOC3
ApoC-III(载脂蛋白 C-III) 存在于富含甘油三酯脂蛋白(如 VLDL、乳糜微粒及其残粒)表面,也存在于 HDL 表面。ApoC-III 在脂质代谢中的核心作用是抑制脂蛋白脂肪酶(LPL)——LPL 是负责血液中 TG 水解的关键酶。
ApoC-III 水平升高与高甘油三酯血症相关,因它会损害富含甘油三酯脂蛋白的清除;APOC3 功能获得性突变与高甘油三酯血症相关,而功能缺失性突变则与 TG 水平降低、脂质谱整体改善、富含甘油三酯脂蛋白清除增强以及动脉粥样硬化和冠心病风险显著降低相关。这些发现使 APOC3 成为降低 TG、减少心血管风险的潜在治疗靶点。
目前研发的 APOC3 降低药物(包括 2 种 ASO 和 1 种 siRNA),旨在治疗高 TG 患者、预防动脉粥样硬化,同时降低急性胰腺炎风险,重点针对家族性乳糜微粒血症综合征(FCS,一种主要由 LPL 基因突变引起的罕见常染色体隐性疾病)或高甘油三酯血症患者:
沃拉诺森(Volanesorsen):一种第二代 ASO,特异性靶向 APOC3 mRNA。在高甘油三酯血症患者中,沃拉诺森单药或联合稳定贝特类治疗时,可呈剂量依赖性降低 ApoC-III(高达 80%)和 TG(高达 71%),且对 FCS 患者同样有效。但沃拉诺森治疗与血小板减少症风险增加相关,因此需研发肝细胞特异性更高的其他策略。
奥列扎森(Olezarsen):一种 GalNAc 偶联的 ASO,选择性靶向肝脏 ApoC-III 合成。其核酸序列与沃拉诺森相同,但 GalNAc 基团使其给药频率更低、剂量显著降低。在中度高甘油三酯血症且高风险 / 已确诊 CVD 的患者中,奥列扎森显著降低 TG 水平和致动脉粥样硬化脂蛋白;在 FCS 患者中,奥列扎森使 ApoC-III 降低 81%、TG 降低 59%,且治疗 53 周时,安慰剂组发生 11 次急性胰腺炎,奥列扎森各剂量组均仅发生 1 次。奥列扎森已获美国食品药品监督管理局(FDA)批准用于降低 FCS 患者的 TG,且被欧洲药品管理局(EMA)指定为 FCS 治疗的孤儿药。目前正在进行奥列扎森的 III期试验,进一步评估其安全性和疗效,包括 CORE CS5–TIMI 72a 和 CORE2 CS6–TIMI 72b,以及 ESSENCE CS9–TIMI 73b。
普洛扎森(Plozasiran):一种 GalNAc 偶联的 siRNA,旨在抑制肝脏 ApoC-III 生成。在混合性血脂异常患者中,皮下注射普洛扎森(10 mg、25 mg、50 mg,第 1 天和第 12 周给药,即每季度 1 次)可使 TG 降低 50%-62%;50 mg 剂量每半年给药 1 次(第 1 天和第 24 周)可使 TG 降低 44%(安慰剂对照,II 期 MUIR 试验)。在 10% 的安慰剂组参与者和 20% 的 50 mg 季度剂量组参与者中观察到血糖控制恶化,但 25 mg 剂量组无此现象,该剂量已进入正在进行的 3 期试验。此外,普洛扎森在严重高甘油三酯血症患者中同样有效(II 期 SHASTA-2 试验中,90% 的患者 TG 降至急性胰腺炎风险阈值以下),且在 FCS 患者中显著降低 TG 水平和胰腺炎发生率(III 期 PALISADE 试验)。核磁共振分析显示,普洛扎森使富含甘油三酯脂蛋白数量减少约 50%,并使 LDL 颗粒分布向更大、可能致动脉粥样硬化性更低的颗粒偏移。
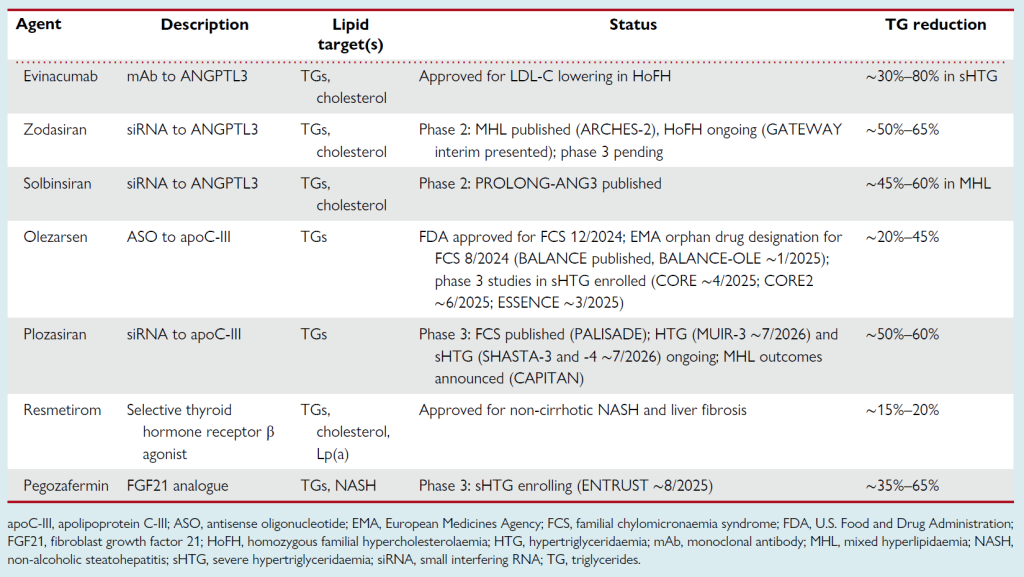
Table 2 Triglyceride-rich lipoprotein-targeting therapies: stage in development
FGF21
代表药物:培戈扎芬
FGF21(成纤维细胞生长因子 21) 是一种主要由肝脏分泌的激素,在脂肪组织、骨骼肌和胰腺中也有表达,可调节脂质和葡萄糖代谢及能量消耗,但因其半衰期短,作为药物靶点的潜力受限。
培戈扎芬(Pegozafermin)是一种 FGF21 类似物,通过位点特异性糖基转移酶进行 PEG 化修饰,以延长其活性、减缓降解,目前正研发用于治疗高甘油三酯血症和非酒精性脂肪性肝炎(NASH)。
在严重高甘油三酯血症患者中,培戈扎芬使 TG 降低 44%;在 NASH 患者中,培戈扎芬可改善肝纤维化。目前正在进行培戈扎芬在严重高甘油三酯血症患者中的 III 期试验(NCT05852431)。
CETP
代表药物:奥比特拉派
CETP(胆固醇酯转移蛋白) 促进 VLDL 和 LDL 中的 TG 与 HDL 中的胆固醇酯交换。遗传研究表明,CETP 活性低与脂蛋白谱改善、心血管事件发生率降低相关,这促使研究人员探索 CETP 抑制对血浆脂质和 CVD 结局的影响 —— 最初重点是升高 HDL-C 水平,而强效 CETP 抑制剂还可降低血浆 LDL-C 和 ApoB 水平。
目前临床研发中最强效的 CETP 抑制剂是奥比特拉派(Obicetrapib):在高强度他汀治疗仍不达标的患者中,加用奥比特拉派可使 LDL-C 降低 50%,并降低 ApoB、非 HDL-C 和 Lp (a) 水平;奥比特拉派联合依折麦布可使 LDL-C 降低 63%。
近期 3 期 BROOKLYN 试验证实,在 HeFH 患者中,奥比特拉派单药联合最大耐受 lipid-lowering therapy(LLT),较安慰剂使 LDL-C 降低 36%;
类似的 BROADWAY 试验显示,在 HeFH 和 / 或 ASCVD 患者中,奥比特拉派较安慰剂使 LDL-C 降低 33%。
在 TANDEM 试验中,奥比特拉派 – 依折麦布固定剂量复方片剂较安慰剂使 LDL-C 降低 49%,较依折麦布单药降低 28%,较奥比特拉派单药降低 17%;
目前正在进行一项心血管计算机断层扫描血管造影研究,评估该固定剂量复方对冠状动脉粥样硬化斑块体积的影响。
奥比特拉派的潜在获益似乎与 ApoB 和 LDL-C 的共同降低直接相关,提示 CETP 抑制可降低不同类型的致动脉粥样硬化脂蛋白。
值得注意的是,一项 II 期试验将评估开放标签奥比特拉派单药及后续联合依洛尤单抗对 Lp (a) 水平升高患者的影响(NCT06496243)。
CETP 抑制剂药理学领域仍存在知识空白,包括:抑制胆固醇酯向 VLDL 和 LDL 颗粒的转移如何促进其分解代谢;CETP 活性变化是否会影响其他生理功能,从而可能使 CETP 抑制剂在其他领域(如败血症、黄斑变性、阿尔茨海默病等神经系统疾病)得到再利用。
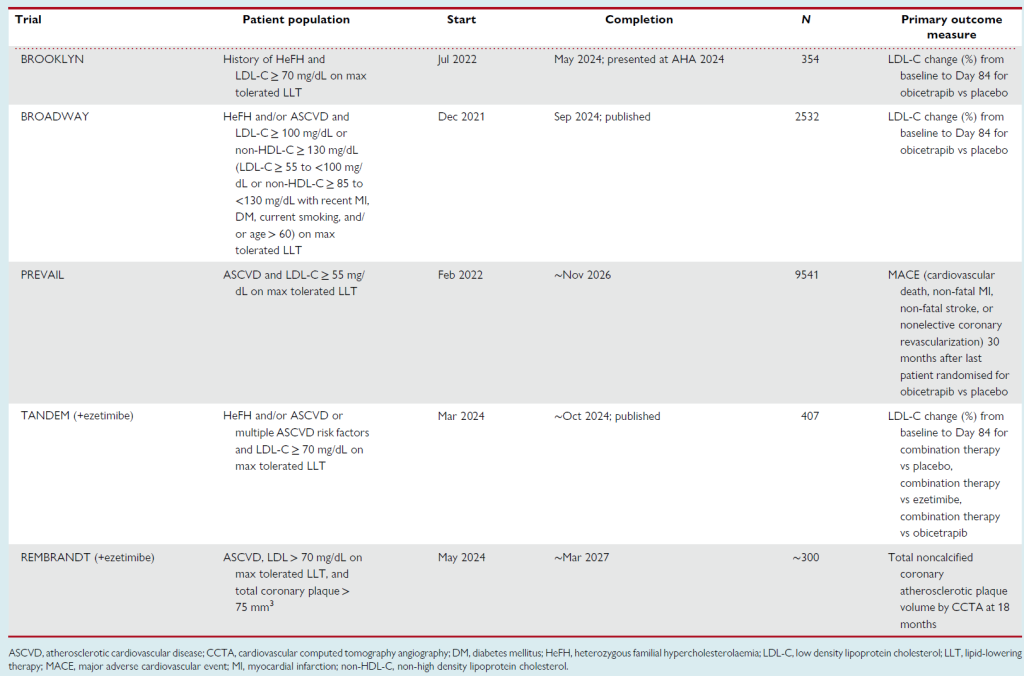
Table 3 CETP-targeting therapy in development: obicetrapib phase 3 trials
apo (a)
Lp (a) 是一种类似 LDL 的颗粒,其 ApoB 与 apo (a) 共价结合。Lp (a) 水平升高是 CVD(包括主动脉瓣狭窄、心肌梗死、卒中)的风险因素。遗传和流行病学数据提示,在控制其他心血管风险因素的基础上靶向 Lp (a),可能降低 CVD 风险,尤其在极高风险患者中。
当前降脂疗法对 Lp (a) 水平的影响为中性或仅降低 20%-25%;现有数据显示,目前最强效的 CETP 抑制剂奥比特拉派可使 Lp (a) 降低高达 56%,选择性甲状腺激素受体 β 激动剂雷西替罗(Resmetirom)可使 Lp (a) 降低约 33%,但这些降幅似乎不足以抵消 Lp (a) 的致动脉粥样硬化潜力 —— 事实上,据估计需降低 > 80% 才具有临床有效性,因此需更强效的治疗方案。
尽管目前尚无专门获批用于降低血浆 Lp (a) 的药物,但多种治疗方案正处于临床研发阶段,包括:(i)反义寡核苷酸(ASO)、(ii)小干扰 RNA(siRNA)、(iii)Lp (a) 翻译后组装特异性抑制剂、(iv)基于 CRISPR-Cas9 的 apo (a) 基因编辑技术。其中,基因沉默策略目前在临床研发中进展最快。
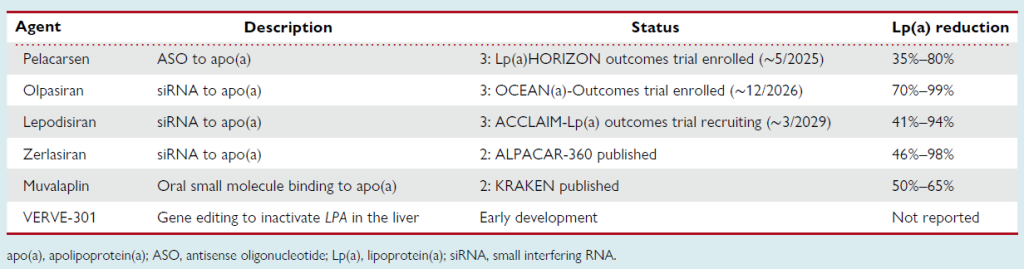
Table 4 Lipoprotein(a)-targeting therapies: stage in development
主要研发药物:
-
佩拉卡森(Pelacarsen):一种靶向 apo (a) 的 ASO,设计为结合成熟人 apo (a) mRNA 的第 24-25 外显子剪接位点(3901-3920 位)—— 该区域 DNA 序列无多态性,且在纤溶酶原 mRNA 中不存在,确保了选择性。在 CVD 合并血浆 Lp (a) 升高的患者中,佩拉卡森的临床试验显示 Lp (a) 降低 66%-92%。与此前易导致流感样症状(尤其血小板减少症)的 ASO 不同,佩拉卡森未引起血小板计数变化、肝肾功能异常,且流感样症状发生率与安慰剂无差异。目前正在进行 III 期随机心血管结局试验 Lp (a) HORIZON(随访 4 年),评估每月皮下注射 80 mg 佩拉卡森使 Lp (a) 降低 > 80%,是否可降低 CVD 合并 Lp (a) ≥70 mg/dL 患者的主要不良心血管事件风险(NCT04023552)。
-
奥帕西兰(Olpasiran)、泽拉西兰(Zerlasiran)、莱波地西兰(Lepodisiran):三种靶向 apo (a) mRNA 的 siRNA,均采用 GalNAc 化学修饰以选择性靶向肝脏,但药代动力学存在差异。奥帕西兰使 Lp (a) 降低 71%-98%,其心血管结局试验 OCEAN (a)-Outcomes–TIMI 75 正在 Lp (a) 水平极高的患者中进行(NCT05581303);泽拉西兰和莱波地西兰可快速使 Lp (a) 降低 > 90%,且时间平均降幅 > 80%;莱波地西兰的 III 期心血管结局研究 ACCLAIM-Lp (a) 正在招募患者(NCT06292013);泽拉西兰的 II 期研究 ALPACAR-360 已发表。
-
穆瓦拉普林(Muvalaplin):一种口服小分子药物,通过结合 apo (a) 阻止其与 ApoB 结合,从而抑制 Lp (a) 形成。研究显示,穆瓦拉普林可使 Lp (a) 显著降低 50%-86%(II 期 KRAKEN 研究已发表)。
-
VERVE-301:一种通过基因编辑灭活肝脏中 LPA 基因的疗法,目前处于早期研发阶段,尚未报告 Lp (a) 降低幅度。
尽管上述方法几乎可完全清除循环中的 Lp (a),但在将 Lp (a) 降低纳入 CVD 风险降低策略之前,需明确这种降幅能在多大程度上转化为心血管保护作用。在等待心血管结局试验结果的同时,需监测长期极低血浆 Lp (a) 水平是否影响葡萄糖代谢 —— 因遗传因素导致血浆 Lp (a) 极低的个体,新发糖尿病风险增加。
三
结 论
-
机制突破:现有药物依赖 LDLR 途径,新型靶点(如 ANGPTL3、MTP)通过非 LDLR 机制,解决 HoFH、他汀不耐受等难治人群需求。
-
疗效升级:Lp (a) 需降 > 80% 才具临床意义,基因沉默(如Olpasiran)、口服小分子(Muvalaplin)等技术可实现强效降低,等待结局试验验证心血管获益。
-
临床策略:联合治疗是趋势(如他汀 + 依折麦布 + PCSK9 抑制剂),需结合患者风险分层(如极高危患者优先联合);同时需关注药物经济学与长期安全性(如肝脂肪、血糖影响)。
参考文献
Christie M. Ballantyne and Giuseppe D. Norata. The evolving landscape of targets for lipid lowering: from molecular mechanisms to translational implications. European Heart Journal (2025) 00, 1–14 https://doi.org/10.1093/eurheartj/ehaf606


