Early Check 项目中新生儿测序筛查(gNBS)的标准化Panel筛选与临床检测应用
- boke
- 2025-09-16
- 2:25 下午
研究背景与目标
新生儿筛查(NBS)的核心目标是早期识别可干预遗传病,以降低发病率与死亡率。近年来,两大进展为 NBS 带来机遇:一是罕见病新型疗法快速研发,二是基因组测序(GS)技术在公共卫生场景的可行性提升。然而,当前全球十余项gNBS研究中,“基因 – 疾病对”的筛选方法差异显著,导致基因列表重叠率低,阻碍跨研究比较与成果转化。
美国 Early Check 项目通过 “标准化Panel筛选+ 公共卫生场景应用”,开发了以 “可干预性” 为核心的标准化基因Panel,筛选形成高可干预性的 Panel 1 与潜在可干预性的 Panel 2,并在公共卫生场景中开展扩大gNBS。
项目第一阶段:Panel筛选逻辑,2021年启动采用GS技术筛查数百种罕见单基因疾病,基于“可干预性” 分层筛选逻辑确定筛选Panel;第二阶段:检测应用实例,2023年9月-2024年5月,招募参与者并应用Panel检测。以上研究分别于2024年9月、2025年9月在《Genetics in Medicine》、《Nature Medicine》上发表相应研究成果。

第一部分
Panel筛选逻辑
为确保纳入“基因 – 疾病对”的 “可干预性”与 “临床价值”,项目组建专业工作组(GPWG),筛选阶段通过 “基于年龄的半定量评分体系(ASQM)” 结合专家评审,确定 Panel 1 含 178 个“基因 – 疾病对”(169 个独特基因)、Panel 2 含 29 个“基因 – 疾病对”(29 个独特基因)。
1. 基因Panel工作组(GPWG)组建
2021 年成立的 GPWG 是筛选核心团队,成员涵盖 14 名跨领域专家:4 名临床遗传学家、1 名儿科医生、5 名遗传咨询师、1 名社会科学家(遗传咨询背景)、1 名遗传流行病学家、1 名转化基因组研究员及 1 名仅参与 Panel 2 评审的临床心理学家。成员均具备 NBS 或基因组测序经验,包括前 “新生儿与儿童遗传性疾病咨询委员会”主席、ClinGen 可干预性工作组成员,确保筛选决策的专业性与权威性。
2.分层筛选框架设计
框架核心是 “以可干预性为导向,区分高优先级与潜在优先级”,Panel 1 与 Panel 2 的筛选标准各有侧重,且均需通过技术与临床可行性验证。
Panel 1
Panel 1 (必筛,高可干预性)定位为 “与美国推荐统一筛查Panel(RUSP)核心疾病可比”:
标准:仅纳入 “生命前 2 年需启动干预”的疾病,参考 ASQM 评分(优先≥13 分),自动包含可测序的 RUSP 核心疾病(如囊性纤维化);
结果:178 个“基因 – 疾病对”(169 个独特基因),非 RUSP 疾病具备 “类 RUSP 属性”。
Panel 2
Panel 2 (可选,潜在可干预性)定位为 “未来可能升级至 Panel 1 的储备Panel”:
标准:纳入 “有获批疗法但缺新生儿干预证据” 或 “有儿童临床试验”的疾病(如杜氏肌营养不良);
结果:29 个“基因 – 疾病对”(29 个独特基因)。
3. 技术与临床可行性评估
筛选后的“基因 – 疾病对”需通过临床诊断实验室验证,剔除存在技术局限或临床报告风险的条目,最终 14 个“基因 – 疾病对”因技术局限性、临床风险及变异报告规则被剔除。
4. 跨研究比较结果
与 GUARDIAN 研究(同合作实验室):Panel 1 “基因 – 疾病对”重叠率 49%(共 87 个重叠条目),差异可能源于筛选方法不同;
与 6 项研究共识基因列表(55 个基因):47 个纳入 Panel 1,3 个(SLC25A15、SLC25A20、SLC2A1)因 “干预证据不足” 纳入 Panel 2,后续计划将 SLC2A1 调整至 Panel 1。
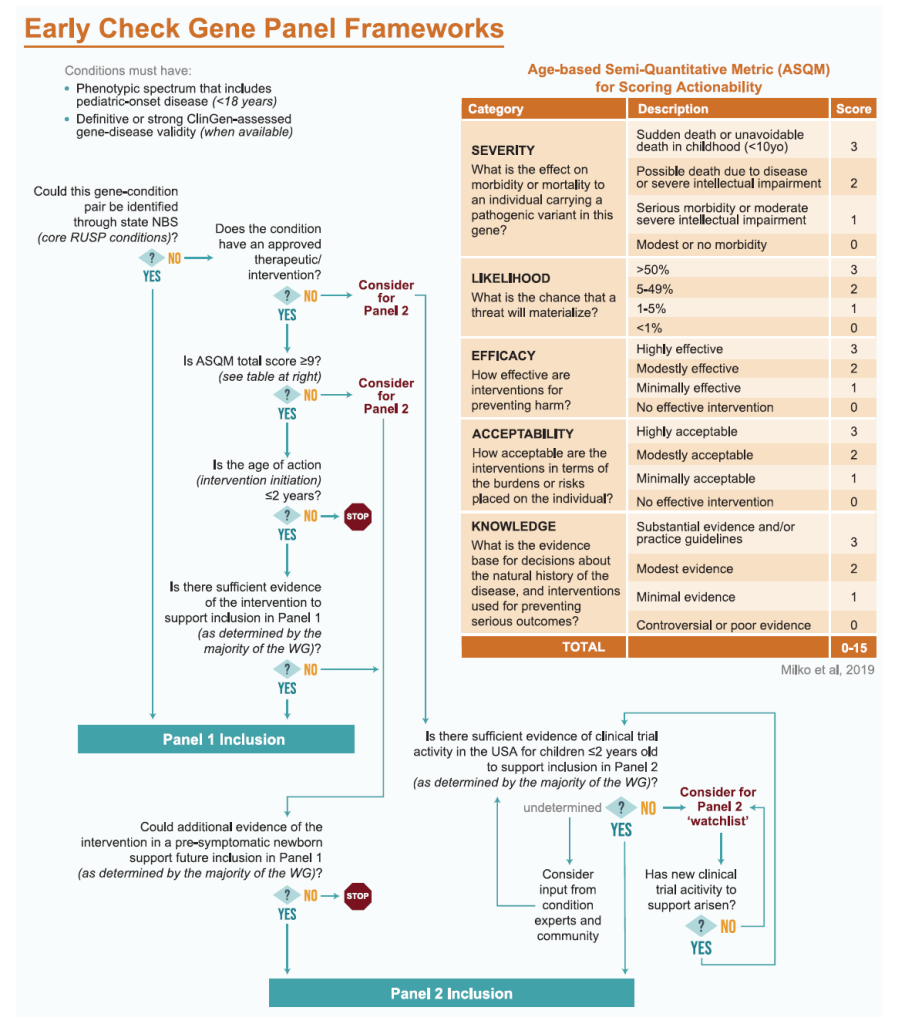
Figure 1 Early Check gene panel frameworks.
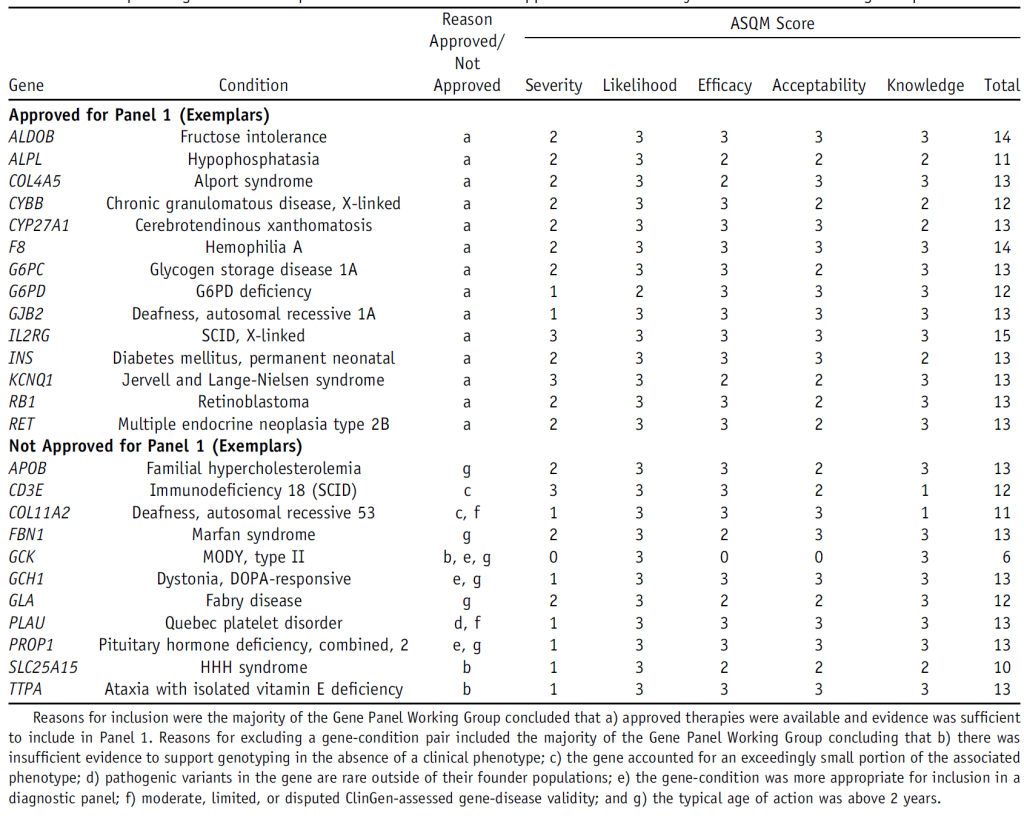
Table1 Examples of gene-condition pairs that were and were not approved for Panel 1by the Gene Panel Working Group.

第二部分
检测应用实例
2023 年 9 月至 2024 年 5 月(8.5 个月),项目基于上述Panel及干血斑(DBS)样本开展全州范围 gNBS 实践,共完成 1979 名新生儿筛查,验证了Panel在公共卫生场景的应用效果。
1.入组招募及人群特征
1.1招募情况
邮寄招募:向 42434 个新生儿家庭发送招募信,响应率约 5%(每 100 封信招募 5 人);
医院招募:接触 816 名产后母亲,71% 愿了解项目,32% 当场报名。
1.2人群特征
白人占比 58.8%(州占比 50.8%),黑人(7.3% vs 州 20.8%)、西班牙裔(5.2% vs 州 19.8%)覆盖不足。
2.筛查设计与执行
2.1 Panel选择
Panel 1:所有 1979 名新生儿均接受筛查(必筛);
Panel 2:82.9% 的家长选择额外筛查,但少数族裔母亲选择率显著更低(非裔 OR=0.37,西班牙裔 OR=0.43),可能与知情同意理解度、医疗信任度相关。
2.2 成功筛查率:93%(2125 名注册者中 1979 人完成)。
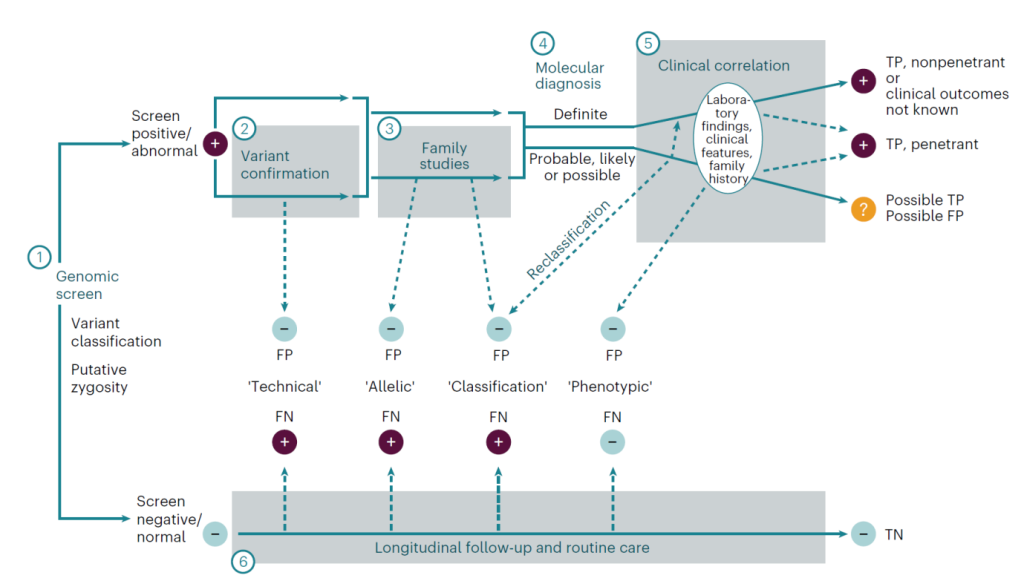
Figure 2 Rubric for categorizing screen-positive results.
3.筛查阳性结果
总阳性率:2.5%(50/1979 人),1 人同时携带 SCN1A(癫痫相关)与 MITF(黑色素瘤风险相关)双阳性。
Panel分布:Panel 1 占 47 例(94%),Panel 2 占 4 例(6%)。
核心病因:G6PD 缺乏症占阳性近半数(24 例,阳性率 1.2%),MITF 基因变异(脱靶结果,关联黑色素瘤风险)占 12 例(24%)。
调整后阳性率:排除 MITF 脱靶结果后为 2.0%,再排除 G6PD 后为 0.8%(更接近临床核心干预需求)。
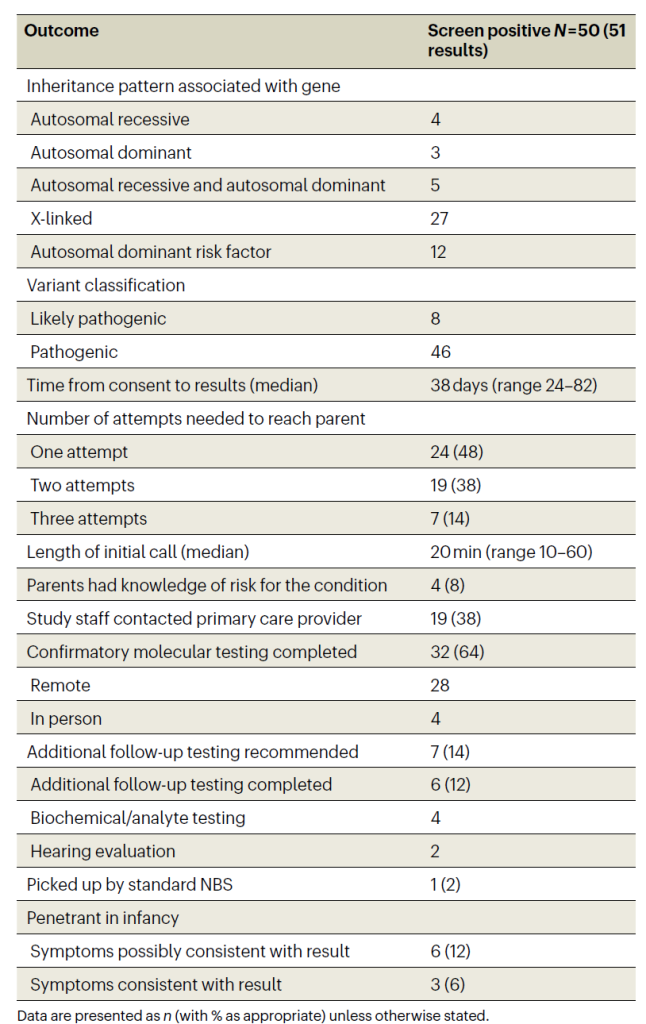
Table 2 Results and follow-up metrics for 51 screen-positive results in 50 participants
4.验证与随访
后续检测依从性:74% 的家长同意进一步验证,64% 提供口腔拭子,所有筛查变异均获实验室确认;17 人未完成验证,多为 G6PD/MITF 等非紧急情况。
额外评估:7 人需专项检测(如听力评估、生化检测),6 人完成,其中 2 人确诊听力损失(SLC26A4、TMPRSS3 基因变异)。
婴儿期外显率:多数阳性新生儿无症状,仅 6 人出现相关症状(3 例听力损失、5 例 G6PD 相关黄疸、1 例 SCN1A 相关癫痫样发作,其中 1 例为重叠症状)。
5.临床应用案例
早干预改善结局:SLC26A4 阳性婴儿新生儿期听力筛查通过,但 15 周随访发现听力下降趋势,8 个月佩戴助听器,18 个月已掌握 30-40 个单词 + 手语。
纠正误诊:TMPRSS3 阳性婴儿初诊为先天性巨细胞病毒感染,gNBS 明确为基因相关性听力损失,避免不必要的抗病毒治疗。
不确定性管理:Panel 2 中 MECP2 阳性(关联瑞特综合征)婴儿,8 个月神经发育正常,计划 2 岁再评估,平衡 “早期预警” 与 “过度焦虑”。
6.假阴性分析
gNBS 灵敏度(外显子组测序 88%)低于标准 NBS(串联质谱 99%),共发现 3 例假阴性,分三类:
技术性假阴性:镰状细胞病,gNBS 初判阴性,复核发现 HBB 纯合变异,因分析疏漏导致误判。
分类性假阴性:晚发性庞贝病,标准 NBS 检出 GAA 基因 P 变异 + 意义未明变异(VUS),gNBS 因不报告 VUS 仅判为携带者。
病因覆盖不足假阴性:先天性甲减,部分病例非单基因遗传,gNBS 未涵盖所有病因,无法确定是否可检测。
7. 分子诊断分类(标准化体系)
为统一结果解读,项目建立分子诊断分类体系,50 例阳性结果分布如下:
真阳性 / 疑似真阳性:28 例(55%),均获专科转诊与干预指导;
需延长随访:4 例(8%),可能为真阳性但症状未显现(如 MECP2 变异);
假阳性:17 例(34%),含 12 例表型假阳性(脱靶,如 MITF)、5 例等位基因假阳性(如顺式变异、隐性基因杂合子);
假阴性:2 例(4%,技术性、分类性各 1 例)。
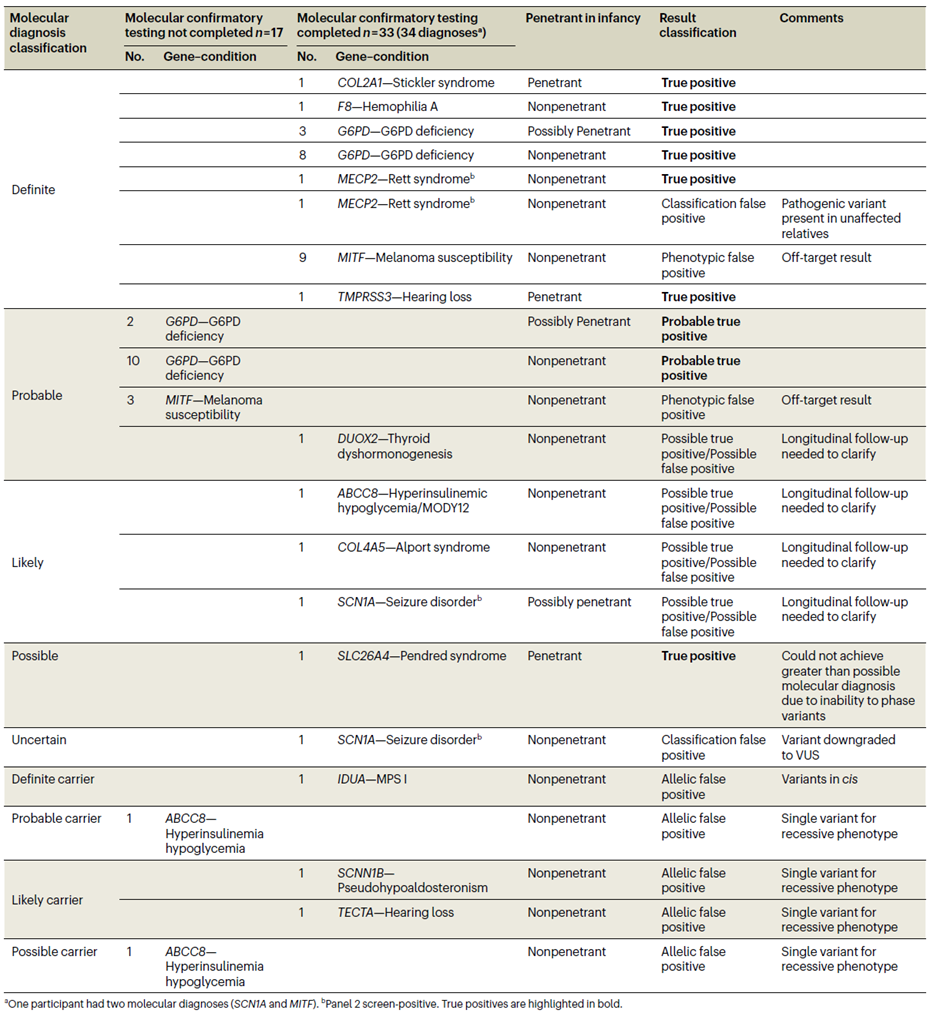
Table 3 Molecular diagnoses and result classification for the 50 screen-positive Early Check participants
第三部分
结论与挑战、展望
Early Check 项目构建的 “基于 ASQM 的分层筛选框架”,为新生儿测序Panel提供了透明、可重复的筛选方法,Panel 1 中非 RUSP 疾病的 “类 RUSP 属性” 证明其具备纳入公共卫生 NBS 的潜力;而 gNBS 应用实践验证了技术可行性,2.5% 的阳性率与临床效用案例(如听力损失早干预)凸显其补充价值。
然而,人群代表性不足、周转时间长、灵敏度低于标准 NBS 等问题,提示 gNBS 暂不能取代传统 NBS,需通过 “统一标准、技术升级、长期验证”逐步完善。
未来,随着跨研究协作深化与利益相关方参与,该框架与实践经验可为全球 gNBS 的公共卫生转化提供关键参考。
1.核心挑战
1.1筛选框架局限:人工整理与评审耗时耗力;主观性风险:GPWG 成员构成可能影响决策。
1.2检测应用问题:人群代表性不足、检测及报告周期长(无法满足紧急干预需求,如早发型代谢病)、资源压力、成本高。
2.未来方向
2.1 框架优化与标准化:
跨研究协作:依托 “国际新生儿测序联盟(ICoNS)”,推动建立全球统一的“基因 – 疾病对”筛选标准,减少研究间差异;
利益相关方参与:纳入患者家庭、少数族裔代表、初级保健医生,评估其对 “可干预性” 的优先级认知,平衡技术标准与实际需求。
2.2 技术与流程升级
技术整合:结合短读长(降成本)与长读长测序(提升复杂变异检测能力),整合串联质谱与 gNBS,互补提升灵敏度;
流程简化:优化 DBS 样本处理流程(如自动化 DNA 提取),缩短周转时间至 2 周内;开发多语言知情同意工具,提升少数族裔 Panel 2 选择率。
2.3 长期验证
临床结局研究:开展 5-10 年随访,验证 gNBS 早期干预对疾病预后的改善效果(如智力发育、并发症发生率);
卫生经济学评估:测算 gNBS 的成本效益(如避免重症监护的费用节约),为公共卫生报销提供依据。
参考文献:
1.Heidi L. Cope, et al. A systematic framework for selecting gene-condition pairs for inclusion in newborn sequencing panels: Early Check implementation. Genetics in Medicine (2024) 26, 101290. https://doi.org/10.1016/j.gim.2024.101290
2.Heidi L. Cope, et al. Feasibility and clinical utility of expanded genomic newborn screening in the Early Check program. Nature medicine 05 September 2025. https://doi.org/10.1038/s41591-025-03945-8


