伯科平台技术助力MRD临床应用转化
2021-03-25
MRD(Minimal Residual Disease),即微小残留病灶,指癌症患者在治疗中或治疗后体内仍有残留的恶性肿瘤细胞存在,细胞坏死或凋亡过程中释放出肿瘤循环DNA(Circulating tumor DNA,ctDNA)。同时也有NCCN指南和专家共识将MRD表示为Measurable Residual Disease,即可测量残留病灶[1]。MRD会引起癌症患者术后肿瘤复发,所以癌症患者需要监控MRD,监测术后肿瘤复发风险。

图1. MRD监测示意图
基于检测ctDNA的技术因其高灵敏度和无创、便捷等特点,优于传统的临床或影像学方法鉴定出有肿瘤复发的患者。但是ctDNA的检测受大量游离DNA(cell-free DNA,cfDNA)背景信号影响。因此,MRD检测应使用高灵敏度的检测技术。目前检测MRD的技术众多(详见图 2),而最广泛使用的检测技术是其中三种:
1)多参数流式细胞术(MFC),是一种快速、定量鉴定癌细胞的方法,其峰值灵敏度为0.01%,即检测出1万个正常细胞中的1个癌细胞。6色(或更多)流式细胞术分析是检测异常MRD免疫表型的最常用方法。
2)聚合酶链式反应技术,分为qPCR或RT-qPCR,可以根据其特有的遗传变异,如突变或染色体变异识别恶性肿瘤细胞;本质上是癌细胞的特定DNA片段被复制和扩增,使它们更容易检测和计数,因此即使癌细胞数量非常少,也能通过PCR检测出基因异常;
3)NGS是一种极为敏感的DNA测序方法,其峰值灵敏度为0.0001%,即100万个正常细胞中有1个癌细胞。NGS可以检测B/T细胞抗原受体基因的克隆性重排,作为新兴的MRD检测方法,已受到国内外专家认可并推荐。2017年版国际临床实践指南(NCCN)、和2017年版《中国多发性骨髓瘤诊治指南》均推荐NGS作为MRD检测方法。
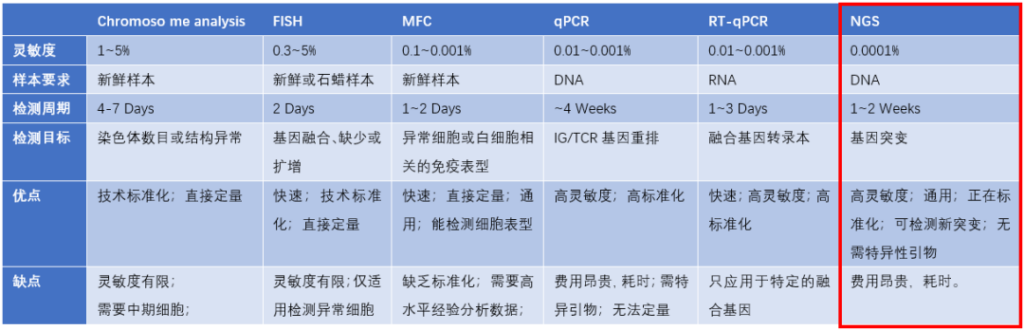
图2. 六种主流MRD检测技术比较[2]
总的来说,临床应用中,应根据不同治疗目的,选择合适的MRD检测方法。qPCR及RT-qPCR检测MRD的灵敏度较MFC高,但更为费时。NGS作为MRD检测的最新技术,进一步提高了MRD检测的灵敏度,对于评价治疗疗效、预测疾病复发、实施精准治疗具有重要的指导意义。
个体化定制方案
MRD检测最成熟也是最主要的应用是血液肿瘤,已成为NCCN临床标准实践的一部分,FDA唯一批准的MRD检测产品也仅用于血液疾病。但随着很多临床试验的推进,MRD近年也在慢慢扩展到实体肿瘤中,如乳腺癌,肺癌,结直肠癌,前列腺癌等,并以实验室自建方法(LDT)的方式参与临床决策[3-6]。目前实体肿瘤MRD的检测难度较大,主要体现在两方面:
1、不同实体瘤个体化差异大,即每个患者个体中仅携带非常少量、相同的基因突变,对panel的设计要求高。
2、早期实体瘤释放到外周血的ctDNA含量非常少(低于1%),对检测灵敏度要求极高。
针对上述难题有两种解决方案:①使用NGS大panel;②开发个性化的MRD检测panel。也就是目前采用ctDNA检测MRD主要存在两大技术路线:tumor-agnostic(仅基于血浆检测的固定panel)和tumor-informed(基于肿瘤组织测序的ctDNA个性化定制方案)[7]。
由于组织先验(tumor-informed)策略在检测灵敏度上的优势,目前许多肿瘤检测公司基于此进行开发。其技术路线为先检测与肿瘤发生发展相关基因的变异信息,形成每个患者的个性化基因变异图谱,将其纳入MRD检测;最后通过液体活检定向追踪患者血液中的个性化变异。
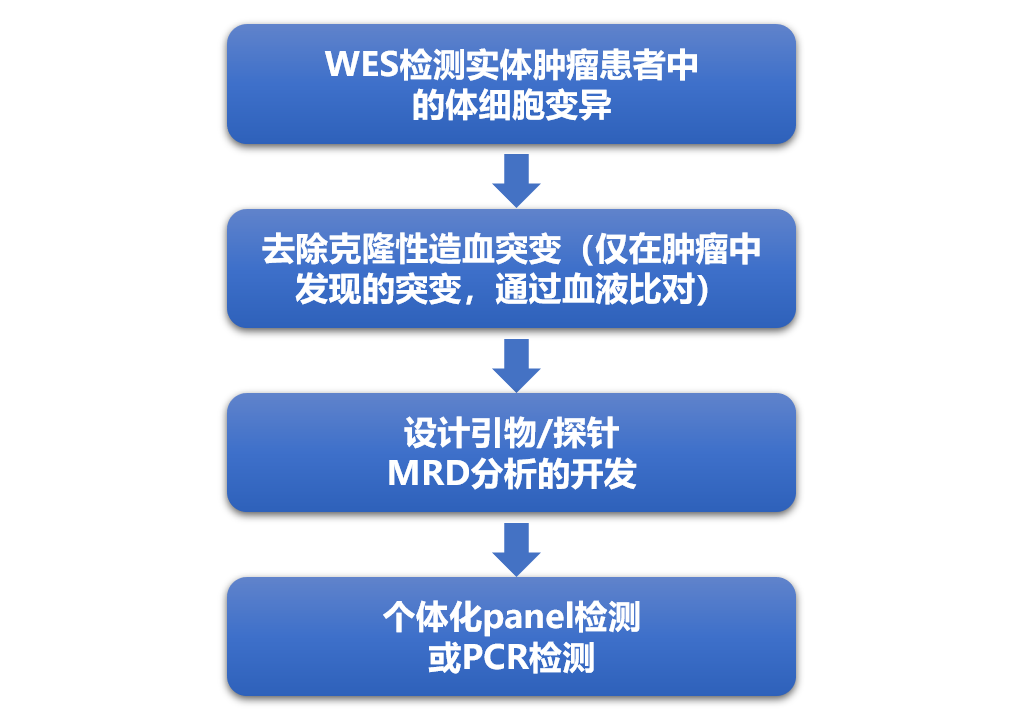
图3. tumor-informed策略技术路线[8]
如上图所示,通过采集患者肿瘤组织进行全外显子测序(WES),针对每位患者选取肿瘤特异性的克隆位点进行个性化定制NGS Panel(或使用多重PCR方法),在监测时提取血浆中的ctDNA进行超高深度测序,通常在术后约四周进行MRD检测。在一项研究中,相对于固定panel测序策略,可为病人多争取42%的时间采取适合的对策[6]。
与此同时,也有研究引入新的方法学进一步升级MRD检测。鉴于甲基化在肿瘤发生早期已有显著变异、变异位点数目丰富,这些表观基因组“标记”在不同患者之间甚至在不同癌症之间更相似,使其成为新MRD检测方法的可能(尤其是针对早期患者)。针对甲基化位点进行设计个性化Panel,这种多组学捕获可以对肿瘤治疗全过程进行精准、高效地全程监测。
伯科技术优势
1 Panel卓越的性能表现
不论是10Kb小Panel还是42Mb WES,伯科液相捕获芯片均展现出卓越的性能:优异捕获效率与均一性。因此能保证个性化的panel检测灵敏度,为MRD检测提供优质的工具。
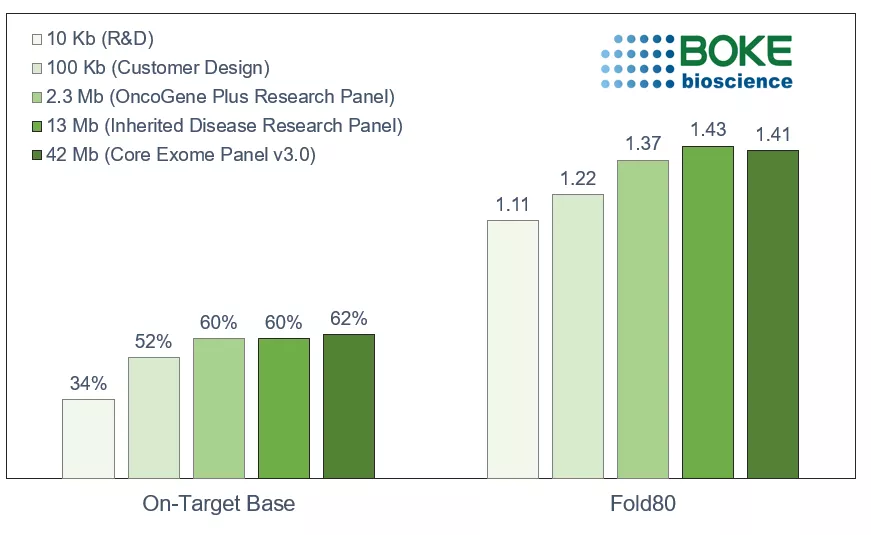
图4. 伯科设计的不同大小Panel性能表现(Dedup On-Target)
2 丰富的引物/探针设计经验,极速定制周期
快速针对患者选取肿瘤特异性的克隆位点设计引物/NGS Panel,最大程度实现MRD检测高特异性的同时,七天极速定制周期能极大满足临床术后约四周进行MRD检测的需求。
3 极大满足定制个性化Panel与Spike in需求
TRACERx研究发现大约12%的患者复发时是一个新原发肿瘤[9]。部分检测机构为了提高MRD检测灵敏度的同时降低检测成本,采用基础模块(癌症中常见的热点驱动基因突变位点)+个体化模块(个体化突变位点)组合个体化定制panel代替原有大panel进行MRD检测。不论是小区域还是大区间,不论是Spike-in到小Panel还是全外显子,伯科探针体系均能胜任,实现了MRD检测广度和深度上的完美结合。

图5. 不同大小Panel Spike in后的数据表现
4 拥有多组学共捕获Panel开发经验
例如DNA&RNA共捕获技术。随着检测技术的进步,可进一步支撑DNA&Methyl共捕获等技术流程的开发。
参考文献:
[1] Minimal Residual Disease (MRD).(n.d.). Minimal Residual Disease (MRD). Leukemia & Lymphoma Society.
[2] Chen Xueyan, Wood Brent L.,Monitoring Minimal Residual Disease in Acute Leukemia: Technical Challenges andInterpretive Complexities, Blood Reviews (2016), doi:10.1016/j.blre.2016.09.006
[3]Coakley Maria, Garcia-Murillas Isaac, Turner Nicholas C, MolecularResidual Disease and Adjuvant Trial Design in Solid Tumors. [J] .Clin CancerRes, 2019, 25: 6026-6034.
[4] NCCN Guidelines https://www.nccn.org/professionals/physician_gls/default.aspx
[5]Abbosh C, Birkbak NJ, Wilson GA, et al. Phylogenetic ctDNAanalysis depicts early-stage lung cancer evolution [published correctionappears in Nature. 2017 Dec 20]. Nature. 2017;545(7655):446-451.doi:10.1038/nature22364
[6] Coombes RC, Page K, Salari R, et al.Personalized Detection of Circulating Tumor DNA Antedates Breast CancerMetastatic Recurrence. Clin Cancer Res. 2019;25(14):4255-4263.doi:10.1158/ 1078-0432.CCR-18-3663
[7] Prof.Jeanne Tie, 2020.ASCO-GI
[8] Shannon chuai,ctDNA Methylation & Mutation — A Two-Dimensional MRD MethodIdentifies More At-risk Patients and Predicts DFS in NSCLC.
[9] Zviran, A. et al. Genome-widecell-free DNA mutational integration enables ultra-sensitive cancer monitoring.Nat Med 26, 1114–1124 (2020). https://doi.org/10.1038/ s41591-020-0915-3





