长文丨BS-free技术的来龙去脉
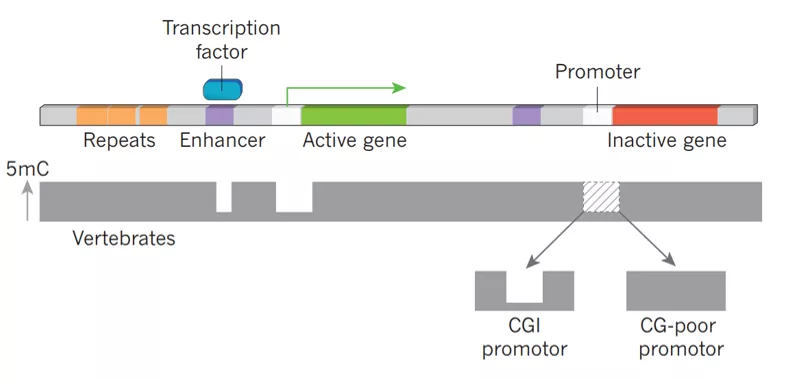
胞嘧啶(C)可能是ATCG四种碱基中最“忙碌”的一个。作为DNA上的“信号灯”,5-甲基胞嘧啶(5mC)像是红灯,基因表达停止;需要表达时,5mC还原为C,甲基化修饰被清除,绿灯行。这一神奇的化学修饰发生在基因的物理坐标上之后,赋予了固定碱基序列影响自身表达的生物学功能,因此,5mC也被称为“第五碱基”。
除了5mC外,C的5’修饰形式还包括5hmC,5fC和5caC ,5mC的修饰调控涉及到不同的化学反应和蛋白酶,这些生化过程的揭示给研究人员提供了一个“工具箱”,为5mC的酶学法检测奠定了基础。在真核生物中,5mC主要作为基因沉默的表观遗传标记,在发育、基因印迹、X染色体失活等生理过程中发挥作用;同样,在疾病发生时,5mC也会出现异常,比如肿瘤的发生,这也正是5mC作为分子标志物应用于辅助生殖、癌症筛查等领域研究的生物学基础。
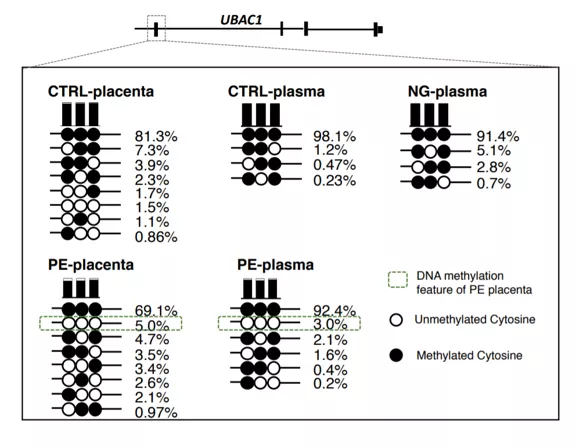
图1. 先兆子痫cfDNA甲基化标志物研究[1]
5mC和C在NGS检测时,都会被判读为C,二者无法区分(三代测序直测暂不纳入讨论)。因此,需要对5mC和C进行预处理,将二者转化为可以区分的碱基形式。
接下来,我们先来打开研究人员的转化工具箱,按照功能可以分成2类:
1. 脱氨基:Bisulfite,Borane,AID/APOBEC
2. 辅助工具:氧化:TET,K2RuO4;糖基转移:βGT

脱氨基工具
工具虽多先看关键,脱氨基工具,这是NGS检测胞嘧啶修饰的关键,C与U只差一个氨基,脱氨基后,C变为U,再被PCR扩增,U变为T,完成C到T的转化。同时,转化过程需要有特异性,比如,只转化5mC或C,而另一种不变。沿着这个思路,我们看看不同的脱氨基工具。
Bisulfite属于化学试剂,它也最为特殊,属于“独行侠”,它能将C转化为T,5mC和5hmC不变,只身一人就完成修饰到序列差异的转化。需要强调的是,由于不稳定中间产物的存在,Bisulfite会造成DNA严重损伤。因此,Bisulfite也有“面目全非盐”的称号,Bisulfite虽战功赫赫,科学家还是希望能有更好的BS-free技术的出现。
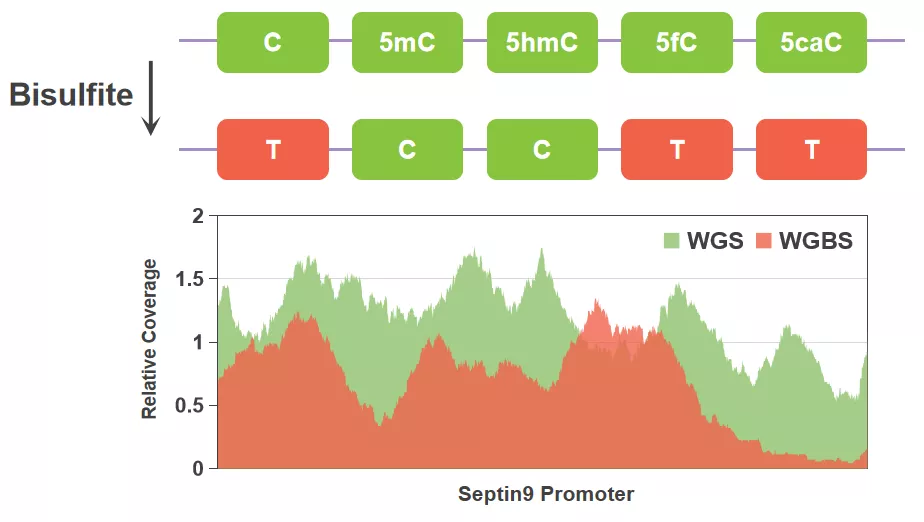
图2. 亚硫酸氢盐转化示意图及WGS/WGBS在Septin9启动子区域覆盖
另一种脱氨基工具Pyridine Borane也属于化学试剂,但与Bisulfite相比有两点不同,首先,Pyridine Borane转化5fC和5caC为U碱基类似物,但不转化C、5mC和5hmC,不能区分C和5mC,无法单独使用。其次,Pyridine Borane对DNA损伤低,是更理想的转化工具。
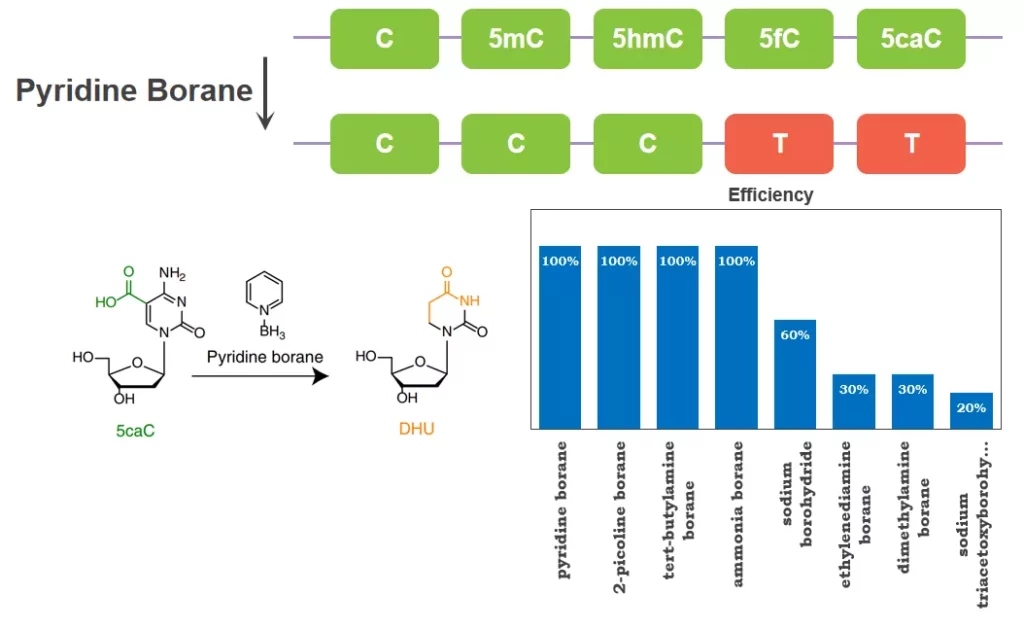
图3. Pyridine Borane转化示意图
最后一种脱氨基工具是蛋白酶家族AID/APOBEC,它在免疫系统中发挥着重要作用,具有脱氨基活性。在AID/APOBEC家族中,APOBEC3A (A3A)活性最高,如图4所示,A3A对C和5mC的脱氨基效率最高,对5hmC、5fC和5caC活性较低,A3A对5hmC的活性只有C的~1/5000。需要注意的是,由于A3A对5mC活性低于C,需要提高酶量来保证5mC的转化,但同时也会提高对hmC的脱氨基活性,尤其是TThmC(~10%)模块序列。此外,AID/APOBEC这种酶学脱氨工具也是不能区分C和5mC的,无法单独使用,同时还需要解决特异性的问题。
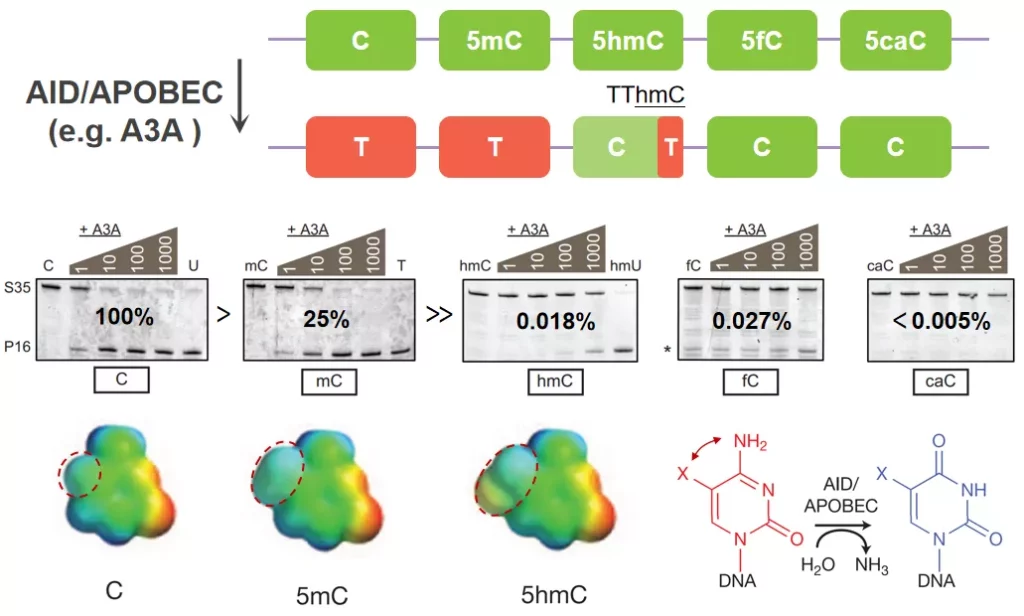
图4. AID/APOBEC转化示意图及不同的底物活性
脱氨工具介绍完了,我们简单总结一下,化学脱氨中,Bisulfite效率高、特异性好,但损伤大,Pyridine Borane损伤小,但只对5fC和5caC起作用,无法区分C和5mC;酶学法AID/APOBEC脱氨温和,但也不能区分C和5mC,同时还存在对5hmC非特异识别的问题。
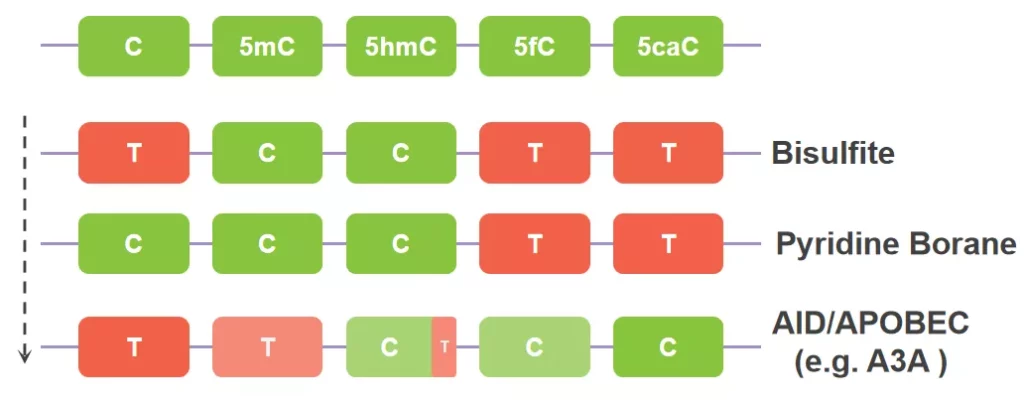
图5. 三种脱氨基工具
如果能够事先区分C和5mC,再结合Borane和AID/APOBEC脱氨基,问题就迎刃而解了,辅助工具是时候登场了。
辅助工具
TET(ten-eleven translocation)是一种α-酮戊二酸(α-KG)和Fe2+依赖的双加氧酶,在体内,TET可以催化5mC转化为5hmC,5hmC转化为5fC,5fC转化为5caC,再通过碱基修复过程还原为C,参与DNA去甲基化过程。此外,高钌酸钾也能选择性氧化5hmC为5fC。需要注意的是,TET更偏好5mC作为底物,对5hmC和5fC氧化效率较低。
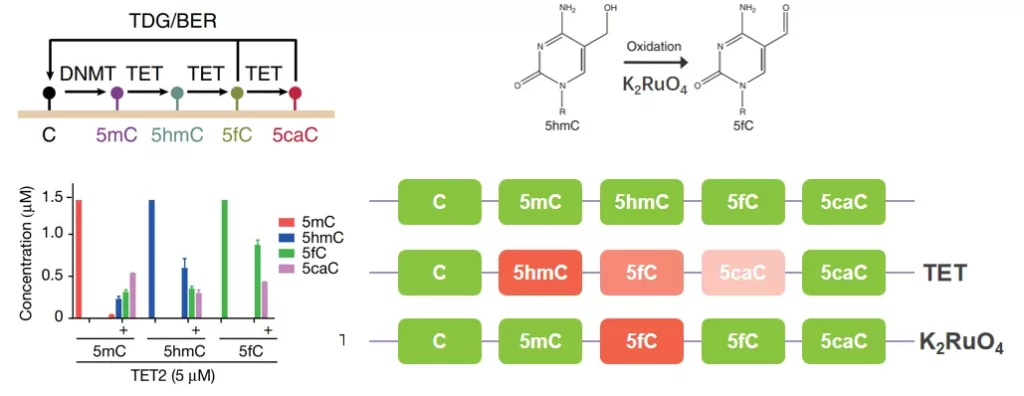
图6. TET和高钌酸钾氧化示意图
上文提到过量AID/APOBEC介导的脱氨基反应,会导致部分5hmC发生脱氨基的情况,这里介绍本文的最后一个辅助工具糖基转移酶βGT。噬菌体利用βGT抵抗宿主的免疫系统攻击(限制性内切酶),首先,噬菌体将宿主dNTP池中的dCTP替换为5hm-dCTP,进而复制出只含有5hmC的自身基因组,随后通过βGT将自身基因组中的5hmC修饰为5ghmC,逃避宿主限制性内切酶的切割。同样,5ghmC也能逃脱AID/APOBEC的识别,使用βGT将5hmC事先修饰为5ghmC,再进行AID/APOBEC脱氨基,这样就解决了5hmC被AID/APOBEC作为底物部分脱氨的背景问题。
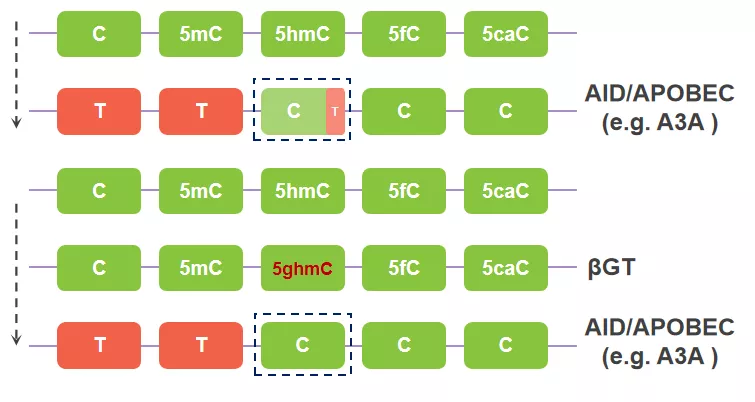
图7. βGT查漏补缺
好了,大部分工具都介绍完了,该看看研究人员如何巧妙的使用它们。我们先介绍一下EM-Seq,该流程如下,先通过TET2将5mC/5hmC/5fC向5caC方向氧化,但是这个流向中存在一个漏洞,由于Fe(IV)-羰基中间体的存在,TET2对5mC/5hmC/5fC的氧化反应效率有限,存在未被彻底氧化的5hmC,为了堵住这个漏洞,利用βGT对5hmC进行封闭保护,即使存在5hmC,在A3A进行脱氨基作用时,也不会被识别。这样,利用TET2氧化,βGT查漏补缺,二者协同配合,最后通过A3A将未修饰的C脱氨基,将C与5mC/5hmC成功的转化为不同的碱基信号,T和C。
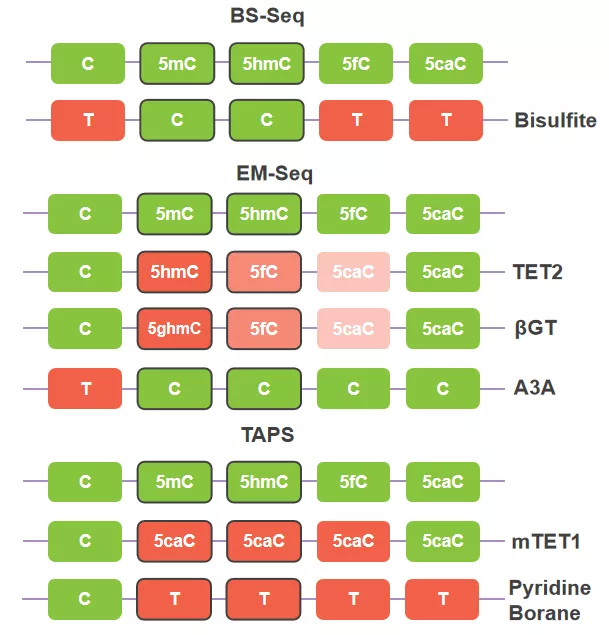
图8. BS-free技术EM-Seq和TAPS
2019年NBT发表的TAPS,也是利用TET的氧化活性,为了进一步提高TET效率,研究人员筛选出活性更好的mTET1对DNA进行多次氧化处理,尽可能保证5mC/5hmC彻底氧化为5fC和5caC,随后通过Pyridine Borane的脱氨基作用,将5fC和5caC转化为U类似物,最终,C与5mC/5hmC被转化为不同的碱基信号,C和T。
2021年,《Science Advances》文章报道,利用针对cfDNA的cfTAPS技术,研究人员对“无伤”甲基化检测技术TAPS在cfDNA中同时检测多组学标志物的潜力进行了初步的探索,包括甲基化、CNV和片段化特征。《Genome Research》发表的最新研究显示,EM-seq文库中检测到的5mC和5hmC修饰与亚硫酸氢盐文库一致性好。EM-seq在覆盖率、冗余度等参数上都优于亚硫酸氢盐文库。EM-seq最低投入量低至100 pg DNA,更加适用于挑战性的样本(FFPE)和低投入量样本(cfDNA),为研究和临床应用开辟了新的途径。
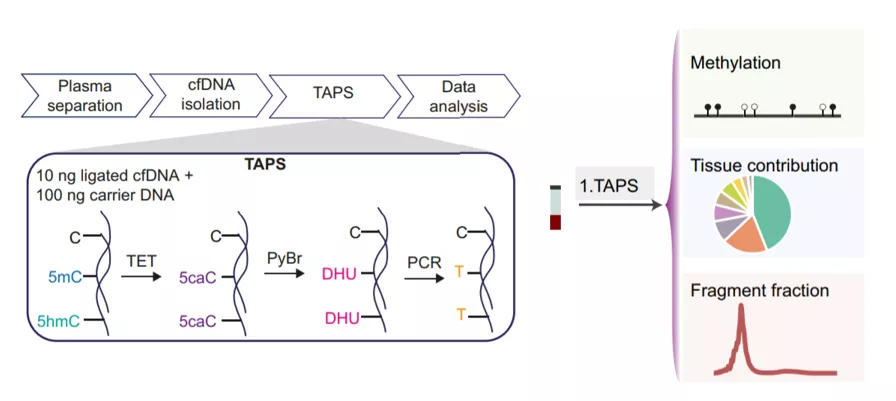
图9. cfTAPS检测cfDNA多组学特征
除上述的两种代表性的BS-free技术,研究人员利用上文介绍的生化工具还开发出大量的胞嘧啶修饰测序检测技术,在这里就不一一介绍了。综上所述,酶学方法依赖酶活和底物特异性,并且对反应环境要求苛刻,从基础研究到应用优化,BS-free技术的每一次进步都需要大量的基础研究,我们也希望研究人员再接再厉,让BS-free技术早日进入临床实践。
伯科TargetCap靶向捕获技术已为研究人员提供大量多组学基因芯片及配套试剂,包括DNA、RNA和甲基化检测等,性能优异,批次稳定。

参考文献:
[1] He W, Wei Y, Gong X, et al. Developmentally Delayed Epigenetic Reprogramming Underlying the Pathogenesis of Preeclampsia[J]. bioRxiv, 2020.
[2] Wang T, Loo C E, Kohli R M. Enzymatic Approaches for Profiling Cytosine Methylation and Hydroxymethylation[J]. Molecular Metabolism, 2021: 101314.
[3] Siejka-Zielińska P, Cheng J, Jackson F, et al. Cell-free DNA TAPS provides multimodal information for early cancer detection[J]. Science advances, 2021, 7(36): eabh0534.
伯科已经为国内外用户交付了100多款液相基因芯片(Gene Panel),性能卓越,配备7-15工作日极速交付方案,并已完成NGS接头引物的开发,支持个性化设计。
欢迎咨询定制。





