2025 V4.0 NCCN指南 | 食管和食管胃结合部癌的诊断与精准治疗
- boke
- 2026-02-13
- 2:30 下午
一、食管癌概述
食管癌是起源于食管黏膜上皮的恶性肿瘤,是全球范围内发病率和死亡率均较高的癌症之一,其早期症状隐匿,多数患者确诊时已属中晚期,预后较差。食管癌的全球发病率存在显著地域差异,高发地区与低发地区的发病率相差60倍。从伊朗北部延伸至中亚,再到中国北方是食管癌高发区域,被称为“食管癌带”。食管癌在组织学上分为鳞状细胞癌(SCC)和腺癌,两者在病因、病理、肿瘤位置、治疗方法和预后方面存在差异[1]。
食管癌是多种环境因素与遗传因素共同作用的结果。目前确定的与食管癌相关的风险因素包括:
饮食因素:烫食热饮、食用腌制霉变食物、缺乏营养等。
生活方式:烟草和酒精摄入是鳞状细胞癌的主要危险因素;体重指数(BMI)过高已被证实是食管腺癌主要风险因素。
疾病:胃食管反流病是食管腺癌的主要潜在病因;Barret食管患者发生食管腺癌的风险是普通人群的30至60倍。
遗传:家族中有食管癌病史的人群,患病风险相对更高;另外部分遗传综合征会增加食管癌的发病风险。

与食管癌和食管胃结合部癌发病风险增加相关的
遗传性癌症易感综合征
二、食管癌诊断
病史与体格检查(H&P)、食管胃十二指肠镜(EGD)+活检、胸/腹部增强CT、盆腔增强CT(临床指证)、FDG-PET/CT(无远处转移M1)、全血细胞计数(CBC)+全面生化检查、无M1且肿瘤可切除时,进行内镜超声(EUS)、内镜切除术(ER,用于早期癌症)、转移性癌症需进行活检。
实验室与分子生物标志物检测:微卫星不稳定性(MSI)/错配修复(MMR)检测、PD-L1表达检测、HER2、CLDN18.2 检测。
三、食管癌治疗方案
根据不同的临床分期和组织学亚型进行不同治疗。
(一)Ⅰ–ⅣA期(局部区域性疾病,不包括T4b或不可切除的N3)
1
鳞状细胞癌
(1)初始治疗:进行多学科评估,判断患者是否适合进行手术。
适合手术患者的治疗方案:
pTis,pT1a:首选内镜治疗(内镜切除±消融、单独消融)、食管切除术
pT1b,N0:食管切除术
cT1b-cT2,N0(低风险):食管切除术(非颈段食管)
cT2,N0(高风险),cT1b-cT2,N+或cT3-cT4a,Any N:术前放化疗(首选)、根治性放化疗
cT4b:根治性放化疗、单独化疗(在气管、大血管、椎体或心脏受侵)
不适合手术患者的治疗方案:
pTis:内镜切除±消融、单独消融
pT1a:内镜切除±消融
pT1b,N0:内镜切除±消融,后续考虑对预后不良的肿瘤进行放化疗。
cT1b-T4a,N0-N+或cT4b(不可切除):
能够耐受放化疗:根治性放化疗
不能耐受放化疗:姑息性放射治疗(RT)或姑息性/最佳支持治疗
(2)初始治疗反应评估与后续治疗
进行后续治疗前,需先进行初始治疗反应评估:FDG-PET/CT、胸/腹增强CT(如果进行FDG-PET/CT,则不需要)、EGD和活检(若计划手术,则可选)。
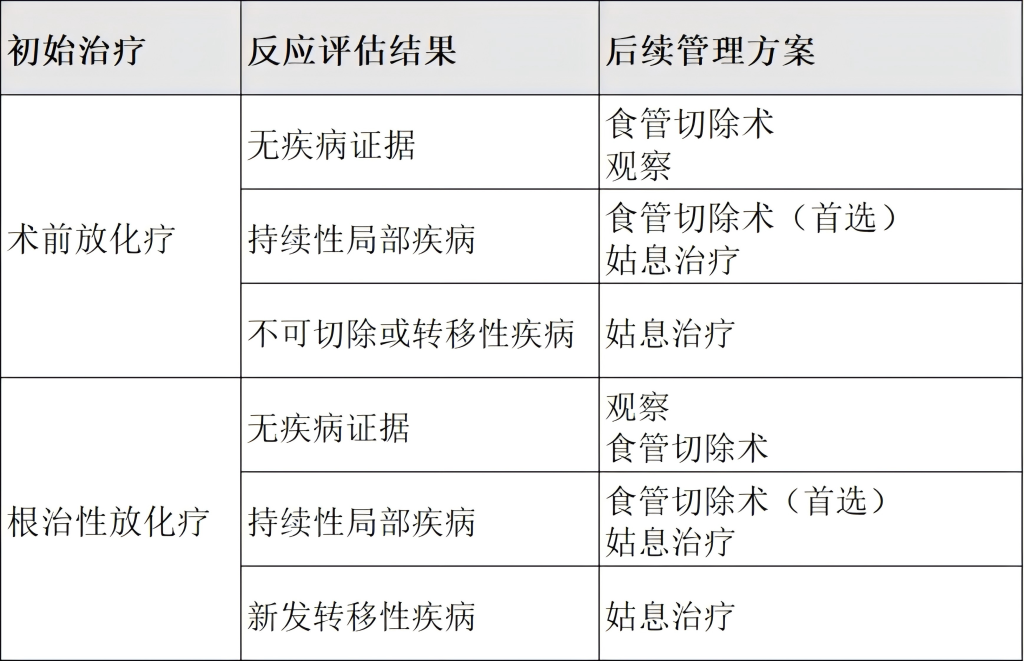
鳞状细胞癌患者进行食管切除术后患者后续管理方案:
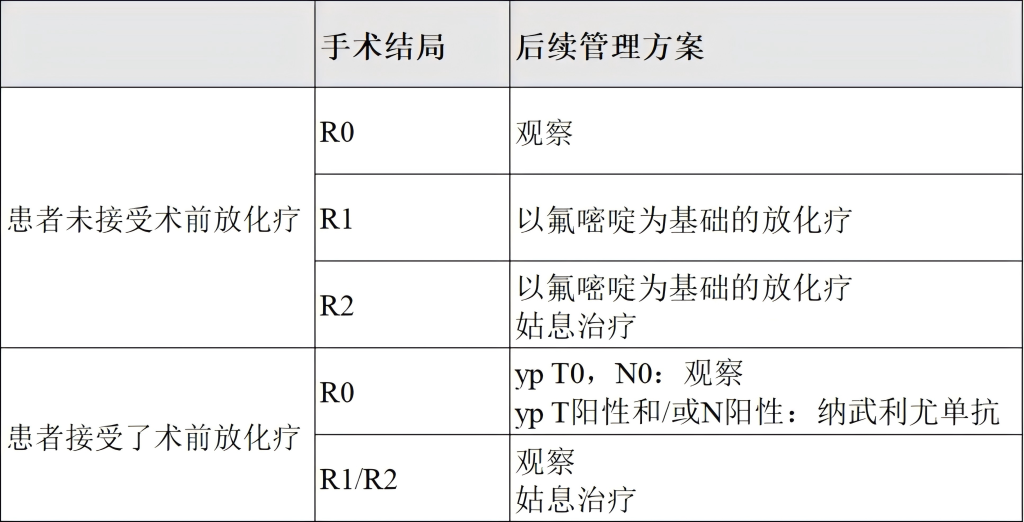
(3)SCC患者治疗后随访与监测
H&P:每3-6个月进行一次H&P,持续1-2年,每6-1-2个月进行一次H&P,持续3-5年;生化检查、CBC、影像学检查、EGD和活检(根据临床指征);吻合口狭窄扩张术;营养评估和咨询。
局部复发(既往食管切除术,既往无放化疗):同步放化疗(首选)、手术、全身治疗、姑息治疗/最佳支持治疗,后续通过胸/腹增强CT评估治疗反应,若再次复发,则进行姑息治疗。
局部复发(既往放化疗,既往无食管切除术):若可切除且可进行医学手术,进行食管切除术,后续通过胸/腹增强CT评估治疗反应,若再次复发,则进行姑息治疗;若不可切除或医学上不可手术,进行姑息治疗。
转移性疾病:进行姑息治疗。
2
腺癌
(1)初始治疗:多学科评估,判断患者是否适合进行手术。
适合手术患者的治疗方案:
pTis:首选内镜治疗(ER±消融、单独消融)、食管切除术
pT1a:首选:内镜治疗(ER±消融、食管切除术
浅表pT1b:ER±消融、食管切除术
pT1b,N0:食管切除术
cT1b-cT2,N0(低风险病变):食管切除术
cT2,N0(高风险病变),cT1b-cT2,N+或cT3-cT4a,Any N:围手术期全身治疗(首选),术前放化疗(计划食管切除术),新辅助或围手术期ICI治疗(MSI-H/dMMR),根治性放化疗(拒绝手术的病人)
cT4b:根治性放化疗、单独化疗(气管、大血管、椎体或心脏受侵)
不适合手术患者的治疗方案:
pTis:内镜切除±消融、单独消融
pT1a:内镜切除±消融
pT1b,N0:内镜切除±消融,后续考虑对预后不良的肿瘤进行放化疗
cT1b-T4a,N0-N+或cT4b(不可切除):
能够耐受放化疗:根治性放化疗
不能耐受放化疗:姑息性放射治疗(RT)、姑息性/最佳支持治疗
(2)初始治疗反应评估与后续治疗
进行后续治疗前,需先进行初始治疗反应评估:FDG-PET/CT、胸/腹增强CT(如果进行FDG-PET/CT,则不需要)、EGD和活检(计划手术,考虑选择)。
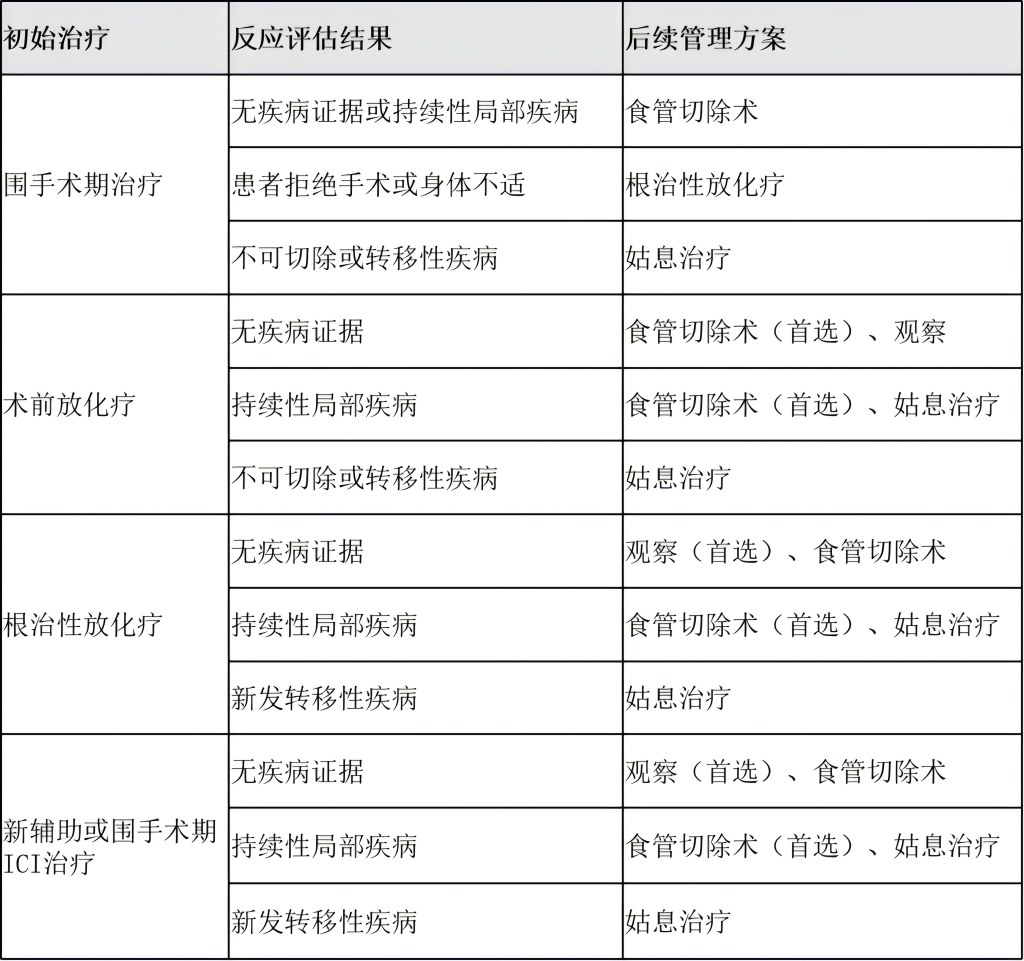
腺癌患者进行食管切除术后患者后续管理方案:
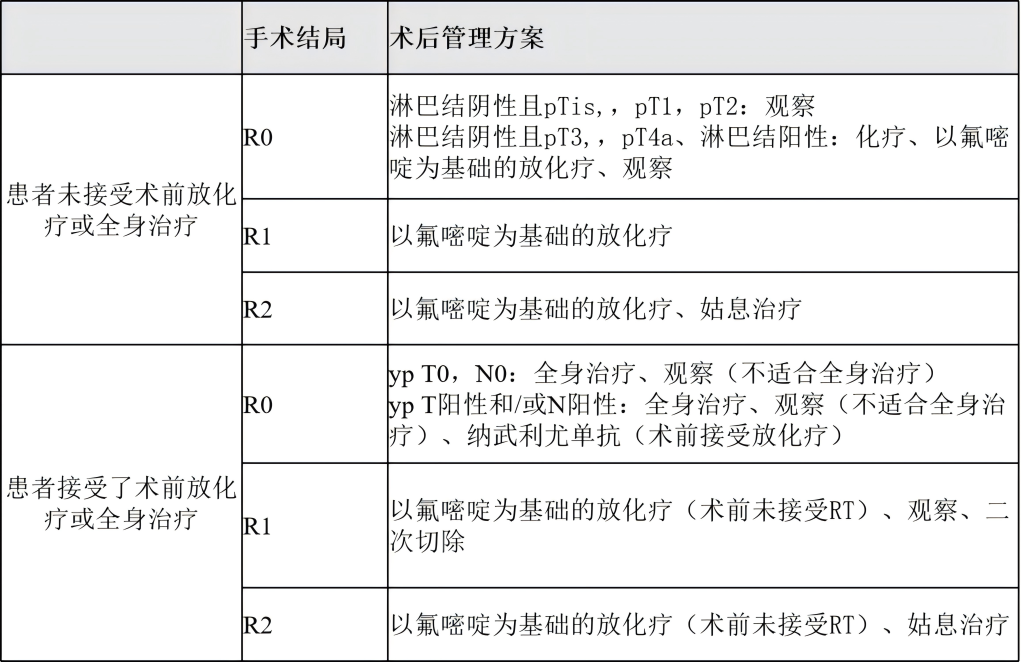
(3)腺癌患者治疗后的随访/监测
H&P:如果无症状:每3-6个月进行一次H&P,持续1-2年,每6-1-2个月进行一次H&P,持续3-5年;生化检查、CBC、影像学检查、EGD和活检(根据临床指征);吻合口狭窄扩张术;营养评估和咨询。
局部复发(既往食管切除术,既往无放化疗):同步放化疗(首选)、手术、全身治疗、姑息治疗/最佳支持治疗,后续通过胸/腹增强CT评估治疗反应,若复发,则进行姑息治疗。
局部复发(既往放化疗,既往无食管切除术):若可切除且可进行医学手术,进行食管切除术,后续通过胸/腹增强CT评估治疗反应,若复发,则进行姑息治疗;若不可切除或医学上不可手术,进行姑息治疗。
转移性疾病:进行姑息治疗。
(二)ⅣA期(包括T4b或仅不可切除的N3期)和ⅣB期(转移性疾病)
1
SCC患者治疗方案
体能状态良好(KPS≥60%或ECOG≤2):MSI和PD-L1检测(如果之前未进行),进行全身治疗±姑息治疗/最佳支持治疗。
体能状态差(KPS<60%或ECOG≥3):姑息/最佳支持治疗。
2
腺癌患者治疗方案
体能状态良好(KPS≥60%或ECOG≤2)进行MSI、PD-L1、HER2 和CLDN18.2 检测(如果之前未进行)。
体能状态差(KPS<60%或ECOG≥3):姑息/最佳支持治疗。
(三)具体治疗方案
1
全身治疗方案
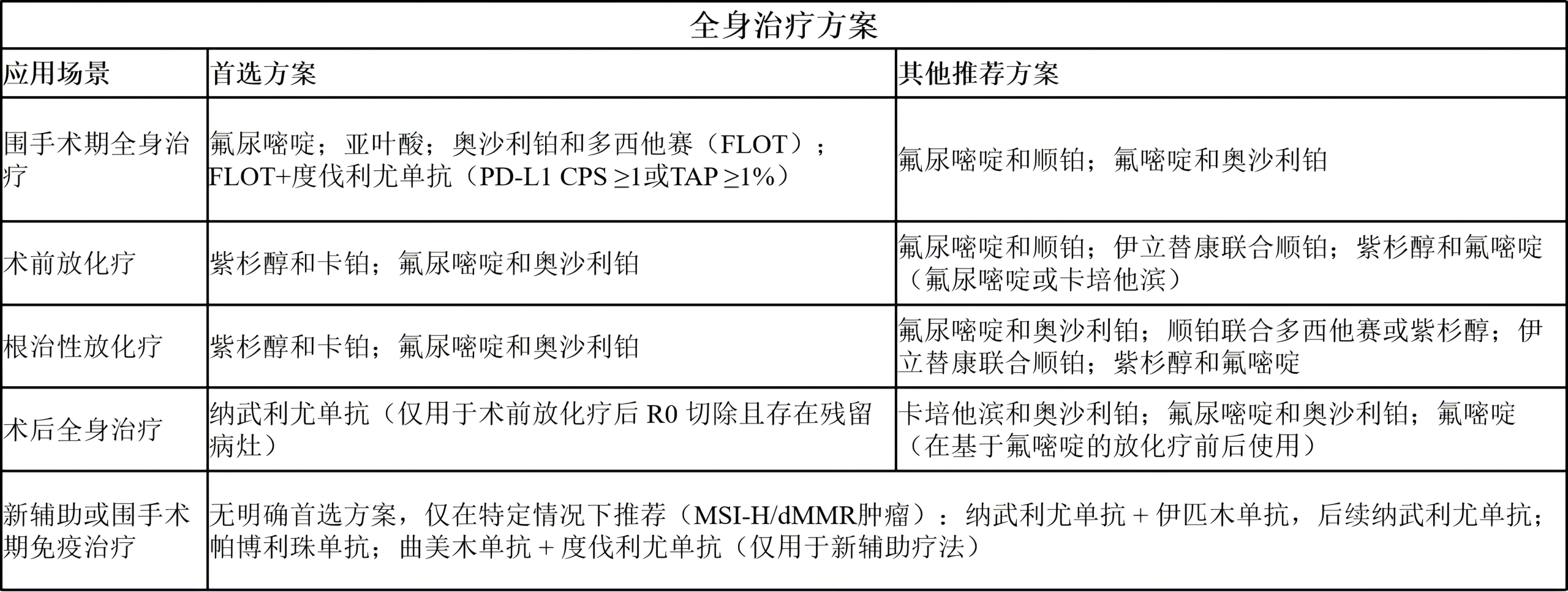
2
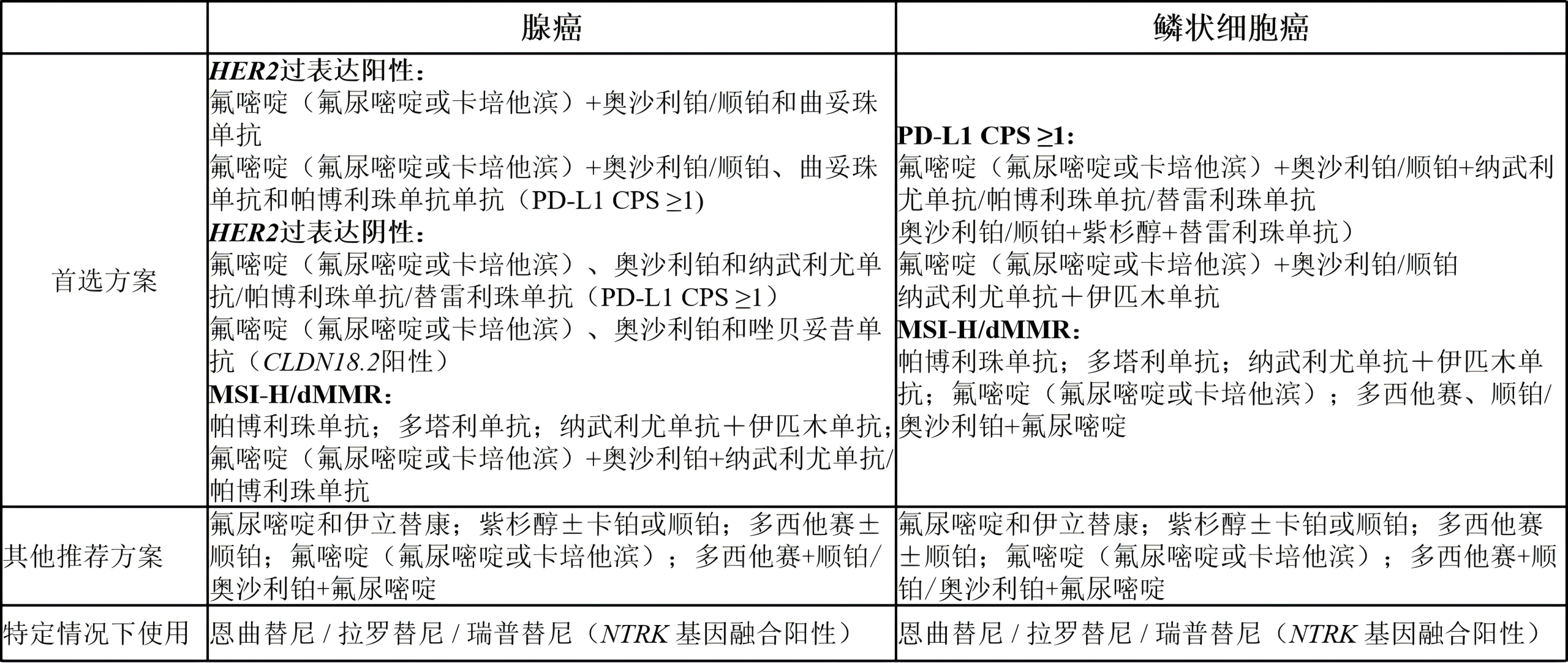
不可切除的局部晚期、复发或转移性疾病的全身治疗方案(不适用于局部治疗)
(1)一线治疗(由于毒性较低,奥沙利铂优于顺铂)
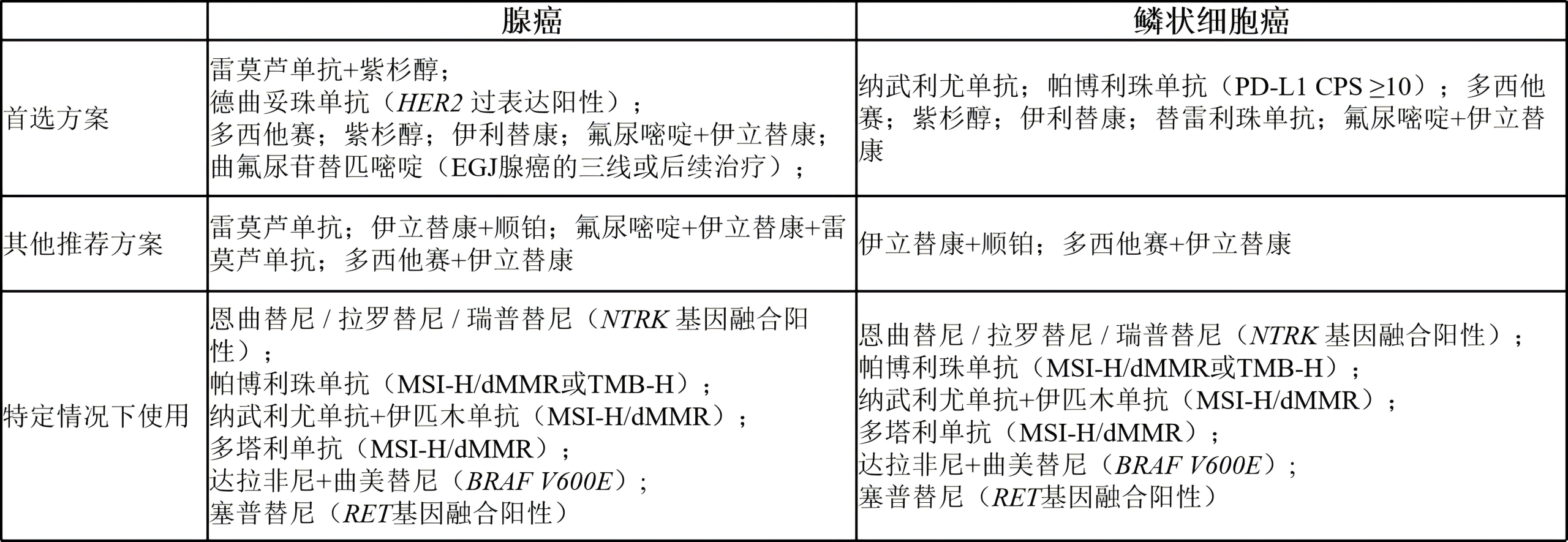
(2)二线或后续治疗(取决于既往治疗和PS)
四、生物标志物检测与靶向治疗
1
生物标志物检测
(1)微卫星不稳定性(MSI)/错配修复(MMR)
检测方式:PCR、NGS、IHC
(2)PD-L1检测
检测方式:IHC
(3)HER2过表达/扩增、CLDN18.2高表达、肿瘤突变负荷(TMB)、NTRK基因融合、RET基因融合、BRAF V600E突变
检测方式:IHC、ISH、靶向PCR、NGS
(4)循环肿瘤DNA(ctDNA)
检测方式:NGS
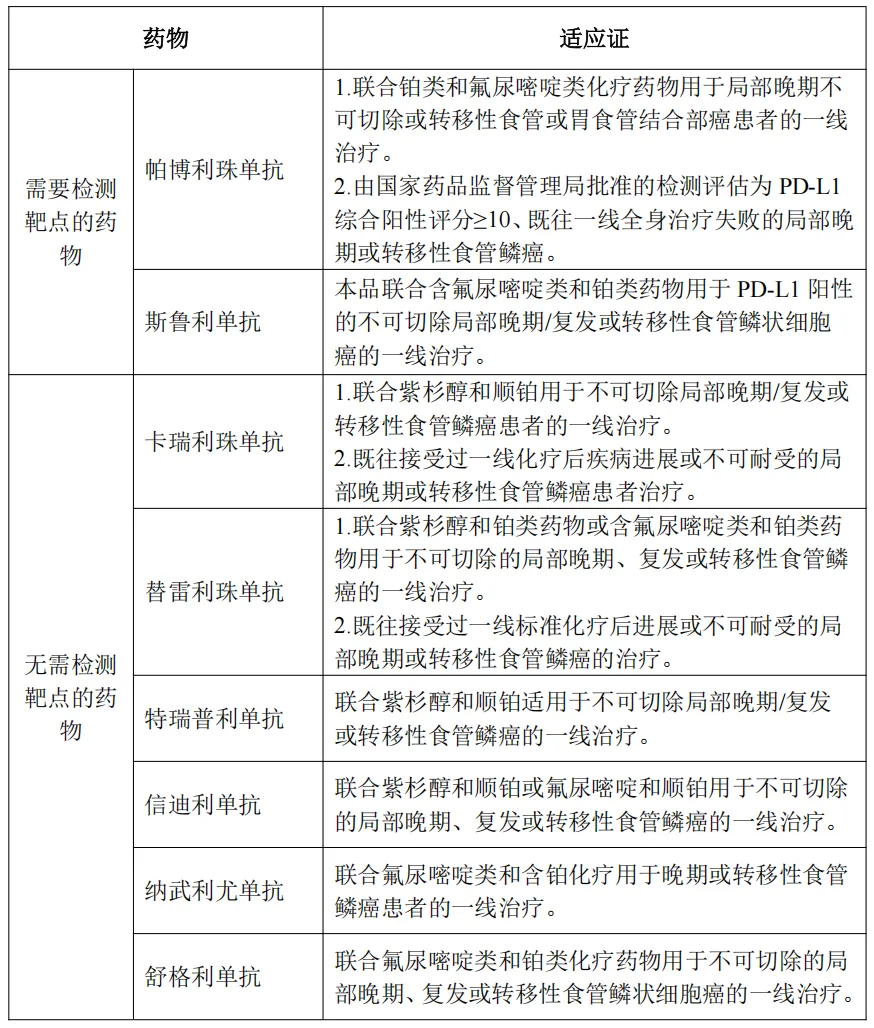
高通量测序(NGS)在食管癌诊疗中发挥着关键作用,它通过对肿瘤进行综合分子分析,实现食管癌的精准诊断与分型;检测HER2扩增、NTRK基因融合等靶点以指导靶向治疗;通过TMB、MSI等指标评估免疫治疗获益,同时通过ctDNA检测实动态监测肿瘤负荷、评估疗效并提示复发,为食管癌个体化精准诊疗提供有力支撑。
伯科生物在国内已经建设了全流程国产化的高通量核酸合成与应用技术转化中心,建立了GMP厂房和ISO9001、ISO13485质量体系。已经为国内外数百家知名医院、科学研究机构、临床检验所开发了上千款Gene Panel(液相基因芯片),并配套完整的检测试剂,各项性能参数均与国际竞品相当或优于(详见附表1),在基因组、转录组、甲基化组及病原体的检测应用方向均有成熟的产品管线。
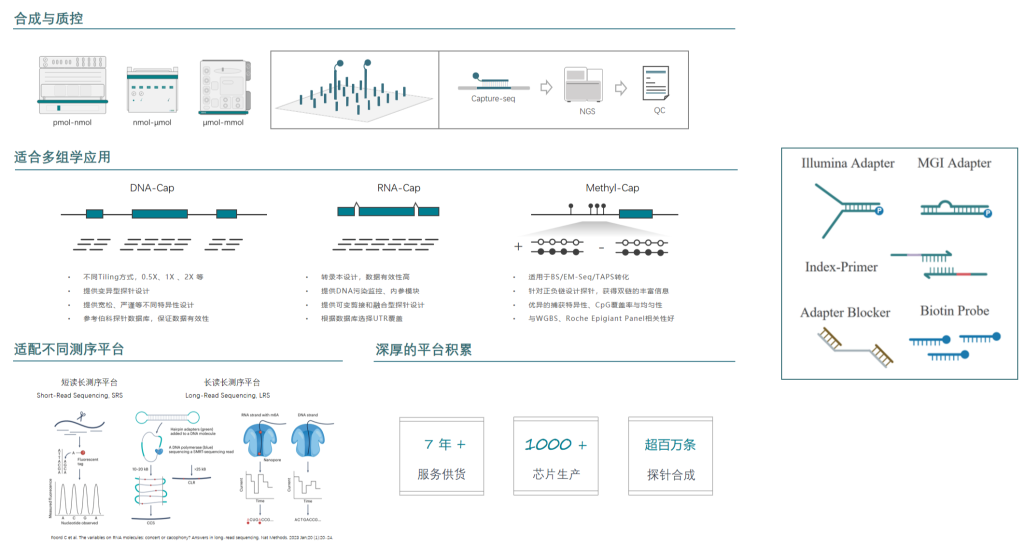
附表1: 产品简介
肿瘤液相基因芯片
伯科设计的TargetCap® OncoGene Plus Research Panel基于美国食品药品监督管理局(FDA)批准的用于肿瘤基因检测的FoundationOne CDxTM与MSK-IMPACTTM,其覆盖702个肿瘤相关基因编码区和34个基因的非编码区(融合基因),含有6个MSI和53个化药相关位点,探针覆盖2.32Mb区间。这些区域涵盖更多基因,检测范围更泛,涉及肿瘤高频突变、肿瘤易感、药物靶向、药物耐受等多种类型基因。
性能表现
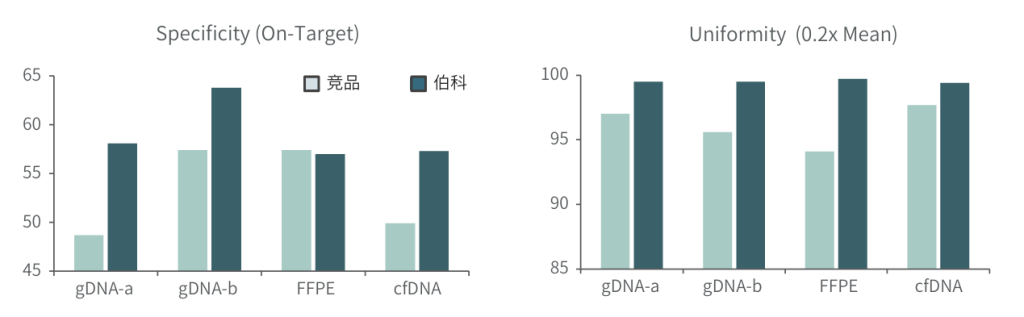
竞品评测
采用gDNA/cfDNA/FFPE/泛肿瘤800gDNA标准品文库,分别使用伯科商品化肿瘤大Panel-OncoGene Plus Research Panel与竞品肿瘤大Panel进行性能比较(二者大小相近),在捕获特异性上(On-Target)和覆盖均一性(0.2XMean)上,伯科均优于竞品。
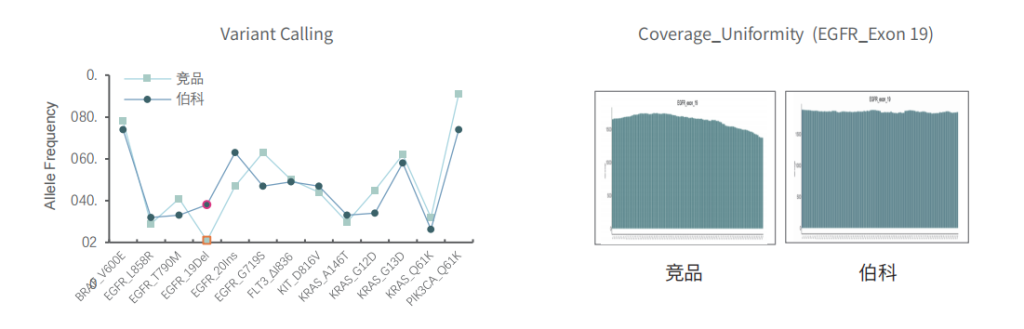
对于gDNA标准品,竞品测序35.9Gb,伯科测序19.6Gb,虽然伯科测序数据少,深度低,但二者的突变频率检出无明显差异,伯科对EGFR的19号外显子缺失变异的检出优于竞品。
不同样本类型表现
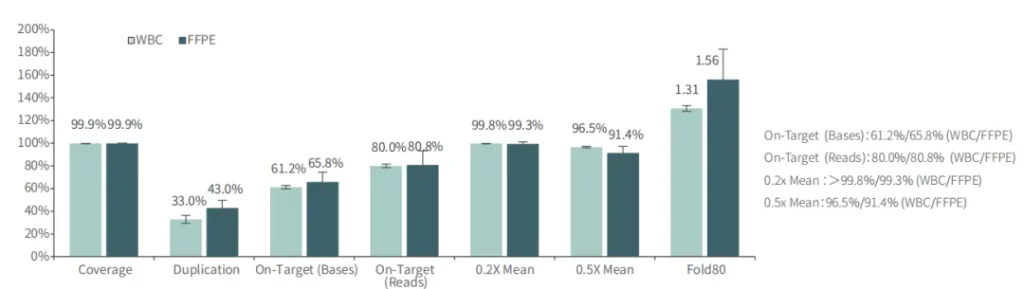
对不同质量的gDNA样本 (WBC/FFPE, >150例),TargetCap® OncoGene Plus Research Panel表现稳定。
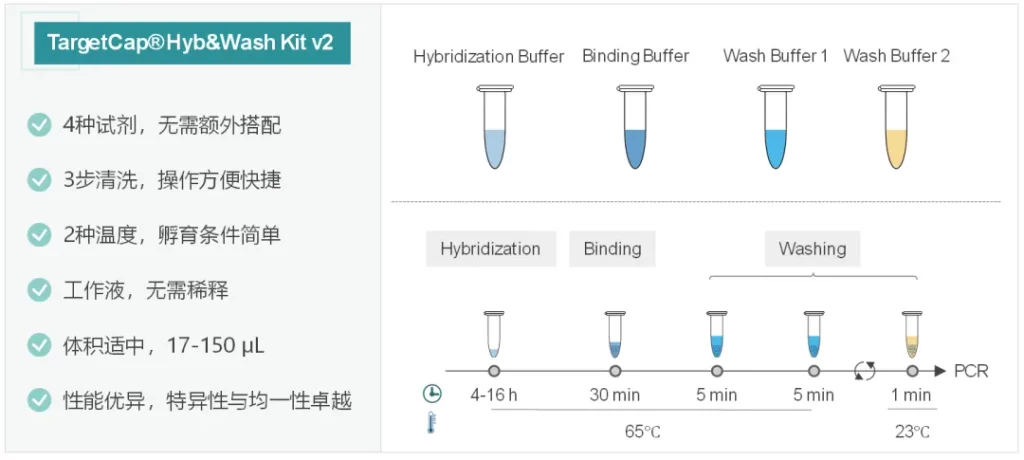
杂交与清洗试剂盒v2 简介
试剂盒概述
伯科杂交与清洗试剂盒v2 (TargetCap® Hybridization and Wash Kit v2,下文简称Hyb&Wash Kit v2)简化了试剂组分和操作流程,同时仍保持优异的捕获性能。Hyb&Wash Kit v2包含4种缓冲液组分,仅需3步清洗,操作流程更加便捷。
性能表现介绍
Ⅰ. 基本QC表现
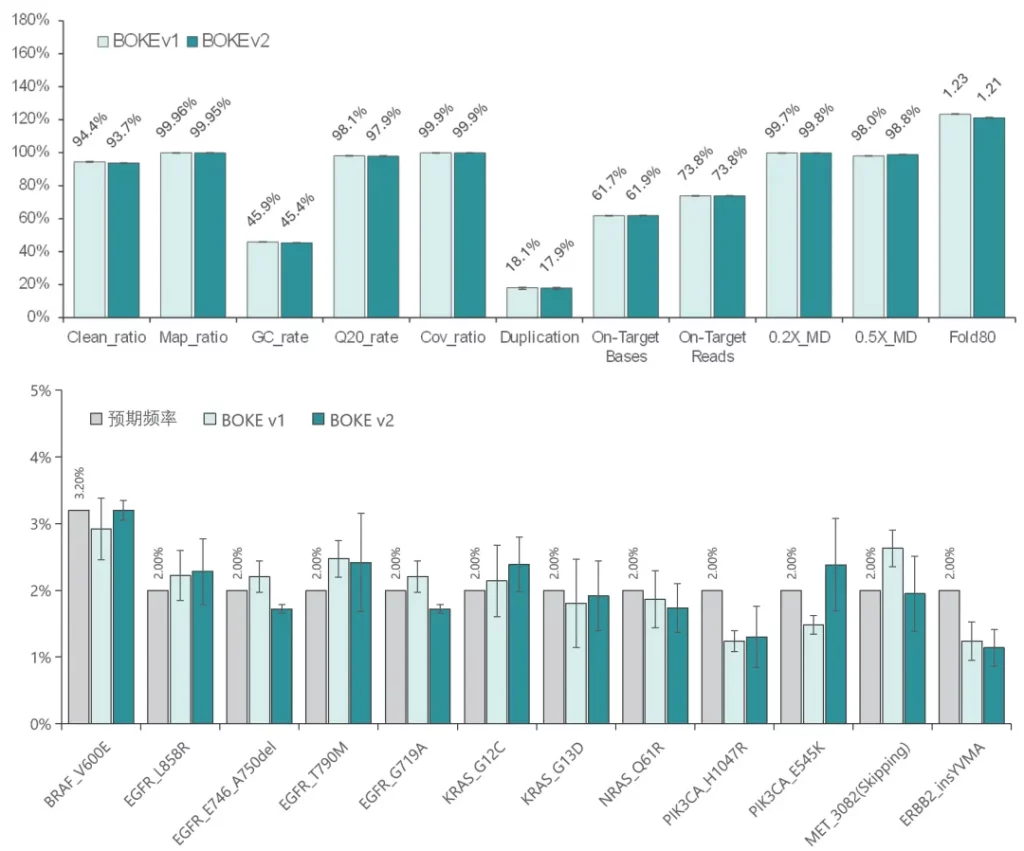
使用NA12878和NA24694 gDNA标准品,采用三款不同大小的Gene Panel (650Kb、2.3Mb和42Mb) 对Hyb&Wash Kit v2 和 v1 进行比较测试。
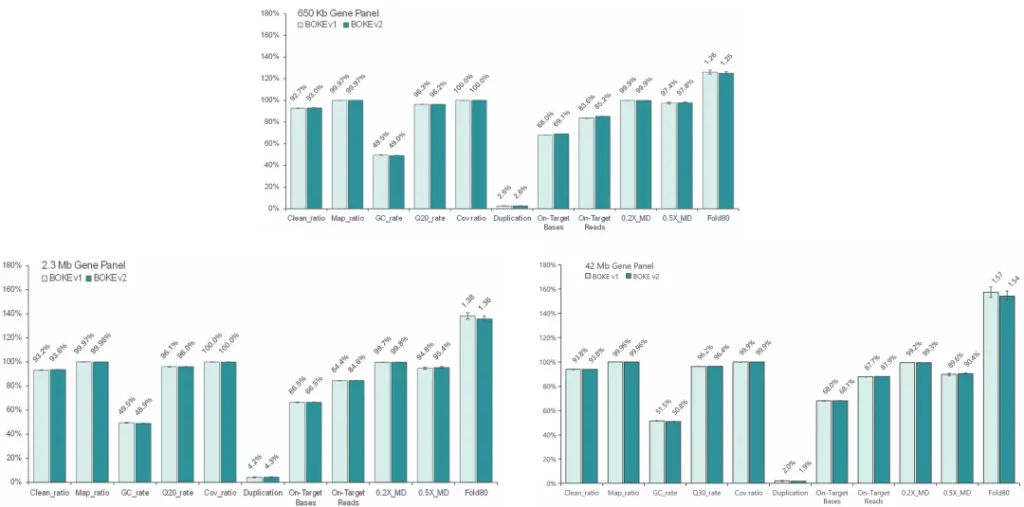
结果显示,在不同大小的Gene Panel中,对于杂交与清洗试剂盒的关键参数-中靶率和均一性,v2与v1试剂盒表现相当,v2试剂盒表现更好的均一性(0.2X_MD、0.5X_MD和Fold80)。
Clean_ratio、Map_ratio等基本参数两款试剂盒表现一致,由于v2试剂盒对低GC目标区域覆盖更佳,其GC_rate率略低于v1。
Ⅱ. 低频变异检测
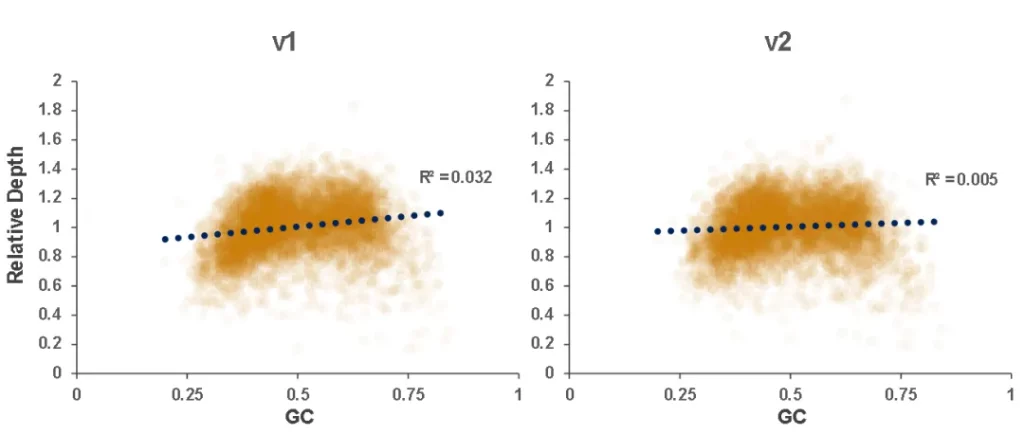
使用肿瘤 SNV gDNA 标准品Ⅱ (GW-OGTM006) 对Hyb&Wash Kit v2的低频变异检测性能进行验证。GW-OGTM006 DNA标准品包含 EGFR、KRAS、NRAS、BRAF、PIK3CA、FGFR3、Her2、MET 等多个常见伴随诊断基因及位点,包含点突变、插入和缺失等多种变异类型。
采用300 Kb Gene Panel对该标准品进行捕获,捕获数据显示,v1与v2试剂盒的基本捕获性能表现相当,v2的中靶率与均一性略优于v1。同时,v1与v2试剂盒均能对12个已知变异准确检出。
参考文献:
1.NCCN Clinical Practice Guidelines in Esophageal and Esophagogastric Junction Cancers (2025 Version 4).
2.新型抗肿瘤药物临床应用指导原则(2025年版),国家卫生健康委


