2023NRG综述|回顾孟德尔遗传学:医学遗传学中的显性与隐性(三)
- boke
- 2023-05-09
- 7:07 上午
众所周知,携带相同单基因变异的个体可能表现出截然不同的临床特征[14]。外显率和表现度这两个术语用于描述这种现象,即并非所有具有特定基因变异的个体都会有相同疾病表型,并且个体之间在具体表现上也可能存在差异。
外显率是指某一杂合显性基因在特定的群体及环境中表现出相应表型的比例,常用百分率(%)来表示。外显率为100%时称为完全外显,外显率低于100%时称为不完全外显或外显不全。
表现度是指在不同遗传背景及环境因素影响下,相同的基因改变在不同个体或同一个体的不同部位,其性状或疾病的表现程度可能存在显著差异。将极为罕见的高外显率变异与更常见的功能性变异结合起来,可以改进单基因和多因素特征的个体风险评估的多基因评分模型[15,16]。
两个基因中存在致病变异才表现出疾病的现象称为双基因遗传[17,18]。为了描述基因对下游非等位基因的抑制现象[19],Bateson提出了“上位遗传”(epistatic)的概念。双基因遗传表示两个基因在疾病发展中的作用相对平等,而上位遗传描述了一个基因对它下游另一个基因的表型具有遮盖作用。上位遗传可以解释同一疾病的不一致的显性和隐性遗传模式。
例如,7型痉挛性截瘫(spastic paraplegia type 7)通常由SPG7基因的双等位致病变异引起,但也可能由SPG7杂合变异与SPG7相互作用基因变异共同作用导致[20]。
大多数肿瘤抑制基因杂合变异属于常染色体显性遗传,不是所有携带杂合致病变异的个体都会发展为肿瘤,而且患病表现也会因人而异。遗传性肿瘤风险的增加并不是因为遗传了某种特定的肿瘤,而是因为遗传和环境因素以及偶发的体细胞突变增加了患病的几率。
这一概念体现在Alfred G. Knudson基于视网膜母细胞瘤的统计研究提出的“双重打击”假说(见图8a)以及更复杂的双等位基因丧失发展成Schwann瘤的发病过程中(见图8b)。
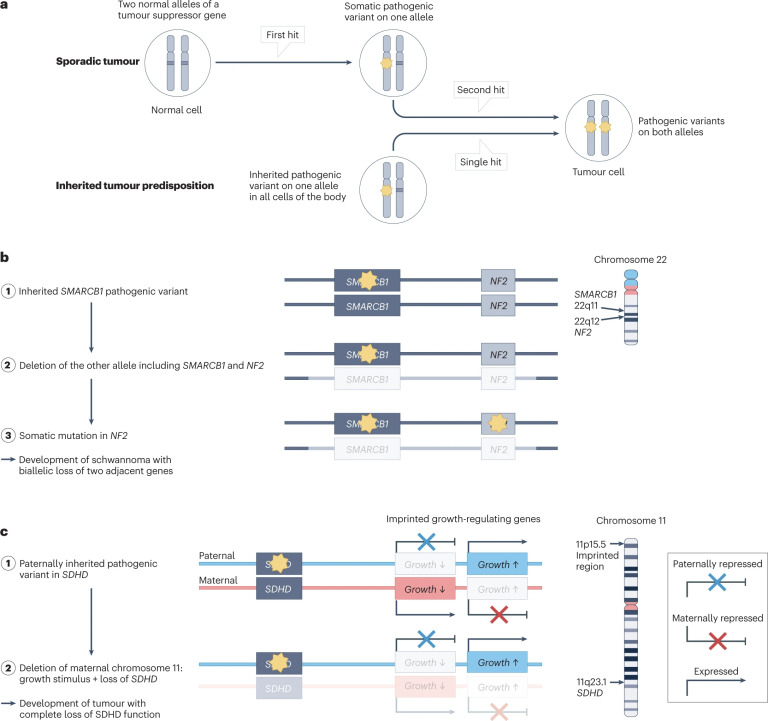
图8 单等位基因与双等位基因的肿瘤易感性
图8a展示了肿瘤发展的病理学机制,多数单基因肿瘤是由于肿瘤抑制基因中杂合致病变异所致,因此具有显性遗传特征。通常需要同一细胞内的两个独立变异事件(hits)才能产生这种影响。通过遗传突变失活使一个等位基因失活,单个变异事件就足以完全失去肿瘤抑制基因功能,表现为常染色体显性遗传特征。值得注意的是,一些肿瘤抑制基因(TP53)的特定致病突变可能具有增强效应。
图8b展示了神经鞘瘤(又名Schwann细胞瘤(Schwannoma))的病理学机制:染色体23q11位置上三个基因(SMARCB1、LZTR1和DGCR8)中任何一个的遗传性杂合变异导致Schwann细胞瘤表现出常染色体显性遗传特征。2型神经纤维瘤(NF2)也会导致Schwann细胞瘤,这是由于位于染色体22q12的NF2基因遗传性杂合变异所致。
在神经鞘瘤中频繁发现体细胞NF2变异,可以通过病理学机制作出解释:
(1)在相关基因SMARCB1中出现致病突变(黄色星号);
(2)体细胞失去22q等位基因的另一个等位基因,包括SMARCB1、NF2和其他相关基因的野生型(WT)等位基因;
(3)与遗传SMARCB1变异在相同染色体上的野生型NF2等位基因发生突变(黄色星)。两个基因丧失了野生型等位基因型导致了神经鞘瘤症状。
一些肿瘤只有从特定亲本(通常是父亲)遗传成为杂合致病变异时才会显示出单基因风险。如果杂合致病变异在同一染色体链上存在带有印记的生长促进等位基因(通常来自父方),那么两个位点失去另一个(母方)等位基因将导致一个细胞失去野生型蛋白。
例如SDHD相关的副神经节瘤-嗜铬细胞瘤综合症(PPGL,图8c)以及位于染色体11p15.1上相邻基因KCNJ11或ABCC8中杂合型致病变异引起的先天局限性高胰岛素血症。副神经节瘤-嗜铬细胞瘤综合症由苯丙酸脱氢酶(SDH)亚基基因中的杂合性的缺失变异引起,它们包括四个同源基因(SDHA、SDHB、SDHC和SDHD)。与SDHA、SDHB和SDHC变异相关的PPGL不同,与位染色体11q位置上的SDHD相关的PPGL几乎仅限于父系遗传的突变(黄色星)。
由于细胞中X染色体只有一套等位基因处于活跃表达状态[21],细胞通常仅表达性染色体基因的一套等位基因,性染色体变异的表型的并不反映细胞内两个不同等位基因型。所以X染色体连锁的遗传性状不宜用显性和隐性术语描述[22]。
显性和隐性同样也不适用于线粒体DNA的致病变异,因为在大多数线粒体DNA相关疾病中,不同的临床表现是由于线粒体DNA的突变效应或者不同器官中线粒体拷贝的数量异质性造成的。
致病性X染色体变异的表现依赖于细胞存活和细胞间的代偿机制,有四类发病机制:
a、处于(功能性)半合子状态且与细胞存活不兼容的变异会导致男性死亡并引起女性出现偏倚的X染色体失活现象;
b、扰乱基本细胞功能但不致细胞死亡的变异,在女性中表现较男性轻微,女性的临床症状往往由于可变的X失活导致。例如X连锁的鸟氨酸转移酶(otc)缺陷引发尿素循环障碍;
c、对于编码分泌蛋白或其他细胞功能的基因来说,当在一些细胞中野生型(WT)基因失活时,正常的相邻细胞的功能会补偿这种失活,通常在女性中是无症状的,例如血友病和许多X染色体连锁代谢疾病;
d、在极少数情况下,女性杂合子个体或男性嵌合体患者存在的细胞干扰会产生比半合子男性表现更严重的表型。例如EFNB1相关的颅面鼻综合症[23]和PCDH19相关的癫痫[24]。
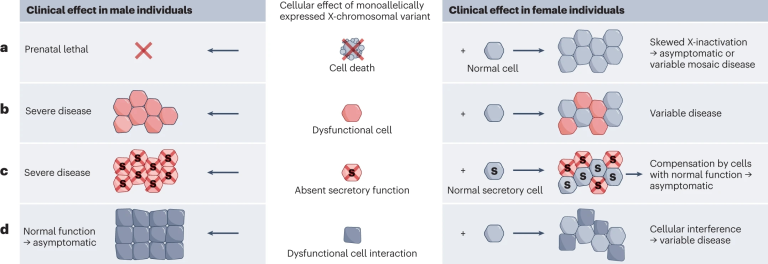
图9 致病性X染色体变异的四类发病机制
将疾病和遗传模式在单个基因的注释信息中做记录仍然有很大难度。理解基因变异对转录本和各种表型水平的特定影响,以及与野生型等位基因和其他等位和非等位基因的功能相互作用,是正确解释医学遗传学中遗传变异致病性的关键。
当前许多数据库中的功能变异信息仅限于一般致病性可能性的估计。当前的分类系统应该落实基因的复杂功能和临床效应,以便确定某些基因变异的遗传模式。此外,变异名称中还可以加入对转录本水平(表示为r.)或编码蛋白功能影响(表示为p.)的预测信息,同时应该在变异数据库中补充数量遗传效应和质量遗传效应信息。
在基因单基因变异效应的预测方面,需要关注以下几点:
该变异是否存在数量遗传效应?
例如,数量效应变异可能会出现在基因CNV(例如完整的基因缺失或染色体CNV)变异、抑制转录的调控或启动子变异、移码突变或提前终止密码子的变异以及许多导致蛋白质降解或除去蛋白质功能的错义突变中。
该基因是否有剂量敏感性?
目前为了确定错义突变和其他突变的Hyp效应并预测相应的表型,仍然需要依赖表型分离实验中获得的数据。
该基因是否有潜在的质量遗传效应?
预测基因突变造成的蛋白质功能效应改变仍然是很困难的。目前已有生物信息学方法通过比较观察和预期的突变频率来估计特定基因错义突变的潜在致病性。
其他因素比如基因的可变剪切和表观遗传模式是否也影响基因突变的表型?
对于大多数编码蛋白质的基因,NCBI和EMBL-EBI(MANE)项目已经确定了生物学功能对应的单个转录本。基因的其他可变剪切形式中出现的致病突变则有可能会被忽略。另外表观遗传因素也会使单基因病的外显率下降。