载脂蛋白与疾病[Apo(a)]
- boke
- 2024-05-31
- 4:05 下午
血脂是血清中的胆固醇、甘油三酯(Triglyceride,TG)和类脂(如磷脂)等的总称,与临床密切相关的血脂主要是胆固醇和 TG。由于血脂不溶于水,因此必须与特殊的蛋白质,即载脂蛋白(apoprotein,Apo),结合形成脂蛋白才能溶于血液,并被运输至组织进行代谢[1]。
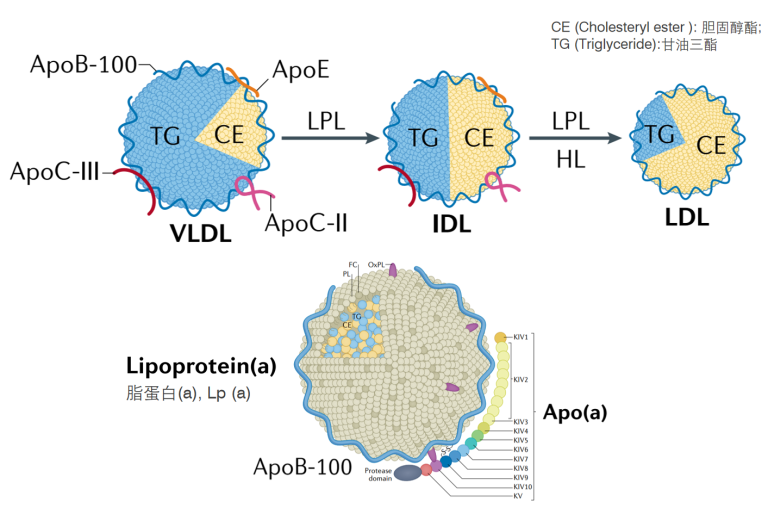
不同脂蛋白结合的载脂蛋白[2]
按照脂蛋白进行分类,包括乳糜微粒(chylomicron,CM)、极低密度脂蛋白(very low-density lipoprotein,VLDL)、中间密度脂蛋白(intermediate-density lipoprotein,IDL)、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipoprotein,HDL)和 脂蛋白(a)[ Lipoprotein(a), Lp(a)]。
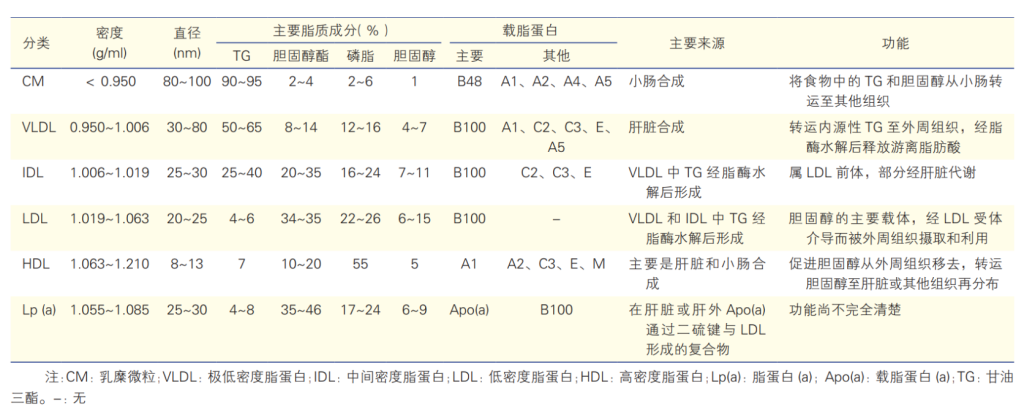
脂蛋白的物理及生物学特性和功能[1]
按照载脂蛋白进行分类,包括载脂蛋白B-100 (ApoB-100)、载脂蛋白B-48 (ApoB-48)、载脂蛋白A-I (ApoA- I)、载脂蛋白C-II (ApoC-II)、载脂蛋白C-III (ApoC-III)、载脂蛋白E (ApoE)、以及载脂蛋白(a)[Apo(a)]等。
不同的脂蛋白,其结合的载脂蛋白种类会存在差异。例如,极低密度脂蛋白(VLDL)除结合载脂蛋白 ApoB-100 外,还包括ApoC-II、ApoC-III和ApoE等载脂蛋白;低密度脂蛋白(LDL)由VLDL转化而来,但LDL中的载脂蛋白95% 以上为ApoB-100,而脂蛋白(a)[Lipoprotein(a), Lp(a)]则包括 ApoB-100和 Apo(a) 两种载脂蛋白。载脂蛋白在人体胆固醇稳态中发挥着重要作用,一旦发生功能变异,则会导致严重的疾病。
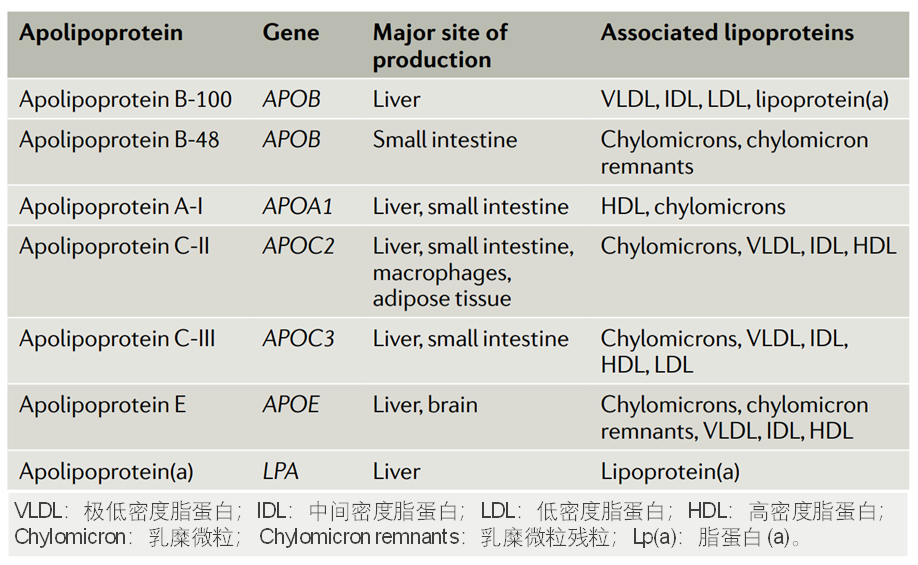
载脂蛋白的编码基因、合成组织和相关的脂蛋白[2]
Lp(a)结构
脂蛋白(a)[Lipoprotein(a), Lp(a)]呈圆球型,由类LDL颗粒(LDL-like particle)和载脂蛋白(a)[Apolipoprotein, Apo(a)]组成,两者以二硫键共价结合。

电子显微镜照片[3]
类LDL颗粒约含有30%~46% 的胆固醇及载脂蛋白B100(ApoB-100)和氧化磷脂(OxPL)[4]。载脂蛋白Apo(a) 是一种高度糖化的亲水蛋白质,占Lp(a)总量的25%~40%。载脂蛋白Apo(a)的KIV-9结构域与载脂蛋白ApoB-100通过二硫键共价结合,氧化磷脂与Apo(a)的KIV-10结构域结合,或存在于类LDL表面。

Lp(a)与LDL结构[5]
Lp(a)多态性
我们每个人所产生的Lp(a)都可能是不一样的,即存在多样性。产生这种多样性的原因来自于载脂蛋白Apo(a)在不同个体中的长短不一。如下图所示,Apo(a)有10个同源的kringle Ⅳ(KⅣ)结构域(与纤溶酶原同源),KⅣ第2个结构域中(KIV-2)的相似环饼从2~40个拷贝数不等,其他均只有一个拷贝数,从而决定了Lp(a)的分子量大小及血浆Lp(a)水平在不同个体间存在较大差异[4]。例如,有的个体血浆Lp(a)浓度为2mg/L,而有的个体则高达1400mg/L,可以相差100~1000倍。
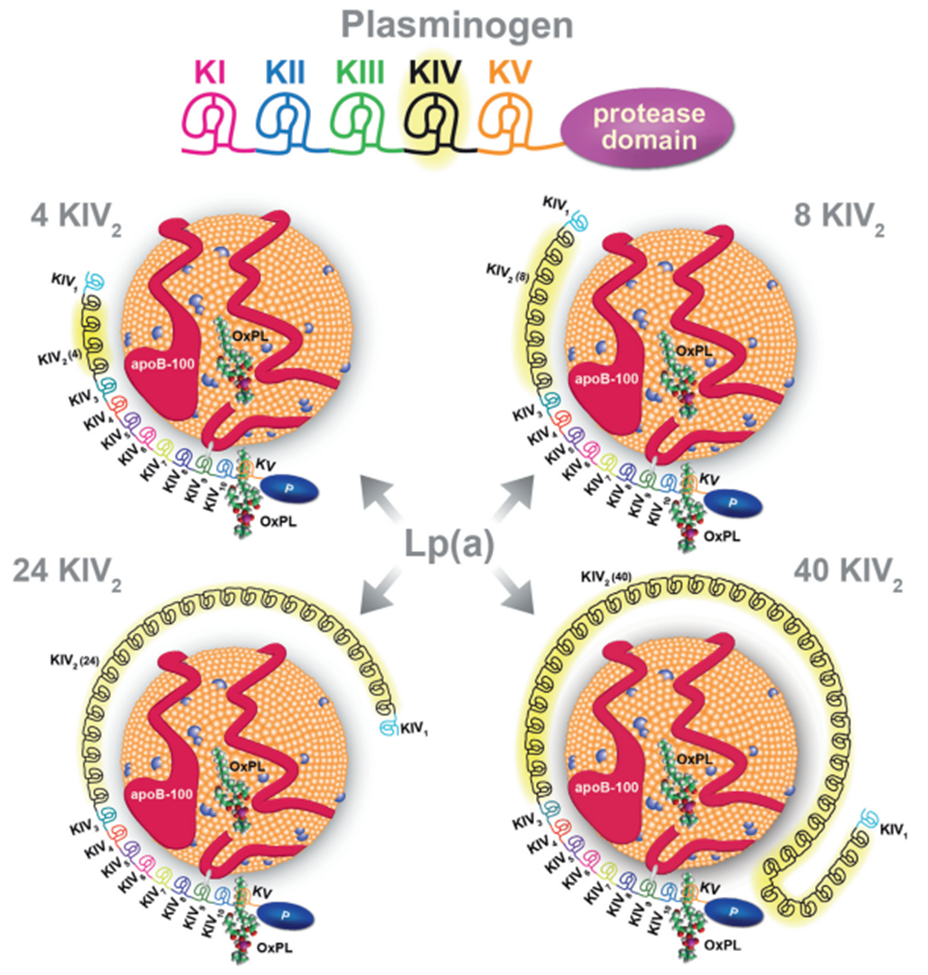
Plasminogen(纤溶酶原)结构以及结合不同长度Apo(a)的Lp(a)[6]
Lp(a)与疾病
Lp(a)升高是多种心脑血管疾病,包括冠心病(CAD)、缺血性脑卒中和钙化性主动脉瓣狭窄(CAVS)等疾病的独立危险因素。
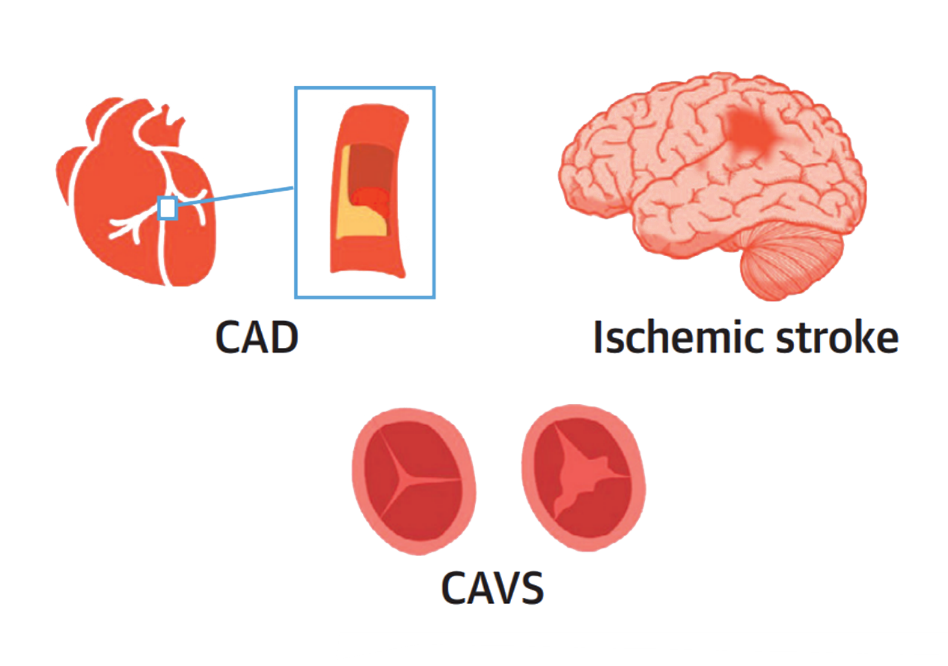
冠心病:多项观察性研究和基因组学研究证实,Lp(a)升高是冠心病的独立危险因素。AIM-HIGH试验提示,LDL-C相似时(1.62 mmol/L),Lp(a) >50 mg/dl的患者较<50 mg/dl患者,主要不良心血管事件(MACE)的风险高90%。一项荟萃分析纳入 7 项 29069 例经他汀治疗的随机对照研究,结果显示,即使经他汀治疗后 LDL-C 较低情况下,Lp(a)升高仍会增加冠心病风险。哥本哈根城市心脏研究分析 7524 例受试者资料,随访时间长达 16 年,结果提示,Lp(a)升高与冠心病风险增加呈显著正相关。中国人群的大型观察性研究表明,Lp(a)是冠心病的独立危险因素。基于 CCSSSCC 数据库进行回顾性分析,纳入1522例首次急性心肌梗死(AMI)患者和1691例无冠心病的对照者,结果提示,与LDL-C<2.6 mmol/L,Lp(a)第1个五分位数的对照组相比,根据Lp(a)五分位分层后,首次AMI的OR值分别为1.51、1.84、1.86和2.66[4]。
缺血性脑卒中:无论从观察性研究还是遗传学的分析,Lp(a)均与缺血性脑卒中的高风险相关。哥本哈根一般人口研究及城市心脏研究纳入6万余例缺血性脑卒中患者,结果显示,高水平的 Lp(a) 与缺血性脑卒中的风险增加相关。与 Lp(a) 水平 <10 mg/dl 的个体相比,Lp(a) >93 mg/dl 缺血性脑卒中的多变量校正后危险比为 1.60。观察性分析中,对于 Lp(a) 水平 >50 mg/dl,缺血性脑卒中的年龄和性别调整后的危险比为1.20。源于上海市嘉定区于2010年3月至8月随机抽取10375名40岁以上居民入组队列数据,8500名受试者纳入最终分析。结果发现,血清Lp(a)水平与脑卒中发生风险之间存在显著相关性(P<0.05)。多变量校正分析显示,与低Lp(a)水平组相比,高Lp(a)水平组发生脑卒中的HR为1.34。孟德尔随机化研究近40万余人数据显示Lp(a)与大动脉闭塞性脑卒中正相关,与小血管闭塞性脑卒中负相关[4]。
CAVS:Lp(a)也是CAVS的危险因素。ASTRONOMER研究在220例轻-中度主动脉狭窄(AS)患者中测量Lp(a),平均随访3.5年。结果提示,Lp(a)水平的升高与CAVS疾病进展相关。有研究以Lp(a)=58.5 mg/dl为切点,发现在Lp(a)升高的患者中,AS的进展更快,提示 Lp(a) 可预测轻–中度 CAVS 的进展[4]。
此外,Lp(a) 升高也是家族性高胆固醇血症(FH)和 2 型糖尿病患者发生 CVD 的危险增强因素。还有报道提示,Lp(a) 升高与动脉血管钙化、静脉血栓性疾病相关,但尚需更进一步积累证据。也有研究指出,极低的Lp(a)水平(<3-5 mg/dL vs 27-55 mg/dL)与糖尿病风险增加38%有关[6]。
Lp(a) 可能的致病机制
低密度脂蛋白胆固醇(LDL-C)是众所周知的“坏”胆固醇,但大量的证据已经表明,Lp(a)可能比LDL更加凶险。JACC(《美国心脏病学会杂志》)发表的一项基于载脂蛋白B(ApoB)的遗传分析提示,Lp(a)的致动脉粥样硬化作用大约是LDL的6.6倍[7]。如下图所示,氧化磷脂(OxPL)与载脂蛋白Apo(a)可能是Lp(a)的两个独特的致病因素。
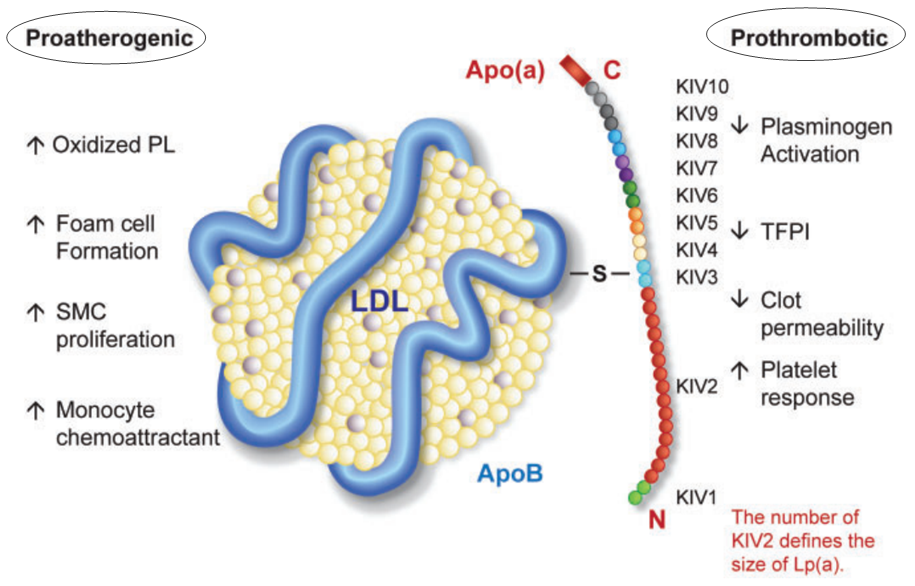
Lp(a) 促动脉粥样硬化和促血栓机制[8]
Lp(a) 是氧化磷脂的最大结合力载体,氧化磷脂具有重要的促炎、促动脉粥样硬化作用,通过诱导内皮细胞、平滑肌细胞和巨噬细胞的促炎信号激活,引发动脉壁的炎症反应(下图)。此外,Lp(a)已显示在体外与纤溶酶原竞争结合位点,导致纤溶酶合成减少和纤维蛋白溶解抑制。推测Lp(a)可能的生理作用之一是参与伤口早期的修复。组织损伤时,细胞外基质暴露于血液中,Lp(a) 被“捕获”至伤口处,促进炎症细胞(如单核细胞)向血管内皮下内流,通过抑制纤溶而发挥促血栓的作用[4]。
因此,与 LDL相比,Lp(a) 同时还可通过促血栓形成和促炎作用加剧 ASCVD的发生与发展。
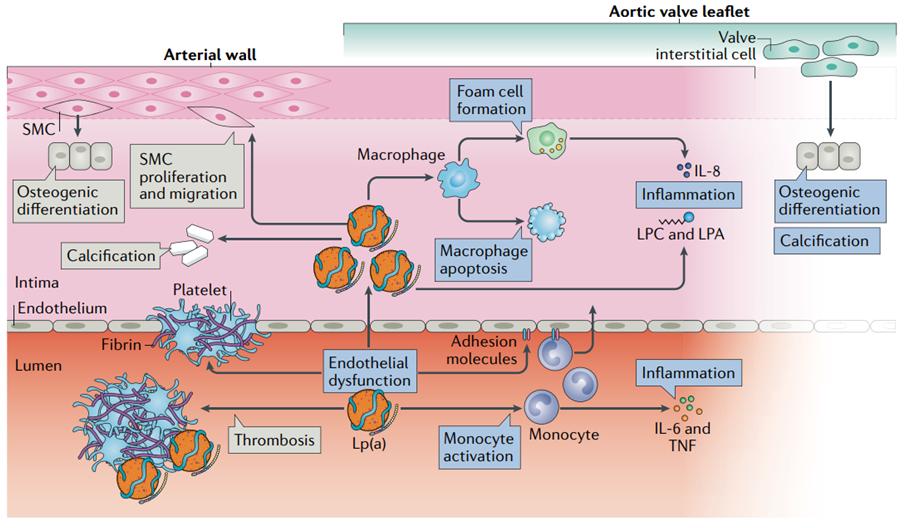
Lp(a)和Lp(a)相关氧化磷脂的细胞效应[9]
Lp(a)的合成与代谢
Lp(a) 与LDL不同,不能由极低密度脂蛋白(VLDL)转化而来,也不能转化为其他脂蛋白,是一类独立的由肝脏合成的脂蛋白。Apo(a)几乎完全在肝细胞内合成,但Lp(a)的组装地点尚未明确,可能在肝细胞内、狄氏间隙或血液循环中完成。组装过程包括 Apo(a) 对接至LDL,然后在Apo(a)的 KⅣ-9和LDL的ApoB之间形成共价二硫键,此过程是否可逆尚不清楚。血浆中Lp(a)的清除途径和机制也了解甚少,目前认为大部分 Lp(a) 在肝脏中经 LDL受体清除,小部分也可经肾脏和其他途径清除。但也有研究显示清道夫受体B型Ⅰ(SR-BⅠ)、纤溶酶原受体、LDL受体相关蛋白1(LDLRP1)及其他受体也参与了肝脏介导的Lp(a)清除[4]。
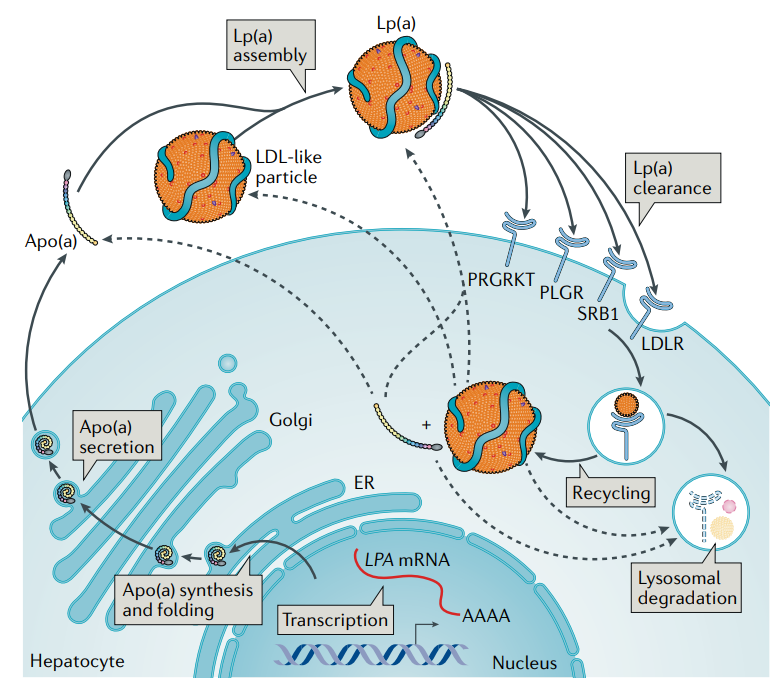
Lp(a)的合成与代谢[9]
Lp(a)的浓度决定因素及治疗
Lp(a)浓度主要由载脂蛋白Apo(a)决定,Apo(a)由LPA基因编码,该基因是灵长类动物等少数物种所特有,由于KIV-2区域的拷贝数多态性存在,LPA基因也是人类最为复杂的基因之一。LPA基因起源于纤溶酶原基因(Plasminogen,PLG),Plasminogen由多个kringle结构域和蛋白酶结构域组成,现在的LPA基因通过基因复制、KI-KIII丢失、KIV扩增、引入KIV-2拷贝数变化并保留KV和蛋白酶结构域(突变失活)形成。
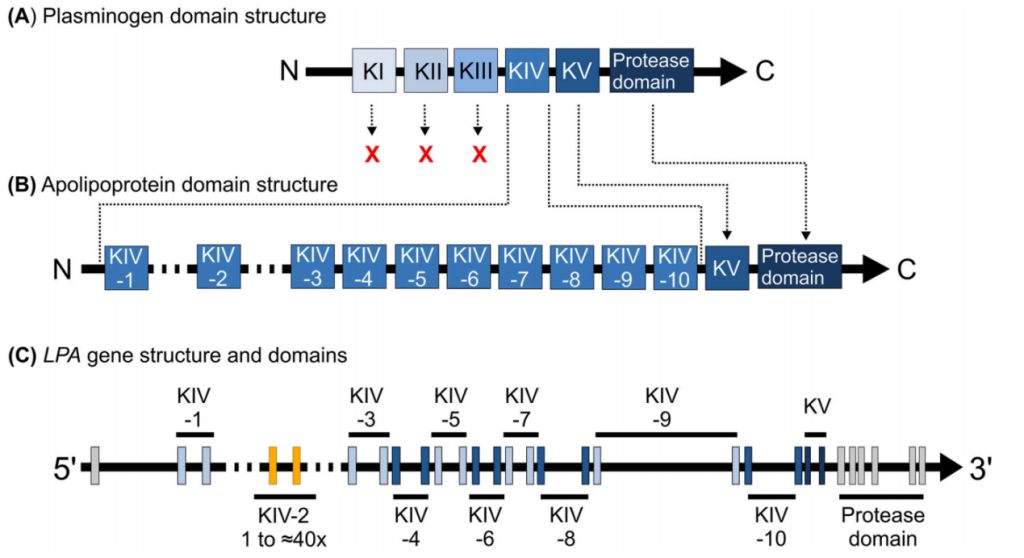
纤溶酶原、载脂蛋白(a)以及LPA基因结构[10]
LPA是人类基因中多态性最高的基因之一,其多态性一方面来自KIV-2 的拷贝数变化(CNV),KIV-2具有大约40种不同的等位基因,可以形成约1600种可能的基因型。在整体趋势上,KIV-2的拷贝数与Lp(a)浓度负相关,KIV-2拷贝数越多,Lp(a)浓度越低,可能的生物学机制是由于高分子量异构体Apo(a)无法在内质网中正常成熟,并在分泌之前被降解导致。
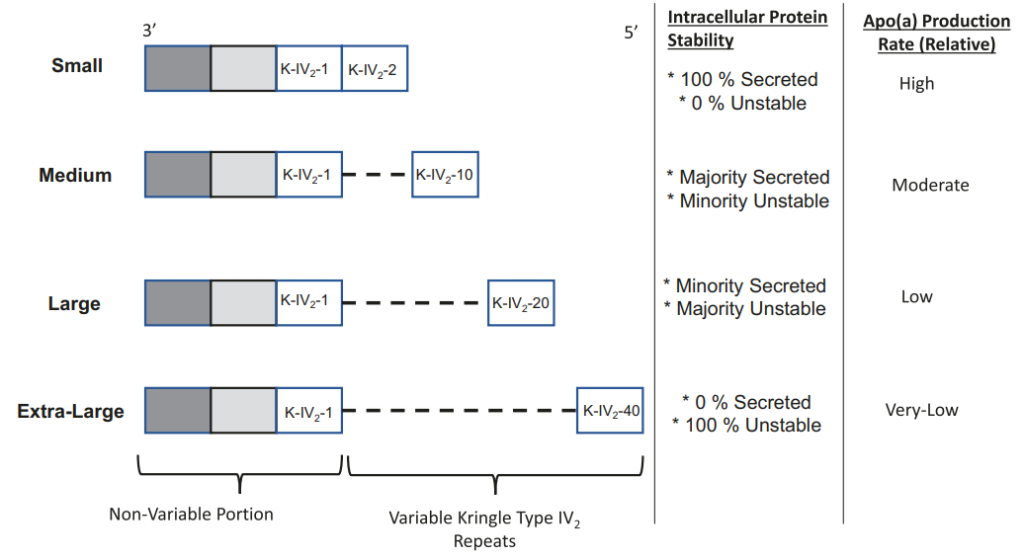
不同分子量Apo(a)的稳定性[3]
人群中Lp(a)水平的差异非常大,在个体之间可以达到1000倍以上,40%-70%的Lp(a)水平差异可以归因于Apo(a)的KIV-2拷贝数多态性,此外,还有很多SNP发挥着作用,整体而言,Lp(a)的浓度由LPA基因的KIV-2 拷贝数与SNPs共同决定。因此,由于LPA复杂的基因组结构,一些功能性SNP往往被KIV-2 CNV的作用所掩盖,这给研究造成了很大的困扰。比如,高拷贝KIV-2异构体的Lp(a)浓度本来较低,与之关联的LOF 突变的功能便被掩盖。
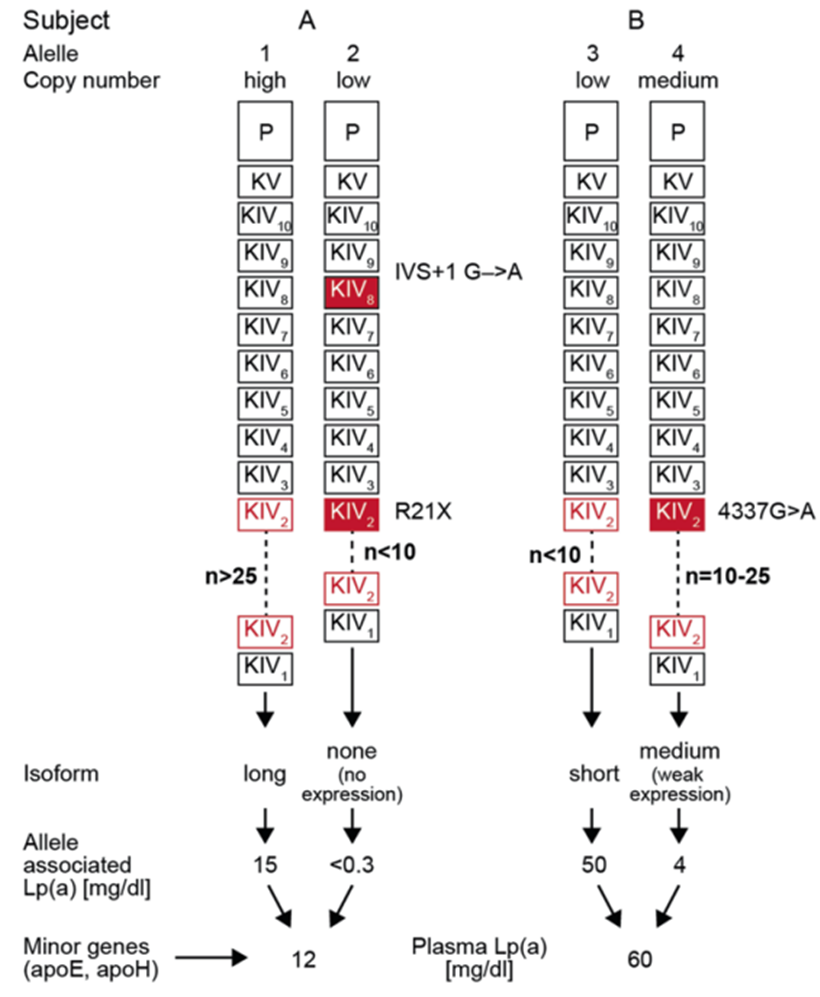
LPA基因的KIV-2拷贝数与SNPs共同决定了Lp(a)浓度[3]
Lp(a)浓度几乎完全由遗传决定,且不受传统心血管风险降低方法的影响,包括生活方式改变和他汀类药物。有研究显示,他汀类药物反而导致Lp(a) 轻微升高(~8–20%)[11],PCSK9抑制剂也只能轻微降低Lp(a)约20%[12]。在中国,约有20%人群的Lp(a)水平异常,但目前市场上尚无批准用于降低Lp(a)水平的药物。
多种靶向Lp(a)的降脂药物也正在开发当中,反义寡核苷酸Pelacarsen(降低80%)和siRNA药物Olpasiran(降低98%),均正在进行第三阶段临床试验。口服小分子药物Muvalaplin(降低65%),能够破坏Apo(a)和载脂蛋白ApoB-100的结合,已显示出安全性和有效性。鉴于Lp(a)的巨大危害,希望有效干预Lp(a)的手段能够早日出现。
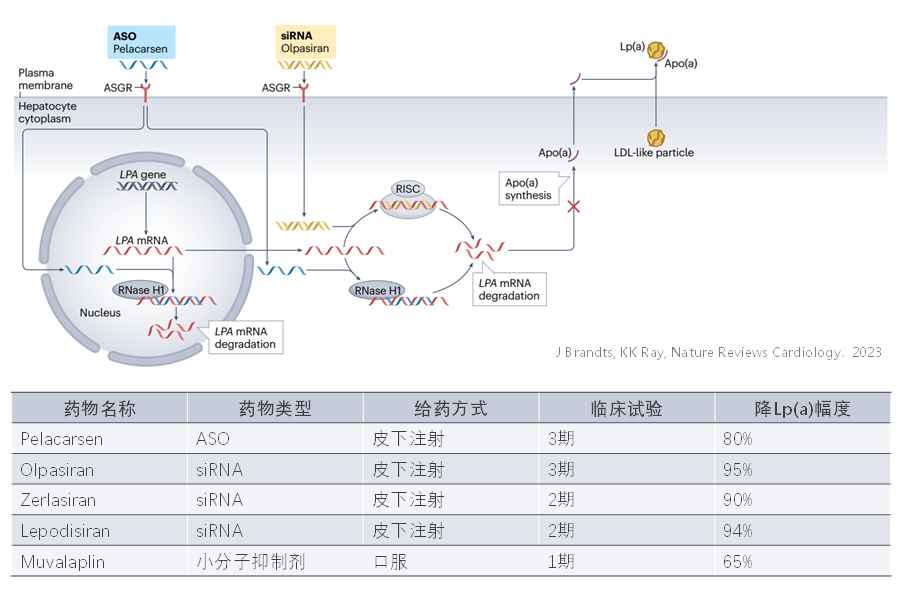
参考资料
1. 中国血脂管理指南(2023 年). 中国循环杂志 2023 年 3 月 第 38 卷 第 3 期(总第 297 期)
2. Mehta A, Shapiro M D. Apolipoproteins in vascular biology and atherosclerotic disease[J]. Nature Reviews Cardiology, 2022, 19(3): 168-179.
3. Kostner, Karam et al., Springer Nature, 2023
4. 脂蛋白 (a) 与心血管疾病风险关系及临床管理的专家科学建议. 中国循环杂志 2021 年 12 月 第 36 卷 第 12 期(总第 282 期)
5. Yu C, Thanassoulis G, Wolfe R, et al. Updated Lipoprotein (a) Genomic Risk Score and Aspirin for Primary Prevention of Cardiovascular Events[J]. JACC: Advances, 2024, 3(1): 100754.
6. Tsimikas S. A test in context: lipoprotein (a) diagnosis, prognosis, controversies, and emerging therapies[J]. Journal of the American College of Cardiology, 2017, 69(6): 692-711.
7. Björnson E, Adiels M, Taskinen MR, Burgess S, Chapman MJ, Packard CJ, Borén J. Lipoprotein(a) Is Markedly More Atherogenic Than LDL: An Apolipoprotein B-Based Genetic Analysis. J Am Coll Cardiol. 2024 Jan 23;83(3):385-395.
8. Gencer B, Kronenberg F, Stroes E S, et al. Lipoprotein (a): the revenant[J]. European heart journal, 2017, 38(20): 1553-1560.
9. Boffa M B, Koschinsky M L. Oxidized phospholipids as a unifying theory for lipoprotein (a) and cardiovascular disease[J]. Nature Reviews Cardiology, 2019, 16(5): 305-318.
10. Coassin S, Kronenberg F. Lipoprotein(a) beyond the kringle IV repeat polymorphism: The complexity of genetic variation in the LPA gene. Atherosclerosis. 2022 May;349:17-35.
11. Tsimikas S, Gordts P, Nora C, Yeang C, Witztum JL. Statin therapy increases lipoprotein(a) levels. Eur Heart J. 2020;41:2275–84.
12. Ajufo E, Rader DJ. Recent advances in the pharmacological management of hypercholesterolaemia. Lancet Diabetes Endocrinol. 2016;4:436–46.


